Materia: estados de la materia y cambios de estado
Anuncio

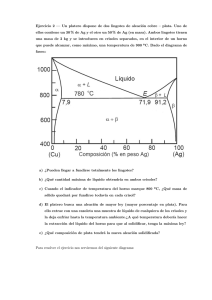
Materia: estados de la materia y cambios de estado • Investiga y elabora un cuadro comparativo entre los estados sólido, lÃ−quido y gaseoso. Cita 5 ejemplos de cada uno. Sólidos • volumen definido • forma definida • lenta difusión • cohesión > repulsión • no fluyen • muy densos • son cristalinos o amorfos LÃ−quidos • volumen definido • forma variable • difusión intermedia • cohesión = repulsión • fluyen + ó • densidad media • amorfos Gaseosos • volumen variable • forma variable • difusión rápida • cohesión < repulsión • fluyen fácilmente • poco densos • amorfos Ejemplos • hielo • piedra • mármol • harina • azúcar 1 Ejemplos • sudor • sangre • sillao • vinagre • alcohol Ejemplos • Helio • Nitrógeno • CO2 • Metano • Vapor de agua 2. El cuarto estado de la materia es el PLASMà TICO, investiga y anota sus caracterÃ−sticas. Da 5 ejemplos. Plasma gas ionizado • conjunto de iones positivos (protones) y negativos (electrones). • Es un gas ionizado • Normalmente esta a temperaturas muy altas • Gases se mueven a gran velocidad (partÃ−culas se mueven más que en el estado gaseoso) *Ionátomo o grupo de átomos con carga positiva o negativa. Ejemplos • sol • estrellas • ionosfera • rayos de tormenta • auroras Boreales 3. ¿De qué factor o factores depende el estado fÃ−sico de las sustancias quÃ−micas? • La temperatura • La presión ejercida sobre las moléculas o átomos de la materia. 4. Investiga y elabora cuadros comparativos entre los cambios de estado producidos por: Aumento de Temperatura • sublimación progresiva 2 • vaporización • fusión Disminución de Temperatura • sublimación inversa • liquefacción • solidificación • a) Fusión - aumenta un poco la repulsión - la presentan algunos sólidos - sólido lÃ−quido - se produce a temperaturas fijas y particulares Vaporización - aumenta la fuerza de repulsión - la presentan todos los lÃ−quidos - lÃ−quido gaseoso - se produce a Tº amb. ó a Tº fijas y particulares Sublimación + - aumenta mucho a fuerza de repulsión - la presentan muy pocos sólidos - sólido gaseoso - se produce a bajas Tº o a Tº ambiente. Ejemplos: - hielo - mantequilla - chocolate 3 - queso - cera Ejemplos: - cuando hierve el agua - perfume destapado Ejemplos: - hielo seco - aromatizadores - bolitas de naftalina b) Solidificación - lÃ−quidosólido - en todos los lÃ−quidos - proceso inverso a fusión - se da a Tº fija y particular Liquefacción - gaseosolÃ−quido - en la mayorÃ−a de gases - proceso inverso a la vaporización - se da a Tº fija y particular Sublimación - gaseososólido - en algunos gases - proceso inverso a la sublimación progresiva - se da a Tº ambiente o más baja Ejemplos 4 - aguahielo - helado - gelatina - huevo frito - chocolate derretido Ejemplos - luna empañada - garúa - gotitas de agua al hervir - galones de gas Ejemplos -cristales de yodogascristales de yodo - naftalina 5. Elabora un diagrama donde se observen los cambios de estado de la materia, por acción del calor. 6. Cita diferencias entre ebullición y evaporización (las dos clases de vaporización). Da 4 ejemplos. Ebullición - se da en todo el lÃ−quido - es ruidosa - se produce a Tº fijas y particulares - es violenta 5 Evaporización - se da en la superficie del lÃ−quido - es silenciosa - se da en el punto de ebullición - es lenta Ejemplos - leche hervida - chocolate hervido - aceite - agua hervida Ejemplos - alcohol - perfumes - acetona - aguarrás 7. ¿Qué dice la teorÃ−a cinético-molecular? ¿Por qué nos permite explicar las propiedades de los sólidos, lÃ−quidos y gases? Dice que: La materia está formada por partÃ−culas, que se hallan más ó menos unidas dependiendo del estado en que se encuentre. Las partÃ−culas se mueven más ó menos dependiendo del estado. Porque dependiendo del aumento ó disminución de temperatura puede variar la rapidez del movimiento de las molñeculas. 6