Iones positivos
Anuncio

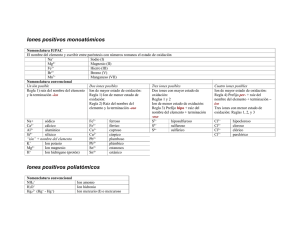
Iones positivos monoatómicos Nomenclatura IUPAC El nombre del elemento y escribir entre paréntesis con números romanos el estado de oxidación Na+ Sodio (I) Mg2+ Magnesio (II) Fe3+ Hierro (III) Br5+ Bromo (V) Mn7+ Manganeso (VII) Nomenclatura convencional Un ión posible Dos iones posibles Tres iones posibles Regla 1) raíz del nombre del elemento Ion de mayor estado de oxidación: Dos iones con mayor estado de y la terminación -ico Regla 1) Ion de menor estado de oxidación: oxidación: Reglas 1 y 2 Regla 2) Raíz del nombre del Ion de menor estado de oxidación: elemento y la terminación -oso Regla 3) Prefijo hipo + raíz del nombre del elemento + terminación oso Na+ sódico Fe2+ ferroso S2+ Hiposulfuroso 2+ 3+ Ca cálcico Fe férrico S4+ Sulfuroso Al3+ alumínico Cu1+ cuproso S6+ sulfúrico Si4+ silícico Cu2+ cúrpico “ión” + nombre del elemento Pb2+ plumboso + K Ion potasio Pb4+ plúmbico Mg2+ Ion magnesio Sn2+ estanosos H+ Ion hidrógeno (protón) Sn4+ estánico Iones positivos poliatómicos Nomenclatura convencional NH4+ H3O+ Hg22+ (Hg+ - Hg+) Ion amonio Ion hidronio Ion mercurio (I) o mercuroso Cuatro iones posibles Ion de mayor estado de oxidación: Regla 4) Prefijo per- + raíz del nombre del elemento + terminación – ico Tres iones con menor estado de oxidación: Reglas 1, 2, y 3 Cl1+ Cl3+ Cl5+ Cl7+ Hipocloroso cloroso Clórico Perclórico Iones negativos Monoatómicos Oxianiones (contienen oxígeno) Otros y excepciones Regla: Regla: Regla Raíz del elemento + terminación uro Aun menos oxígeno Ejemplos: Menos oxígeno _ito _ato Hipo _ ito Ejemplos H- hidruro Mas oxígeno F fluoruro Aun mas oxígeno S2- sulfuro Ejemplos N nitruro ClO hiproclorito C4- carburo ClO2- clorito ClO3- clorato ClO4- perclorato SO32- sulfito SO42- sulfato - 3- - No siguen ninguna regla Per _ato Todos los halógenos (excepto el fluor) forman los cuatro iones. Cuando solo existen dos de los cuatro iones, se usan las terminaciones –ito (para el de menos oxígenos) y –ato (para el de más oxígenos) OH- hidróxido CN- cianuro SCN- tiocianato OCN- cianato O2- óxido O22- peróxico O2- superóxido MnO42- manganato MnO4- permanganato C2H3O2- acetato Cr2O72- dicromato C2O42- oxalato Oxianiones que contienen hidrógeno Regla H - oxianión hidrogeno + nombre del oxianión bi + nombre del oxianión H2 - oxianión dihidrógeno + nombre del oxianión Ejemplos HCO3- hidrógeno carbonato o bicarbonato HSO4- hidrógeno sulfato o bisulfato HPO42- hidrógeno fosfato o bifosfato H2PO4- dihidrógeno fosfato Compuestos Iónicos (catión-anión) Covalente (Nometal- nometal) Compuestos que contienen hidrógeno H- metal H-nometal Regla: Nombre del anión + de + nombre del catión Regla 1. (en ausencia de agua) Nombre anión de + hidrógeno Ejemplos: NaCl MgCl2 Na2CO3 NH4OH NaH CaH2 Ejemplos: HCl cloruro de hidrógeno HF fluoruro de hidrógeno H2S sulfuro de hidrógeno cloruro de sodio cloruro de magnesio carbonato de sodio hidróxido de amonio hidruro de sodio hidruro de calcio Regla 2. Disueltos en agua Ácido nombre apocopado del nometal y terminación -hídrico HCl(ac) ácido clorhídrico HF(ac) ácido fluorhídrico H2S(ac) ácido sulfhídrico H-oxianión Regla 1. (disueltos en agua) ácido hipo-... _oso ácido _oso ácido -ico ácido per_ _ico Ejemplos: HClO HClO2 HClO3 HClO4 HNO2 HNO3 H2SO3 H2SO4 H3PO3 H3PO4 ac. hipocloroso ac. cloroso ac. clórico ac. perclórico ácido nitroso ácido nítrico ácido sulfuroso ácido sulfúrico ácido fosforoso ácido fosfórico Regla: a) El elemento más electronegativo se dice primero b) se especifica el número de átomos de cada clase usando prefijos griegos Ejemplos: N2O4 tetróxido de dinitrógeno CO monóxido de carbono CO2 dióxido de carbono NO2 dióxido de nitrógeno N2O monóxido de dinitrógeno