formulación y nomenclatura de compuestos inorgánicos
Anuncio

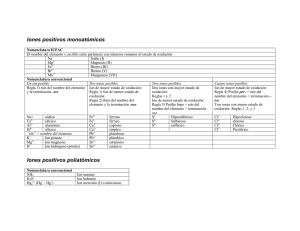
COLEGIO ADVENTISTA MARANATA TERCERO MEDIO DIFERENCIADO QUÍMICA PROF.: CARMEN DAMKE ÁLVAREZ GUÍA DE APRENDIZAJE FECHA: 02 de Mayo de 2016 FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS Algunos compuestos terminan en –uro. En –ato o –ito muchos otros más. Si practicas sus nombres un poco verás que muy pronto los aprenderás. El conocimiento actual de más de diez millones de compuestos ha llevado al desarrollo de métodos para representarlos y nombrarlos, de tal forma que sean aceptados y adoptados por todo el mundo. Este sistema de normas para denominar compuestos químicos se conoce como formulación y nomenclatura química. La formulación y nomenclatura moderna se apoya en un sistema de normas establecidas por la IUPAC (Unión Internacional de Química Pura y Aplicada). La Unión Internacional de Química Pura y Aplicada es una federación internacional de organizaciones adherentes nacionales, fundada en 1919, que representa a los químicos en los distintos países. Es miembro del Consejo Internacional para la Ciencia. La sede internacional de la IUPAC se encuentra en Zürich, Suiza. La oficina administrativa, conocida como la "Secretaría IUPAC", se encuentra en Research Triangle Park, Carolina del Norte, Estados Unidos. Los compuestos químicos se clasifican de acuerdo al número de elementos que constituyen el compuesto en binarios, ternarios o cuaternarios, si están formados por dos, tres o cuatro elementos, respectivamente. También se clasifican según el tipo de elemento constituyente central como compuestos inorgánicos, compuestos orgánicos y compuestos organometálicos. Estos criterios de clasificación se consideran al momento de formular y nombrar un compuesto. Formulación y nomenclatura de compuestos binarios 1. Compuestos hidrogenados. Son sustancias formadas por metales o no metales e hidrógeno. Se clasifican en hidruros metálicos, hidruros no metálicos e hídridos ácidos. a. Hidruros metálicos. Sustancias formadas por hidrógeno y un metal. El hidrógeno, en estos compuestos, participa con número de oxidación −1. Su fórmula general es MHm, siendo M el símbolo del metal, H el símbolo del hidrógeno y m el valor absoluto del número de oxidación del metal. Se nombran escribiendo primero la palabra hidruro y luego el nombre del metal. Ejemplos: NaH, hidruro de sodio; CaH2, hidruro de calcio. b. Hidruros no metálicos. Sustancias formadas por hidrógeno y un no metal. El hidrógeno, en estos compuestos, participa con número de oxidación +1. Su fórmula general es XHm, siendo X el símbolo del no metal, H el símbolo del hidrógeno y m el valor absoluto del número de oxidación del no metal. Se nombran escribiendo primero la palabra hidruro y luego el nombre del no metal o a través de nombres especiales. Ejemplos: CH4, metano/hidruro de carbono (IV); NH3, amoniaco/hidruro de nitrógeno (III); PH3, fosfamina/hidruro de fósforo (III); SiH4, Silano/hidruro de silicio (IV). c. Hídridos ácidos. Son hidruros no metálicos formados por no metales de los grupos 16 o 17 de la tabla periódica que reciben el nombre de hídridos ácidos debido a que pueden formar soluciones acuosas ácidas. El hidrógeno, en estos compuestos, también participa con número de oxidación +1. Su fórmula general es HmX, siendo X el símbolo del no metal, H el símbolo del hidrógeno y m el valor absoluto del número de oxidación del no metal. Los hídridos ácidos, cuando están en solución acuosa, se nombran escribiendo primero la palabra ácido y luego la raíz del nombre del no metal con la terminación hídrico. Cuando no están en solución acuosa se nombran escribiendo el nombre del no metal con la terminación uro seguido de la terminación de hidrógeno. Ejemplos: HF, ácido fluorhídrico o fluoruro de hidrógeno; HCl, ácido clorhídrico o cloruro de hidrógeno; H2S, ácido sulfhídrico o sulfuro de hidrógeno; H2Se, ácido selenhídrico o selenuro de hidrógeno. 2. Compuestos oxigenados. Son sustancias formadas por metales o no metales y oxígeno o el ion peróxido (O22−). Se clasifican en óxidos metálicos, óxidos no metálicos y peróxidos. a. Óxidos. Sustancias formadas por metales o no metales y oxígeno. Se clasifican en óxidos metálicos y óxidos no metálicos, respectivamente. El oxígeno, en estos compuestos, participa con número de oxidación −2. Sus fórmulas generales son: M2Om y X2Ox, donde, M es un metal y X un no metal, m y x son los valores absolutos de los números de oxidación correspondientes. El dos (2) corresponde al valor absoluto del número de oxidación del oxígeno. Para nombrar los óxidos, se escribe primero la palabra óxido de y luego el nombre del metal o no metal seguido de su número de oxidación con número romano entre paréntesis, cuando corresponda. Si el elemento presenta un solo número de oxidación se omite lo último. Ejemplos: CuO, óxido de cobre (II); P2O5, óxido de fósforo (V). b. 3. Peróxidos. Sustancias de carácter iónico formadas por metales de los grupos 1 y 2 de la tabla periódica y el ion peróxido de símbolo O22−, donde el oxígeno presenta número de oxidación −1. La fórmula general es: M2O2 y MO2 para los peróxidos formados por metales del grupo 1 y 2 de la tabla periódica, respectivamente. Para nombrar los peróxidos, se escribe primero la palabra peróxido de y luego el nombre del metal. Ejemplos: Na2O2, peróxido de sodio; CaO2, peróxido de calcio. Sales binarias. Son sustancias formadas por metales generalmente de los grupos 1, 2 y 13 de la tabla periódica, y no metales de los grupos 16 y 17 de la tabla periódica. Se nombran escribiendo primero el nombre del elemento más electronegativo terminado en uro y luego el nombre del otro elemento, agregando si es necesario el número de oxidación. Ejemplos: NaCl, cloruro de sodio; AlCl3, cloruro de aluminio; CaS, sulfuro de calcio; SF4, fluoruro de azufre (IV); ICl3, cloruro de yodo (III); BN, nitruro de boro. Formulación y nomenclatura de compuestos ternarios 1. Hidróxidos. Están formados por iones hidróxido (OH−) y un metal. Su fórmula general es M(OH)n, donde n representa el número de oxidación del metal. Para nombrarlos se escribe primero la palabra hidróxido de y, luego, el nombre del metal. Ejemplos: NaOH, hidróxido de sodio; Ba(OH)2, hidróxido de bario; Fe(OH)2, hidróxido de hierro (II); Fe(OH)3, hidróxido de hierro (III). 2. Oxiácidos. Son compuestos que se forman por la reacción de óxidos no metálicos y agua. Su fórmula general es HnXOm, donde n es el número de átomos de hidrógeno, m el número de átomos de oxígeno y X representa un no metal. En solución acuosa pueden generar los iones H+ y XOyn-. Para nombrarlos se escribe primero la palabra ácido y luego la raíz del nombre del no metal con terminación oso, si el elemento tiene su número de oxidación menor, o en ico, si el elemento tiene su número de oxidación mayor. Cuando hay más números de oxidación se antepone el prefijo hipo al de menor número de oxidación y el prefijo per al mayor. Ejemplos: HClO, ácido hipocloroso; HClO2, ácido cloroso; HClO3, ácido clórico; HClO4, ácido perclórico. 3. Sales ternarias u oxisales. Se forman por la reacción de neutralización entre un oxiácido y un hidróxido, en la cual el hidrógeno del ácido es neutralizado por el hidróxido de la base o hidróxido generando agua y una sal. Para nombrar una sal, se deben seguir las siguientes reglas: Si el ácido termina en ico, el residuo de éste que forma la sal tendrá terminación ato. Si el ácido termina en oso, el residuo de éste que forma la sal tendrá terminación ito. Los prefijos que tenga el ácido no cambian en el nombre de la sal. Ejemplos: NaNO3, nitrato de sodio; CaSO4, sulfato de calcio. Grupo 1: Li, Na, K, Rb, Cs 2: Be, Mg, Ca, Sr, Ba 13: B, Al, Ga 14: C Si, Ge Sn, Pb 15: N P, As, Sb 16: O S, Se, Te 17: F Cl Br, I Números de oxidación más comunes de algunos elementos Números de oxidación Elementos de transición Números de oxidación +1 Cr +2, +3, +6 +2 Mn +2, +3, +4, +6, +7 +3 Fe, Co, Ni +2, +3 Cu +1, +2 +2, +4, −4 Ag +1 −4, +4 Au +1, +3 +2, +4 Zn, Cd +2 −3, +1, +2, +3, +4, +5 Hg +1, +2 −3, +3, +5 Pt +2, +4 −1, −2 −2, +4, +6 −1 −1, +1, +3, +5, +7 −1, +1, +5, +7 Nombre Ion amonio Ion hidronio Ion carbonato ácido (bicarbonato) Ion sulfato ácido (bisulfato) Ion acetato Ion nitrito Ion nitrato Ion cianuro Ion hidróxido Algunos iones poliatómicos comunes Fórmula Nombre NH4+ Ion permanganato H3O+ Ion carbonato − Ion sulfato HCO3 − Ion cromato HSO4 Ion fosfato monoácido CH3CO2− Ion oxalato NO2− − Ion dicromato NO3 − Ion fosfato CN − Ion fosfato diácido OH 2 Fórmula MnO4− CO32− SO42− CrO42− HPO42− C2O42− Cr2O72− PO43− H2PO4−