Nomenclatura GMM
Anuncio

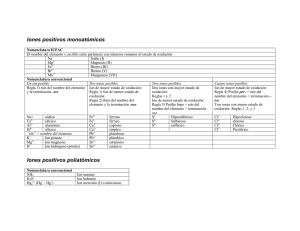
U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S ii REACCIONES QUÍMICAS: TRANSFORMACIONES DE MATERIALES. ¿Para qué se estudian las reacciones químicas? El estudio de una reacción permite entender qué sucede con los átomos y sus uniones, cuales son las que se rompen y cuáles las que se forman, y relacionarlo con lo que sabemos acerca de la estructura de los átomos que forman los materiales de partida Las reacciones químicas pueden ocurrir naturalmente, como cuando se oxida el hierro expuesto al aire húmedo, o cuando una planta transforma dióxido de carbono del aire en azúcares en el proceso de fotosíntesis. Pero también hay reacciones químicas que producimos artificialmente, por ejemplo, cuando se fabrica lavandina a partir de la sal común, o se procesa el petróleo para convertirlo en materiales plásticos. Cuando hay una reacción química, la formación de productos con propiedades nuevas y la desaparición de los reactivos producen cambios observables llamados señales. Son la evidencia de que se ha producido la transformación. DISTINTOS TIPOS DE REACCIONES QUÍMICAS Las reacciones químicas se pueden clasificar de acuerdo al tipo de productos que resulta de la reacción según: 1. Reacciones de combinación o síntesis: Son las reacciones en las que dos o más elementos o compuestos reaccionan para producir uno o varios compuestos. A +B → AB Ej: H2 +F2 → 2HF 1|QG(3203) -2012 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S 2H2 + O2 → 2H2O CaO+ SO2 → CaSO3 2. Reacciones de descomposición o análisis: Al contrario que en el caso anterior, son aquellas en las cuales a partir de un compuesto se forman dos o más compuestos o elementos. AB → A +B Ej. 2H2O → 2H2 + O2 (descomposición o hidrólisis del agua) CaCO3 → CaO + CO2 3. Reacciones de desplazamiento simple o sustitución simple: Son aquellas en las que un elemento sustituye a otro en un compuesto. Pueden ser de oxidación-reducción o precipitación según las especies químicas presentes: A + BC → AC + B Ej. Zn + CuSO4 → Cu + ZnSO4 2Na + 2H2O → 2NaOH + H2 Br2+ 2NaI → 2NaBr + I2 4. Reacción de doble desplazamiento: Son aquellas en las cuales dos o más compuestos intercambian iones. AB + CD → AD + BC Ej. NaCl + AgNO3→ AgCl + NaNO3 HCl + NaOH → NaCl + H2O Pb(NO3)2 + 2Kl → Pbl2 + KNO3 2|QG(3203) -2012 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S ECUACIONES QUIMICAS. Los químicos usan una escritura particular para representar los cambios en una reacción química: las ecuaciones químicas. Éstas se expresan por medio de fórmulas, números, signos de suma y flecha. Una forma global de representación es la siguiente: REACTIVOS → PRODUCTOS Referidos al observador, a la izquierda se escriben las fórmulas de los reactivos, sumadas cuando son dos ó más y, a la derecha, las fórmulas de los productos, sumadas cuando son dos ó más. Los reactivos dan o forman los productos de la reacción, lo cual se indica con una flecha o signo igual. Como en una reacción química los átomos de los elementos se conservan, aunque se encuentren en diferentes sustancias, la ecuación química se ajusta (balancea) introduciendo coeficientes numéricos, de manera de obtener igual número de átomos de cada elemento de ambos lados de la ecuación. Para ilustrar lo expuesto, se analiza a continuación el caso de la formación de agua, la que como se sabe es el resultado de la combinación de los elementos H y O. La correspondiente reacción química es: H2 + O2 → H2 O En ella se destaca que los reactivos no se encuentran naturalmente como átomos, sino como moléculas biatómicas. Un examen de la ecuación anterior muestra que no está ajustada, porque hay dos átomos de O en los reactivos y solo uno del lado de los productos. Para balancear a O, se introduce un coeficiente 2 como factor del lado del producto y, entonces, queda: H2 + O2 → 2H2O De esta manera queda igualado el número de átomos de O, pero ahora no esta ajustado él numero de átomos de H, ya que hay 4 del lado del producto y 2 del lado de reactivos. Esta situación se resuelve introduciendo un factor 2 sobre el reactivo H2 quedando entonces: 3|QG(3203) -2012 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 2H2 + O2 → Y N A T U R A L E S 2H2O Ahora, la ecuación química esta completamente ajustada e indica no solamente que H y O forman agua, sino que 2 moléculas de H2 reaccionan con una molécula de O2 para formar dos moléculas de H2O. El ejemplo analizado tiene carácter general en el método y, se fundamenta en el Principio de conservación de la Masa. FORMACION DE COMPUESTOS INORGANICOS. Números de oxidación El estado de oxidación ó número de oxidación, es la carga formal asignada a ese átomo según una serie de reglas establecidas. Estas reglas son: • El estado de oxidación de un elemento libre es cero ( 0 ) • La suma de los estados de oxidación positivos y negativos de todos los átomos de un compuesto es cero. Si el compuesto es un ión, la suma ha de ser igual a la carga del ión. • El estado de oxidación de un ión monoatómico es igual a la carga del átomo. • El hidrógeno presenta habitualmente número de oxidación +1, a excepción cuando se combina con metales, su número de oxidación es –1. • El oxígeno presenta habitualmente número de oxidación –2, excepto en los peróxidos que es -1 • El estado de oxidación de los metales alcalinos es +1, y el de los alcalinos terreos es +2 • El elemento más electronegativo, el flúor, presenta en todos sus compuestos el número de oxidación -1. • Los elementos Cl, Br, y I presentan habitualmente número de oxidación –1 • Cuando forman compuestos ternarios con oxígeno y metal o hidrógeno pueden presentar número de oxidación +1, +3, +5, +7. 4|QG(3203) -2012 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S Números de oxidación más comunes de elementos usuales Elementos H O Grupo 1 (metales alcalinos) Grupo 2 (metales alcalino térreos) Grupo 13 (térreos) Grupo 14 (carbonoideos, excepto Si, Ge = +4) Grupo 15 (nitrogenoideos) Grupo 16 (anfígenos, excepto O) Grupo 17 (halógenos, excepto F = -1) Grupo 6 Cr Metales Grupo 7 Mn Grupos 8,9,10 Fe, Co, Ni de Grupo 10 Pt Grupo 11 Ag transición Grupo 11 Au Grupos 11, 12 Cu, Hg Grupo 12 Zn, Cd Número de oxidación más frecuente +1, excepto en hidruros metálicos (-1) -2, excepto en los peróxidos (-1) +1 +2 +3 +2, +4, en los hidruros (-4) +1, +3, +5 en los hidruros (-3) +2, +4, +6, en los hidruros (-2) +1, +3, +5, +7, en los hidruros (-1) +2, +3, +6, +7 +2, +4, +6, +7 +2, +3 +1, +2 +2 +1 +1, +3 +2, +4 Vemos de forma más detallada los números de oxidación más comunes de los metales y no metales más usuales Li Na K +1 NÚMEROS DE OXIDACIÓN MÁS USUALES METALES NO METALES Cu H en hidruros +1 metálicos (-1) +1,+2 -1 F Hg O (En los peróxidos +1,+3 Au -2 1) Rb Cs Fr Fe +2, +2,+3 Co +4 Ni C (2, 4) Si (En los hidruros – 4) Ag 5|QG(3203) -2012 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 N A T U R A L E S N Be Mg Ca Y Sn +2,+4 Sr Pb Pt +1 P +3 As +5 Sb (En los hidruros +2 –3) Ba Ra S +2 Zn Cd Se +2,+3,+6 Cr +4 Te (En los hidruros +6 +1 –2) Cl +3 Br +5 I (En los hidruros +7 –1) B +3 Al +2,+3,+4,+6,+7 Mn Bi Ecuaciones y Reglas de Nomenclatura El término denominación o nomenclatura resume una serie de reglas que permiten nombrar a los compuestos, en base a una serie de prefijos, sufijos y declinaciones aplicados a los nombres químicos de los elementos que los forman. La Unión Internacional de Química Pura y Aplicada (International Union of Pure and Applied Chemistry), IUPAC, tiene como miembros a las sociedades nacionales de química. Es la autoridad reconocida en el desarrollo de estándares para la denominación o nomenclatura de los compuestos químicos, mediante su Comité Interdivisional de Nomenclatura y Símbolos (Interdivisional Commitee on Nomenclature and Symbols). TIPOS DE NOMENCLATURA No recomendadas por la IUPAC I. Nomenclatura común, tradicional o funcional. 6|QG(3203) -2012 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 II. Y N A T U R A L E S Nomenclatura antigua. Recomendadas por la IUPAC I. Nomenclatura sistemática o estequiometrica; en donde las proporciones en que se encuentran los elementos en una fórmula puede indicarse por medio de prefijos griegos: mono(1), di(2), tri(3), tetra(4), penta(5), hexa(6), hepta(7), etc. y hemi(1/2) y sesqui(3/2). El prefijo mono, si resulta innecesario, puede omitirse. II. Nomenclatura de Stock (en honor al químico Alemán Alfred Stock) el nº de oxidación del elemento se indica en números romanos y entre paréntesis inmediatamente después del nombre. Si en el compuesto interviene un elemento cuyo nº de oxidación es cte., es innecesario indicarlo. 1. COMPUESTOS DE METALES Y NO-METALES CON HIDRÓGENO: HIDRUROS. La combinación de cualquier elemento con el hidrogeno constituye un hidruro. Los hidruros son compuestos binarios formados por átomos de hidrógeno y de otro elemento químico, pudiendo ser este metal o no metal. Existen dos tipos de hidruros: los metálicos y los no metálicos (hidrácidos). En un hidruro metálico el estado de oxidación del Hidrógeno es -1; mientras que en un hidruro no metálico, el estado de oxidación del Hidrógeno es +1. 1.1. Hidruros metálicos. En los hidruros metálicos el hidrogeno presenta un estado de oxidación de −1. Los hidruros son compuestos iónicos, con el metal (+) y el H (-). Metal + hidrógeno → Hidruro metálico 2 Na + H2 → 2 NaH Para escribir sus fórmulas el símbolo del elemento metálico se escribe primero y debe estar acompañado de tantos H como sea su número de oxidación. Así, los elementos del Grupo 1, forman hidruros cuya fórmula general es: Me1H (Me1 = Li, Na, K, Rb, etc.) ya que todos ellos tienen numero de oxidación (+1). 7|QG(3203) -2012 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S Los metales del Grupo 2, forman hidruros cuya fórmula general es: Me11H2 (Me11 =Mg, Ca, Sr, etc.) ya que todos ellos tienen numero de oxidación +2. Los demás metales, como los del Grupo 3 o los de transición pueden llegar también a formar hidruros. La nomenclatura de estos compuestos dependiendo el sistema utilizado es: i. de Stock: Hidruro del metal utilizando numeral de stock (números romanos entre paréntesis) para indicar el estado de oxidación del metal si este posee mas de un estado de oxidación posible. ii. sistemática: Prefijos indicando la cantidad de átomos del metal y de hidrógeno que existen en la molécula. iii. tradicional o clásica: Hidruro del metal (si el metal posee más de un estado de oxidación posible se utilizará oso para el menor estado de oxidación e ico para el mayor). Ej: Sistemática de Stock Común LiH hidruro de litio hidruro de litio hidruro de litio PbH4 tetrahidruro de plomo hidruro de plomo (IV) hidruro de plomo SnH2 dihidruro de estaño hidruro de estaño (II) Hidruro de estaño CaH2 dihidruro de calcio hidruro de calcio (II) Hidruro de calcio SrH2 dihidruro de estroncio hidruro de estroncio (II) Hidruro de estroncio CuH monohidruro de cobre hidruro de cobre (I) Hidruro cuproso CuH2 dihidriro de cobre hidruro de cobre (II) Hidruro cúprico 1.2. Hidruros no-metálicos. Son compuestos formados por hidrógeno actuando con estado de oxidación +1 y un elemento no metálico. Generalmente se encuentran en estado gaseoso a temperatura ambiente. Algunos manifiestan propiedades ácidas, tales como los hidruros de los elementos flúor, cloro, bromo, 8|QG(3203) -2012 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S yodo, azufre, selenio y telurio; mientras que otros no son ácidos, como el agua, amoníaco, metano, silanos, etc. Ácidos: Se formulan escribiendo primero el símbolo del hidrógeno y después el del elemento no metálico. Los elementos flúor, cloro, bromo y yodo se combinan con el hidrógeno con número de oxidación -1, y los elementos azufre, selenio y telurio lo hacen con -2. Tales compuestos dan disoluciones ácidas cuando se disuelven en agua, llamándose en ese caso hidrácidos (ver hidrácidos). Se nombran añadiendo la terminación uro en la raíz del nombre del no metal y especificando, a continuación, de hidrógeno. Ej: Sistemática Hidrácidos (en disolución acuosa) HF fluoruro de hidrógeno HF(aq) ácido fluorhídrico HCl cloruro de hidrógeno HCl(aq) ácido clorhídrico HBr bromuro de hidrógeno HBr(aq) ácido bromhídrico HI yoduro de hidrógeno HI(aq) ácido yodhídrico H2S sulfuro de hidrógeno H2S(aq) ácido sulfhídrico H2Se seleniuro de hidrógeno H2Se(aq) ácido selenhídrico H2Te teleruro de hidrógeno H2Te(aq) ácido telurhídrico No-ácidos: Cuando se combina H (+1) con C, Si, N, P, As, Sb y O sus disoluciones en agua no presentan carácter ácido. Todos reciben nombres particulares aceptados por la IUPAC. 9|QG(3203) -2012 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S Ej: NH3 Común Sistemática amoníaco trihidruro de SbH3 Común Sistemática estibina trihidruro de nitrógeno PH3 fosfina antimonio trihidruro de CH4 metano tetrahidruro de fósforo N2H4 hidrazina carbono tetrahidruro de SiH4 silano tetrahidruro de dinitrógeno AsH3 arsina Trihidruro de silicio H2O agua dihidruro de arsenico oxigeno 2. COMPUESTOS DE METALES Y NO-METALES CON OXIGENO: OXIDOS Los óxidos son compuestos binarios que contienen uno o varios átomos de oxígeno y otro elemento. En estos compuestos el oxigeno actúa con número de oxidación -2. En general los óxidos son combinaciones del O (–2) con metales (óxidos metálicos) o no metales (óxidos no metálicos), excepto el flúor: 2.1. ÓXIDOS METÁLICOS U ÓXIDOS BÁSICOS Oxigeno + O2 + Metal → 4Li → Óxido de Metal 2Li2O Los elementos del Grupo 1 forman óxidos cuya formula general es: Me12O (Me1 = Li, Na, K, etc.); donde Me representa cualquier metal Esta fórmula se establece considerando que se requieren 2 átomos del metal, cada uno de ellos con número de oxidación (+1), par a balancear al O. Los metales del Grupo 2 forman óxidos, cuya fórmula general es: Me11O (Me11 = Be, Mg, Ca, Sr, Ba, etc.) 10 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S Esta fórmula se establece considerando que el número de oxidación (-2) del O es balanceado exactamente con un átomo de estos elementos, cuyo número de oxidación es (+2). Los elementos del Grupo 3 forman óxidos de fórmula general: Me1112O3 (Me111 = B, Al, Ga, etc.) Esta fórmula se establece considerando que, como cada elemento del Grupo tiene un número de oxidación de (+3) y el O de (-2), el balance se logra buscando el mínimo común múltiplo de ambos números, esto es: 2 x 3 = 6. Esto indica que deben tomarse 2 átomos del Me de número de oxidación (+3) y 3 átomos de O con número de oxidación (-2). Para los elementos representativos del los Grupos 1, 2 y 3, las ecuaciones de formación serian: I. 4 Me1 + O2 → 2Me12O II. 2 Me11 + O2 → 2 Me11O III. 4 Me111 + O2 → 2Me1112O3 La gran mayoría de los metales de transición actúan con número de oxidación (+2) y con el O forman compuestos del mismo tipo que los metales del Grupo 2. Sin embargo, algunos elementos de transición pueden actuar con más de un número de oxidación, como es el caso de Fe. Este elemento puede combinarse con el O, actuando con número de oxidación (+2) y (+3), formando dos óxidos diferentes, cuyas respectivas fórmulas son: I. FeO y II. Fe2O3 Esta familia de compuestos se designa como: i. de Stock: Óxido del metal utilizando numeral de stock (números romanos entre paréntesis) cuando el metal presenta más de un estado de oxidación posible. ii. sistemática: Óxido del metal utilizando prefijos que indiquen la cantidad de átomos de cada elemento. 11 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S iii. tradicional o clásica: Óxido del metal utilizando los prefijos oso e ico cuando el metal presenta más de un estado de oxidación posible. Ej: Sistemática de Stock Común Li2O monóxido de litio oxido de litio (I) oxido de litio CaO monóxido de calcio oxido de calcio (II) oxido de calcio MgO Monóxido Al2O3 de oxido de magnesio oxido de magnesio magnesio (II) trióxido de aluminio oxido de aluminio oxido de aluminio (III) FeO monóxido de hierro óxido de hierro (II) óxido ferroso Fe2O3 trióxido de dihierro óxido de hierro (III) óxido férrico Cr2O3 trióxido de dicromo óxido de cromo óxido crómico de cromo trióxido de cromo (III) CrO3 trióxido de cromo óxido (VI) Estas reglas de nomenclatura tienen carácter general y se aplican a cualquier otro elemento. 2.2. ÓXIDOS NO-METÁLICOS U ÓXIDOS ÁCIDOS Son compuestos que se forman como consecuencia de la reacción de un no metal con el oxígeno. Oxígeno + No-metal → Óxido de No-metal O2 + → SO2 S 12 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S Los no metales del Grupo 7 (llamados halógenos), con excepción del F, en sus combinaciones con el O, pueden actuar con los siguientes números de oxidación: +1+3, +5 y +7. Los compuestos que Se forman responden, respectivamente, a las siguientes fórmulas: Numero de oxidacion: (X= Cl, Br, I) +1 +3 +5 +7 X2O X2O3 X 2 O5 X2O7 Dentro de los no metales del Grupo 6, el S es un representante típico y forma con el O dos anhídridos principales. En uno de ellos, el S actúa con número de oxidación +4 y en el otro con número de oxidación +6. Las fórmulas de estos compuestos son como se indica: I. SO2 (S: número de oxidación = +4) II. SO3 (S: número de oxidación = +6) Dentro de los no metales del Grupo 5, el N y el P son los más importantes. Estos elementos forman con O varios compuestos, de los cuales los mas importantes son aquellos en que actúan con número de oxidación +3 y +5. Las fórmulas de estos compuestos son como se indica: I. N2O3 (N: número de oxidación = +3) II. N2O5 (N: número de oxidación = +5) III. P2O3 (P: número de oxidación = +3) IV. P2O5 (P: número de oxidación = +5) Los óxidos no-metálicos, al igual que los metálicos se pueden nombrar según la nomenclatura: i.de Stock: donde se indica el número de oxidación del elemento oxidado con números romanos. ii. sistemática: consiste en anteponer a la palabra “óxido” un prefijo que nos indique el número de oxígenos seguida de “de” y el nombre del no metal con un prefijo que nos indique el número de átomos de ese no metal. 13 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S iii. tradicional o clásica: Se los nombra como anhídrido (se utiliza para óxidos básicos, no los óxidos ácidos) nombrándose a éstos con el término general de anhídrido, a los que se agrega el nombre del no-metal, con una serie de prefijos y sufijos para distinguir los diferentes estados de oxidación (E.O.) con que pueden actuar. Hipo_______oso E.O menor _______oso 1 E.O. 2 E.O. 3 E.O 4 E.O. ________ico Per________ico E.O mayor Ej: Sistemática Stock Clásica Anhídrido hipofluoroso F2 O Monóxido de diflúor Óxido de flúor (excepción a la norma general de prefijos y sufijos) Cl2O Monóxido de dicloro Óxido de cloro (I) SO Monóxido de azufre Óxido de azufre (II) I2O3 Trióxido de diodo Óxido de Iodo (III) Anhídrido sulfuroso SeO2 Dióxido de Selenio Óxido de selenio (IV) Anhídrido selenioso Br2O5 Pentaóxido de dibromo Óxido de bromo (V) Anhídrido brómico S2O3 Óxido de azufre (VI) Anhídrido sulfúrico Trióxido de azufre Anhídrido hipocloroso Anhídrido hiposulfuroso 3. COMPUESTOS FORMADOS POR REACCIÓN DE: ÓXIDOS Y AGUA 3.1. HIDRÓXIDOS O BASES Estos compuestos se forman por reacción de un óxido básico con agua. El proceso puede esquematizarse de la siguiente forma: 14 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Oxido + agua → hidróxido Na2O + H2 O → 2NaOH Y N A T U R A L E S La transformación química involucra la reacción del O del óxido con agua, de acuerdo con el siguiente esquema: O= + H2O →2OH - - Es decir, que se forma un ión hidróxido, OH . Resulta importante notar que en este proceso el ión metálico del óxido original no sufre transformación alguna. Ej. Na2O + Oxido de Sodio CaO Hidróxido de Sodio + H2O → Ca(OH)2 Oxido de Calcio Al2O3 + → 2Na(OH) H2O Hidróxido de Calcio 3H2O → Oxido de Aluminio 2Al(OH)3 Hidróxido de Aluminio Desde el punto de vista de la nomenclatura estos compuestos se designan al igual que las otras familias según: i. de Stock: hidróxido del metal utilizando numeral de stock (números romanos entre paréntesis) cuando el metal presenta más de un estado de oxidación posible. ii. sistemática: Prefijos indicando la cantidad de iones oxidrilo (OH-) presentes en el compuesto. Ejemplos: Cu(OH)2 (dihidròxido de cobre), NaOH (monohidròxido de sodio), Fe(OH)3 Trihidròxido de hierro). iii. tradicional o clásica: Hidróxido del metal, utilizando los prefijos oso e ico cuando el metal presenta mas de un estado de oxidación posible. 15 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S Ej: Sistemática Monohidróxido de NaOH sodio Stock Clásica Hidróxido de sodio Hidróxido sódico. Ca(OH)2 Dihidróxido de calcio Hidróxido de calcio Hidróxido cálcico Ni(OH)2 Dihidróxido de níquel Hidróxido de níquel (II) Hidróxido niqueloso Hidróxido de aluminio Hidróxido alumínico Al(OH)3 Pb(OH)4 Trihidróxido de aluminio Tetrahidróxido de Hidróxido de plomo plomo (IV) Hidróxido plúmbico 3.2. OXACIDOS U OXOACIDOS. Los ácidos se originan por la reacción de los óxidos ácidos o anhídridos con agua. Los ácidos que provienen de anhídridos se especifican como oxácidos, por el hecho de contener oxígeno en sus moléculas. El proceso general de la formación de ácidos puede esquematizarse de la siguiente manera: Anhídrido SO2 + + Agua → H2 O → Acido SO3H2 La característica saliente de estos compuestos, los ácidos, es que disueltos en agua, sufren un proceso de disociación, formándose iones H+ y los correspondientes iones negativos. Nomenclatura: i. tradicional o clasica. El uso de la nomenclatura tradicional en los ácidos oxácidos, también llamados oxoácidos, es admitida por la IUPAC, como es el caso del ácido sulfúrico, H2SO4 o el ácido nítrico HNO3. Por tanto los prefijos y sufijos: hipo…oso, oso, ico y per…ico, nos indicarán el número de oxidación del elemento central del ácido, de menor a mayor. Por ejemplo: 16 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Nº de oxidación impar” Prefijo/sufijo Tipo de Fórmula Fórmula +1 hipo -oso HXO HClO +3 +5 -oso -ico HXO2 HXO3 HNO2 HBrO3 +7 per - ico HXO4 HClO4 Nº de oxidación “par” Prefijo/sufijo Tipo Fórmula de Fórmula Y N A T U R A L E S Nombre tradicional Ácido hipocloroso Ácido nitroso Ácido brómico Ácido perclórico Nombre tradicional +2 -oso H2XO2 H2CO2 +4 -ico H2XO3 H2CO3 +2 hipo -oso H2XO2 H2SO2 +4 +6 -oso -ico H2XO3 H2XO4 H2SO3 H2SO4 Ácido carbonoso Ácido carbónico Ácido hiposulfuroso Ácido sulfuroso Ácido sulfúrico ii. sistemática: Para nombrar estos ácidos con el criterio de la nomenclatura sistemática, empezaremos indicando mediante un prefijo (mono, di tri, tetra, …) el número de oxígenos (terminado en “oxo”) seguido del nombre del elemento central en “ato”, indicando entre paréntesis el número de oxidación de éste y finalmente diciendo “de hidrógeno”. Así por ejemplo el ácido sulfúrico es el tetraoxosulfato (VI) de hidrógeno. Otros ejemplos: Fórmula HNO2 H2SO3 HIO4 H2CrO4 H2SO2 HIO sistemática Dioxonitrato (III) de hidrógeno Trioxosulfato (IV) de hidrógeno Tetraoxoyodato (VII) de hidrógeno Tetraoxocromato (VI) de hidrógeno Dioxosulfato (II) de hidrógeno Monoxoyodato (I) de hidrógeno sistemática Ácido dioxonítrico (III) Ácido trioxosulfúrico (IV) Ácido tetraoxoyódico (VII) Ácido tetraoxocrómico (VI) Ácido dioxosulfúrico (II) Ácido monoxoyódico (I) La nomenclatura simplificada empieza el nombre del compuesto por la palabra “ácido” seguido por el número de oxígenos terminando en “oxo” y finalmente el nombre del elemento central terminado en “ico”, indicando el número de oxidación entre paréntesis en números romanos. El ácido dicrómico, es muy conocido por la utilización de sus sales. Su formula es: H2Cr2O7. 17 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Fórmula sistemática sistemática funcional H2Cr2O7 Heptaoxodicromato (VI) de hidrógeno Ácido heptaoxodicrómico (VI) Y N A T U R A L E S tradicional Ácido dicrómico El ácido ortofosfórico, H3PO4, también es muy usado en los laboratorios de química y se le suele denominar simplemente ácido fosfórico. En la siguiente tabla vemos las diferentes nomenclaturas de dicho ácido: Fórmula H3PO4 Nomenclatura sistemática Nomenclatura sistemática funcional Tetraoxofosfato (V) Ácido tetraoxofosfórico (V) de hidrógeno Nomenclatura tradicional Ácido ortofosfórico (Ácido fosfórico) 4. COMPUESTOS FORMADOS POR REACCIÓN DE: HIDRUROS Y AGUA. 4.1. HIDRACIDOS Se designan así a las soluciones acuosas de los compuestos que se forman entre el H y los no metales de los Grupos 7 y 6. Desde el punto de vista de la nomenclatura, estas soluciones acuosas se designan como ácidos y los nombres toman como raíz el nombre químico del nometal y se les agrega la terminación hídrico. Por ejemplo: Ej: Hidruros (en fase gaseosa) Hidrácidos (en disolución acuosa) HF fluoruro de hidrógeno HF(aq) ácido fluorhídrico HCl cloruro de hidrógeno HCl(aq) ácido clorhídrico HBr bromuro de hidrógeno HBr(aq) ácido bromhídrico HI yoduro de hidrógeno HI(aq) ácido yodhídrico H2S sulfuro de hidrógeno H2S(aq) ácido sulfhídrico H2Se seleniuro de hidrógeno H2Se(aq) ácido selenhídrico H2Te teleruro de hidrógeno H2Te(aq) ácido telurhídrico 5. COMPUESTOS FORMADOS POR REACCIÓN DE ÁCIDOS Y BASES: SALES 18 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S Con este nombre se designan los compuestos que se forman por reacción de un ácido con una base, según el esquema general: ACIDO + BASE SAL + AGUA Las sales son compuestos que pueden o no ser solubles en agua y se forman por el balance de las cargas negativas de los iones (aniones) formados por la disociación del ácido con las cargas positivas de los iones (cationes) de los elementos metálicos, provenientes de la disociación de la base. Juntamente con este proceso, los iones H+ del ácido se combinan con los iones OH- de la base, de acuerdo con la siguiente reacción: H+ (Ácido) + OH- (Base) → H2 O 5.1. SALES NEUTRAS: Las sales neutras de los ácidos oxácidos, surgen de sustituir los hidrógenos del ácido por el metal correspondiente, intercambiando los subíndices. i. tradicional o clasica: El nombre se forma de la siguiente manera; nombre del ácido del cual proviene, cambiando la terminación de (HÍDRICO por URO, OSO por ITO e ICO por ATO) del ( nombre del metal o radical catiónico). Si el metal tiene varios estados de oxidación, se utilizará el sistema Stock (números romanos entre paréntesis). Ejemplos: Fórmula FeCO3 Fe2(CO3)3 Nombre Carbonato de Hierro(II) Carbonato de Hierro(III) ii. sistemática: la denominación se realiza como; (Nombre del anión) de (nombre de metal o catión). El nombre del metal estaría sin ninguna variación, si el metal tiene varios estados de oxidación se utilizaría el Sistema Stock. El nombre del anión se forma con las normas establecidas. Si el átomo central se repite se utilizaría un prefijo de cantidad adecuado. 19 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S Ejemplos: Fórmula K2SiO3 NH4IO2 Nombre Trioxosilicato de Potasio Dioxoyodato(III) de Amonio Se puede prescindir de la notación del Oxígeno cuando el nombre no lleve a confusiones y se pueda escribir la fórmula fácilmente. Se puede emplear prefijos de cantidad para el número de átomos del catión. Ejemplos: Fórmula K2SiO3 NH4IO2 Nombre Silicato de Potasio Yodato(III) de Amonio Resumiendo: A continuación se da ejemplos de denominación de sales empleando la nomenclatura clásica y sistemática Fórmula KMnO4 sistemática Tetraoxomanganato (VII) de potasio clásica Permanganato potásico o permanganato de potasio. CaSO4 Tetraoxosulfato (VI) de calcio Sulfato cálcico o sulfato de calcio AgNO3 trioxonitrato (V) de plata Nitrato de plata Fe(NO2)3 dioxonitrato(III) de hierro(III) Nitrito férrico Cu(ClO4)2 tetraoxoclorato (VII) de cobre (II) Perclorato cúprico Na3PO4 tetraoxofosfato (V) de sodio Ortofosfato sódico o Fosfato sódico o fosfato de sodio K2Cr2O7 heptaoxodicromato (VI) de potasio Dicromato potásico o dicromato de potasio. 20 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S A continuación se da el nombre del metal como en los óxidos o hidróxidos. En lo que sigue se dan ejemplos de las reacciones químicas de formación de sales y la denominación correspondiente: HCl + Acido Clorhídrico H2S + Acido sulfhídrico 2 H ClO4 + Acido Perclórico 3H2SO4 + Acido sulfúrico Na(OH) → NaCl + → Hidróxido de sodio 2K(OH) → K2S Cloruro de sodio + Hidróxido de potasio Ba(OH)2 → → 2H2O Sulfuro de potasio Ba(ClO4)2 Hidróxido de bario Al(OH)3 H2 O + 2H2O Perclorato de bario Al2(SO4)3 Hidróxido de Aluminio + 6H2O Sulfato de Aluminio 5.2. SALES ÁCIDAS Si un ácido tiene más de un hidrógeno, puede ceder solamente alguno de ellos, originando una sal ácida. Así por ejemplo del ácido sulfúrico, H2SO4, se puede obtener el hidrógenosulfato de sodio, NaHSO4. Otra forma de nombrar este compuesto es, sulfato ácido de sodio. Otros ejemplos: Fórmula sistemática NaHCO3 Hidrógenotrioxocarbonato (IV) de sodio o Hidrógenocarbonato de sodio NaHSO3 Hidrógenotrioxosulfato (IV) de sodio o Hidrógenosulfito de sodio KH2PO4 Dihidrógenotetraoxofosfato (V) de potasio o Dihidrógenofosfato de potasio clásica Carbonato ácido de sodio Sulfito ácido de sodio Ortofosfato potasio diácido de El hidrógenocarbonato de sodio, NaHCO3, también es conocido como “bicarbonato sódico”, pero esto no es aceptado por la IUPAC. 21 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Y N A T U R A L E S 6. FORMULACIÓN DE IONES Los iones están formados por un átomo o un grupo de átomos con carga eléctrica. Si tienen carga negativa se denominan aniones y si es positiva cationes. Un ejemplo de anión es el ion cloruro, Cl-, y un ejemplo de catión es el ion calcio, Ca2+. Ejemplos: Cationes Aniones Ion sulfuro Ion tetraoxosulfato (VI) (ion sulfato) Ion trioxonitrato (V) (ion nitrato) Ion heptaoxodicromato (VI) (ion dicromato) Ion óxido Ion Peróxido Ion hidróxido Ion dioxoclorato (III) (ion clorito) Ion tetraoxomanganato (VII) (ion permanganato) 7. CUADRO 2- S SO42- Ion plata Ion aluminio Ag+ Al3+ NO3- Ion cobre (II) (ion cúprico) Cu2+ Cr2O72- Ion hierro (III) (ion férrico) Fe3+ O2O22OHClO2- Ion hidroxonio Ion hidrógeno (protón) Ion cobre (I) (ion cuproso) Ion plomo (IV) (ion plúmbico) H3O+ H+ Cu+ Pb4+ MnO4- Ion amonio NH4+ RESUMEN DE FORMULACIÓN Y NOMENCLATURA INORGÁNICA 1.Compuestos binarios Fórmulas y Nombres Ejemplos Na2O (Óxido de sodio) Nx O y PbO2 [Óxido de plomo (IV)] 1.1 Óxidos: óxidos básicos (metálicos) y óxidos ácidos (no metálicos) Stock [óxido de metal (nº romano)] Cl2O7 (Heptaóxido de dicloro) Sistemática: Prefijo numeral SO3 (Trióxido de azufre) MxO2 (peróxido de metal) 1.2 Peróxidos Peróxido = óxido + oxígeno K2O2 (Peróxido de potasio) BaO2 (Peróxido de bario) 22 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 MHx 1.3 Hidruros metálicos BiH3 (Hidruro de bismuto) NH3 (Trihidruro de nitrógeno; amoníaco) N Hx CH4 (Tetrahidruro de carbono; metano) Sistemática: Prefijo numeral. 1.4.1. Hidruros volátiles N A T U R A L E S CuH2 [Hidruro de cobre (II)] Stock [Hidruro de metal (nº romanos)] 1.4 Hidruros no metálicos: Y Nombres especiales HxN (---uro de hidrógeno) 1.4.2 Ácidos hidrácidos (ácido --- hídrico) 1.5 Combinaciones binarias metal - no metal: Sales binarias 1.6 Combinaciones binarias entre no metales: no metal no metal. 2. Compuestos ternarios Stock [--uro de metal (nº romano)] NxN´y Fórmulas y Nombres M(OH)x 2.1. Hidróxidos. 2.2. Oxácidos. Stock: Hidróxido de metal (nº romanos) HxXOy Tradicional (ácido ---oso) (ácido –ico) Sistemática [prefijo—oxoato (nº romano) de hidrógeno] Mx(XOy)z 2.3. Sales neutras. Oxosales HCl (Cloruro de hidrógeno) (ácido clorhídrico) Fe Cl3 [Cloruro de hierro (III)] MxNy Sistemática: Prefijo numeral. Tradicional: –ato de metal (nº romano) H2S (Sulfuro de hidrógeno) (ácido sulfhídrico) Al2S3 [Sulfuro de aluminio] CCl4 (Tetracloruro de carbono) SF6 (Hexafluoruro de azufre) Ejemplos Cu(OH)2 [Hidróxido de cobre (II)] Ca(OH)2 (Hidróxido de calcio) HClO3 (ácido clorico) (Trioxo clorato (V) de hidrógeno). H2SO3 (ácido sulfuroso) [Trioxo sulfato (IV) de hidrógeno] Ba(ClO3)2 (Clorato de bario) [Trioxo clorato (V) de bario] 23 | Q G ( 3 2 0 3 ) - 2 0 1 2 U N I V E R S I D A D N A C I O N A L D E R Í O C U A R T O F A C U L T A D D E C I E N C I A S E X A C T A S F Í S I C O - Q U Í M I C A S D E P A R T A M E N T O D E Q U Í M I C A Q U Í M I C A G E N E R A L G ( 3 2 0 3 ) A Ñ O : 2 0 1 2 Sistemática [prefijo—oxoato (nº romano) de hidrógeno] Y N A T U R A L E S Pb (SO4)2 [Sulfato de plomo (IV)] [Tetraoxosulfato (VI) de plomo (IV)] K2Cr2O7 Dicromato potasico Mx(HXOy)z Compuestos cuaternarios 2.4. Sales ácidas. 3. Iones: 3.1 Aniones Hidrogeno—no metal--ato de metal (nº romano) Especies cargadas Especies cargadas negativamente [Heptaoxodicromato (VI) de potasio] NaHCO3 [Hidrógenocarbonato de sodio] [Hidrógenotrioxocarbonato (IV) de sodio] Ejemplos Cl-[ion cloruro]; sulfuro] S2- [Ion Monoatómicos: Ion --uro Poliatómicos: ion --ato o --ito 3.2 Cationes Especies cargadas positivamente SO42-[Ion sulfato]; SO32-[Ion sulfito] MnO4-[Ion tetraoxomanganato (VII)] Cu2+ [Ion cobre (II)]; Al3+ [Ion aluminio] Ion nombre de metal (nº romano) NH4+ [Ion amonio]; Fe3+ [Ion Nota: El ion mercurio (I) es diatómico: hierro (III)] Hg22+ 24 | Q G ( 3 2 0 3 ) - 2 0 1 2