Apéndice: Formulación y nomenclatura en Química Inorgánica 1
Anuncio

Apéndice: Formulación y nomenclatura en Química Inorgánica
FORMULACIÓN Y NOMENCLATURA EN QUÍMICA INORGÁNICA
Denominamos nomenclatura al conjunto de normas necesarias para nombrar las
fórmulas de sustancias u otras especies químicas como los iones y formulación, al
procedimiento utilizado para establecer las fórmulas de las sustancias y especies
químicas.
En este apéndice hemos seguido las últimas recomendaciones de la IUPAC (Unión
Internacional de Química Pura y Aplicada), con las que intenta homogeneizar los
distintos criterios que se utilizan para escribir las fórmulas y los nombres de las
sustancias químicas. Por razones de diversa índole, algunos compuestos, como el ácido
sulfúrico, se siguen identificando con su nombre tradicional. Esto ha llevado a la
IUPAC a admitirlos como válidos.
Tanto para formular como para nombrar se ha utilizado tradicionalmente el concepto de
valencia. En la actualidad, este concepto ha caído en desuso y se prefiere el de número
de oxidación (en adelante n.ox). El n.ox. de un átomo en una sustancia o ion es un
número ficticio (al contrario que la carga eléctrica que es real). Se define como la
diferencia entre el número de electrones que un átomo neutro tiene en la capa de
valencia y el número de electrones que tendría en un enlace químico, después de
asignar los electrones de enlace al átomo más electronegativo. Así, en el NaCl, como el
sodio transfiere su único electrón de valencia al Cl que se queda con un electrón de
más, el n.ox. del Na es +1 y el del Cl -1. En el caso del CO2, los electrones de los
dobles enlaces C=O se asignan al oxígeno, por ser éste más electronegativo que el
carbono. De esta manera el carbono se quedará sin sus electrones que le son asignados
a los átomos de oxígeno; en consecuencia, el n.ox. del C será +4 y el del O -2.
Este procedimiento para calcular los n.ox. requiere identificar los enlaces químicos
presentes, lo que puede resultar tedioso y, en el caso de moléculas complicadas, difícil.
Para salvar esta situación se dispone de un conjunto de reglas (que no estudiamos aquí)
que permiten calcular de forma muy sencilla el n.ox. Además, una regla que deberemos
tener en cuenta siempre es que la suma de los n.ox. de todos los átomos en una
molécula neutra es cero y en un ion poliatómico coincide con la carga del ion. Así en el
CO2 (dióxido de carbono), por ejemplo, la suma del n.ox. del C (+4) y del n.ox. de cada
O (-2) es +4 + (-2-2) = 0; en el NH4+ (ion amonio), la suma del n.ox. del N (-3) y del
n.ox. de cada H (+1) es -3 + (+1+1+1+1) = +1. En el cuadro que se incluye al final de
este apéndice, se encuentran los n.ox. más frecuentes.
En las páginas que siguen, hemos recogido lo que consideramos que es necesario que
aprendan los alumnos de bachillerato. Esto nos ha llevado a renunciar a estudiar la
nomenclatura tradicional. Aunque aparece en muchos libros de texto y se emplea
profusamente fuera del ámbito académico (en industrias o laboratorios), creemos que
este pequeño sacrificio facilita que se pueda dedicar el escaso horario lectivo de la
asignatura de química a otros contenidos más formativos o de mayor actualidad.
Si bien el estudio de la nomenclatura y la formulación es necesario, no debe
considerarse como un conjunto de reglas que tienen que ser memorizadas sin más, sino
que deben tratarse en estrecha relación con los enlaces químicos. Nuestro objetivo es
que nombres correctamente, aunque no de todas las maneras posibles, las especies
químicas más frecuentes cuando conozcas su fórmula y que las formules cuando
conozcas algunos de sus nombres.
Finalmente, queremos señalar que saber formular o nombrar las sustancias no significa,
necesariamente, saber química. La formulación y la nomenclatura forman parte de la
química pero conocer el lenguaje no significa que se comprenda el significado de las
cosas que se dicen.
1
Apéndice: Formulación y nomenclatura en Química Inorgánica
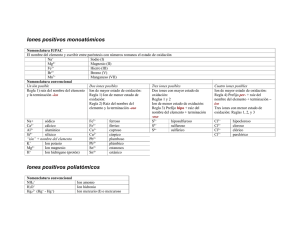
1. SUSTANCIAS SIMPLES
El n.ox. de un elemento en una sustancia simple es cero. Se nombran utilizando prefijos
numerales que indican el número de átomos del elemento, que se escriben como
subíndice, en la fórmula de la sustancia. Cuando el subíndice es la unidad no se utiliza
el prefijo mono.
Fórmula
Nomenclatura sistemática
O2
O3
H2
Fe
Ne
Dioxígeno
Trioxígeno
Dihidrógeno
Hierro
Neón
Nomenclatura
Tradiconal
Oxígeno
Ozono
Hidrógeno
Hierro
Neón
2. SUSTANCIAS COMPUESTAS
2.1 COMBINACIONES BINARIAS
Para formular las sustancias binarias, se coloca a la derecha el elemento más
electronegativo y a la izquierda el menos electronegativo.
Óxidos
Son combinación de cualquier elemento con el oxígeno, en las que el n.ox. de éste es 2. (O-2) . Se tiene que cumplir que la suma de los n.ox. debe ser cero. Así por ejemplo
en el óxido de litio, como el n.ox. del Li es +1, la fórmula es Li2O. Para el óxido de
magnesio, al ser el n.ox. del Mg +2, la fórmula será MgO.
Fórmula
K 2O
Cu2O
Fe2O3
CO
SiO2
N 2O 5
Nomenclatura sistemática
Monóxido de dipotasio
Monóxido de dicobre
Trióxido de dihierro
Monóxido de carbono
Dióxido de silicio
Pentóxido de dinitrógeno
Nomenclatura Stock
Óxido de potasio
Óxido de cobre (I)
Óxido de hierro (III)
Óxido de carbono (II)
Óxido de silicio (IV)
Óxido de nitrógeno (V)
En la nomenclatura de Stock, en el caso de que el metal tenga un solo n.ox., no es
necesario especificarlo.
En la nomenclatura sistemática, cuando los dos subíndices son 1, el prefijo “mono” sólo
es necesario utilizarlo como prefijo de la palabra óxido (monóxido de carbono, en lugar
de monóxido de monocarbono). En el caso de que solo uno de los dos elementos tenga
como subíndice 1, puede no utilizarse el prefijo “mono” (óxido de dipotasio en lugar de
monóxido de dipotasio o dióxido de silicio en lugar de dióxido de monosilicio).
Peróxidos
En estos compuestos el oxígeno tiene de n.ox. -1. Hay que tener en cuenta que los
átomos de O con n.ox. -1 no existen como átomos aislados, sino que se presentan en
grupos de dos átomos (O2-2).
2
Apéndice: Formulación y nomenclatura en Química Inorgánica
La nomenclatura sistemática de los peróxidos es la misma que la de los óxidos (K2O2),
dióxido de dipotasio; CaO2, dióxido de calcio). No se utiliza la nomenclatura de Stock.
También se utiliza el nombre tradicional (peróxido de potasio y peróxido de calcio).
Fórmula
Na2O2
BaO2
H 2O 2
MgO2
Nomenclatura sistemática
Dióxido de disodio
Dióxido de bario
Dióxido de dihidrógeno
Dióxido de magnesio
Nomenclatura
Tradicional
Peróxido de sodio
Peróxido de bario
Peróxido de hidrógeno
Peróxido de magnesio
Hidruros.
Son combinaciones del hidrógeno con otro elemento.
Hidruros metálicos.
El hidrógeno que tiene n.ox. -1 se combina con un metal con n.ox. positivo. De forma
análoga a los óxidos, cuando el metal solo tiene un n.ox. no es necesario indicarlo
(NaH, hidruro de sodio, en lugar de hidruro de sodio (I))
Fórmula
KH
NiH3
CuH2
PbH4
Nomenclatura
sistemática
Hidruro de potasio
Trihidruro de níquel
Dihidruro de cobre
Tetrahidruro de plomo
Nomenclatura Stock
Hidruro de potasio
Hidruro de níquel (III)
Hidruro de cobre (II)
Hidruro de plomo (IV)
Hidruros no metálicos de los grupos 13, 14 y 15
El hidrógeno tiene n.ox. +1 y, obviamente, el otro elemento tiene un n.ox. negativo.
Estos hidruros constituyen una excepción, pues en la fórmula se escribe el elemento
menos electronegativo a la derecha. Así, para la combinación del hidrógeno y el
nitrógeno, y según la regla general, se debería escribir H3N en lugar de NH3 (fórmula
aceptada para el amoniaco).
Fórmula
BH3 (*)
CH4
SiH4
NH3
PH3
Nomenclatura
sistemática
Trihidruro
de
boro
Tetrahidruro de
carbono
Tetrahidruro de
silicio
Trihidruro
de
nitrógeno
Trihidruro
de
fósforo
Nomenclatura
Stock
Hidruro de Boro
(III)
Hidruro
de
carbono (IV)
Hidruro de silicio
(IV)
Hidruro
de
nitrógeno (III)
Hidruro
de
fósforo (III)
Nomenclatura
tradicional
Borano
Metano
Silano
Amoniaco
Fosfina
(*) En realidad el BH3 no existe. El hidruro de boro estable es el B2H6 cuyo nombre es
diborano (hexahidruro de diboro)
Hidruros no metálicos de los grupos 16 y 17
3
Apéndice: Formulación y nomenclatura en Química Inorgánica
El hidrógeno tiene n.ox. +1, por lo que no se trata de hidruros propiamente dichos. Al
escribirse, según la regla general, como HX, se nombran con la raíz del nombre del
elemento X terminado en –uro, y a continuación “de hidrógeno”.
Fórmula
HI
HBr
H 2S
H2Se
Nomenclatura sistemática
Yoduro de hidrógeno
Bromuro de hidrógeno
Sulfuro de dihidrógeno o
Sulfuro de hidrógeno
Seleniuro de dihidrógeno o
Seleniuro de hidrógeno
En disolución acuosa
(hidrácidos)
Ácido yodhídrico
Ácido bromhídrico
Ácido sulfhídrico
Ácido selenhídrico
Al formar cada elemento un solo compuesto con el hidrógeno, la nomenclatura
sistemática se puede simplificar (yoduro de hidrógeno en lugar de monoyoduro de
hidrógeno y sulfuro de hidrógeno en lugar de sulfuro de dihidrógeno).
Las disoluciones acuosas de estos compuestos tienen propiedades ácidas, por lo que se
denominan hidrácidos. Para nombrarlos se utiliza el prefijo “ácido” y el sufijo
“hídrico”. Así, por ejemplo, la disolución acuosa del cloruro de hidrógeno (HCl) se
denomina ácido clorhídrico [HCl (aq)]
Otras combinaciones binarias
En este grupo se incluyen las combinaciones metal-no metal y no metal-no metal. El
elemento más electronegativo se escribe a la derecha y al nombrar la sustancia se
emplea el sufijo –uro, que se añade al nombre de dicho elemento, seguido del nombre
del otro elemento.
En las combinaciones no metal-no metal el elemento que en la fórmula figura a la
izquierda emplea siempre uno de los n.ox. positivos. Aquel elemento que figura a la
derecha utiliza el n.ox. negativo. Así, por ejemplo, en el triyoduro de fósforo (PI3), el
n.ox. del yodo es -1; en cambio, en el heptafluoruro de yodo (IF7), el n.ox. del yodo es
+7.
Las combinaciones binarias metal-no metal se conocen como sales neutras (NaCl, CsI,
BaSe).
Fórmula
FeS
PF3
AuCl3
SCl4
MnS2
Nomenclatura sistemática
Monosulfuro de hierro
Trifluoruro de fósforo
Tricloruro de oro
Tetracloruro de azufre
Disulfuro de manganeso
2.2. COMBINACIONES TERNARIAS
Hidróxidos
4
Nomenclatura Stock
Sulfuro de hierro (II)
Fluoruro de fósforo (III)
Cloruro de oro (III)
Cloruro de azufre (IV)
Sulfuro de manganeso
(IV)
Apéndice: Formulación y nomenclatura en Química Inorgánica
Son compuestos que contienen el ion hidróxido, OH-, unido a un catión, normalmente
metálico. Fíjate que la suma de los n.ox. del O y del H es igual a la carga del ion (en
efecto, el n.ox. del O es -2 y el del H es +1 y la suma de ambos es -1).
Hay que tener en cuenta que la carga eléctrica neta de la fórmula ha de ser cero.
Fórmula
Al (OH)3
Pb(OH)2
Co(OH)3
Mn(OH)4
Nomenclatura
sistemática
Trihidróxido de aluminio
Dihidróxido de plomo
Trihidróxido de cobalto
Tetrahidróxido
manganeso
de
Nomenclatura Stock
Hidróxido de aluminio
Hidróxido de plomo (II)
Hidróxido de cobalto
(III)
Hidróxido de manganeso
(IV)
La disolución de amoníaco en agua, llamada hidróxido de amonio es NH4OH, ya que
contiene los iones NH4+ y OHOxoácidos
Estas sustancias se denominan así por presentar carácter ácido y tener oxígeno en su
molécula. Su fórmula general es HaXbOc, en la que X suele ser un elemento no metálico
aunque puede ser un metal de transición con alto n.ox. (Mn, Cr, W, etc.)
Para nombrar estos ácidos, según la nomenclatura sistemática, se indica mediante un
prefijo (di, tri, tetra…) el número de átomos de oxígeno seguido de la terminación -oxo.
A continuación se escribe mediante un prefijo (di, tri, tetra…) el número de átomos del
elemento central seguido de la raíz del nombre de dicho elemento terminado en -ato,
indicando entre paréntesis y con números romanos su número de oxidación. Finalmente
se añade “de hidrógeno”. Así, por ejemplo, el H2SO4 se nombrará como
Tetraoxosulfato (VI) de hidrógeno. Observa que para poder nombrar un oxoácido es
necesaario averiguar, antes de nada, el n.ox. del átomo central.
En la llamada nomenclatura sistemática funcional se empieza nombrando el
compuesto con la palabra “ácido” seguida, de forma análoga a la nomenclatura del
párrafo anterior, por el número de átomos de oxígeno junto con la raíz del nombre del
átomo central, pero terminado en ico, y añadiendo el n.ox. entre paréntesis en notación
romana. En este caso, no es necesario poner al final “de hidrógeno”.
Fórmula
HNO2
H2SO3
HIO4
H2Cr2O7
H2CrO4
H2SO2
HIO
Nomenclatura sistemática
Dioxonitrato (III) de
hidrógeno
Trioxosulfato (IV) de
hidrógeno
Tetraoxoyodato (VII) de
hidrógeno
Heptaoxodicromato (VI) de
hidrógeno
Tetraoxocromato (VI) de
hidrógeno
Dioxosulfato (II) de
hidrógeno
Oxoyodato (I) de
hidrógeno
5
Nomenclatura
sistemática funcional
Ácido dioxonítrico (III)
Ácido trioxosulfúrico
(IV)
Ácido tetraoxoyódico
(VII)
Ácido
heptaoxodicrómico (VI)
Ácido tetraoxocrómico
(VI)
Ácido dioxosulfúrico (II)
Ácido oxoyódico (I)
Apéndice: Formulación y nomenclatura en Química Inorgánica
La IUPAC admite para determinadas sustancias los nombres de la nomenclatura
tradicional. Esto se debe a la importancia (en la industria, el comercio, etc) de estos
compuestos. En la siguiente tabla se indican aquellos oxoácidos cuyo nombre
tradicional ha de memorizarse.
Fórmula
HNO3
HNO2
H2SO4
Nomenclatura
sistemática
Trioxonitrato (V)
de hidrógeno
Dioxonitrato (III)
de hidrógeno
Tetraoxosulfato
(VI) de hidrógeno
H2SO3
Trioxosulfato (IV)
de hidrógeno
H3PO4
Tetraoxofosfato
(V) de hidrógeno
HClO4
Tetraoxoclorato
(VII) de hidrógeno
H2CO3
Trioxocarbonato
(IV) de hidrógeno
HMnO4
Tetraoxomanganato
(VII) de hidrógeno
H2CrO4
Tetraoxocromato
(VI) de hidrógeno
H2Cr2O7
Heptaoxodicromato
(VI) de hidrógeno
H4SiO4
Tetraoxosilicato
(IV) de hidrógeno
H3BO3
Trioxoborato
de hidrógeno
(III)
Nomenclatura
sistemática
funcional
Nomenclatura
tradicional
Ácido nítrico
Ácido dioxonítrico
(III)
Ácido
tetraoxosulfúrico
(VI)
Ácido
trioxosulfúrico
(VI)
Ácido
tetraoxofosfórico
(V)
Ácido
tetraoxoclórico
(VII)
Ácido
trioxocarbónico
(IV)
Ácido
tetraoxomangánico
(VII)
Ácido
tetraoxocrómico
(VI)
Ácido
heptaoxodicrómico
(VI)
Ácido
tetraoxosilícico
(IV)
Ácido trioxobórico
(III)
Ácido nítroso
Ácido
sulfúrico
Ácido
sulfuroso
Ácido
fosfórico
Ácido
perclórico
Ácido
carbónico
Ácido
permangánico
Ácido
crómico
Ácido
dicrómico
Ácido silícico
Ácido bórico
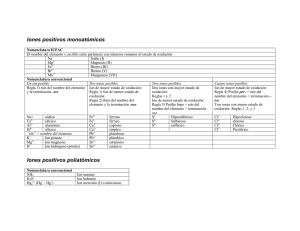
Iones
Un ion es un átomo o un grupo de átomos con carga eléctrica. Si tienen carga negativa
se denominan aniones y si es positiva, cationes. Para nombrar los cationes
monoatómicos se utiliza la palabra ion seguida del nombre del elemento y, si es
necesario, su n.ox. entre paréntesis y con notación romana (ion sodio: Na+; ion cobre
(I): Cu+). De los cationes poliatómicos, los más usuales son: H3O+ (hidronio) y NH4+
(amonio).
Para nombrar los aniones monoatómicos se escribe la raíz del elemento seguida de la
terminación -uro (ion cloruro: Cl-; ion nitruro: N3-). Los aniones poliatómicos sresultan
6
Apéndice: Formulación y nomenclatura en Química Inorgánica
de la eliminación total o parcial de los iones H+ de los oxoácidos. Así, del H2CO3 se
pueden formar dos aniones: HCO3- y CO32-. El nombre de cada uno de ellos se obtiene
eliminando la terminación “de hidrógeno” en el nombre sistemático del oxoácido de
partida. En consecuencia, el HCO3- se denomina ion hidrógenotrioxocarbonato (IV), y
el CO32- ion trioxocarbonato (IV).
Aniones
Ion sulfuro
Ion cianuro
Ion tetraoxosulfato (VI)
Ion trioxonitrato (V)
Ion heptaoxodicromato (VI)
Ion óxido
Ion Peróxido
Ion hidróxido
Ion dioxoclorato (III)
Ion tetraoxomanganato (VII)
(ion permanganato)
Ion dioxonitrato (III)
Ion trioxonitrato (IV)
OHClO2MnO4-
Cationes
Ion plata
Ion hidronio
Ion aluminio
Ion cobre (II)
Ion hierro (III)
Ion calcio
Ion hidrógeno
(protón)
Ion cobre (I)
Ion plomo (IV)
Ion oro (III)
Cu+
Pb4+
Au3+
NO2SO32-
Ion sodio
Ion amonio
Na+
NH4+
S2CNSO42NO3Cr2O72O2O22-
Ag+
H 3O +
Al3+
Cu2+
Fe3+
Ca2+
H+
Por su extendido uso, se recoge en la tabla siguiente la nomenclatura tradicional de
algunos aniones poliatómicos. El nombre tradicional se obtiene eliminando la palabra
“ácido” del oxoácido de partida y cambiando su terminación “ico” por “ato” o su
terminación “oso” por “ito”
Fórmula
HNO3
HNO2
H2SO4
H2SO3
H3PO4
HClO4
H2CO3
HMnO4
H2CrO4
H2Cr2O7
H4SiO4
H3BO3
Oxoácido
Nomenclatura
tradicional
Ácido nítrico
Ácido nítroso
Ácido sulfúrico
Ácido sulfuroso
Ácido fosfórico
Ácido perclórico
Ácido carbónico
Ácido
permangánico
Ácido crómico
Ácido dicrómico
Ácido silícico
Ácido bórico
NO3NO2SO42SO32PO43ClO4CO32MnO4-
Anión
Nomenclatura
tradicional
Ion nitrato
Ion nitrito
Ion sulfato
Ion sulfito
Ion fosfato
Ion perclorato
Ion carbonato
Ion permanganato
CrO42Cr2O72SiO44BO33-
Ion cromato
Ion dicromato
Ion silicato
Ion borato
Fórmula
Sales neutras
Además de las sales vistas en el apartado “Otras combinaciones binarias”, existen las
sales neutras de los oxoácidos. Están formadas por un catión y un anión, de manera que
la carga neta de la combinación de los iones sea cero.
Así en el Na2SO4 el catión es el Na+ (ion sodio) y el anión es el SO42- (ion
tetraoxosulfato (VI); el nombre de esta sal es tetraoxosulfato (VI) de sodio. Fíjate que
primero se nombra primero el anión y luego el catión.
7
Apéndice: Formulación y nomenclatura en Química Inorgánica
Fórmula
KMnO4
CaSO4
AgNO3
Fe(NO2)3
Cu(ClO4)2
Na3PO4
K2Cr2O7
Fe(NO3)3
Nomenclatura sistemática
Tetraoxomanganato (VII)
de potasio
Tetraoxosulfato (VI) de
calcio
Trioxonitrato (V) de plata
Dioxonitrato(III)
de
hierro(III)
Tetraoxoclorato (VII) de
cobre (II)
Tetraoxofosfato (V) de
sodio
Heptaoxodicromato (VI) de
potasio
Trioxonitrato (V) de hierro
(III)
Nomenclatura
tradicional
Permanganato
de
potasio
Sulfato de calcio
Nitrato de plata
Nitrito de hierro (III)
Perclorato de cobre
(II)
Fosfato de sodio
Dicromato de potasio
Nitrato de hierro (III)
Sales ácidas
En estas sales el anión posee algún hidrógeno ácido (esto es en disolución acuosa se
libera como H+). Se nombran procediendo de la misma manera que el resto de las sales,
es decir, primero el anión y luego el catión.
Fórmula
NaHCO3
NaHSO3
KH2PO4
Nomenclatura sistemática
Hidrógenotrioxocarbonato (IV) de sodio
Hidrógenotrioxosulfato (IV) de sodio
Dihidrógenotetraoxofosfato (V) de potasio
El hidrógenotrioxocarbonato (IV) de sodio, NaHCO3, es conocido ampliamente como
“bicarbonato sódico”, un nombre que no es aceptado por la IUPAC.
Nota: Las sales ácidas son compuestos cuaternarios, ya que están formados por cuatro
elementos.
8
Apéndice: Formulación y nomenclatura en Química Inorgánica
Números de oxidación más comunes de elementos usuales
METALES
+1
+1
Li
Litio
Na
Sodio
K
Potasio
Rb
Rubidio
Cs
Cesio
Ag
Plata
+2
Be
Berilio
Mg
Magnesio
Ca
Calcio
Sr
Estroncio
Ba
Bario
Zn
Cinc
Cd
Cadmio
+3
B (-3)
Boro
Al
Aluminio
+1
+2
+1
+3
+2
+3
+2
+4
Cu
Cobre
Hg
Mercurio
-2
Au
Oro
(En los peróxidos -1)
Fe
Hierro
Co
Cobalto
Ni
Níquel
Sn
Estaño
Pb
Plomo
Pt
Platino
+2
+3
+4
+5
+6
+2,
+3
+4
+6
+7
-1
NO METALES
H
Hidrógeno
(En los hidruros
metálicos -1)
F
Flúor
O
Oxígeno
Cr
Cromo
Mn
Manganeso
-4
+4
-3
+3
+5
C (+2)
Carbono
Si
Silicio
N (+1, +2, +4)
Nitrógeno
P (+1)
Fósforo
As
Arsénico
Sb
Antimonio
-2
+2
+4
+6
S
Azufre
Se
Selenio
Te
Teluro
-1
+1
+3
+5
+7
Cl
Cloro
Br
Bromo
I
Yodo
El oxígeno con n.ox. -1 y el mercurio +1 no existen como iones aislados, sino en
agrupaciones diatómicas (dímeros) de fórmulas O22- y Hg22+, respectivamente.
9
Apéndice: Formulación y nomenclatura en Química Inorgánica
CUADRO RESUMEN DE FORMULACIÓN Y NOMENCLATURA INORGÁNICA
1.Compuestos
binarios
Fórmulas/Nombres
N xO y
Nomenclatura
preferente:
• o. metálicos:
Stock
• o, no metálicos:
Sistemática
1.1 Óxidos:
metálicos
y no metálicos
1.2 Peróxidos
M xO 2
1.3
Hidruros
metálicos.
MHx
1.4 Hidruros no
metálicos:
1.4.1.
Hidruros
grupos 13, 14 y 15.
1.4.2
Hidruros
grupos 16 y 17
(Hidrácidos).
1.5 Combinaciones
binarias metal-no
metal:
Sales binarias
1.6 Combinaciones
binarias no metal no metal.
NHx
Na2O (Óxido de
sodio)
PbO2 [Óxido de
plomo (IV)]
Cl2O7 (Heptaóxido
de dicloro)
SO3 (Trióxido de
azufre)
K2O2 (Peróxido de
potasio)
BaO2 (Peróxido de
bario)
CuH2 [Hidruro de
cobre (II)]
BiH3 (Hidruro de
bismuto)
NH3 (Trihidruro de
nitrógeno;
amoníaco)
CH4 (Tetrahidruro
de
carbono;
metano)
H2S (Sulfuro de
hidrógeno) (ácido
sulfhídrico)
HCl (Cloruro de
hidrógeno) (ácido
clorhídrico)
FeCl3 [Cloruro de
hierro (III)]
Al2S3 [Sulfuro de
aluminio]
CCl4 (Tetracloruro
de carbono)
SF6 (Hexafluoruro
de azufre)
H xN
M xN y
NxN´y
2.
Compuestos
ternarios
Fórmulas/Nombres
2.1.
Hidróxidos.
M(OH)x
2.2.
Oxoácidos.
HaXbOc
2.3.
Oxosales
Ejemplos
Ejemplos
Cu (OH)2 [Hidróxido de
cobre (II)]
Ca (OH)2 (Hidróxido de
calcio)
HClO3 (ácido clorico)
(Trioxo clorato (V) de
hidrógeno).
H2SO3 (ácido sulfuroso)
[Trioxo sulfato (IV) de
hidrógeno]
Ba(ClO3)2
[Trioxo clorato (V) de
bario]
[Sulfato
de
Pb(SO4)2
Ma(XbOc)d
10
Apéndice: Formulación y nomenclatura en Química Inorgánica
Compuestos
cuaternarios
2.4.
Sales
ácidas.
plomo (IV)]
[Tetraoxosulfato (VI) de
plomo (IV)]
K2Cr2O7 (Dicromato de
potasio)
[Heptaoxodicromato (VI)
de potasio]
NaHCO3
[Hidrógenotrioxocarbonato
(IV) de sodio]
Ma(HbXcOd)e
3. Iones:
Especies cargadas
3.1 Aniones
Monoatómicos: XnPoliatómicos: XaObn-
3.2 Cationes
Monoatómicos: Yn+
Poliatómicos.
11
Ejemplos
Cl- (ion cloruro)
S2- (Ion sulfuro)
SO42- [Ion tetraoxosulfato
(VI)] (ion sulfato)
SO32- [Ion trioxosulfato
(IV)] (Ion sulfito)
MnO4[Ion
tetraoxomanganato (VII)]
Cu2+ [Ion cobre (II)]
Al3+ (Ion aluminio)
NH4+ (Ion amonio)
Fe3+ [Ion hierro (III)]
Apéndice: Formulación y nomenclatura en Química Inorgánica
Ejercicios de formulación inorgánica propuestos en las Pruebas de Acceso a la
Universidad (PAU) del Distrito Universitario de Canarias.
Formular o Nombrar (de una sola forma) según corresponda, las siguientes especies
químicas:
Formular
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
Nombrar
Cloruro de nitrógeno (III) (Tricloruro de nitrógeno)
Hidróxido de calcio
Peróxido de litio (Dióxido de dilitio)
Óxido de hierro (II)
Sulfuro de sodio
Hidróxido de plomo (II)
Peróxido de potasio (Dióxido de dipotasio)
Hidróxido de plata
Óxido de estaño (IV)
Hidróxido de aluminio
Sulfuro de bario
Óxido de plata
Hidróxido de sodio
Sulfuro de hidrógeno (Ácido sulfhídrico)
Óxido de plomo (IV)
Hidróxido de cobre (II)
Cloruro de níquel (II)
Peróxido de bario (Dióxido de bario)
Hidruro de fósforo (III)
Hidróxido de potasio
Ácido trioxoclórico (V) (Ácido clórico)
Tetraoxomanganato (VII) de sodio (Permanganato sódico)
Hidruro de potasio
Peróxido de cobre (I)
Ácido tetraoxocrómico (VI) (Ácido crómico)
Tetraoxosulfato (VI) de aluminio (Sulfato de aluminio)
Hidruro de magnesio
Hidróxido de bario
Trioxoclorato (V) de potasio (Clorato potásico)
Óxido de bario
Cloruro de plata
Hidruro de estroncio
Hidróxido de plomo (IV) (Hidróxido plúmbico)
Tetraoxoclorato (VII) de potasio (Perclorato potásico)
Ion cobre(I) (Ion cuproso)
Óxido de sodio
Sulfuro de hierro(III) (Sulfuro férrico)
Ion trioxosulfato (IV) (Ion sulfito)
Hidróxido de hierro (II) (Hidróxido ferroso)
Cloruro de magnesio
Ácido tetraoxomangánico (VI) (Ácido mangánico)
Bromuro de fósforo (III) (Tribromuro de fósforo)
Hidrógenotrioxocarbonato (IV) de litio (Bicarbonato de litio)
Ion mercurio(II)
12
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
Cu2+
ClO3H2SO4
K2MnO4
HClO4
CO32H3PO4
CaI2
NH4ClO3
NaHSO4
HCO3PH5
H2O2
HSO4K2O2
H2PO4FeCl3
NaMnO4
FNaHCO3
Al3+
PO3Fe2O3
LiHCO3
Mg2+
Li2O
FeS
Na2HPO4
Pb2+
SO32CuO2
NaH2PO4
H2CrO4
Hg2+
NO3H2MnO4
BaO2
PCl3
CuH2
NaH2PO3
PI5
Cu+
CaO2
KBr
Apéndice: Formulación y nomenclatura en Química Inorgánica
Formular
45.
46.
47.
48.
49.
50.
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
83.
84.
85.
86.
87.
88.
89.
90.
Nombrar
Cromato de plata [Tetraoxocromato (VI) de plata]
Ácido ortofosfórico [Tetraoxofosfato (V) de hidrógeno]
Carbonato de bario [Trioxocarbonato (IV) de bario]
Hidróxido de mercurio (II)
Ácido trioxomangánico (IV) (Ácido manganoso)
Carbonato potásico [Trioxocarbonato (IV) de potasio]
Trihidruro de antimonio (estibina)
Permanganato de calcio [Tetraoxomanganato (VII) de calcio]
Trioxoclorato (V) de amonio (Clorato de amonio)
Hidróxido de calcio (Dihidróxido de calcio)
Bromuro de plata (Monobromuro de plata)
Cloruro de mercurio (I) (Cloruro mercurioso)
Fosfito diácido de sodio [Dihidrogenotrioxofosfato (III) de sodio]
Perclorato de potasio [Tetraoxoclorato (VII) de potasio]
Fosfina (Trihidruro de fósforo)
Óxido de hierro (III) (Trióxido de dihierro)
Ácido crómico (Ácido tetraoxocrómico VI)
Acido monoxoyódico (I) (Ácido hipoyodoso)
Ácido tetraoxofosfórico(V) (Ácido ortofosfórico)
Oxido de platino (IV) (Dióxido de platino)
Ácido bromhídrico (Monobromuro de hidrógeno)
Trioxocarbonato (IV) de potasio (Carbonato potásico)
Bromuro de potasio (Bromuro potásico)
Ácido trioxosulfúrico (IV) (Ácido sulfuroso )
Tetraoxosulfato (VI) de hierro(III) (Sulfato férrico)
Dihidruro de cobre (Hidruro de cobre (II))
Óxido de cromo (III) (Trióxido de dicromo)
Ácido mangánico (Tetraoxomanganato (VI) de hidrógeno)
Heptaóxido de dimanganeso [Óxido de manganeso (VII)]
Ácido hipocloroso [Monoxoclorato (I) de hidrógeno]
Nitrito de hierro (II) {Bis[dioxonitrato (III)] de hierro (II)}
Bis[Tetraoxomanganato (VII) ] de calcio (Permanganato de calcio)
Monóxido de nitrógeno (Óxido de nitrógeno II)
Ácido perbrómico [Tetraoxobromato (VII) de Hidrógeno]
Dihidrogenotetraoxofosfato (V) de hierro (III)
Sulfuro de estroncio (Monosulfuro de estroncio)
Tricloruro de cromo (Cloruro de cromo (III)).
Yodato cúprico [Trioxoyodato (V) de cobre (II)]
Óxido de níquel (III) (Trióxido de diníquel)
Ácido nítrico [Ácido trioxonítrico (V)]
Sulfato de bario [Tetraoxosulfato (VI) de bario]
Hidruro de aluminio (Trihidruro de aluminio)
Hidróxido de cobre (II) (Dihidróxido de cobre)
Ácido sulfúrico [Ácido tetraoxosulfúrico (VI)]
Perclorato potásico [Tetraoxoclorato (VII) de potasio]
Hidruro de estroncio (Dihidruro de estroncio)
13
45.
46.
47.
48.
49.
50.
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
83.
84.
85.
86.
87.
88.
89.
90.
Fe2(SO4)3
NO2
SrO2
Cu(OH)2
HClO
AgBO2
Li2HPO3
Li2MnO3
BaO
K2Cr2O7
Pb2+
Ca(HCO3)2
NaOH
H2SO3
SO32Fe (OH)2
KClO3
H2 SO4
FeO
CrBr3
Ag+
Ni2O3
SO32HNO2
PO33Cu2O
NaMnO4
Hg(NO3)2
MgCl2
H2CO3
H2SiO3
HF
BaCO3
PtO2
FeI3
Pb(SO4)2
Li2O2
PCl5
NiH3.
N2 O5
H2Se.
Ag2CrO4
HMnO4
NiCl2.
CaO
NH3.
Apéndice: Formulación y nomenclatura en Química Inorgánica
Soluciones
de los ejercicios de formulación inorgánica propuestos en las PAU
(Pruebas de Acceso a la Universidad) del Distrito Universitario de Canarias.
Formula
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
NCl3
Ca(OH)2
Li2O2
FeO
Na2S
Pb(OH)2
K2O2
Ag OH
SnO2
Al(OH)3
BaS
Ag2O
NaOH
H2S
PbO2
Cu(OH)2
NiCl2
BaO2
PH3
KOH
HClO3
NaMnO4
KH
Cu2O2
H2CrO4
Al2(SO4)3
MgH2
Ba(OH)2
KClO3
BaO
AgCl
SrH2
Pb(OH)4
KClO4
Cu+
Na2O
Fe2S3
SO32Fe(OH)2
MgCl2
H2MnO4
PBr3
LiHCO3
Hg2+
Ag(CrO4)2
H3PO4
Nombre
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
Ion Cobre (II) [Catión cobre (II)]
Ion trioxoclorato (V)
Ácido tetraoxosulfúrico (VI) [Ácido sulfúrico]
Tetraoxomanganato (VI) de potasio
Ácido tetraoxoclórico (VII) [Ácido perclórico]
Ion trioxocarbonato (IV) [Anión carbonato]
Ácido tetraoxofosfórico (V) [Ácido fosfórico]
Yoduro de calcio (Diyoduro de calcio)
Trioxoclorato (V) de amonio (Clorato de amonio)
Hidrógenotetraoxosulfato (VI) de sodio
Ion hidrógenotrioxocarbonato (IV)
Pentahidruro de fósforo [Hidruro de fósforo (V)]
Peróxido de hidrógeno (Agua oxigenada)
Ion hidrógenotetraoxosulfato (VI)
Peróxido de potasio (Dióxido de dipotasio)
Ion dihidrógenotetraoxofosfato (V)
Cloruro de hierro (III) (Tricloruro de hierro)
Tetraoxomanganato (VII) de sodio (Permanganato de sodio)
Ion fluoruro
Hidrógenocarbonato de sodio
Ion aluminio
Ion trioxofosfato (V)
Óxido de hierro (III) (Trióxido de dihierro)
Hidrógenotrioxocarbonato (IV) de litio
Ion magnesio
Óxido de litio (Óxido de dilitio)
Sulfuro de hierro (II)
Hidrógenotetraoxofosfato (V) de sodio
Ion plomo (II)
Ion trioxosulfato (IV)
Peróxido de cobre (I) (Dióxido de cobre)
Dihidrógenotetraoxofosfato (V) de sodio
Ácido tetraoxocrómico (VI) (Ácido crómico)
Ion mercurio (II)
Ion trioxonitrato (V)
Ácido tetraoxomangánico (VI)
Peróxido de bario (Dióxido de bario)
Tricloruro de fósforo [Cloruro de fósforo (III)]
Hidruro de cobre (II) [Dihidruro de cobre]
Dihidrógenotrioxofosfato (III) de sodio
Pentayoduro de fósforo. [Yoduro de fosforo (V)]
Ion cobre (I)
Peróxido de calcio (Dióxido de calcio)
Bromuro de potasio
Tetraoxosulfato (VI) de hierro (III) [Sulfato de hierro (III)]
Dióxido de nitrógeno
14
Apéndice: Formulación y nomenclatura en Química Inorgánica
47.
48.
49.
50.
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
83.
84.
85.
86.
87.
88.
89.
90.
BaCO3
Hg(OH)2
H2MnO3
K2CO3
SbH3
Ca(MnO4)2
NH4ClO3
Ca(OH)2
AgBr
Hg2Cl2
NaH2PO3
KClO4
PH3
Fe2O3
H2CrO4
HIO
H3PO4
PtO2
HBr
K2CO3
KBr
H2SO3
Fe2(SO4)3
CuH2
Cr2O3
H2MnO4
Mn2O7
HClO
Fe(NO2)2
Ca(MnO4)2
NO
HBrO4
Fe(H2PO4)3
SrS
CrCl3
Cu(IO3)2
Ni2O3
HNO3
BaSO4
AlH3
Cu(OH)2
H2SO4
KClO4
SrH2
47.
48.
49.
50.
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
83.
84.
85.
86.
87.
88.
89.
90.
Peróxido de estroncio (Dióxido de estroncio)
Hidróxido de cobre (II) (Dihidróxido de cobre)
Ácido oxoclórico (I)
Dioxoborato (III) de plata
Hidrógenotrioxofosfato (III) de litio
Trioxomanganato (IV) de litio
Óxido de bario
Heptaoxodicromato (VI) de potasio
Ion plomo (II)
Hidrogenotrioxocarbonato (IV) de calcio
Hidróxido de sodio
Ácido trioxosulfúrico (IV) (Ácido sulfuroso)
Ion trioxosulfato (IV) (Ion sulfito)
Hidróxido de hierro (II) (Dihidróxido de hierro)
Trioxoclorato (V) de potasio
Ácido tetraoxosulfúrico (VI) (Ácido sulfúrico)
Óxido de hierro (II) (Monóxido de hierro)
Bromuro de cromo (III) (Tribromuro de cromo)
Ion plata
Óxido de níquel (III) (Trióxido de diníquel)
Ion trioxosulfato (IV) (Anion sulfito)
Ácido dioxonítrico (III) [Dioxonitrato (III) de hidrógeno]
Ion Trioxofosfato (III)
Óxido de cobre (I) (Monóxido de cobre)
Tetraoxomanganato (VII) de sodio
Trioxonitrato (V) de mercurio (II) (Nitrato de mercurio (II)
Cloruro de magnesio (Dicloruro de magnesio)
Trioxocarbonato (IV) de hidrógeno
Trioxosilicato (IV) de hidrógeno [Ácido trioxosilícico (IV)]
Fluoruro de hidrógeno (Ácido fluorhídrico)
Trioxocarbonato (IV) de bario (Carbonato de bario)
Óxido de platino (IV) (Dióxido de platino)
Yoduro de hierro (III) (Triyoduro de hierro)
Tetraoxosulfato(VI) de plomo (IV) [Sulfato de plomo (IV)]
Peróxido de litio (Dióxido de dilitio)
Pentacloruro de fósforo [Cloruro de fósforo (V)]
Hidruro de níquel (III) (Trihidruro de níquel)
Pentaóxido de nitrógeno [Óxido de nitrógeno (V)]
Seleniuro de hidrógeno (Ácido selenhídrico)
Tetraoxocromato (VI) de plata (Cromato de plata)
Tetraoxomanganato (VII) de hidrógeno (Ácido permangánico)
Cloruro de níquel (II)
Óxido de calcio
Amoníaco (Trihidruro de nitrógeno)
15