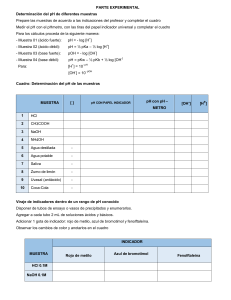
Calculo del pH de disolución básica muy diluida
Anuncio

Calcula el pH de una disolución de NAOH de concentración 1 x 10‒9 M. Solución. Por tratarse de una disolución muy diluida, además de los OH‒ provenientes de la disociación de la base, habrá que tener en cuenta la concentración de oxidrilos de la autoionización del agua. El NaOH es una base fuerte que se disocia totalmente NaOH NaOH 2→ Na + (aq ) + OH − 10-9 0 − 10-9 C. I. C. F. H O − 10 − 9 Debido a la baja concentración de oxidrilos de la base, es necesario tener en cuenta la autoionización del agua. H 2 O ↔ H 3O + C.I. exc − C.Eq exc x + OH − 10 − 9 x + 10 − 9 La autoionización del agua esta regida por la constante Kw. [ ][ ] ( ) K w = H 3O + ⋅ OH − = x ⋅ x + 10 −9 = x 2 + 10 −9 x = 10 −14 Ecuación de segundo grado. x 2 + 10−9 x − 10 −14 = 0 Resolviendo la ecuación de segundo grado se obtienen dos valores, uno de ellos negativo, que no tiene sentido químico. x = 9,95 × 10−8 x = −1,005 × 10− 7 La concentración de oxidrilos de la disolución es: [OH ] = 9,95 ×10 + 10 = 1,005 ×10 pOH = − log[OH ] = − log(1,005 × 10 ) = 6,998 − −8 −9 − −7 −7 pH = 14 − pOH = 14 − 6,998 = 7,002 El pH de la disolución también se puede calcular directamente, ya que x representa la concentración de protones de la disolución. [ ] ( ) pH = − log H 3O + = − log 9,95 × 10 −8 = 7,002