Estructura y función de proteínas
Anuncio

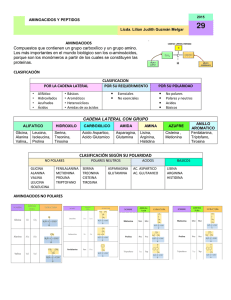
Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural escamas, cuernos, lana, uñas y plumas. de pelo, 1.2.1 Estructura y función de los aminoácidos (aa) Funciones: Formación de proteínas. Transmisión del impulso nervioso. Regulación del crecimiento celular. Biosíntesis de porfirinas, purinas, pirimidinas y urea. Participan en las vías de transmisión de señales. Señalización hormonal. El grupo amino está a la izquierda El grupo amino está a la derecha Clasificación de los aminoácidos No polares Cadena lateral alifática: Gli, Ala, Pro, Val, Leu, Met, Ile. Cadena lateral aromática: Phe, Tir, Trp. aa Polares Cadena lateral con carga Positiva: Lis, Arg, His (Básicos). Negativa: Asp, Glu (Ácidos). Cadena lateral sin carga: Ser, Thr, Cis, Asn, Gln. 1 pI ( pK1 pK 2 ) 2 pI 1 11.94 (2.34 9.60) 5.97 2 2 Punto isoeléctrico: Valor de pH en el que una molécula no tiene carga neta. Si pH<pI, el aa tiene carga (+); Si pH>pI, el aa tiene carga (-). 1 pI ( pK1 pK R ) 2 pI 1 (2.19 4.25) 3.22 2 1 pI ( pK R pK 2 ) 2 1 pI (6 9.17) 7.59 2 pI: Ácido aspártico: 3.02 Lisina: 9.7 Arginina: 10.8 Grupos ionizables de los aminoácidos En el intervalo de pH fisiológico tanto los grupos de ácido carboxílico como los grupos amino de los α-aminoácidos se hallan completamente ionizados. Ejercicio 1. Relación entre la curva de titulación y las propiedades ácido-base de la glicina Una solución de 100 mL de glicina 0.1 M a pH 1.72 se tituló con una solución de NaOH 2 M. Se midió el pH y los resultados se graficaron. Los puntos clave en la titulación se designaron como I, II, III, IV, y V. Para cada uno de los casos, identifique el punto apropiado en la titulación y justifique la respuesta. a) La glicina está completamente titulada b) Este es el punto isoeléctrico c) El grupo carboxilo ha sido titulado por completo d) El pH es igual al pKa del grupo carboxilo e) El pH es igual al pKa del grupo amino protonado f) La glicina tiene su máxima capacidad amortiguadora g) La carga neta de la glicina es 0 h) La mitad de los grupos amino están ionizados i) La glicina está presente predominantemente como +H3N-CH2-COOH j) La especie predominante es +H3N-CH2-COO k) La carga neta promedio de la glicina es -1 l) La glicina está presente predominantemente en una mezcla de 50:50 de +H3N-CH2-COOH y de +H3N-CH2-COO m) La carga neta promedio de la glicina es de +1/2 n) Este es el fin de la titulación o) Peores regiones de pH para poder amortiguador Ejercicio 2. Tamaño de proteínas ¿Cuál es el peso molecular aproximado para una proteína de 682 residuos de aminoácidos? Ejercicio 3. Punto isoeléctrico de la pepsina Pepsina es el nombre dado a muchas enzimas digestivas secretadas por glándulas presentes en el estómago. Estas glándulas también secretan HCl, el cual disuelve algunos componentes de la comida, permitiendo que la pepsina actúe enzimáticamente sobre las proteínas. La mezcla de comida, HCl y enzimas de digestión se conoce como Quimo y tiene un pH de 1.5. El punto isoeléctrico (pI) de la pepsina es 1.0 a) ¿Qué grupos funcionales deben de estar presentes en la pepsina para darle este punto isoeléctrico? b) ¿Qué aminoácidos de la enzima pueden contener estos grupos funcionales? Ejercicio 4. Punto isoeléctrico de histonas Las histonas son proteínas que se encuentran en el núcleo de células eucariotas, fuertemente ligados al ADN, el cual tiene muchos grupos fosfato. El pI de las histonas es muy alto, 10.8. a) ¿Cuáles residuos de aminoácidos deben estar presentes en alta proporción en las histonas? b) ¿En qué manera contribuyen estos residuos a la unión fuerte de las histonas con el ADN? Ejercicio 5. Solubilidad de polipéptidos Un método para separar polipéptidos hace uso de sus diferentes solubilidades. La solubilidad de una cadena polipeptídica larga depende de la polaridad de los grupos R, particularmente del número de grupos ionizables, entre más grupos ionizables estén presentes, mayor será la solubilidad del polipéptido. ¿Cuál de los siguientes pares de polipéptidos es más soluble al pH indicado? a) (Gly)20 o (Glu)20 a pH 7.0 b) (Lys-Ala)3 o (Phe-Met)3 a pH 7.0 c) (Ala-Ser-Gly)5 o (Asn-Ser-His)5 a pH 6.0 d) (Ala-Asp-Gly)5 o (Asn-Ser-His)5 a pH 3.0 Ejercicio 6. Carga de la His a diferentes pH • ¿Cuál es la carga neta de la histidina a pH 1, 4, 8 y 12? Determine a cada pH si la histidina migra hacia el ánodo (+) ó hacia el cátodo (-) cuando se coloca en un campo eléctrico. Ejercicio 7. Separación de aminoácidos Algunas mezclas de aminoácidos son analizadas primero por cromatografía de intercambio iónico. Los aminoácidos se colocan en una resina de intercambio catiónico que contiene grupos sulfonato (-SO3-) y que fluyen hacia abajo a diferentes velocidades debido a dos factores que influyen en su movimiento: 1) La atracción de los residuos de los iones -SO3- en la columna y las cargas positivas de los grupos funcionales de los aminoácidos, y 2) Las interacciones hidrofóbicas entre la cadena lateral de los aminoácidos y la fuerza hidrofóbica de la resina de poliestireno. Para cada par de aminoácido de la lista, determine cuál eluye primero de la columna de intercambio iónico utilizando un amortiguador a pH 7.0. Asp y Lis Arg y Met Glu y Val Gli y Leu Ser y Ala • Si pH<pI el aminoácido tiene carga (+) • Si pH>pI el aminoácido tiene carga (-) Ejercicio 8. Estereoisómeros • La citrulina posee la siguiente estructura. ¿Es aminoácido D o L? Explique Clasificación y funciones de los aminoácidos (aa) Canónicos: A, C, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, T, V, W, Y Proteínicos Derivados: selenocisteína, hidroxiprolina, hidroxilisina. Neurotransmisores: GABA, dopamina. aa Hormona: tiroxina. Mediador de reacciones alérgicas: histamina No proteínicos Intermediarios de reacciones metabólicas: citrulina, ornitina, homocisteína, S-adenosilmetionina. Presentes en antibióticos: D-valina (en valinomicina, gramicidina A y actinomicina D). Niveles de estructuración en las proteínas: Estructura primaria Niveles de estructuración en las proteínas La estructura primaria de las proteínas es la descripción de todos los enlaces covalentes que unen los residuos de aminoácidos en una cadena polipeptídica: Enlace peptídico Enlace disulfuro ENLACE PEPTÍDICO Es plano, por lo que no existe rotación alrededor del enlace. Posee un carácter de doble enlace, lo que significa que es mas corto que un enlace sencillo por lo que es rígido y plano. Esta característica previene la libre rotación alrededor del enlace entre el carbono carbonílico y el nitrógeno del enlace peptídico. El resto de la molécula puede rotar libremente. Esta capacidad de rotación permite a las proteínas adoptar una inmensa gama de configuraciones. ENLACE PEPTÍDICO Residuo Residuo Conocido también como enlace amida PÉPTIDOS Péptido: Cadena de residuos de aminoácidos unidos mediante enlaces peptídicos. Enlace disulfuro Enlace covalente entre los grupos tiol (-SH2) de dos cisteínas FUNCIONES DE LAS PROTEÍNAS Estructurales: colágeno, elastina. De transporte: hemoglobina, albúmina. De defensa: inmunoglobulina G. Hormonas: insulina, epinefrina, glucagon, tiroxina. Factores de crecimiento: hormona del crecimiento. Enzimas: hexocinasa, fosfohexosa isomerasa. Contráctiles: actina, miosina, conectina. Receptores: receptor de insulina, receptor de epinefrina. De transferencia de electrones: citocromo c.