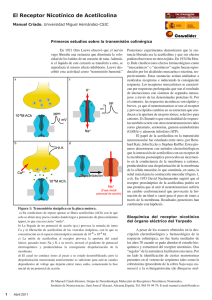
Receptores acoplados a proteínas G (efector: adenilil
Anuncio

René Campos Estudiante de Medicina Universidad de Panamá Receptores acoplados a proteínas G (efector: adenilil ciclasa). Muchas de las hormonas que circulan en el cuerpo son de naturaleza hidrosoluble (catecolaminas y péptidos), lo que hace necesario la utilización de mecanismos alternos para la producción de las distintas reacciones que las hormonas hidrosolubles llevan a cabo. La razón de esto es su naturaleza que no les permite difundirse a través de la bicapa lipídica que forma la membrana celular como lo hacen, fácilmente, las hormonas liposolubles. Los receptores acoplados a proteínas G conforman la familia más grande de receptores de superficie celular. Constan de 7 dominios que se encuentran inmersos en la membrana celular debido a su carácter hidrófobo; el residuo amino terminal, en el medio extracelular; y el residuo carboxilo terminal, en el medio intracelular. La hormona se une mediante interacciones no covalentes con el receptor acoplado a proteína G (puentes de hidrógeno, puente salino, fuerzas de Van der Waals e interacción hidrófobica). Dicha unión lleva como consecuencia un cambio conformacional de algunos de los 7 dominios transmembranales del receptor acoplado a la proteína G. Cuando esto sucede, entra en juego la proteína G -un heterodímero conformado por las subunidades alfa, beta y gamma, donde las subunidades beta y gamma cumplen función de anclaje por medio de grupos prenilados, actuando casi como un heterotrímero; y la subunidad alfa cumple con la función de unión a un receptor-. Con el cambio conformacional de los dominios transmembranales del receptor acoplado a proteína G, ocurre un intercambio entre GDP (guanosín difosfato), que posee la subunidad alfa, y GTP (guanosín trifosfato), lo que da como resultado que el complejo beta-gamma se disocie de la subunidad alfa que ahora contiene un GTP y se unirá a un efector, los cuales son muy diversos, (por ejemplo: adenilil ciclasa, canales de Ca+2, canales de Na+, canales de Cl_, canales de K+, fosfolipasa C-beta, cGMP fosfodiesterasa, etc). Los productos que resultan de la acción de estos efectores son los conocidos segundos mensajeros. René Campos Estudiante de Medicina Universidad de Panamá Nos ocuparemos en explicar el sistema de la adenilil ciclasa, que es quizás el más importante y general, de los sistemas de producción de segundos mensajeros dentro del ser humano. La unión de subunidad alfa-GTP a una liasa -llamada adenilil ciclasa-, cataliza la conversión de ATP en cAMP (AMP cíclico, el segundo mensajero); éste se une a una molécula heterotetramérica, que consta de dos subunidades catalíticas y dos subunidades reguladoras. Esta molécula se llama: proteína quinasa A (PKA). El cAMP se une a las dos subunidades reguladoras, por lo que el tetrámero se disocia, dejando así las subunidades catalíticas libres para que lleven a cabo sus reacciones de fosforilación. Es importante decir que son 4 los cAMP necesarios para la disociación del tetrámero (2 para cada subunidad reguladora). Las proteínas fosforiladas tienen efectos fisiológicos diversos como: esteroidogénesis; secreción; transporte de iones; metabolismo de triacilgliceroles y carbohidratos; inducción de enzimas; regulación de genes; transmisión sináptica; crecimiento y replicación celular; entre muchos otros. Hay que tener presente que, después de esta cascada de reacciones, estos procesos deben regularse apropiadamente para mantener la homeostasis del organismo. Las fosofodiesterasas, fosfoproteínas fosfatasas y las proteínas G inhibitorias son los principales sistemas de regulación de la acción del segundo mensajero cAMP. Estos mecanismos serán explicados brevemente: Las fosfodiesterasas catalizan la hidrólisis de cAMP hacia 5´-AMP, bajando así las concentraciones de cAMP. Las fosfoproteínas fosfatasas, actúan desfosforilando las proteínas que previamente fueron fosforiladas por la subunidad catalítica de la PKA, así estas proteínas quedan fisiológicamente desactivadas. Las proteínas G inhibitorias que siguen el mismo mecanismo que las proteínas G estimulantes (la mencionada arriba unida a el receptor de la René Campos Estudiante de Medicina Universidad de Panamá hormona, solo que la unión de la subunidad alfa-GTP al efector, frena la acción catalítica del efector). En estos principios estimulantes e inhibitorios de los receptores acoplados a proteínas G, se basan muchos de los mecanismos de acción de diversos fármacos, además de diversas toxinas que causan patologías como el cólera, tosferina y difteria. Bibliografía. Robert K. Murray; David A. Bender; Kathleen M. Botham; Peter J. Kenelly; Victor W. Rodwell; P. Anthony Weil (2009). Harper Bioquímica ilustrada. Vigésimo octava edición. Gerald Karp (2005). Biología celular y molecular: conceptos y experimentos. Cuarta edición. http://www.ebi.ac.uk/interpro/potm/2005_9/Page2.htm http://www.psicofarmacos.info/?contenido=antipsicoticos&farma=abilifyazymol-irazem René Campos Estudiante de Medicina Universidad de Panamá Esquema de mecanismo de acción de una hormona hidrosoluble. Mecanismo de acción del cólera.