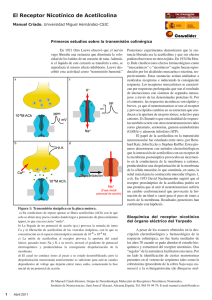
La insulina inicia su acción al interaccionar con su receptor
Anuncio

La insulina inicia su acción al interaccionar con su receptor específico ubicado en la membrana celular. Este receptor es una glucoproteína que pertenece a la familia de receptores para factores de crecimiento con actividad específica de quinasas de Tirosina. El receptor de la insulina es tetramérico, es decir, consta de cuatro subunidades; dos subunidades Alfa (α) y dos subunidades Beta (β); las subunidades α son periféricas y por ende son las que interaccionan con la insulina. Tal interacción induce un cambio conformacional en dichas subunidades, que a su vez permite que una molécula de ATP se enlace a las subunidades β y así se active la propiedad tirosina quinasa intrínseca que caracteriza al receptor de insulina. La actividad tirosina quinasa permite que una subunidad β fosforile los residuos de tirosina de la subunidad β continua, y viceversa dándose así un mecanismo de fosforilación cruzada. Una vez fosforilados la subunidad β de los receptores de la insulina, interaccionan con una proteína citoplasmática llamada Sustrato de receptor de insulina (IRS-1) mediante un dominio PTB; dicho sustrato es fosforilado por las mismas subunidades β del receptor de insulina, específicamente en los residuos de tirosina. El IRS-1 a su vez actúa con otra proteína, la Fosfoinositol 3 quinasa (PI3K), la cual es un heterodímero que consta de una subunidad reguladora y de una subunidad catalítica. Las subunidades reguladoras son proteínas adaptadoras que contienen dos dominios SH2, los cuales permiten su unión a las proteínas IRS-1. La interacción entre ambas proteínas provoca cambios alostéricos en la conformación de la subunidad reguladora dando por resultado la activación de la subunidad catalítica de PI3K y por ser éste una quinasa tendrá la capacidad de fosforilar otros compuestos. La PI3K, fosforila al lípido de membrana Fosfoinositol 4,5 bifosfato (PIP2) y es transformado en Fosfoinositol 3, 4, 5 trifosfato (PIP3). Éste último estando fosforilado, es reconocido por el dominio PH de una proteína quinasa dependiente de fosfoinositoles (PDK); dicha interacción induce un cambio conformacional en la PDK que permite su activación. La PDK, estando activa, puede actuar sobre la proteína Proteinquinasa B (PKB). Dicha proteína quinasa B se encuentra interaccionando con una molécula de PIP3 por lo cual se encuentra anclada a la membrana plasmática y adyacente a la PDK, así esta ultima fosforilara a la PKB induciéndole un cambio conformacional que permitirá su desacoplamiento de la membrana y su activación encargándose de dversos mecanismos como: favorecer la translocación del citoplasma a la membrana plasmática de la célula de vesículas que contienen transportadores de glucosa GLUT-4 en tejidos como el adiposo y el muscular, permitiendo así el incremento de glucosa en el medio intracelular; activando fosfodiesterasas que convertirán el AMPc en AMP lineal y; activando enzimas con actividad fosfatasa para que éstas desfosforilen compuestos según se requieran en período postpandrial.