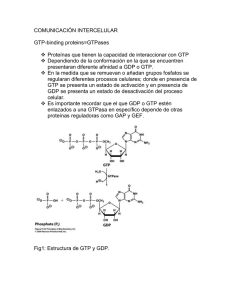
GTPasa, separa un monofosfato, vuelve a su conformación inicial
Anuncio

GTPasa, separa un monofosfato, vuelve a su conformación inicial con GDP unido y se une de nuevo a β y γ para formar la proteína heterotrimérica que es inactiva hasta que empieza de nuevo el ciclo al unirse una molécula de ligando al receptor correspondiente. La estructura que podemos encontrar debajo de la membrana plasmática estaría formada por las tres subunidades α, β y γ, y tienen una serie de modificaciones con lípidos que permiten que estén ancladas a la membrana. Las subunidades β y γ van a mantenerse unidas siempre, en todos los ciclos, y la subunidad α es la que va a separarse. Subunidades α, β, γ de las proteínas G grandes - Función de las subunidades α Sitio de unión a nucleótidos de guanina Actividad GTPasa Sitios para ADPribosilación Varios tipos clonados: - αs (Gs) 45-52 kD Se une al receptor y al efector por su extremo carboxílico Se une al dímero βγ por su extremo amino palmitoilado en Cys Estimula adenilato ciclasa - αi (Gi) miristoilada en Gly N-terminal Incrementa su unión a la membrana y su afinidad por el dímero βγ Inhibe adenilato ciclasa Algunos autores piensan que la subunidad α deriva de una proteína Ras que después se ha unido a las otras dos moléculas (β y γ) porque es la que mantiene la mayoría de las funciones, sobre todo la unión a GTP y GDP. La subunidad α es la que lleva el sitio de unión a nucleótidos de guanina, es la que tiene actividad GTPasa y tiene unos sitios para una modificación permanente que es la ADP-ribosilación que la modifica y cambia su función. Se han encontrado diferentes tipos en las que hay pequeñas diferencias y tienen distintas sus funciones: - αs. A la proteína G que lleva αs se la puede denominar Gs. Tiene una palmitoilación en su extremo amino en un residuo de cistina, que es lo que la mantiene unida a la membrana. Su función principal es la de estimular a la adenilato ciclasa, que produce cAMP. - αi. A la proteína G que lleva αi se la puede denominar Gi. Tiene una miristoilación en su extremo amino en un residuo de glicina y esta modificación parece ser que incrementa su unión a la membrana y su afinidad por el dímero βγ. Su función principal es la de inhibir a la adenilato ciclasa, por lo que las células que tienen receptores con proteínas G con αi, van a tener una vía de transducción de señales diferente en la cual la adenilato ciclasa no va a estar haciendo su función. Por lo tanto, en este caso se inhibe la producción de cAMP. En estas tablas se representan las funciones de las subunidades alfa. Por ejemplo: - Al hablar de Gs está hablando de una subunidad α capaz de activar a la adenilato ciclasa y a los canales de calcio. - Si hablamos de Golf nos referimos a una α capaz de activar a la adenilato ciclasa en neuronas del sistema olfativo. - La Gi tiene una subunidad α que inhibe la adenilato ciclasa. En este caso, el dímero βγ va a activar canales de potasio. Respecto a la estructura, aquí podemos ver la subunidad α. Hay partes de la molécula que van a modificarse (SwitchI, que es un segmento lineal, y SwitchII, que es un segmento helicoidal) según tenga unido GDP o GTP. Están representados los nombres de las distintas cadenas de la molécula. Al unirse GTP, la posición de Switch I y la posición de Switch II han variado. Podemos ver lo mismo en este tipo de representación. En este primer paso, la molécula está más abierta (GDP unido) y en el segundo paso la molécula está más cerrada (GTP unido). ADP-ribosilación de αs (Gs) por la toxina del cólera - Cepas patógenas de Vibrio cholerae en el lumen intestinal - Producen endotoxina que se une al epitelio intestinal - La toxina no penetra en la circulación sistémica - αs es ADP-ribosilada en Arg 210 (arginina conservada en αs en región G-2) - La ADP-ribosilación anula la capacidad GTPasa de αs. Consecuencias: Puede unir GTP pero no puede hidrolizarlo αs se mantiene en estado activado permanentemente Estimula la producción de cAMP continuamente Estimula la secreción de agua y electrolitos al lumen Diarrea típica del cólera, deshidratación y muerte Ahora vamos a ver lo que es la ADPribosilación de subunidades α que tienen puntos de ADPribosilación. Esto tiene un interés patológico porque precisamente una modificación permanente de esta subunidad α va a producir una enfermedad que es el cólera. La toxina desde el epitelio intestinal va a producir las modificaciones. αs es ADPribosilada en un residuo de arginina (210) que es una arginina conservada en la región G-2. La ADP-ribosilación anula la capacidad GTPasa de αs y las consecuencias son: puede unir GTP pero no puede hidrolizarlo, como no puede hidrolizarlo, αs se mantiene en estado activo permanentemente, entonces se estimula la producción de cAMP de forma continua. Grandes cantidades de cAMP en las células intestinales estimula una secreción enorme de agua y electrolitos al lumen intestinal. Entonces, se produce una diarrea típica del cólera, una deshidratación general y puede llegar a la muerte. Vamos a ver el mecanismo molecular. La molécula de la toxina del cólera está formada por dos subunidades: - A1. Es la subunidad que va a actuar como toxina. - B5. Es un pentámero. Sirve para que la molécula se una a unos receptores que hay en las células del epitelio intestinal. Aquí está representada la subunidad β de la toxina del cólera que es un pentámero. Este es el mecanismo de acción de la toxina del cólera (la reacción que se produce). Se trata de una modificación covalente permanente. Tenemos una arginina que se localiza en la región Gαs y una proteína. A partir del NAD+ y actuando la subunidad A1 como enzima que catalizaría esta reacción, aquí se unen un grupo ADP-ribosilo (en rojo) y la arginina (se une a ella por el extremo NH2); por otro lado queda separada la nicotinamida. Es una reacción covalente permanente de manera que la subunidad αs queda permanentemente modificada con este resto de ADP-ribosilo. Precisamente el hecho de que esté modificada de esta manera es lo que le hace perder su actividad GTPasa. Este esquema es igual que el anterior. Normal ion movement, Na+ from lumen to blood, no not Cl- movement Na+ movement blooked, not Cl- movement to lumen Massive water movement to the lumen Activation of epithelial adenyl cyclase by cholera toxin Mecanismo de acción de la toxina del cólera 1. Es el estado normal, en el que se producen movimientos de Na+ desde el lumen a la sangre y no hay movimiento de Cl-. 2. Existen unos receptores que se denominan GM1 que son los receptores a los que se va a unir la toxina del cólera. En este caso, la toxina se une a los receptores GM1, se activa la adenilato ciclasa de las células intestinales y el ATP pasa a cAMP cíclico en grandes cantidades. 3 y 4. En estas condiciones, el Cl- y el agua sale hacia el lumen intestinal y el Na+ no puede entrar. Hay una pérdida de agua y de Cl- por parte de la sangre y esto es debido a las altas concentraciones de cAMP en las células intestinales. ADP-ribosilación de αi (Gi) por la toxina pertussis - Bacteria Bordetella pertussis se aloja en los bronquios tos ferina - ADP-ribosilación en residuo de Cys - La ADP-ribosilación impide a αi interferir con los receptores - Se estimula la producción de cAMP Hay otra modificación, en este caso es otra ADP-ribosilación por la toxina pertussis que modifica a αi. La bacteria va a alojarse en los bronquios y va a dar lugar a la tos ferina. A nivel molecular, se ADP-ribosila un residuo de cisteína del extremo C-terminal de la subunidad αi y esta ADP-ribosilación interfiere con los receptores impidiendo que se una adecuadamente a los receptores correspondientes para transducir la señal. Pero como se impide la función de αi, de nuevo la consecuencia es la estimulación de la producción de cAMP. En este esquema vemos lo que ocurre cuando actúan la toxina colérica y la toxina pertussis. 1. Si la subunidad α con GTP, que activa a la adenilato ciclasa, está modificada por la toxina del cólera, va a estar activando a la toxina del cólera continuamente. 2. En este otro caso que tenemos la Gi sucede lo contrario, la toxina pertussis impide la unión y al ser inhibidora, deja de inhibir la adenilato ciclasa. En ambos casos, se está estimulando la producción de cAMP, aunque el mecanismo sea diferente porque se empieza por modificar una subunidad α distinta. Subunidades α β γ de las proteínas G grandes - Funciones de las subunidades: β 25 kD Une magnesio Se une a las subunidades α y γ por los primeros 30 aminoácidos N-terminales γ 8,4 kD La más cercana a la subunidad α Está poliprenilada: necesario para su unión a α