ÁCIDOS HIDRÁCIDOS (-I) F Cl Br I HF HCl HBr HI F
Anuncio

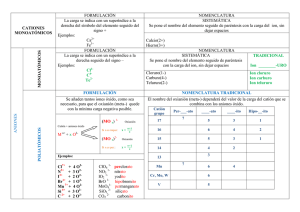
NOMENCLATURA DE COMPUESTOS BINARIOS Y DE HIDRÓXIDOS Los compuestos binarios están formados por dos elementos (unidos mediante enlace iónico o enlace covalente). La IUPAC (Unión Internacional de Química Pura y Aplicada) solamente admite la NOMENCLATURA SISTEMÁTICA, de modo que aconseja evitar otras nomenclaturas, como la de Stok, para evitar errores. Los ÓXIDOS de metales (formados por metal y oxígeno) y de no metales (formados por no metal y oxígeno) se formulan mediante la nomenclatura sistemática, que consiste en utilizar el prefijo ÓXIDO y acabar con el nombre del metal o del no metal utilizando delante de dicho nombre los prefijos mono, di, tri, tetra, etc. Por ejemplo, el N2O4 es el tetraóxido de dinitrógeno (no es conveniente decir óxido de nitrógeno (IV), como se haría con la nomenclatura de Stok). LAS SALES HALUROS Y CALCOGENUROS son compuestos de cationes y los aniones procedentes de halógenos (F, Cl, Br, I) o de calcógenos (S, Se, Te). Se nombran utilizando el prefijo mono, di, tri, tetra, delante del halógeno o calcógeno, el cual se nombra sustituyendo la terminación URO por la -O del nombre del halógeno o del calcógeno y después se nombra el catión. Por ejemplo, FeCl2 se nombra dicloruro de hierro Existe la costumbre (la IUPAC aconseja abandonarla), derivada de la nomenclatura antigua de Stok, de nombrar el halogenuro y, después de nombrar el catión, si éste puede tener más de un número de oxidación, se indica el número de oxidación del catión, o sea, la carga, en números romanos. Por ejemplo, FeCl2 en la nomenclatura de Stok es cloruro de hierro (II), en cambio el CaCl2 es cloruro de calcio (no se indica el número de oxidación porque solamente puede ser +2 y no hay duda de qué catión se trata). Si el halogenuro o calcogenuro está unido al hidrógeno tiene carácter ácido, por ello, en la NOMENCLATURA TRADICIONAL se llaman ÁCIDOS HIDRÁCIDOS y se nombran mediante la palabra ÀCIDO y la terminación –HíDRICO. Por ejemplo el H2S es el sulfuro de dihidrógeno en la nomenclatura sistemática; en la nomenclatura tradicional se llama ácido sulfhídrico. NO METALES SALES HALUROS ÁCIDOS HIDRÁCIDOS (nº oxidación) (-I) F HF Cl HCl Br HBr I HI Ácido fluorhídrico (Fluoruro de hidrógeno) Ácido clorhídrico (Cloruro de H) Ácido bromhídrico (Bromuro de H) Ácido yodhídrico (Yoduro de H) F- Ion fluoruro Cl- Ion cloruro Br- Ion bromuro I- Ion Yoduro (-II) Ácido sulfhídrico (sulfuro de H) S2- Ácido selenhídrico (seleniuro de H) Se2- Ion seleniuro Te2- Ion telururo S H2S Se H2Se Te H2Te Ácido telurhídrico (telurururo de H) Ion sulfuro También forman aniones el hidrógeno (cuando se combina con metales), H-, que se llama hidruro; el nitrógeno, N3-, nitruro, el fósforo, P3-, fosfuro, etc. En la nomenclatura de Stock se nombran los cationes y, si tienen más de un número de oxidación, se indica en números romanos entre paréntesis. Ejemplo, cloruro de hierro (III) FeCl3. NÚMEROS DE OXIDACIÓN MÁS FRECUENTES EN METALES QUE FORMAN CATIONES número de oxidación METALES +1 Li Na +1 y +2 Cu Hg +1 y +3 Au Tl +2 Be Mg +2 y +3 Cr +2 y +4 Mn Sn +3 Al Ga Fe K Rb Cs Ag Ca Sr Ba Zn Co Ni Cd Pb Nota: el catión NH4+, se llama amonio y es parecido a los cationes que forman los metales alcalinos (Li, Na, K, Rb, Cs) Los HIDRÓXIDOS son compuestos iónicos están formados por iones OH- (iones hidróxido) y cationes. En la nomenclatura sistemática se nombra el número de OH presentes en la fórmula con los prefijos mono, di, tri o tetra. Por ejemplo, Sn(OH)2 es el dihidróxido de estaño. En la nomenclatura de Stok se nombra solamente la palabra hidróxido y, a continuación, el nombre del catión con el número de oxidación (en números romanos) si el catión puede tener más de un número de oxidación. Por ejemplo, Sn(OH)2, en la nomenclatura de Stok es hidróxido de estaño (II); en cambio el Ca(OH)2 es hidróxido de calcio.