CATIONES MONOATÓMICOS FORMULACIÓN NOMENCLATURA
Anuncio

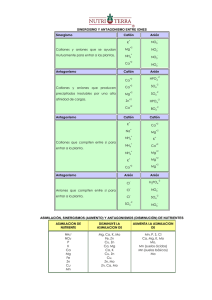
MONOATÓMICOS CATIONES MONOATÓMICOS FORMULACIÓN La carga se indica con un superíndice a la derecha del símbolo del elemento seguido del signo + Ejemplos: Ca2+ Fe3+ FORMULACIÓN La carga se indica con un superíndice a la derecha seguido del signo – Ejemplos: Cl1C4Te2- (MO x) 1POLIATÓMICOS ANIONES FORMULACIÓN Se añaden tantos iones óxido, como sea necesario, para que el oxianión (meta-) quede con la mínima carga negativa posible. Oxianión NOMENCLATURA SISTEMÁTICA Se pone el nombre del elemento seguido de paréntesis con la carga del ion, sin dejar espacios Calcio(2+) Hierro(3+) NOMENCLATURA SISTEMÁTICA Se pone el nombre del elemento seguido de paréntesis con la carga del ion, sin dejar espacios Cloruro(1-) Carburo(4-) Telururo(2-) TRADICIONAL Ion ________-URO Ion cloruro Ion carburo Ion telururo NOMENCLATURA TRADICIONAL El nombre del oxianión (meta-) dependerá del valor de la carga del catión que se combina con los aniones óxido. Catión grupo 17 Per-___-ato 7 ____-ato ____-ito Hipo-__-ito 5 3 1 Catión + aniones óxido M n+ Si n es impar: x= 16 6 4 2 (MO x)2- Oxianión 15 5 3 1 Si n es par : x= 14 4 2 2- +xO Ejemplos: Cl7+ + N5+ + I3+ + Br1+ + Mn 7+ + Si 4+ + C 2+ + 4 O23 O22 O21 O24 O23 O22 O2- 3 13 ClO4 1NO3 1IO2 1BrO 1MnO41SiO3 2CO2 2- perclorato nitrato yodito hipobromito permanganato silicato carbonito Mn 7 6 Cr, Mo, W 6 V 5 4 FORMULACIÓN Catión + Anión → Fórmula SALES BINARIAS SALES NEUTRAS Catión metálico + anión no metálico M a+ + X -b → MbXa PREFIJOS (Leemos la fórmula simplificada) (Empezamos a leer por la izquierda) (Los prefijos corresponden a los subíndices) STOCK (nº romano = la carga del catión) (se omite el nº romano cuando sólo hay una posibilidad de ese catión) Ejemplos: Ca 2+ + F 1- → Ca F 2 Difluoruro de calcio Fluoruro de calcio Ni 2+ + N 3- → Ni 3 N 2 Dinitruro de triníquel Nitruro de níquel (II) FORMULACIÓN Catión + Anión → Fórmula SALES VOLÁTILES Catión no metálico + anión no metálico Z a+ + X -b → PREFIJOS STOCK Ejemplos: B 3+ + S 2- → B2S3 Trisulfuro de diboro Sulfuro de boro C 4+ + Cl 1- → C Cl 4 Tetracloruro de carbono Cloruro de carbono (IV) Catión + Anión → Fórmula M n+ + OH 1- → Catión + GRUPO HIDRÓXIDO NOMENCLATURA ZbXa FORMULACIÓN HIDRÓXIDOS NOMENCLATURA M (OH)n NOMENCLATURA PREFIJOS (Leemos la fórmula simplificada) (Empezamos a leer por la izquierda) (Los prefijos corresponden a los subíndices) STOCK (nº romano = la carga del catión) (se omite el nº romano cuando sólo hay una posibilidad de ese catión) Dihidróxido de calcio Hidróxido de calcio Tetrahidróxido de plomo Hidróxido de plomo (IV) Ejemplos: Ca 2+ + (OH) 1- → Ca (OH) 2 Pb 4+ + (OH) 1- → Pb (OH) 4 FORMULACIÓN NOMENCLATURA STOCK (nº romano = la carga del catión) (se omite el nº romano cuando sólo hay una posibilidad de ese catión) Catión + Anión → Fórmula M n+ + O 2- → M 2 O n ÓXIDOS METÁLICOS Y NO METÁLICOS (Se simplifica) Ejemplos: Ca 2+ + O 2- → Ca O Fe 3+ + O 2- → Fe 2 O 3 COMBINACIONES OXÍGENO BINARIAS DEL PREFIJOS (Leemos la fórmula simplificada) (Empezamos a leer por la izquierda) (Los prefijos corresponden a los subíndices) S 6+ + O 2- → S2 O 6 → S O 3 Monóxido de calcio Óxido de calcio Trióxido de dihierro Óxido de hierro (III) Trióxido de azufre Óxido de azufre (VI) NOMENCLATURA FORMULACIÓN Catión + Anión → Fórmula M n+ + O2 2- → M 2 (O2 )n (El grupo peróxido no se simplifica) PERÓXIDOS PREFIJOS (Leemos la fórmula como si fuera un óxido) (Los prefijos corresponden a los subíndices) Ejemplos: H 1+ + O2 2- → H 2 (O2 ) 1 → H 2 O 2 Dióxido de dihidrógeno Peróxido de hidrógeno Cu 2+ + O2 2- → Cu O 2 Dióxido de cobre Peróxido de cobre (II) Cu 1+ + O2 2- → Cu 2 O 2 Dióxido de dicobre Peróxido de cobre (I) FORMULACIÓN _____-UROS DE NOMENCLATURA PREFIJOS (Los prefijos corresponden a los subíndices) Catión + Anión → Fórmula ___- OXÍGENO O 2+ + X n- → O n X 2 (Combinaciones del Oxígeno con los halógenos) STOCK (nº romano la carga del catión) (se omite el nº romano cuando sólo hay una posibilidad de ese catión) Ejemplo: O 2+ + F 1- → O F 2 Difluoruro de oxígeno FORMULACIÓN Catión + Anión → Fórmula HIDRÓGENO DEL M n+ + H 1- → M Hn Ejemplos: Na 1+ + H 1- → Na H Au 3+ + H 1- → Au H 3 Pb 4+ + H 1- → Pb H 4 PREFIJOS (Los prefijos corresponden a los subíndices) STOCK (nº romano = la carga del catión) Catión + Anión → HIDRUROS NO M n+ + H 1- → METÁLICOS CON los no metales de LOS Ejemplos: GRUPOS B 3+ + H 1- → 13, 14 y 15 C 4+ + H 1- → N 3+ + H 1- → Fórmula M Hn BH3 CH4 NH3 _________- UROS DE HIDRÓGENO (Combinaciones del hidrógeno con los grupos 16 y 17 ) con el grupo 17 Catión + Anión → Fórmula H 1+ + X 1- → H X Ejemplo: H 1+ + F 1- → H F H 1+ + Cl 1- → H Cl ------------Plumbano NOMENCLATURA PREFIJOS (Empezamos a leer por la izquierda) (Los prefijos corresponden a los subíndices) Nomenclatura de sustitución Terminación -ANO Trihidruro de boro Tetrahidruro de carbono Trihidruro de nitrógeno FORMULACIÓN con el grupo 16 Catión + Anión → Fórmula H 1+ + X 2- → H 2 X Ejemplo: H 1+ + S 2- → H 2 S H 1+ + Se 2- → H 2 Se Nomenclatura de sustitución Terminación -ANO Sólo para los hidruros metálicos de los grupos 13,14 y15) Hidruro de sodio Hidruro de sodio Trihidruro de oro Hidruro de oro (III) Tetrahidruro de plomo Hidruro de plomo (IV) FORMULACIÓN BINARIAS COMBINACIONES HIDRUROS METÁLICOS NOMENCLATURA Borano Metano Azano (Amoniaco) NOMENCLATURA Tradicional Ácido _____-hídrico Nomenclatura de sustitución Terminación -ANO Sulfuro de hidrógeno Seleniuro de hidrógeno Ácido sulfhídrico Ácido selenhídrico Sulfano Selano Fluoruro de hidrógeno Cloruro de hidrógeno Ácido fluorhídrico Ácido clorhídrico Fluorano clorano _____- URO DE HIDRÓGENO (No prefijos) OXIÁCIDOS FORMULACIÓN NOMENCLATURA TRADICIONAL H+ + oxianión oxiácido H+ + ClO4 1H+ + NO3 1H+ + IO2 1H+ + Br O 1H+ + MnO413 H+ + PO4 32 H+ + Si O3 2- HClO4 HNO3 H IO2 H Br O H MnO4 H3 PO4 H2SiO3 FORMULACIÓN OXISALES M M n+ + x O22- 2- (MOx ) + O Oxianión META (n = par) (MOx+1 ) Oxianión ORTO 4- NOMENCLATURA DE OXIANIONES ORTOLos ORTO – oxianiones se nombran igual que los META- , pero añadiendo el prefijo ORTO- al nombre. ** Importante: con los elementos: B, Si , P , As y Sb , cuando nos pidan formular sus oxianiones, sales o ácidos, si no se especifica qué tipo es, se formula la forma ORTO SALES ÁCIDAS (MOx+1 ) 3Oxianión ORTO SALES DOBLESS (MOx ) 1- + O 2Oxianión META ( n = impar) + oxianión Cu+ + ClO4 1Fe 2+ + NO3 1Na+ + IO2 1Au3+ + Br O 1K+ + MnO41Ca2+ + PO4 3Mg2+ + Si O3 2- oxisal Cu ClO4 Fe (NO3)2 Na IO2 Au( Br O)3 K MnO4 Ca3( PO4)2 MgSiO3 FORMULACIÓN M n+ + hidrogenooxianión FORMULACIÓN DE OXIANIONES ORTO- Catión + aniones óxido n+ oxisal Ácido perclórico Ácido nítrico Ácido yodoso Ácido hipobromoso Ácido permangánico Ácido fosfórico ****** Ácido metasilísico ****** NOMENCLATURA TRADICIONAL (nº romano= carga del catión que neutraliza al oxianión) Perclorato de cobre (I) Nitrato de hierro(II) Yodito de sodio Hipobromito de oro (III) Permanganato de potasio Fosfato de calcio ******** Metasilicato de magnesio ****** NOMENCLATURA TRADICIONAL (nº romano= carga del catión que neutraliza al oxianión) Na+ + (H CO3) 1- Na HCO3 Hidrogenocarbonato de sodio Li+ + (H2 PO4) 1- Li H2 PO4 Dihidrogenofosfato de litio ****** FORMULACIÓN M n+ + X m+ + oxianión sal doble NOMENCLATURA TRADICIONAL (nº romanos = carga de los cationes que neutralizan al oxianión) Cu+ + Na++ NO3 1- CuNa(NO3)2 Nitrato de cobre(I) y sodio Cu2+ + Mg2+ + SO42- CuMg(SO4)2 Sulfato de cobre (II) y magnesio OXIANIONES METALos oxianiones meta- se forman añadiéndole, a un catión, el nº de iones óxido suficiente para que resulte un anión poliatómico, con el menor nº de cargas posible. Podemos encontrarnos con dos casos: - Catión con carga par, el nº de iones óxido que debemos añadirle se calcula fácilmente: sumamos 2 a la carga del catión y el resultado lo dividimos entre dos. M n+ + x O2- (MOx )2- Oxianión x= Si n es par : OXIÁCIDOS Son compuestos neutros formados a partir de un oxianión cuya carga o cargas negativas se compensan añadiendo tantos H1+ como sea necesario. Tenemos dos posibilidades para formular un ácido ORTO : a) A partir de su correspondiente orto-oxianión, neutralizamos sus cargas negativas añadiéndole tantos H1+ como sea necesario Ejemplo: 3 H1+ + PO43H3PO4 anión ortofosfórico S - 6+ 2- + xO SO4 2- x= =4 Catión con carga impar, el nº de iones óxido que debemos añadirle se calcula fácilmente: sumamos 1 a la carga del catión y el resultado lo dividimos entre dos. M n+ + x O2- (MOx ) 1- N 5+ + x O2- NO3 1- Oxianión Si n es impar: x= x= = 3 OXIANIONES ORTOLos oxianiones orto- se formulan igual que los meta- pero sumándole un ion óxido (un oxígeno y sus dos cargas negativas). (MOx ) 2- + O 2Si 6+ + x O2- P 5+ + x O2- SiO4 2- + O 2- ácido ortofosfórico (MOx+1 ) 4- SiO5 4- Anión metasilicato Anión ortosilicato Anión metafosfato Anión ortofosfato PO31- + O 2- PO43- (MOx ) 1- + O 2- (MOx+1 ) 3- b) A partir de su correspondiente ácido meta-, sumándole 1 H2O Ejemplo: H PO3 + 1 H2O H3PO4 ácido metafosfórico ácido ortofosfórico OXISALES Son compuestos neutros formados a partir de un oxianión cuya carga o cargas negativas se compensan con uno o varios cationes del mismo elemento. Cu+ + ClO4 1- Cu ClO4 Perclorato de cobre (I) SALES ÁCIDAS Son compuestos neutros formados a partir de un oxianión cuya carga o cargas negativas se compensan al menos con un H1+ y un catión. Na+ + (H CO3) 1- Na HCO3 Hidrogenocarbonato de sodio SALES DOBLES Son compuestos neutros formados a partir de un oxianión cuya carga o cargas negativas se compensan con varios cationes de diferentes elementos. Cu+ + Na++ NO3 1- CuNa(NO3) Nitrato de cobre(I) y sodio Nitrato de sodio y cobre(I) ELEMENTOS IMPORTANTES Pt +2, +4 Pt