FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA
Anuncio

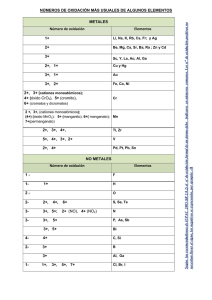
FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA Normas de la I.U.P.A.C. DEPARTAMENTO DE FÍSICA Y QUÍMICA. I.E.S. FUENTEPIÑA 1.- NORMAS DE LA I.U.P.A.C SOBRE NOMENCLATURA La IUPAC (Unión Internacional de Química Pura y Aplicada) es el organismo internacional encargado de sancionar los nombres de las distintas sustancias químicas y de definir las normas generales de nomenclatura química. Dado lo difícil que resulta abandonar nombres de la nomenclatura tradicional, aunque la IUPAC prohíbe algunos, admite otros muchos, con la recomendación de que se vayan abandonando. 2.- NÚMERO DE OXIDACIÓN O VALENCIA DE UN ELEMENTO El número de oxidación o valencia de un elemento en un compuesto representa la capacidad para combinarse con el hidrógeno y viene dado por el nº de electrones captados, cedidos o compartidos por un átomo de dicho elemento al formar un compuesto según sea iónico o covalente. Se han de cumplir las siguientes reglas generales: • En un elemento el número de oxidación de sus átomos es cero. • El número de oxidación en un ion monoatómico coincide con su carga. • El número de oxidación del hidrógeno es +1 (aunque también puede presentar número de oxidación –1 como en los hidruros iónicos o covalentes como el B2H6 o SiH4. • El número de oxidación del oxígeno es –2, excepto en los peróxidos que es –1 y cuando se combina con el flúor que es +2. • Los metales alcalinos siempre tienen número de oxidación +1 y los alcalinotérreos +2. • La suma de los números de oxidación de los átomos que constituyen un compuesto multiplicados por sus correspondientes subíndices es cero si el compuesto es neutro y si es un ion poliatómico (SO42-), coincide con su carga. Números de oxidación de los elementos más frecuentes en formulación: NO METALES Elementos Símbolos Valencias Hidrógeno H -1 1 Flúor F -1 Cloro Cl Bromo Br -1 1,3,5,7 Iodo I Oxígeno Azufre Selenio Teluro Nitrógeno O S Se Te N -2 -1 -2 2,4,6 1,2,3,4,5 -3 Fósforo Arsénico Antimonio Bismuto Boro Carbono P As Sb Bi B C 1,3,5 -3 3,5 -3 3 2,4 -4 Silicio Si 4 IONES Nombre Fórmula Valencias Cianuro CN-1 Hidróxido -1 OHAmonio 1 NH4+ o azanio Nota: Las valencias subrayadas son las únicas que utilizan esos elementos para formar oxoácidos. Elementos Litio Sodio Potasio Rubidio Cesio Francio Plata Berilio Magnesio Calcio Estroncio Bario Radio Cinc Cadmio Cobre Mercurio Aluminio Oro Indio Talio Hierro Cobalto Níquel Estaño Plomo Platino Iridio Cromo Manganeso METALES Símbolos Li Na K Rb Cs Fr Ag Be Mg Ca Sr Ba Ra Zn Cd Cu Hg Al Au In Tl Fe Co Ni Sn Pb Pt Ir Cr Mn Valencias 1 2 1,2 3 1,3 2,3 2,4 2,3,6 2,3,4,6,7 2 3.- NORMAS PRÁCTICAS ELEMENTALES SOBRE FORMULACIÓN • • Para formular un compuesto binario debemos escribir juntos los símbolos los átomos de los dos elementos que lo forman. Se escribe siempre en primer lugar el símbolo del elemento que se encuentra más a la izquierda de la siguiente lista: Metales, B, Si, C, Sb, As, P, N, H, Te, Se, S, O, I, Br, Cl, F (1) Al nombrarlos se hace en orden inverso: Ejemplo: NaCl Cloruro de sodio Al2(SO4)3 Tris(tetraoxidosulfato) de dialuminio • Se piensa en los respectivos números de oxidación con que actúan los elementos o en la carga si es un ion poliatómico: Na+ ClAl3+ CO32- • Si se puede se simplifican los subíndices, teniendo en cuenta que deben ser números enteros y que le subíndice 1 no se escribe: N4+ O2N2O4 NO2 4.- PREFIJOS NUMERALES GRIEGOS uno...................mono dos....................di tres....................tri cuatro................tetra cinco.................penta seis....................hexa siete...................hepta ocho..................octa 5.- FORMULACIÓN Y NOMENCLATURA 5.1.- SUSTANCIAS SIMPLES -Cómo se formulan: Las sustancias simples se formulan mediante el símbolo del elemento acompañado de un subíndice que indica el número de átomos que forman la unidad estructural. -Cómo se nombran: Las sustancias simples formadas por moléculas sencillas se nombran anteponiendo al nombre del elemento el prefijo numeral griego que corresponde al número de átomos presentes en la molécula. En la práctica, este prefijo se suprime cuando se trata de la forma más usual del elemento, o si tiene un nombre común aceptado: H2 F2 Cl2 Br2 I2 N2 Hidrógeno Fúor Cloro Bromo Iodo Nitrógeno o o o o o o Dihidrógeno Diflúor Dicloro Dibromo Diiodo Dinitrógeno O2 O3 P4 S8 Oxígeno Ozono o o Dioxígeno Trioxígeno Tetrafósforo Octaazufre 3 5.1.- COMPUESTOS BINARIOS 5.2.1. Óxidos Los óxidos son compuestos binarios constituidos por oxígeno y un elemento cualquiera, a excepción de los halógenos. En todos el oxígeno actúa con número de oxidación –2. Los óxidos de metales se llaman óxidos metálicos o básicos y los de los no metales se llaman óxidos no metálicos o ácidos. Ambos se nombran de igual forma: a) Con número de oxidación: Se escribe la palabra óxido seguida del nombre del elemento. Si el elemento tiene más de una valencia o número de oxidación se indica con números romanos y entre paréntesis a continuación y sin espacio. b) Número de composición: Indicando el número de átomos de cada elemento presentes en la unidad estructural con prefijos numerales griegos: c) Con el número de carga: (Sólo para óxidos metálicos y con más de una carga). En este caso, se coloca entre paréntesis el valor de la carga iónica en números arábigos seguido de su signo, y el paréntesis se escribe a continuación del nombre, sin dejar espacios. Hay que tener en cuenta que los halógenos son considerados, por convenio, más electronegativos que el oxígeno. Por tanto, las combinaciones binarias de un halógeno con el oxígeno se nombran como haluros de oxígeno y no como óxidos, y el halógeno se escribirá a la derecha (*): OCl2 dicloruro de oxígeno Fórmula Na2O Al2O3 CaO FeO Fe2O3 O5Cl2 OBr2 O3Cl2 dicloruro de trioxígeno Número de oxidación Óxido de sodio Óxido de aluminio Óxido de calcio Óxido de hierro(II) Óxido de hierro(III) Número de composición Número de carga Monóxido de disodio Trióxido de dialuminio Monóxido de calcio Monóxido de hierro Óxido de hierro(2+) Trióxido de dihierro Óxido de hierro(3+) Dicloruro de pentaoxígeno Dibromuro de oxígeno (*) El prefijo mono puede ser omitido si ello no lleva a confusión. 5.2.2. Peróxidos En estos compuestos el oxígeno actúa con valencia –1, siendo el ion característico de estos compuestos el O22- y se combina con elementos de los grupos 1, 2, 11 y 12. La fórmula general de estos compuestos es: Mn(O2)m. Estos compuestos se nombran: a) Con número de oxidación: Se escribe la palabra peróxido seguida del nombre del elemento. Si el elemento tiene más de una valencia o número de oxidación se indica con números romanos, entre paréntesis y sin espacios. b) Número de composición: Indicando el número de átomos de cada elemento presentes en la unidad estructural con prefijos numerales griegos: Fórmula Li2O2 BaO2 H2O2 Cu2O2 CuO2 Número de oxidación Peróxido de litio Peróxido de bario Peróxido de hidrógeno Peróxido de cobre(I) Peróxido de cobre(II) Número de composición Dióxido de dilitio Dióxido de bario Dióxido de dihidrógeno (agua oxigenada) Dióxido de dicobre Dióxido de cobre 4 5.2.3. Hidruros Son las combinaciones binarias del hidrógeno con otro elemento, que puede ser metálico o no metálico. Existen tres tipos de hidruros: 1. Hidruros metálicos: tienen carácter básico, en ellos el hidrógeno utiliza la valencia –1 y se combina con un metal con sus valencias correspondientes. Se formulan escribiendo primero el símbolo del elemento metálico y después el del hidrógeno. A continuación se intercambian las valencias. Se nombran escribiendo la palabra hidruro seguida del nombre del metal. a) Con Número de composición: se utilizan prefijos para indicar el número de átomos de hidrógeno en el compuesto. b) Con número de oxidación: se especifica a continuación del nombre del metal, su valencia entre paréntesis y sin espacios y con números romanos en el caso de que este tenga varias valencias. Fórmula LiH MgH2 AlH3 CrH2 CrH3 Número de oxidación Hidruro de litio Hidruro de magnesio Hidruro de aluminio Hidruro de cromo(II) Hidruro de cromo(III) Número de composición Hidruro de litio Dihidruro de magnesio Trihidruro de aluminio Dihidruro de cromo Trihidruro de cromo 2. Hidruros de nometales de los grupos 13, 14 y 15 del Sist. Periódico. Están formados por la combinación del hidrógeno con los no metales que están a su izquierda en la lista (1). Los de los grupos 13 y 15 utilizan la valencia -3 y los del grupo 14 utilizan la valencia -4. • Se formulan escribiendo primero el símbolo del elemento y después el del hidrógeno, a continuación se intercambian sus valencias. • Se nombran con la palabra hidruro seguida del nombre del no metal, utilizándose prefijos para indicar el número de hidrógenos. Todos estos compuestos tienen nombres particulares admitidos por la IUPAC: Fórmula NH3 PH3 AsH3 SbH3 BiH3 CH4 SiH4 BH3 N2H4 B2H6 Nom. composición Nom. de sustitución N. tradicional Trihidruro de nitrógeno Azano Amoníaco Trihidruro de fósforo Fosfano Trihidruro de arsénico Arsano Trihidruro de antimonio Estibano Trihidruro de bismuto Bismutano Tetrahidruro de carbono Metano Tetrahidruro de silicio Silano Trihidruro de boro Borano Tetrahidruro de dinitrógeno Diazano Hidracina Hexahidruro de diboro Diborano 3. Hidruros de los grupos 16 y 17 del Sist. Periódico (haluros de hidrógeno). Están formados por la combinación del hidrógeno con los no metales que están a su derecha en la lista (1). En estos compuestos el hidrógeno actúa con la valencia +1 y los no metales con su única valencia negativa. Los haluros de hidrógeno en disolución acuosa dan disoluciones ácidas y reciben el nombre de ácidos hidrácidos. 5 • Se formulan: escribiendo primero el símbolo del hidrógeno y después el del no metal intercambiándose sus valencias. • Se nombran: añadiendo la terminación –uro a la raíz del nombre del no metal y especificando a continuación de hidrógeno. En disolución acuosa se nombran anteponiendo la palabra ácido seguida de la raíz del nombre del no metal con la terminación -hídrico Esta nomenclatura es aplicable al caso del HCN Fórmula HF HCl HBr HI H2S H2Se H2Te HCN Nomenclatura de composición Fluoruro de hidrógeno Cloruro de hidrógeno Bromuro de hidrógeno Yoduro de hidrógeno Sulfuro de hidrógeno Seleniuro de hidrógeno Telururo de hidrógeno Cianuro de hidrógeno En disolución acuosa Nom. Sustitución Ácido fluorhídrico Fluorano Ácido clorhídrico Clorano Ácido bromhídrico Bromano Ácido iodhídrico Yodano Ácido sulfhídrico Sulfano Ácido selenhídrico Selano Ácido telurhídrico Telano Ácido cianhídrico La fórmula es la misma en las tres situaciones, aunque cuando están en su estado natural que es gaseoso puede acompañarse a la fórmula con (g) y cuando están en disolución acuosa puede acompañarse con (ac). 5.2.4 Sales Binarias Se tratan de dos tipos de combinaciones: a) Sales neutras: combinación de un metal y un no metal, a excepción del oxígeno y del hidrógeno b) Sales volátiles: combinaciones de no metales entre sí, a excepción del oxígeno y del hidrógeno. • Se formulan: en ambos casos el elemento más electronegativo, es decir, el que se encuentra más a la derecha en la lista (1), se coloca a la derecha utilizando su única valencia negativa y el otro a la izquierda utilizando todas sus valencias positivas. Luego se intercambian las mismas. • Se nombran: Añadiendo la terminación –uro a la raíz del nombre del elemento situado a la derecha de la fórmula y a continuación se añade el nombre del otro elemento. a) Con número de composición: se utilizan prefijos para indicar el número de átomos de cada clase. b) Con número de oxidación: se especifica a continuación la valencia utilizada por el elemento nombrado en segundo lugar, en números romanos, entre paréntesis y sin espacio (si tiene más de una valencia). Fórmula LiF CaCl2 MnS CoBr2 CoBr3 BrF3 P2 S5 IF7 Número de oxidación Fluoruro de litio Cloruro de calcio Sulfuro de manganeso(II) Bromuro de cobalto(II) Bromuro de cobalto(III) Fluoruro de bromo(III) Sulfuro de fósforo(V) Fluoruro de yodo(VII) Número de composición Fluoruro de litio Dicloruro de clacio Sulfuro de manganeso Dibromuro de cobalto Tribromuro de cobalto Trifluoruro de bromo Pentasulfuro de difósforo Heptafluoruro de yodo 6 5.2.4.1 Cationes Cuando un átomo o un grupo de átomos pierden electrones, se convierten en un ion positivo o catión. • Se formulan con el símbolo o símbolos de los átomos que lo constituyen, escribiendo, como subíndice la cantidad de átomos que haya de cada uno y como superíndices la carga eléctrica que presenta. • Se nombran con la palabra ion o catión seguida del nombre del elemento. Si el elemento puede formar más de un catión: a) Con número de oxidación: se pone la palabra catión y se especifica a continuación la valencia utilizada por el ion, en números romanos, entre paréntesis y sin espacio. Para los cationes poliatómicos existen nombres particulares. b) Con Número de carga: se pone la palabra ion y se indica a continuación el número de carga, con el signo + entre paréntesis y si espacio. Fórmula Número de oxidación Número de carga H+ K+ Mg2+ Ni2+ Ni3+ Hg22+ H3O+ NH4+ Catión hidrógeno(I) Catión potasio(I) Catión magnesio(II) Catión níquel(II) Catión níquel(III) Catión dimercurio(II) Ion hidrógeno(1+) Ion potasio(1+) Ion magnesio(2+) Ion níquel(2+) Ion níquel(3+) Ion dimercurio(2+) Ion oxonio u oxidanio Ion azanio N. tradicional Amonio 5.2.4.2 Aniones Cuando un átomo o un grupo de átomos ganan electrones, se convierten en un ion negativo o anión. • • Se formulan con el símbolo o símbolos de los átomos que lo constituyen, escribiendo, como subíndice la cantidad de átomos que haya de cada uno y como superíndices la carga eléctrica que presenta. Se nombran: los aniones monoatómicos/homopoliatómicos con la palabra ion o anión seguida de la raíz del nombre del elemento terminado en –uro y puede ponerse o no la carga del ion entre paréntesis y sin espacio entre el nombre y el paréntesis. La única excepción es el nombre del anión O-2 que se llama anión óxido y el O22- dióxido o peróxido. Fórmula ClS2O2O22- Nomenclatura de composición Anión cloruro(1-) o cloruro Anión sulfuro(2-) o sulfuro Anión óxido(2-) u óxido Anión dióxido(2-) o peróxido Los aniones poliatómicos se estudiarán más adelante. Un anión poliatómico muy importante es el OH-, se le llama ion hidróxido. 5.3 COMPUESTOS TERNARIOS 5.3.1 Hidróxidos Los hidróxidos se caracterizan por tener el grupo OH-, llamado hidróxido, de valencia –1, unido a un catión metálico. Estos compuestos se llaman hidróxidos o bases por el carácter básico de sus disoluciones acuosas. 7 • Se formulan escribiendo primero el catión y después el ion hidróxido intercambiando sus valencias: K+ , OHKOH Ca2+ , OHCa(OH)2 • Se nombran en la notación de Stock con la palabra hidróxido seguida del nombre del metal, si el metal puede actuar con varias valencias, se especifica esta, entre paréntesis y con números romanos. En la notación de composición se utilizan prefijos numerales. Fórmula Fe(OH)2 Al(OH)3 NaOH 5.3.2 Número de oxidación Hidróxido de hierro(II) Hidróxido de aluminio Hidróxido de sodio Número de composición Dihidróxido de hierro Trihidróxido de aluminio Hidróxido de sodio Ácidos Oxoácidos Los ácidos oxoácidos son compuestos formados por hidrógeno, un no metal y oxígeno, cuya fórmula general es: HxXyOz, donde X representa en general un no metal. Hay algunas excepciones con metales de transición con elevados números de oxidación como cromo, manganeso, tecnecio, molibdeno, etc. Cuando se encuentran en disolución acuosa, dejan en libertad protones (H+), dando propiedades ácidas a las disoluciones. • Se formulan a partir de los números de oxidación de los elementos que forman la molécula. En los oxoácidos de fórmula HxXyOz, el hidrógeno tiene número de oxidación +1, el oxígeno–2 y el elemento X puede tener cualquiera de sus números de oxidación positivos. La suma de todos los productos de los subíndices de cada elemento por los correspondientes números de oxidación debe ser igual a cero. Así para formular el ácido del azufre con número de oxidación +6, se busca el número de oxígenos que multiplicado por su valencia (-2) sobrepase a este número. Para neutralizar el exceso de carga se utilizan tantos hidrógenos como haga falta: 6+ (2-) 6+ (2-)·4 6+ 82(1+) 6+ 8H2SO4 H S O4 H S O4 H S O4 H2 S O4 Carga total: 2(+1) + 6 -8 = 0 • Se nombran: La IUPAC admite la nomenclatura tradicional, aunque recomienda la nomenclatura de hidrógeno • Nomenclatura tradicional: Se escribe la palabra ácido seguida de la raíz del nombre del elemento X que vendrá acompañado de prefijos y sufijos en función del números de estados de oxidación que pueda presentar el elemento X: - Si el elemento tiene cuatro estados de oxidación se utiliza: Ácido hipo........oso Ácido ...............oso Aumenta el número de oxidación Ácido ...............ico Ácido per..........ico - Si el elemento tiene tres estados de oxidación se utiliza: Ácido hipo........oso Ácido ...............oso Aumenta el número de oxidación Ácido ...............ico - Si el elemento tiene dos estados de oxidación se utiliza: Ácido ...............oso Ácido ...............ico - Aumenta el número de oxidación Si el elemento tiene un estado de oxidación se utiliza: Ácido ...............ico 8 Así en el ejemplo anterior como el azufre tiene tres números de oxidación positivos (+2,+4 y +6), al utilizar el mayor de los tres, el ácido acabará en –ico, por lo tanto será el ácido sulfúrico. • Nomenclatura de hidrógeno o composición: Se pone la palabra hidrogeno sin acento (con un prefijo numérico si hay más de uno) y a continuación se indica entre paréntesis la palabra óxido (con un prefijo numeral antepuesto a la palabra óxido, si hay más de un oxígeno en la fórmula) seguido del nombre del elemento X (con un prefijo si hay más de un átomo de X) acabado siempre en -ato: Prefijo(a)hidrogeno(prefijo(a)-óxido- prefijo(b)-raíznombre de X-ato) a. prefijo que indica el número de hidrógenos. b. “ “ “ “ “ de oxígenos c. “ “ “ “ “ de átomos de X Fórmula HClO HClO2 HBrO3 HClO4 H2SeO2 Nomenclatura tradicional Ácido hipocloroso Ácido cloroso Ácido brómico Ácido perclórico Ácido hiposelenioso Nomenclatura de hidrógeno (composición) Hidrogeno(oxidoclorato) Hidrogeno(dioxidoclorato) Hidrogeno( trioxidobromato) Hidrogeno(tetraoxidoclorato) Dihidrogeno(dioxidoseleniato) Excepciones de los ácidos oxoácidos Existen algunos elementos que pueden formar varios oxoácidos con el mismo nº de oxidación, la diferencia estriba en el distinto contenido en hidrógenos y oxígenos. • Ácidos del fósforo, arsénico y antimonio: pueden formar ácidos meta- , di- y orto-. - Los ácidos meta- serían los “normales”, como el ejemplo anterior del ácido sulfúrico. - Los ácidos orto- se forman a partir de los meta- sumándole una molécula de agua. No se suele poner el prefijo orto: HPO3 (ácido metafosfórico) + H2O H3PO4 [ácido fosfórico o o hidrógeno(trioxidofosfato) trihidrógeno(tetraoxidofosfato)] - Los ácidos di- se forman quitándole una molécula de agua a la suma de dos moléculas del ácido orto: 2 x H3PO3 (ácido fosforoso o = H6P2O6 - H2O= H4P2O5 [ácido difosforoso o Trihidrógeno(trioxidofosfato) tetrahidrógeno(pentaoxidodifosfato)] * Si el elemento no forma ácidos orto-, se parte del ácido normal, como el caso del azufre y el cromo: 2x H2SO4= H4S2O8 – H2O= H2S2O7 [ácido disulfúrico o dihidrógeno(heptaoxidodisulfato)] También existen ácidos tri-, tetra- ,...., hacen referencia al grado de polimerización de los ácidos, en general se quita una molécula de agua menos que el número que indica el grado de polimerización: 3 x H3PO4 = H9P3O12 – 2 H2O= H5P3O10 (ácido trifosfórico) • Ácidos del boro y silicio: estos dos elementos forman ácidos meta- y orto-, que siguen las mismas reglas que los anteriores: HBO2 (ácido metabórico) + H2O = H3BO3 [ácido bórico o trihidrogeno(trioxidoborato)] H2SiO3 (ácido metasilícico) + H2O = H4SiO4 [ácido silícico o tetrahidrogeno(tetraoxidosilicato )] 9 • Tioácidos: se forman a partir de oxoácidos donde un oxígeno es sustituido por un azufre con el mismo nº de oxidación: H2SO4 (ácido sulfúrico) • H2S2O3 (ácido tiosulfúrico) Ácidos de algunos metales [Cr(6+), Mn(6+ y 7+), Vanadio, Niobio y Tántalo(5+)]: Cada uno de ellos forma al menos dos ácidos: H2CrO4 H2MnO4 HVO3 HNiO3 Fórmula HAsO2 H3SbO4 H2S2O5 Ácido crómico Ácido mangánico Ácido metavanádico Ácido metanióbico Nomenclatura tradicional Ácido metaarsenioso Ácido antimónico Ácido disulfuroso H2Cr2O7 HMnO4 H3VO4 H3NiO4 Ácido dicrómico Ácido permangánico Ácido vanádico Ácido nióbico Nomenclatura de hidrógeno (composición) Hidrogeno(dioxidoarseniato) Trihidrogeno(tetraoxidoantimoniato) Dihidrogeno(pentaoxidoodisulfato) 5.3.2.1 Aniones de los oxoácidos Cuando una molécula de un oxoácido pierde todos sus hidrógenos en forma de H+, se convierte en un ion con tanta carga negativa como hidrógenos haya perdido. • • Se nombran en la nomenclatura tradicional sustituyendo la palabra ácido por ion, y la terminación –oso por –ito y la –ico por –ato. En la de hidrógeno se escribe la palabra óxido (con un prefijo numeral antepuesto a la palabra óxido, si hay más de un oxígeno en la fórmula) seguido del nombre del elemento X (con un prefijo si hay más de un átomo de X) acabado siempre en –ato y por último la carga del ion entre paréntesis y sin espacios : Fórmula ClOSO32PO43P2O54- Nomenclatura tradicional ion hipoclorito ion sulfito ion fosfato ion difosfito Nomencaltura de composición ion oxidoclorato(1-) ion trioxidosulfato(2-) ion tetraoxidofosfato(3-) ion pentaoxidodifosfato(4-) 5.3.2.2 Aniones de los oxoácidos con hidrógeno o hidrógenos Cuando el ácido tiene al menos dos hidrógenos, como el H2SO4, H3PO4, etc., es posible que no pierda todos los hidrógenos, con lo que se forman aniones con al menos un hidrógeno: H3PO4 H2PO4+ H+ Ác. fosfórico ion dihidrógenofosfato o Dihidrogeno(tetraoxidoofosfato)(1-) Trihidrogeno(tetraoxidofosfato) La nomenclatura es igual que en los aniones anteriores, solo que hay que añadir delante del nombre el número de átomos de hidrógeno que quedan en el ion. En la nomenclatura de hidrógeno además se pone paréntesis después de la palabra hidrogeno: H2SO4 HSO4- + H+ Ác. sulfúrico ion hidrogenosulfato o hidrogeno(tetraoxidosulfato)(1-) Dihidrogeno(tetraoxidosulfato) 10 5.3.3 Oxisales neutras Cuando un oxiácido pierde todos sus hidrógenos y se convierte en un anión y se combina con un metal o el ion amonio (NH4+), se forma una oxisal. • Se formulan: escribiendo el catión a la izquierda de la fórmula seguido del anión derivado del oxoácido. Se intercambian las cargas de los dos iones y si es posible se simplifica: Fe3+ + SO42- • Fe2(SO4)3 Se nombran: en la nomenclatura tradicional con el nombre del anión seguido de la preposición de y a continuación el nombre del catión metálico y entre paréntesis y sin espacios la carga del metal en números romanos o en números arábigos. En este segundo caso se acompaña con el signo + : En el caso anterior sería: Sulfato de hierro(III) o Sulfato de hierro(3+) En la nomenclatura de hidrógeno se escribe la palabra óxido (con un prefijo numeral antepuesto a la palabra óxido, si hay más de un oxígeno en la fórmula) seguido del nombre del elemento X (con un prefijo si hay más de un átomo de X) acabado siempre en –ato y a continuación el nombre del catión metálico con un prefijo numérico si hay más de uno en la fórmula: Si el anión tiene subíndice numérico, se expresa con prefijos griegos multiplicativos: bis-, tris-, tetrakis-, etc En el caso anterior sería: Tris(tetraoxidosulfato) de dihierro 5.4 COMPUESTOS CUATERNARIOS 5.4.1 Sales ácidas de los oxoácidos Una sal ácida está formada por la combinación de un catión metálico con un anión que todavía contiene átomos de hidrógeno. • Se formulan escribiendo el catión a la izquierda de la fórmula seguido del anión derivado del oxoácido. Se intercambian las cargas de los dos iones y si es posible se simplifica: Fe3+ + HSO4Fe(HSO4)3 Ion hierro(3+) anión hidrogenosulfato o ion hidrogeno(tetraoxidosulfato)(1-) • Se nombran con el nombre del anión seguido de la preposición de y, a continuación el nombre del catión metálico y entre paréntesis y sin espacios la carga del metal en números romanos o en números arábigos. En este segundo caso se acompaña con el signo + : En el caso anterior sería: Hidrogenosulfato de hierro(III) o (3+) Tris[hidrogeno(tetraoxidosulfato)] de hierro Fórmula KHSO3 Ni(H2PO4)3 NaHCO3 Nomenclatura tradicional Hidrogenosulfito de potasio Dihidrogenofosfato de níquel(III) Hidrogenocarbonato de sodio Nomenclatura de composición Hidrogeno(trioxidosulfato) de potasio Tris[dihidrogeno(tetraoxidofosfato)] de níquel Hidrogeno(trioxidocarbonato) de sodio 11 Número de oxidación Óxidos Hidruros ácidos En disolución acuosa | N. sustitución Número de oxidación Hid. Metálicos Nomenclatura de sustitución Hid. volátiles Número de oxidación Sales binarias Número de oxidación Hidróxidos Tradicional Oxoácidos Tradicional Oxisales 1 H2O 2 3 Trióxido de dialuminio As2O5 4 5 Óxido de bario MgO 6 Óxido de carbono(IV) 7 8 Monóxido de cobre Cu2O 9 Dibromuro de pentaoxígeno 10 Trióxido de dicobalto 11 HgO 12 SnO2 13 14 Peróxido de potasio CaO2 15 16 Dióxido de hierro H2O2 17 18 Peróxido de cinc HCl 19 Ácido sulfhídrico 20 21 Bromuro de hidrógeno HI 22 23 24 Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de hidrógeno Nomenclatura de hidrógeno Seleniuro de hidrógeno NH3 Metano 12 Número de oxidación Óxidos Hidruros ácidos En disolución acuosa | N. sustitución Número de oxidación Hid. Metálicos Nomenclatura de sustitución Hid. volátiles Número de oxidación Sales binarias Número de oxidación Hidróxidos Tradicional Oxoácidos Tradicional Oxisales 25 26 Tetrahidruro de silicio NiH3 27 Borano 28 29 Dihidruro de plomo AlH3 30 31 Hidruro de platino(IV) HF 32 Telururo de hidrógeno 33 34 Hidruro de litio AgBr 35 Sulfuro de amonio 36 37 Tricloruro de hierro Ca3P2 38 Cloruro de arsénico(V) 39 40 Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de hidrógeno Nomenclatura de hidrógeno Heptafluoruro de cloro BF3 41 Tetracloruro de carbono 42 Seleniuro de dicobre 43 KCN 44 CdS 45 Sulfuro de carbono(IV) 46 Dinitruro de trimagnesio 47 PbSe 48 NH4Cl 13 Óxidos Hidruros ácidos Hid. Metálicos Hid. volátiles Sales binarias Hidróxidos Oxoácidos Oxisales 49 50 Número de oxidación En disolución acuosa | N. sustitución Número de oxidación Nomenclatura de sustitución Número de oxidación Número de oxidación Tradicional Tradicional Cianuro de sodio NaOH 51 Hidróxido de oro(III) 52 53 Trihidróxido de aluminio Sn(OH)2 54 55 Hidróxido de amonio Pt(OH)4 56 57 Hidróxido de mercurio(II) HNO3 58 Ácido hipobromoso 59 60 Hidrogeno(tetraoxidoclorato) H2SeO3 61 Ácido sulfúrico 62 63 Dihidrogeno(dioxidosulfato) H2CO3 64 Ácido peryódico 65 Ácido nitroso 66 H3PO4 67 Ácido metaarsenioso 68 69 Dihidrogeno(heptaoxidodisulfato ) H4As2O7 70 Ácido silícico 71 Ácido metabórico 72 Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de hidrógeno Nomenclatura de hidrógeno HPO2 14 Óxidos Hidruros ácidos Hid. Metálicos Hid. volátiles Sales binarias Hidróxidos Oxoácidos Oxisales 73 Número de oxidación En disolución acuosa | N. sustitución Número de oxidación Nomenclatura de sustitución Número de oxidación Número de oxidación Tradicional Tradicional H2SiO3 74 Ácido pemangánico 75 Ácido dicrómico 76 Tetrahidrogeno(pentaoxidodiarseniato) 77 HClO 78 H2CrO4 79 80 Ácido yódico AgNO3 81 Carbonato de hierro(III) 82 83 Dioxidonitrato de potasio (NH4)2SO2 84 Perclorato de plomo (IV) 85 86 Trioxidofosfato) de triplata SnP2O7 87 Antimoniato de oro(I) 88 Permanganato de potasio 89 MgCrO4 90 FeSO3 91 Hiposelenito de mercurio(II) 92 Tetraoxidofosfato de triamonio 93 PtSiO4 94 K2CO3 95 96 Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de hidrógeno Nomenclatura de hidrógeno Nitrito de estaño(II) Heptaoxidodicromato de disodio 15 Óxidos Hidruros ácidos Hid. Metálicos Hid. volátiles Sales binarias Hidróxidos Oxoácidos Oxisales 97 NH4BrO3 98 Li3AsO4 Número de oxidación En disolución acuosa | N. sustitución Número de oxidación Nomenclatura de sustitución Número de oxidación Número de oxidación Tradicional Tradicional 99 Sulfato de cadmio 100 Cromato de cesio 101 Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de hidrógeno Nomenclatura de hidrógeno Trioxidocarbonato de plata 102 CuNO3 103 Borato de aluminio 104 K2MnO4 105 Dicromato de potasio 106 Trioxidoborato de trisodio 107 Sr(NO3)2 108 PbCO3 109 CaHPO4 110 Hidrogenosulfito de cobalto(III) 111 Hidrogeno(tetraoxidofosfato) de dilitio 112 KHCO3 113 MgH2As2O7 114 Hidrogenosulfato de hierro(II) 115 Dihidrogeno(tetraoxidosilicato) de dipotasio 116 AgHSeO3 117 KHS 118 Didrogenosilicato de cadmio 119 LiH3P2O5 120 Hidrogenotelurito de sodio 16 Óxidos Hidruros ácidos Hid. Metálicos Hid. volátiles Sales binarias Hidróxidos Oxoácidos Oxisales Número de oxidación En disolución acuosa | N. sustitución Número de oxidación Nomenclatura de sustitución Número de oxidación Número de oxidación Tradicional Tradicional Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de hidrógeno Nomenclatura de hidrógeno 121 MnO2 122 Óxido de plomo(IV) 123 Dióxido de estaño 124 Cs2O2 125 Peróxido de berilio 126 O5Cl2 127 AuH 128 PH3 129 Silano 130 Trihidruro de cobalto 131 HBr 132 Ácido fluorhídrico 133 Fosfuro de aluminio 134 KsS 135 HgCl 136 Ni(OH)2 137 Hidróxido de cadmio 138 KOH 139 Tetrahidróxido de estaño 140 HIO2 141 Ácido hiposulfuroso 142 143 Hidrogeno(tetraoxidobromato) Ácido metasilícico 144 H4SiO4 17 Número de oxidación Óxidos Hidruros ácidos En disolución acuosa | N. sustitución Número de oxidación Hid. Metálicos Nomenclatura de sustitución Hid. volátiles Número de oxidación Sales binarias Número de oxidación Hidróxidos Tradicional Oxoácidos Tradicional Oxisales 145 Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de composición Nomenclatura de hidrógeno Nomenclatura de hidrógeno Ácido diarsenioso 146 Hidrogenotrioxidonitrato 147 H2Cr2O7 148 Ácido disulfúrico 149 Tetrahidrogeno(pentaoxidodifosfato) 150 H2CO3 151 Ácido fosfórico 152 Hg2SO4 153 Nitrito de plata 154 Trioxidoseleniato de hierro(II) 155 Co(NO2)3 156 BaCO3 157 Ortofosfato de níquel (II) 158 Dicromato de plomo (IV) 159 Tetraoxidosilicato de dicalcio 160 LiNO3 161 Perclorato de oro (III) 162 Hidrogenosulfato de cobalto (II) 163 Ca(HCO3)2 164 Bis-[dihidrogeno(tetraoxofosfato)] de cinc 165 MgH2SiO4 166 Hidrogenocarbonato de plata 167 NaHSO3 168 Hidrogenoseleniuro de potasio 18