Cifras significativas
- Todas las cifras distintas a 0 son significativas.
- Los ceros a la derecha de la coma son significativos.
- Los ceros del principio de un número no son significativos.
- Los ceros al final de un número sin coma no son significativos.
Redondeo
- Si el primer dígito despreciado es 5 ó mayor de 5, se aumenta la cifra anterior.
- Si el primer dígito despreciado es menor de 5, la cifra permanece inalterada.
- En sumas o restas el número resultante no debe tener más cifras decimales que el
número que menos posea.
- En multiplicaciones o divisiones el número resultante no debe superar el número de
cifras significativas que el número que menos posea.
Sistema Internacional de Unidades
Magnitud
Longitud
Masa
Tiempo
Temperatura
Intensidad de corriente
Intensidad luminosa
Cantidad de sustancia
Unidad
Metro
Kilogramo
Segundo
Kelvin
Amperio
Candela
Mol
Símbolo
m
Kg
s
K
A
cd
mol
Múltiplos y submúltiplos
tera (T)
giga (G)
mega (M)
kilo (k)
mili (m)
micro (µ)
nano (n)
pico (p)
12
10
9
10
6
10
3
10
-3
10
-6
10
-9
10
-12
10
Notación científica
Se representa el número con una parte entera de una sola cifra seguida de la parte
decimal y una potencia de 10.
5
521787’2 = 5’217872 · 10
Tipo de magnitudes
Medir magnitudes es comparar una unidad con una cantidad que se toma como patrón
o unidad. Existen dos tipos de magnitudes:
- Escalares: se expresa mediante un número que representa el valor de la magnitud y
la unidad correspondiente. El tiempo, la energía o la carga eléctrica.
- Vectoriales: se expresa indicando su intensidad y su unidad, la dirección y el sentido.
La fuerza, la velocidad o la aceleración.
Precisión y sensibilidad
La precisión de un instrumento de medida es el valor mínimo de la magnitud que puede
apreciar.
La sensibilidad de un instrumento es la capacidad de detectar cambios de la magnitud
a medir.
Todos estos conceptos van relacionados con las cifras significativas.
Ejemplos:
17’3g = el aparato de medida tiene una precisión igual a ±0’1g
17’300g = el aparato de medida tiene una precisión igual a ±0’001g
Errores sistemáticos y accidentales
Todas las medidas están afectadas por algún error. Podemos clasificarlos en:
- Errores sistemáticos: tienen que ver con la forma de realizar la medida.
Error de calibrado: el instrumento tiene un error en la puesta a cero.
Error de paralaje: cuando un observador mira de forma oblicua una escala
analógica.
- Errores accidentales: son aquellos que se producen al azar debido a causas
imposibles de controlar. Para minimizar su efecto medimos varias veces y tomamos
como el valor más probable la media aritmética de las medidas.
Cinco alumnos han medido la altura de uno de sus compañeros y han obtenido las
siguientes medidas:
163, 162,164, 164, 162 (cm)
Halla el error absoluto (Ea) y el error relativo (Er) de cada medida.
Ea
Er
𝐸𝑎
|ẋ - xn|
· 100
ẋ
0
163 cm
|163 – 163| = 0 cm
· 100 = 0%
162 cm
|163 – 162| = 1 cm
164 cm
|163 – 164| = 1 cm
164 cm
|163 – 164| = 1 cm
162 cm
|163 – 162| = 1 cm
ẋ = 163 cm
163
1
163
1
163
1
163
1
163
· 100 = 0’6%
· 100 = 0’6%
· 100 = 0’6%
· 100 = 0’6%
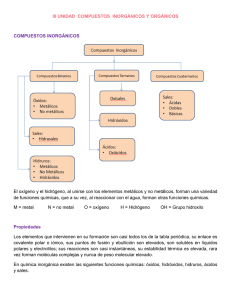
Formulación y nomenclatura inorgánica
- Número de oxidación: es un nº teórico que indica el nº de electrones que el átomo
habría ganado o perdido si fuese completamente iónico.
El nº de oxidación de los átomos de un elemento libre es cero.
El nº de oxidación del hidrógeno es -1 (hidruros metálicos) y +1 (resto de
compuestos).
El nº de oxidación del oxígeno es -2 (a excepción de algunos compuestos)
El nº de oxidación de los metales es siempre positivo.
os
La suma algebraica de los n de oxidación de los átomos de una molécula es cero.
os
- Compuestos binarios: siguen el principio del cambio de n de oxidación sin signo
An Bm
Óxidos: agrupación de cualquier elemento más el oxígeno. Podemos diferenciar
entre óxidos metálicos y no metálicos, y los nombramos con la nomenclatura
sistemática o la de Stock.
Hidruros: agrupación de cualquier elemento más el hidrógeno
Hidruros no metálicos de los grupos 16 y 17 del SP
- Nº de oxidación +1
- Disoluciones acuosas de carácter ácido
- Se nombran mediante la nomenclatura sistemática y la tradicional
Fórmula
Nomenclatura
Nomenclatura
sistemática
tradicional
HF
Fluoruro de hidrógeno
Ácido fluorhídrico
HCl
Cloruro de hidrógeno
Ácido clorhídrico
HBr
Bromuro de hidrógeno
Ácido bromhídrico
HI
Yoduro de hidrógeno
Ácido yodhídrico
H2S
Sulfuro de dihidrógeno
Ácido sulfhídrico
H2Se
Seleniuro de dihidrógeno
Ácido selenhídrico
H2Te
Telururo de dihidrógeno
Ácido telurhídrico
Hidruros no metálicos de los grupos 13, 14 y 15 del SP
- Disoluciones acuosas muy volátiles
- Se nombran mediante la nomenclatura sistemática y la tradicional
Fórmula
Nomenclatura
sistemática
Trihidruro de boro
Tetrahidruro de carbono
Tetrahidruro de silicio
Trihidruro de nitrógeno
Trihidruro de fósforo
Trihidruro de arsénico
Trihidruro de antimonio
Nomenclatura
tradicional
Borano
Metano
Silano
Amoníaco
Fosfina
Arsina
Estibina
BH3
CH4
SiH4
NH3
PH3
AsH3
SbH3
Hidruros metálicos
- Situamos en primer lugar el metal y luego el hidrógeno
- Podemos nombrarla mediante nomenclatura sistemática y de Stock
Ejemplos:
FeH2 – Dihidruro de hierro – Hidruro de hierro (II)
AlH3 – Trihidruro de aluminio – Hidruro de aluminio
Sales binarias: son combinaciones binarias formadas por un metal y un no metal.
- Se nombran con la nomenclatura sistemática y de Stock
Ejemplos:
FeCl2 – Dicloruro de hierro – Cloruro de hierro (II)
Al2S3 – Trisulfuro de dialuminio – Sulfuro de aluminio
- Compuestos ternarios: en este apartado veremos únicamente los hidróxidos,
compuestos formados por la unión de un metal con el ión OH y los ácidos oxoácidos,
compuestos formados por el hidrógeno, el oxígeno y un no metal.
Hidróxidos
M(OH)x
M metal
OH Oxígeno + hidrógeno (grupo hidróxido)
x valencia del elemento
Estos compuestos los podemos nombrar por la nomenclatura sistemática y por la
de Stock.
Ácidos oxoácidos
HxEyOz
El hidrógeno actúa con nº de oxidación +1.
El oxígeno actúa con nº de oxidación -2.
El elemento E(no metal) actúa con nº de oxidación positivo.
- Nomenclatura sistemática: prefijo que indica el número de átomos de oxígeno,
os
nombre del no metal terminado en –ato, número de oxidación del no metal en n
romanos, la terminación de hidrógeno.
Pasos del método científico
1. Observación y planteamiento del problema.
2. Formulación de una hipótesis verosímil.
3. Comprobación de la hipótesis: planificación de experimentos, control de variables…
4. Interpretación de resultados ¿Hipótesis comprobada?
Sí: Establecemos leyes y teorías.
No: Revisamos la hipótesis y volvemos a realizar todo el proceso.