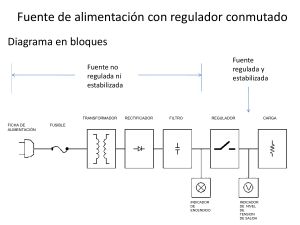
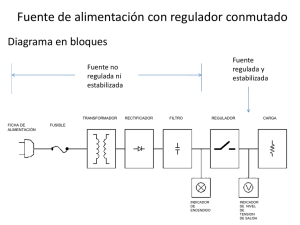
Correccin de puntos de ebullicin a presin estndar
Anuncio

Práctica Número 3. Separación de los componentes de una mezcla. Corrección de puntos de ebullición a presión estándar La corrección de los puntos de ebullición puede ser realizada, usando la siguiente ecuación: Δt = ( 273.1+ t )( 2.8808− log p ) φ + 0.15( 2.8808− log p ) Ecuación 1 Donde Δt= los grados centígrados que se deben adicionar al punto de ebullición observado t= punto de ebullición observado, ºC log p= el logaritmo de la presión observada en mmHg φ = la entropía de vaporización a 760 mmHg El Valor de φ puede ser estimado de la tabla y grafica. Las sustancias que no aparecen en la tabla, pueden ser consideradas en aquellos grupos de compuestos que presentan semejanzas físicas o estructurales. Ejemplo El benceno hierve a 20 ºC a una presión de 75 mmHg. Con estos datos cual será a temperatura de ebullición a 1 atmosfera? El benceno no aparece en la Tabla, pero los hidrocarburos se encuentran en el grupo 2. Así que un compuesto en el grupo dos que tiene una temperatura de ebullición de 20 ªC, tiene un valor de φ de 4.6. Sustituyendo estos datos en la ecuación 1 Se tiene que Δt1= 62ºC Así, la temperatura de ebullición será T= t+Δt= 20 +62= 82 ºC como primera aproximación. Ahora, la gráfica muestra que para un compuesto que hierve a 82 ºC el valor de φ es 4,72, en lugar de 4,60, valor que fue utilizado inicialmente. Como φ se encuentra en el denominador, este aumento en φ disminuirá el nuevo valor de Δt en la ecuación 1. En una segunda aproximación el nuevo Δt2 queda determinado por Δt 2 = Δt1*φ 1 φ2 Ecuación 2 y Δt2 = 60.4 ºC De esta manera el punto de ebullición corregido vendrá dado por T = (20 + 60.4) ºC= 80.4 ºC a 1 atmósfera Los posibles solventes utilizados son n-hexano grupo 2 cloroformo grupo 2 acetona grupo3 tetracloruro de carbono