42,5 kB - Webnode
Anuncio

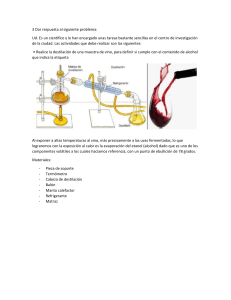
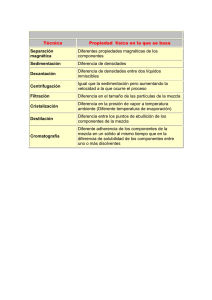
INSTITUCION EDUCATIVA DEPARTAMENTAL “JOSEMARIA ESCRIBA DE BALAGUER” CHIA GUIA DE LABORATORIO DE QUIMICA GRADOS DECIMOS 2010 Practica No. Nombre de la práctica: _______________________________________________ 1. Objetivos:_______________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 2. Fundamentación teórica: Existe gran cantidad de sustancias que para identificarlas, se separan en sistemas homogéneos sencillos. Para conocer su composición, utilizan procesos que reciben el nombre de análisis químico. Hay varios métodos para separar los componentes de una mezcla. En el laboratorio son usuales: la decantación, la filtración, la destilación. La cristalización, el magnetismo, la cromatografía, etc. Decantación: Se usa para separar mezclas formadas por sólidos o por dos o más líquidos no miscibles. Consiste en dejar reposar el líquido que contiene partículas sólidas en suspensión. En el fondo del recipiente se va depositando el sedimento o precipitado más denso y queda sobrenadando el líquido. Luego se trasvasa con cuidado el líquido. Esta técnica se utiliza también con líquidos no miscibles, como el agua y el aceite. Para ello se utiliza el embudo de decantación o de Gibson. Filtración: Se utiliza para separar sólidos no solubles en líquidos La separación se hace por medios porosos que retienen las partículas sólidas y dejan pasar el líquido Destilación: Las soluciones o mezclas de líquidos miscibles pueden separarse por cambios de estado: congelación, evaporación, condensación. Para separar los componentes de una solución se emplea con frecuencia la destilación; también se emplea para purificar sustancias líquidas. El agua se destila con el fín de eliminar sales contenidas en ésta. La destilación se basa en la diferencia en los puntos de ebullición de sus componentes. Se calienta la solución y se concentran los vapores. La sustancia que tiene menor punto de ebullición se convierte en vapor antes que la otra. Esta primera sustancia se hace pasar por el condensador para llevarla a estado líquido. Cristalización: En este proceso se utilizan los puntos de solidificación. La solución se enfría hasta que uno de sus componentes alcance el punto de solidificación y cristalice. Se emplea además para purificar sólidos, disolviendo un sólido impuro en el disolvente adecuado en caliente. Al bajar la temperatura, el primer sólido se cristaliza, con lo cual quedará libre de impurezas. Magnetismo: Se vale de las propiedades magnéticas. Se emplea para separar mezclas en donde uno de sus componentes es magnético o un metal. Por ejemplo para separa hierro del mineral magnetita. Cromatografía: Se basa en la diferente absorción y adsorción de algunos materiales que ejercen sobre los componentes de la solución. Hay varios tipos de cromatografías: de columna, de capa fina, de papel, etc. 3. Materiales y reactivos: Oxido de calcio agua, embudo de vidrio, papel de filtro, mechero, agitador, vaso de precipitado de 100 ml, embudo de decantación, pipeta, sulfato de bario. Sulfato de calcio, sulfato de cobre (II), aceite de ricino. 4. Procedimiento. 1. Preparar una mezcla de óxido de calcio y agua y dejarla en reposo. Pasar la mezcla a través de un papel de filtro, colocado en un embudo de vidrio. Registrar las observaciones. ¿qué nombres reciben la parte sólida y líquida? 2. En un volúmen de 25 ml de agua, mezcle dos gramos de sulfato de bario o de calcio con dos gramos de sulfato de cobre (II); agitar fuertemente y calentar durante 3 minutos. Retirar el vaso del mechero. Dejar en reposo hasta que se precipite el sólido; esperar a que decante la solución; separar el sólido del líquido por decantación; si quedan partículas en suspensión, filtrar a través de un papel de filtro. Registrar las observaciones. INSTITUCION EDUCATIVA DEPARTAMENTAL “JOSEMARIA ESCRIBA DE BALAGUER” CHIA GUIA DE LABORATORIO DE QUIMICA GRADOS DECIMOS 2010 3. En un embudo de decantación, mezclar 10 ml de agua y 10 ml de aceite de ricino; agitar y dejar en reposo. Una vez formadas las dos fases, separarlas. Cuando termine de salir la primera fase, manejar con cuidado la llave, dándole vuelta en forma rápida para evitar que se pase parte de la fase superior. Observe y registrar. 5. CONTESTE LAS SIGUIENTES PREGUNTAS: a. ¿En cuál(es) de la(s) actividad(es) realizada(s) se formó una mezcla homogénea? b. ¿En cuál(es) de la(s) actividad(es) realizada(s) se formó una mezcla heterogénea? c. ¿Qué otros métodos podrían utilizarse para separar estas mezclas? d. Al disolver los sulfatos en agua ¿Qué clases de sustancias se forma? Hacer un cuadro comparativo. 6. Investigue: En un mapa conceptual escriba las clases de cromatografía En una prueba de cromatografía cuáles son las fases? Explíquelas. Explique cada una de ellas: De columna, de capa fina, de papel. Proponga un experimento donde utilice separación de mezclas por cromatografía 7. CONCLUSIONES: Cuál de los procesos utilizados para separar mezclas son los más utilizados?. Por qué? Qué diferencias existen entre procesos físicos, químicos y nucleares? Escriba el resultado de la experiencia, sus aportes y que le pareció más interesante? ¡ RECUERDE! En el laboratorio de química NO SIEMPRE SE PUEDEN UTILIZAR TODOS LOS SENTIDOS. Dejar el sitio de trabajo completamente ordenado y limpio. Tener en cuenta los primeros auxilios en caso de accidente. Lea los avisos de precaución. Tenga en cuenta los símbolos de peligrosidad en los reactivos químicos. Sistema de rotulación de las Naciones Unidas. Entregue el informe del laboratorio al finalizar la práctica. NOMBRES DE LOS INTEGRANTES DEL GRUPO Y CURSO ( en orden alfabético)