23 TEMA Nº 2.- GLÚCIDOS INTRODUCCIÓN Son un tipo de
Anuncio

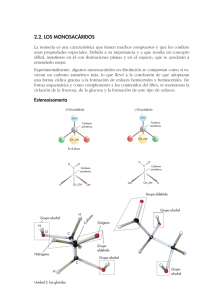
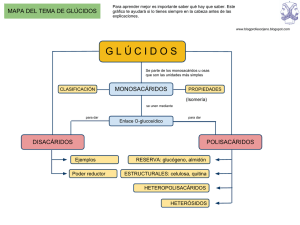
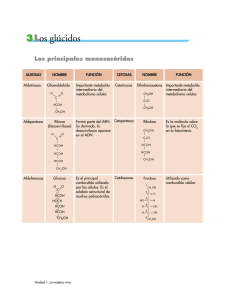
Glúcidos 23 TEMA Nº 2.- GLÚCIDOS INTRODUCCIÓN Son un tipo de Principios Inmediatos Orgánicos en cuya composición intervienen carbono, oxígeno e hidrógeno. También se les conoce como hidratos de carbono, o como azúcares. El nombre de glúcidos tiene su origen en el griego (glykys=dulce). Se les denomina hidratos de carbono porque en ellos el carbono, el hidrógeno y el oxígeno (C:H:O) están en proporción de 1:2:1, por lo que responderían a una fórmula general (CH2O)n. Esta proporción parecía indicar que eran combinaciones del carbono con el agua. Esta forma de nombrarlos no es la más correcta ya que existen muchos glúcidos, como es el caso de la desoxirribosa (C5H10O4) o la glucosamina (C6H13O5N), que no se ajustan a la fórmula general, mientras que compuestos no glucídicos como el ácido láctico (C3H6O3) responden a ella. Por último, se les denomina azúcares por su sabor dulce, lo que tampoco es del todo correcto ya que existen muchos glúcidos que no lo son. Para su estudio se clasifican en dos grupos que son: 1.- OSAS. También llamados monosacáridos. Se incluyen en este grupo todos aquellos glúcidos, no hidrolizables, cuyas moléculas tienen entre 3 y 8 átomos de carbono. También se incluyen sus derivados. 2.- ÓSIDOS. Formados por la unión de varios monosacáridos, pudiendo existir además otros compuestos en su molécula. Se subdividen en: 2.1.- Holósidos. Formados exclusivamente por monosacáridos. A su vez son: 2.1.1.- Oligosacáridos. Formados por la unión de 2 a 10 moléculas de monosacáridos. 2.1.2.- Polisacáridos. Formados por unión de más de 10 moléculas de monosacáridos. Se subdividen en: 2.1.2.1.- Homopolisacáridos. Formados por un único tipo de monosacárido. 2.1.2.2.- Heteropolisacáridos. Formados por dos o más tipos de monosacáridos. 2.2.- Heterósidos. Son ósidos formados por unión de monosacáridos con otras sustancias no glucídicas. 1.- OSAS O MONOSACÁRIDOS Se definen como polihidroxialdehidos o polihidroxicetonas, es decir en su estructura presentan varios grupos funcionales hidroxi (-OH) y un grupo aldehído (-CHO) o un grupo cetona (-CO-), nunca ambos a la vez. Se caracterizan porque responden, con algunas excepciones, a una fórmula general (figura 2.1). Cn H2n On ; (n≥3) Figura 2.1.- Fórmula general de los monosacáridos. Glúcidos 24 1.1.- Clasificación y nomenclatura Los monosacáridos presentan, entre sí, dos tipos de diferencias características, una está en relación con el número de átomos de carbono, la otra lo está con el grupo funcional específico que lleven en su molécula. Estas dos características se utilizan con carácter sistemático y, según el criterio que utilicemos los monosacáridos se clasifican de una u otra manera. A) Según el número de átomos de carbono que presentan se nombran utilizando los prefijos griegos tri, tetra, penta, hexa, hepta, etc. De esta forma, si tienen 3 átomos de carbono son Tri-osas; si tienen 4 átomos de carbono son Tetr-osas; si tienen 5 átomos de carbono son Pent-osas; si tienen 6 átomos de carbono son Hex-osas; etc. B) Según el grupo funcional específico que presenten se nombran utilizando los prefijos Aldo o Ceto, según que dicho grupo funcional sea aldehído o cetona respectivamente. Si presentan el grupo funcional aldehído son Ald-osas. Si presentan el grupo funcional cetona son Cet-osas. En la actualidad se sigue una nomenclatura que no es mas que el resultado de fundir las dos anteriores, por ejemplo, si se trata de una osa que presenta grupo funcional aldehído y cuatro átomos de carbono se la nombra como una Aldo-tetr-osa. Si se tratara de una osa que presentara grupo funcional cetona y cinco átomos de carbono se la nombraría como Cetopent-osa etc. Todos los monosacáridos derivan, por deshidrogenación, de un trialcohol, la glicerina, la cual, por pérdida de dos átomos de hidrógeno de uno de sus átomos de carbono terminales, origina una aldosa, el gliceraldehido; si la pérdida de esos dos átomos de hidrógeno se produce en el átomo de carbono central se origina una cetosa, la dihidroxiacetona (figura 2.2). H2 + ► CHO I HCOH I CH2OH ← Gliceraldehído CH2OH I HCOH I CH2OH Glicerina → CH2OH I ► C=O + I CH2OH H2 Dihidroxiacetona Figura 2.2.- Formación de osas elementales por deshidrogenación a partir de glicerina. Las flechas (►) marcan los grupos específicos aldehído o cetona. 1.2.- Propiedades de los monosacáridos 1.2.1.- Propiedades físicas Son sólidos cristalinos, blancos, hidrosolubles y, muchos, de sabor dulce. Su marcada solubilidad es debida a la presencia de radicales hidroxilo (-OH) y de radicales hidrógeno (-H), ya que estos presentan una marcada polaridad eléctrica, lo que permite la formación de enlaces de atracción electrostática (enlaces de hidrógeno) con las moléculas de agua, que también son polares. Recuérdese que al estudiar el agua ya se vio que era un buen disolvente de compuestos covalentes como los glúcidos. 1.2.2.- Propiedades químicas Cuando se encuentran en presencia de sustancias menos oxidantes que ellos, los glúcidos se oxidan. Este proceso de oxidación suele manifestarse en la pérdida de electrones que se produce en la transformación de un grupo alcohol (-OH), o de un grupo aldehído (-CHO) a grupo ácido (-COOH). A la vez que ellos se oxidan la otra sustancia se reduce. En esta propiedad se basa una técnica de reconocimiento de monosacáridos, la denominada reacción 2+ de Fehling, en la que una sal cúprica (Cu ) en medio alcalino es reducida por el grupo Glúcidos 25 carbonilo con producción de óxido de cobre (I), de color rojo ladrillo. Esta capacidad de reducir el licor de Fehling, se utiliza en los análisis cuantitativos de estos compuestos. También es característica su capacidad para asociarse con grupos aminos, formándose compuestos denominados aminoglúcidos. Entre los más característicos, un derivado de la glucosa denominado glucosamina, que interviene en el formación de la quitina (polisacárido del esqueleto de los Artrópodos) o del peptidoglucano (polisacárido de las paredes bacterianas) como veremos más adelante. Existen dos propiedades características de los glúcidos que por su importancia se van a tratar en apartados específicos, son la Isomería óptica o estereoisomería y la Actividad óptica. 1.2.3.- Isomería óptica Todos los monosacáridos, a excepción de la dihidroxiacetona, poseen uno o más átomos de carbono asimétricos y son por tanto moléculas quirales. Un átomo de carbono asimétrico se define como aquel que presenta todas sus valencias ocupadas por grupos funcionales distintos (figura 2.3). 1 2 3 CHO I H - *C - OH I CH2OH D-gliceraldehído Figura 2.3.- Marcado en rojo, el átomo de carbono asimétrico. Como puede observarse en la figura anterior, el átomo de carbono del gliceraldehido marcado con un asterisco presenta sus cuatro valencias ocupadas por grupos funcionales distintos, por tanto es asimétrico. Si colocamos dicha molécula frente a un espejo, podremos observar que la figura que aparece en dicho espejo presenta los mismos átomos pero distinta disposición espacial. Ambas moléculas reciben el nombre de isómeros ópticos o estereoisómeros y se caracterizan por ser una la imagen especular de la otra, sólo en este caso reciben el nombre de estereoisómeros o enantiómeros (figura 2.4). 1 2 3 CHO I H - *C - OH I CH2OH D-gliceraldehido 1 2 3 CHO I HO - *C - H I CH2OH L-gliceraldehido Figura 2.4.- Isómeros ópticos (ENANTIÓMEROS) del gliceraldehído. Los estereoisómeros se caracterizan por ser moléculas químicamente iguales, diferenciándose solamente en la disposición espacial de sus grupos funcionales. Convencionalmente se adopta que cuando el grupo hidroxilo (-OH), del átomo de carbono asimétrico, se dispone hacia la derecha, el estereoisómero recibe el nombre de forma D. Si se dispone hacia la izquierda recibe el nombre de forma L. Las fórmulas lineales de los principales monosacáridos se muestran en las figuras 2.5 y 2.6 respectivamente. Glúcidos 26 1 1 2 3 4 5 1 CHO I HCOH I HCOH I CH2OH 2 3 4 D-Eritrosa 4 5 6 1 1 2 5 3 3 2 3 4 5 6 D-Alosa 4 2 2 1 CHO I HOCH I HCOH I HCOH I HCOH I CH2OH D-Ribosa 3 1 CHO I HCOH I HCOH I HCOH I CH2OH CHO I HCOH I HCOH I HCOH I HCOH I CH2OH CHO I HCOH I CH2OH CHO I HOCH I HCOH I HCOH I CH2OH 2 3 4 5 6 CHO I HCOH I HOCH I HCOH I HCOH I CH2OH D-Altrosa 1 2 3 4 5 6 CHO I HOCH I HOCH I HCOH I HCOH I CH2OH D-Arabinosa D-Glucosa 1 1 D-Gliceraldehído 2 3 4 5 1 2 3 4 CHO I HOCH I HCOH I CH2OH D-Treosa CHO I HCOH I HOCH I HCOH I CH2OH 2 3 4 5 6 CHO I HCOH I HCOH I HOCH I HCOH I CH2OH D-Manosa 1 2 3 4 5 6 CHO I HOCH I HCOH I HOCH I HCOH I CH2OH D-Xilosa D-Gulosa 1 1 2 3 4 5 CHO I HOCH I HOCH I HCOH I CH2OH 2 3 4 5 6 CHO I HCOH I HOCH I HOCH I HCOH I CH2OH D-Idosa 1 2 3 4 5 6 CHO I HOCH I HOCH I HOCH I HCOH I CH2OH D-Lixosa D-Galactosa D-Talosa Figura 2.5.- Familia de las D-Aldosas con tres a seis átomos de carbono, vistas con sus fórmulas estructurales de cadena abierta. No se han representado los enlaces horizontales con objeto de ahorrar espacio. Estas fórmulas también se conocen como fórmulas de proyección de Fischer. Los compuestos cuyas fórmulas están representadas presentan el radical –OH del último átomo de carbono asimétrico dirigido hacia la derecha, son formas D. Glúcidos 1 1 2 3 4 CH2OH I C=O I HCOH I HCOH I CH2OH 2 3 4 5 6 27 CH2OH I C=O I HCOH I HCOH I HCOH I CH2OH 1 2 3 4 5 6 CH2OH I C=O I HOCH I HCOH I HCOH I CH2OH D-Ribulosa D-Psicosa 1 1 2 3 CH2OH I C=O I CH2OH 2 3 4 D-Fructosa CH2OH I C=O I HCOH I CH2OH Dihidroxiacetona D-Eritrulosa 1 1 2 3 4 5 CH2OH I C=O I HOCH I HCOH I CH2OH 2 3 4 5 6 CH2OH I C=O I HCOH I HOCH I HCOH I CH2OH 1 2 3 4 5 6 CH2OH I C=O I HOCH I HOCH I HCOH I CH2OH D-Xilulosa D-Sorbosa D-Tagatosa Figura 2.6.- Familia de las D-Cetosas con tres a seis átomos de carbono, vistas con sus fórmulas estructurales de cadena abierta, también conocidas como fórmulas de proyección de Fischer. Igual que en la figura anterior las fórmulas de los compuestos representados en la figura presentan el radical –OH del último átomo de carbono asimétrico dirigido hacia la derecha, son también formas D. En dichas figuras sólo se representan los monosacáridos en sus formas D. Las formas L correspondientes se obtienen con facilidad observando las imágenes especulares de estos. Téngase en cuenta que a partir del D-gliceraldehido se van a formar monosacáridos de forma D, mientras que a partir de la dihidroxiacetona se va a formar un monosacárido, la eritrulosa, que puede ser D o L, ya que esta cetosa si que presenta un átomo de carbono asimétrico. De la D-eritrulosa derivarán todas las cetosas de forma D. Para que dos moléculas sean estereoisómeros o enantiómeros deben diferenciarse en la disposición espacial de los sustituyentes de todos sus átomos de carbono asimétricos. Ejemplo D-glucosa y L-glucosa. Cuando dos monosacáridos difieren únicamente en la configuración espacial de uno sólo de sus átomos de carbono asimétricos, reciben el nombre de epímeros. Ejemplo la Dglucosa y la D-manosa son epímeros respecto al átomo de carbono nº 2, mientras que la Dglucosa y la D-galactosa lo son respecto al átomo de carbono nº 4 (figura 2.5). Glúcidos 28 1.2.4.- Actividad óptica Los monosacáridos que presentan átomos de carbono asimétricos, presentan también la capacidad de desviar el plano de la luz polarizada. Por esta razón se dice que presentan actividad óptica. La luz se presenta en dos posibles formas: luz no polarizada, cuando no tiene restricciones en cuanto a las posibilidades de vibración de la onda luminosa; y luz polarizada, aquella que sólo puede oscilar de un determinado modo, es decir mientras que la luz no polarizada está constituida por diversas radiaciones que vibran en distintos planos, la luz polarizada esta constituida por una sola de esas radiaciones que vibra en un solo plano. Polarizar la luz no es mas que filtrarla, eliminando todas las radiaciones que la componen menos una, a la que se llama luz polarizada. Cuando una disolución de monosacáridos es atravesada por un rayo de luz polarizada, el plano de vibración de esa radiación gira un cierto ángulo. Si ese giro se produce hacia la derecha se dice que la molécula de monosacárido es dextrógira (+), si el giro se produce hacia la izquierda se dice que la molécula es levógira (-). No existe ninguna relación entre la estructura D o L que presente una molécula y el hecho de que esta sea dextrógira o levógira. Por ejemplo, la D-fructosa es levógira. Los estereoisómeros se caracterizan porque uno de ellos hará rotar el plano de la luz polarizada hacia la derecha (en sentido de las agujas del reloj) y se llamará dextrógiro, y el otro hará que dicho rayo rote hacia la izquierda (en sentido contrario a las agujas del reloj) y se llamará levógiro. La actividad óptica de un estereoisómero se expresa cuantitativamente por su 25° rotación específica [α]D , determinada a partir de las medidas de la rotación óptica de una concentración determinada, en un tubo de una longitud dada, mediante un polarímetro. [α]D 25° Rotación óptica observada (grados) = ——————————————————————— Longitud del tubo (dm) x concentración (g/ml) Deben especificarse la temperatura y la longitud de onda de la luz empleada. En la figura 2.7, se muestra un esquema en el que se explica el desvio de la luz polarizada. Figura 2.7.- Desvio del plano de la luz polarizada al atravesar una disolución de un monosacárido. Glúcidos 29 1.3.- Formas anoméricas o hemiacetálicas Hasta ahora hemos escrito las estructuras de las aldosas y cetosas en forma de cadena abierta (fórmulas de proyección de Fischer de las figuras 2.5 y 2.6). Tales estructuras son correctas para las triosas y las tetrosas. Sin embargo, la mayor parte de los monosacáridos que poseen cinco o más átomos de carbono en su esqueleto carbonado, aparecen, en general, en forma de compuestos cíclicos, en los que los grupos carbonilo se hallan «enmascarados», y no exhiben sus características químicas habituales. Por ejemplo, hemos visto que la glucosa posee un grupo aldehído, pero se ha encontrado que es relativamente estable frente a los reactivos que, normalmente, reaccionan con facilidad con los grupos aldehído. Así, por ejemplo, la glucosa es totalmente inerte por exposición al aire como por exposición al oxígeno, mientras que la mayor parte de los aldehídos presentan una tendencia a oxidarse en análogas condiciones. Una segunda propiedad de la D-glucosa, que sugiere que pueda poseer una estructura cíclica, es el hecho de que posee dos formas cristalinas. Si se cristaliza en agua, se obtiene 20° una forma llamada α-D-glucosa, cuya rotación específica es [α]D = +112,2°. Cuando se cristaliza de su disolución en piridina, se obtiene la β-D-glucosa, y su rotación específica es 20° [α]D = +18,7°. Ambas formas no difieren sin embargo en su composición química. Cuando se disuelve en agua la α-D-glucosa, su rotación específica cambia gradualmente, con el tiempo, y alcanza un valor estable de +52,7°; la β-D-glucosa tratada de modo análogo, alcanza el mismo valor. A este cambio se le denomina mutarrotación, y se debe a la existencia de una mezcla en equilibrio constituida por un tercio de α-D-glucosa y dos tercios de β-D-glucosa, a 25°C. Partiendo de diversas consideraciones de tipo químico, se ha deducido que los isómeros α y β de la D-glucosa no poseen estructuras de cadena abierta, sino estructuras anulares que se forman al reaccionar el grupo hidroxilo (-OH) del átomo de carbono nº 5 y el grupo aldehído (-CHO). La aparición de estas formas cíclicas no es mas que un caso particular de una reacción química más genérica, la reacción de formación de hemiacetales. Esta reacción ocurre cuando un aldehído o una cetona reaccionan con un alcohol (figura 2.8) OH I R - CO - R' + HO - R" → R - C - OR" I R' Cetona Alcohol R - CHO + HO - R' Aldehído Alcohol Hemiacetal OH I → R - C - OR' I H Hemiacetal Figura 2.8.- Reacciones de formación de hemiacetales. En el caso de los monosacáridos la reacción de formación de hemiacetales se establece entre grupos funcionales de una misma molécula, por lo tanto el compuesto resultante puede ser considerado como un hemiacetal intramolecular. Estos hemiacetales adquieren una estructura espacial de tipo cíclico (anular) apareciendo dos tipos de anillos, unos hexagonales, similares en estructura a un compuesto denominado pirano, y otros pentagonales, similares en estructura a otro denominado furano, por lo que estos compuestos son denominados formas piranosas y formas furanosas respectivamente (figura 2.9). 30 Glúcidos Figura 2.9.- Estructuras del furano y del pirano. La formación de dichos compuestos se efectúa de la siguiente forma: Los monosacáridos que presentan más de cinco átomos de carbono, al disolverse en agua se hidratan, ya que su grupo carbonilo (aldehído o cetona) capta una molécula de agua. El compuesto hidratado, resultante de esta unión, es inestable. Como la estructura abierta de los monosacáridos no es lineal, sino quebrada, debido a los ángulos que existen entre los enlaces de los átomos de carbono, el grupo carbonilo queda enfrentado al penúltimo átomo de carbono de la molécula y, entre ellos se produce una reacción de sus radicales, liberándose una molécula de agua y quedando unidos por un átomo de oxígeno. Las moléculas adquieren así la forma espacial de anillos hexagonales o pentagonales según que se trate de formas piranosas o furanosas respectivamente. Al producirse la ciclación, el átomo de carbono carbonilo, que no era asimétrico en la fórmula lineal, se vuelve asimétrico, pasando a denominarse átomo de carbono anomérico. El átomo de carbono anomérico presenta ahora un grupo hidroxilo (-OH) que recibe el nombre de grupo hidroxilo hemiacetálico el cual, según la disposición que adopte en el espacio (a un lado u otro del plano de la molécula cíclica), va a determinar que la misma molécula pueda aparecer de dos formas distintas que reciben el nombre de anómeros, y que se nombran como forma α y forma β respectivamente. El estudio del proceso de ciclación se realizó bajo la dirección de W. N. Haworth, y en el caso de la D-glucosa se muestra en la figura 2.10. Figura 2.10.- Ciclación de la glucosa mediante la formación de un hemiacetal. A. Todos los carbonos se sitúan en un mismo plano horizontal. B. La estructura abierta se repliega sobre si misma enfrentándose los átomos de carbono nº 1 y nº 5. C. El carbono nº 1 se hidrata. D. A continuación reaccionan los grupos hidroxilos de los carbonos nº 1 y nº 5, se desprende una molécula de agua y se forma un puente de oxígeno. E. El compuesto final resultante. (De izda. a dcha.). Glúcidos 31 Las formas resultantes del proceso anterior son conocidas como proyecciones de Haworth. Todas las aldohexosas se ciclan igual que la D-glucosa (téngase siempre en cuenta la disposición de los radicales de los distintos átomos de carbono). Todos aquellos sustituyentes que en la fórmula lineal se encuentran dispuestos hacia la derecha aparecerán hacia abajo en la fórmula cíclica y viceversa, los que están dispuestos hacia la izquierda en la fórmula lineal aparecerán hacia arriba en la fórmula cíclica Cuando las moléculas de monosacáridos se encuentran cicladas, la nomenclatura cambia, nombrándose de la siguiente manera: En primer lugar se indica si es forma α o β, después si es forma D o L, después se añade el nombre del monosacárido correspondiente, al que se le quita la terminación "sa" y se sustituye por "piranosa" o "furanosa", según el tipo de anillo que forme al ciclarse. Por ejemplo, la D-glucosa, se nombraría como α-D-glucopiranosa o como β- glucopiranosa. El proceso de ciclación puede adoptar también la estructura pentagonal del furano, cosa que ocurre en el caso de las aldopentosas, donde el puente de oxígeno se establece entre los átomos de carbono nº 1 y nº 4. En la figura 2.11, se ha dejado hueco para que se formule la β-D-ribofuranosa. CHO I H - C - OH I H - C - OH I H - C - OH I CH2OH D-Ribosa β-D-Ribofuranosa Figura 2.11.- Ciclación de la D-ribosa. En el caso de las cetohexosas, también se adopta la estructura pentagonal del furano, pero con la salvedad de que el enlace por puente de oxígeno, que se forma al reaccionar el grupo carbonilo con el grupo hidroxilo del penúltimo átomo de carbono, aparece ahora entre los átomos de carbono nº2 y nº 5, ya que es el átomo nº 2 el que lleva el grupo carbonilo específico de estos compuestos que es el grupo cetona. En la figura 2.12, se ha dejado hueco para que se formule la α--D-psicofuranosa. CH2OH I C=O I H - C - OH I H - C - OH I H - C - OH I CH2OH D-Psicosa . Figura 2.12.- Ciclación de la D-psicosa α-D-Psicofuranosa Glúcidos 32 2.- ÓSIDOS Son compuestos formados por la unión de varios monosacáridos, pudiendo existir además otros compuestos en su molécula. Se subdividen en: 2.1.- Holósidos Son ósidos formados exclusivamente por monosacáridos. Dependiendo del nº de monosacáridos que los formen se subdividen en: 2.1.1.- Oligosacáridos Constituyen un grupo de glúcidos que se caracterizan por estar formados por unión de monosacáridos, oscilando el número de estos entre 2 y 10. Son dulces, solubles, cristalizables e hidrolizables en monosacáridos. El enlace que se establece entre los monosacáridos para formar los oligosacáridos (también se forman mediante este enlace los polisacáridos) es denominado enlace Oglucosídico. La aparición de este enlace consiste en la formación de un compuesto denominado acetal (figura 2.13), que se origina al reaccionar el hidroxilo hemiacetálico del átomo de carbono anomérico de un monosacárido con el grupo hidroxilo de cualquier átomo de carbono del otro monosacárido. Al reaccionar ambos grupos hidroxilo, se desprende una molécula de agua y los dos monosacáridos quedan unidos por un puente de oxígeno (figura 2.14). R I H - C - OH + I R' Hemiacetal HO - R" → Alcohol R I H - C - O - R" + H2O I R' Acetal Agua Figura 2.13.- Reacción de formación de acetales. α-D-glucopiranosa + β-D-glucopiranosa Enlace glucosídíco 1→4 Figura 2.14.- Enlace glucosídico. Existen varios tipos de enlaces O-glucosídicos: a) Monocarbonílico, cuando se realiza entre un carbono anomérico de un monosacárido y un carbono no anomérico del otro; a su vez puede ser monocarbonílico α o monocarbonílico β (figura 2.15a y 2.15b). b) Dicarbonílico, cuando el enlace se establece entre los átomos de carbono anoméricos de los dos monosacáridos (figura 2.15c). Todos los azúcares que presentan enlaces dicarbonílicos han perdido su carácter reductor, ya que este reside en el átomo de carbono anomérico que es susceptible de oxidarse a ácido, por lo que no darán la reacción de Fehling. Glúcidos 33 a Enlace monocarbonílico-α b Enlace monocarbonílico-β c Enlace dicarbonílico Figura 2.15.- Tipos de enlaces O-glucosídicos. Dependiendo del número de monosacáridos que se unan mediante enlace Oglucosídico se formarán los siguientes tipos de compuestos: Di-sacáridos, cuando se unen dos monosacáridos; Tri-sacáridos, cuando son tres; Tetra-sacáridos, cuando son cuatro; Penta-sacáridos, cuando son cinco, etc. Los más importantes, por su valor económico e industrial, son los disacáridos y los trisacáridos. Para nombrar un oligosacárido utilizamos la siguiente nomenclatura: El nombre del primer monosacárido se conserva tal cual sustituyendo la terminación osa por osil. Entre paréntesis se escriben los átomos de carbono que participan en el enlace glucosídico. Por último, se escribe el nombre del segundo monosacárido sin modificar, salvo que este segundo monosacárido intervenga en el enlace con su átomo de carbono anomérico, en cuyo caso se sustituye la terminación osa por ósido. Cuando esto ocurre no es necesario indicar los átomos de carbono que participan en el enlace. Por ejemplo el disacárido de la figura 2.14, se nombraría así: α-D-glucopiranosil (1→4) β-D-glucopiranosa. A) Disacáridos. Los más importantes son: Sacarosa, Trehalosa, Celobiosa, Maltosa, Isomaltosa, Gentiobiosa y Lactosa, cuyos nombres bioquímicos se indican a continuación. a) Sacarosa: α-D-glucopiranosil β-D-fructofuranósido. Es el azúcar de uso doméstico que se obtiene de la caña de azúcar y de la remolacha. Glúcidos 34 b) Trehalosa: α-D-glucopiranosil α-D-glucopiranósido. Presente en los hongos y levaduras siendo el principal azúcar de la hemolinfa de los insectos. c) Celobiosa: β-D-glucopiranosil (1→4) β-D-glucopiranosa. Se obtiene por hidrólisis de un polisacárido denominado celulosa, no encontrándose libre en la naturaleza. d) Maltosa: α-D-glucopiranosil (1→4) α o β-D-glucopiranosa. Se encuentra libre en la naturaleza en el grano germinado de la cebada. La cebada germinada artificialmente (malta) se utiliza para la fabricación de cerveza, y tostada se emplea como sustitutivo del café. En la industria se obtiene a partir de la hidrólisis del almidón y del glucógeno. Existe α-maltosa y βmaltosa. e) Isomaltosa: α-D-glucopiranosil (1→6) α-D-glucopiranosa. No se encuentra libre en la naturaleza y se obtiene por hidrólisis de la amilopectina (componente del almidón) y del glucógeno. f) Lactosa: β-D-galactopiranosil (1→4) α-D-glucopiranosa. Se encuentra libre en la leche de los mamíferos. B) Trisacáridos. Formados por unión de tres monosacáridos. El más importante es la Rafinosa, cuyo nombre bioquímico es α-D-galactopiranosil (1→6) α-D-glucopiranosil β-Dfructofuranósido. Se encuentra en la semilla del algodón y en la remolacha. Las fórmulas de todos estos compuestos se realizarán como ejercicios de clase. 2.1.2.- Polisacáridos Son aquellos ósidos que se forman por unión de más de diez moléculas de monosacáridos, o derivados sencillos de estos, mediante enlace O-glucosídico. Presentan elevado peso molecular, no son dulces, pueden ser insolubles en agua (celulosa) o bien formar dispersiones coloidales (almidón), no poseen carácter reductor y desempeñan funciones estructurales y energéticas según que estén constituidos por monosacáridos en forma β o en forma α respectivamente. La D-glucosa es la unidad monosacarídica predominante en los polisacáridos, pero son también corrientes polisacáridos constituidos por la D-manosa, D-fructosa, D y Lgalactosa, D-xilosa y D-arabinosa. También se encuentran, generalmente, derivados de los monosacáridos como la D-glucosamina, el ácido D-glucurónico, y el ácido Nacetilmurámico. Se dividen en Homopolisacáridos, constituidos por un sólo tipo de unidad monomérica, y Heteropolisacáridos, con dos o más unidades monoméricas diferentes. 2.1.2.1.- Homopolisacáridos Los Homopolisacáridos más importantes se describen mejor en relación con sus funciones biológicas. 2.1.2.1.1.- Homopolisacáridos de reserva Estos polisacáridos, entre los cuales el almidón es el que más abunda en las plantas y el glucógeno en los animales, se depositan, habitualmente, en forma de grandes gránulos en el citoplasma celular. Los gránulos de almidón o de glucógeno, pueden aislarse de los extractos celulares por centrifugación diferencial. A) Almidón Se encuentra en dos formas distintas, la α-amilosa y la amilopectina. La α-amilosa está constituida por cadenas largas no ramificadas, en las que todas las unidades de Dglucosa se encuentran unidas mediante enlaces α (1→4). Su peso molecular es variable entre Glúcidos 35 unos millares hasta 500000. La α-amilosa no es verdaderamente soluble en agua sino que forma dispersiones coloidales, y con el iodo se tiñe de color azul característico. La cadena polisacarídica que constituye la α-amilosa constituye un enrollamiento helicoidal (figura 2.16). Figura 2.16.- Enrollamiento helicoidal de la α-amilosa. La amilopectina es muy ramificada, siendo la longitud media de las ramificaciones de 24 a 30 restos de glucosa. En ella se presentan dos tipos de enlaces, los enlaces del esqueleto que son enlaces α (1→4), y los existentes en los puntos de ramificación α (1→6) (figura 2.17). Figura 2.17.- Amilopectina con ramificación en α (1→6). Su peso molecular es variable, pudiendo llegar hasta los 100 millones, es menos soluble que la α-amilosa y con el iodo adquiere una coloración rojo violácea. Los componentes del almidón pueden ser hidrolizados enzimáticamente, de manera que existen enzimas α y β amilasas que al actuar sobre la α-amilosa la rompen liberando moléculas de maltosa y de glucosa libres, pues la hidrólisis se efectúa al azar sobre los enlaces α (1→4). Glúcidos 36 La amilopectina también es atacada por ambas enzimas, pero estas no tienen capacidad de romper los enlaces α (1→6) de los puntos de ramificación, por tanto el producto final es, junto con moléculas de maltosa, un núcleo grande y muy ramificado llamado dextrina límite, cuya designación indica que representa el límite del ataque de las amilasas (figura 2.18). Una enzima desramificadora ataca a los enlaces α (1→6), por tanto la acción combinada de las amilasas y de la enzima desramificadora puede degradar completamente la amilopectina a maltosa y a glucosa. Figura 2.18.- Acción de las amilasas sobre la amilopectina. El núcleo central representa la dextrina límite. B) Glucógeno Es el principal polisacárido de reserva de las células animales constituyendo el equivalente al almidón de las células vegetales. Abunda especialmente en el hígado (10% de su peso húmedo), y en el músculo esquelético (1 al 2% de su peso húmedo). En las células hepáticas el glucógeno aparece en forma de grandes gránulos, constituidos por agrupaciones de simples moléculas, muy ramificadas, cuyo peso molecular es de varios millones. A semejanza de la amilopectina el glucógeno es un polisacárido de la D-glucosa con enlaces α (1→4) y con ramificaciones en α (1→6). Sin embargo está más ramificado y su molécula es más compacta que la de la amilopectina, apareciendo las ramificaciones cada 8 a 12 restos de glucosa. Con el Iodo adquiere una coloración rojo-violácea. Se hidroliza, con igual facilidad que el almidón, al actuar sobre él las enzimas amilasas, que atacan a los enlaces α (1→4), y la enzima desramificadora que ataca a los enlaces α (1→6). C) Otros homopolisacáridos de reserva Los dextranos son también homopolisacáridos ramificados de la D-glucosa, pero difieren del glucógeno y del almidón en que sus enlaces, en el esqueleto, son α (1→6) y presentan ramificaciones en α (1→2), α (1→3) y α (1→4). Se encuentran como polisacáridos de reserva en las bacterias y en las levaduras. Tienen interés farmacéutico y su peso molecular oscila entre 50000 y 100000. Glúcidos 37 Los fructanos (también llamados levanos) son homopolisacáridos constituidos por unidades de D-fructosa presentes en muchas plantas. La inulina, presente en la alcachofa, está constituida por restos de D-fructosa unidos por enlace β (2→1). Los mananos son homopolisacáridos de manosa, hallados en bacterias, levaduras y plantas superiores. De modo parecido, los xilanos y los arabinanos son homopolisacáridos de D-xilosa y de L-arabinosa presentes en los tejidos vegetales. 2.1.2.1.2.- Homopolisacáridos estructurales A) Celulosa Es el constituyente de la pared celular más abundante en el mundo de las plantas. Es un polímero de la D-glucosa que posee enlaces β (1→4). La celulosa es el componente principal de la madera y por lo tanto del papel; el algodón es casi celulosa pura. Su hidrólisis parcial produce un disacárido reductor denominado celobiosa (ver el apartado correspondiente a Disacáridos), mientras que por hidrólisis total produce únicamente D-glucosa. La celulosa realmente es un polímero de la celobiosa de forma que está constituida por 150 a 5000 moléculas de celobiosa con un peso molecular de 800000. Estos polímeros forman cadenas lineales, no ramificadas, que se pueden disponer paralelamente, uniéndose unas con otras por puentes de hidrógeno y agrupándose en cordones, estos se agrupan para formar microfibrillas y estas se agrupan para formar fibrillas de celulosa, 1500 fibrillas de 8 celulosa forman una fibra de algodón, visible a simple vista y formada por 8.10 cadenas de celulosa (figura 2.19). Aunque posee elevada afinidad por el agua es completamente insoluble en ella. A B Figura 2.19.- A. Cadena lineal de moléculas de D-glucosa unidas por enlaces β (1→4). B. Agrupamiento de las cadenas lineales para formar cordones y microfotografía de fibras de celulosa. B) Quitina Es un homopolisacárido estructural constituido por un polímero de un derivado de la Dglucosa, la N-acetil-D-glucosamina (figura 2.20) unidas por enlaces β (1→4). Forma cadenas paralelas y es el componente esencial del exoesqueleto de los Artrópodos. También está presente en el exoesqueleto de los Crustáceos, pero en este caso se encuentra impregnada de sales de CaCO3. Glúcidos 38 Figura 2.20.- Trozo de cadena de una molécula de quitina. Se ha colocado dentro de un corchete la unidad que se repite. 2.1.2.2.- Heteropolisacáridos Son polisacáridos que por hidrólisis dan lugar a varios tipos distintos de monosacáridos o de derivados de ellos. La mayoría de ellos se encuentran formando parte de la pared celular bacteriana, de la pared celular vegetal o de la matriz extracelular de las células animales. En cuanto a sus funciones son los responsables de la forma y rigidez de las células o bien son sustancias de secreción con diversas funciones. Se distinguen tres tipos según su origen, los de origen bacteriano, los de origen vegetal y los de origen animal. A) De origen bacteriano El más frecuente es el denominado peptidoglucano o mureína que constituye una red espacial formada por largas cadenas de azúcares paralelas, que se entretejen mediante cortos péptidos que las unen. En las cadenas existe un disacárido que se repite que está formado por N-acetil-β-D-glucosamina (NAGA) y ácido N-acetil-murámico (NAM) unidos mediante enlace β (1→6), entre los disacáridos consecutivos las uniones son por enlaces β (1→4), la cadena peptídica se une al grupo carboxilo libre del ácido murámico mediante la formación de una amida. (Esta estructura se verá en el tema correspondiente a Microorganismos). B) De origen vegetal Tres son los heteropolisacáridos de importancia presentes en el mundo vegetal: a) Pectina. Constituyente de la pared celular de los vegetales (manzana, pera, ciruela y membrillo). Tiene una elevada capacidad gelificante que se aprovecha en la fabricación de mermeladas. b) Agar-Agar. Compuesto que se extrae de un alga roja, Chondus chrispus, muy hidrófilo, por esta razón se utiliza en microbiología para la preparación de medios de cultivo. c) Goma arábiga. Sustancia segregada por las plantas que sirve para cerrar sus heridas. C) De origen animal Se suelen denominar glucosaminoglucanos. No se encuentran libres, sino asociados con proteínas constituyendo los denominados proteoglucanos (formados por un 20% de proteínas y un 80% de glucosaminoglucanos). Pueden formar estructuras o ser componentes de secreciones: a) Ácido hialurónico. Es el más abundante. Se localiza en el tejido conectivo, en el líquido sinovial y en el humor vítreo del ojo. Constituido por una macromolécula resultado de la unión de moléculas de un disacárido constituido por ácido β-D-glucurónico (1→3) N-acetil-βD-glucosamina. Las moléculas de disacárido se unen entre sí por enlaces de tipo β (1→4), por tanto en las cadenas de esta macromolécula se alternan los enlaces β (1→4) y β (1→3). Glúcidos 39 b) Condroitina. Es un polímero cuya unidad fundamental es el disacárido β-Dglucurónico (1→3) N-acetil-β-D-galactosamina. Las moléculas de este disacárido se unen entre sí por medio de enlaces β (1→4). Dos derivados suyos, el sulfato de condroitina A y el sulfato de condroitina C forman parte de la matriz extracelular de los tejidos conjuntivos, cartilaginoso y óseo. También está presente en las estructuras de la córnea. c) Heparina. Localizado en las sustancias intercelulares y con propiedades de anticoagulante. La unidad básica de repetición está formada por un éster sulfúrico en 2 del ácido α-D-glucurónico y un éster sulfúrico en 3 de la N-sulfato-α-D-glucosamina, unidos mediante enlace α (1→4). 2.2.- Heterósidos Resultan de la combinación de un grupo hidroxilo de un monosacárido o de un oligosacárido con una molécula o grupo de moléculas no glucídicas denominadas aglucón. Cuando estas moléculas son lípidos o proteínas es preferible hablar de asociaciones de glúcidos con lípidos o con proteínas, son las denominadas glucoproteínas y los denominados glucolípidos, que se irán tratando a lo largo de los temas de este curso, pues constituyen un amplio y variado tipo de moléculas que realizan una gran gama de funciones en los seres vivos. Los principales son los siguientes: a) Digitalina. Denominada así por extraerse a partir de la Digitalis purpúrea, se utiliza en el tratamiento de enfermedades vasculares, es un cardiotónico. b) Amigdalósido. Presente en los huesos del melocotón y el albaricoque (tras su digestión libera ácido cianhídrico que provoca peligrosas intoxicaciones). c) Antocianósidos. Responsables del color de las flores. d) Estreptomicina. Importante antibiótico (figura 2. 21). Figura 2.21.- Estructura molecular de la Estreptomicina. e) Tanósidos. De propiedades astringentes, se emplean en el curtido de pieles. f) Nucleótidos. Derivados de la ribosa y de la desoxirribosa, que forman los ácidos nucleicos. 3.- FUNCIONES DE LOS GLÚCIDOS a) Función energética. La glucosa, glúcido más importante en los seres vivos, se puede considerar como la moneda energética de éstos. La sacarosa, el almidón y el Glúcidos 40 glucógeno son formas de almacenar glucosa en los seres vivos, por lo tanto serán formas de reserva energética. b) Función estructural. Hay que destacar la importancia del enlace β-glucosídico, que impide la degradación de estas moléculas y hace que ciertos organismos puedan permanecer cientos de años (árboles). Entre los glúcidos con función estructural podemos citar: la celulosa en los vegetales, la quitina en los artrópodos, los peptidoglucanos de las bacterias, la condroitina en los huesos y cartílagos etc. c) Funciones específicas. Por ejemplo como antibióticos (estreptomicina), funciones vitamínicas (vitamina C), hormonales (hormonas gonadotropas), inmunológicas (las glucoproteínas de membrana constituyen antígenos y, por otro lado, los anticuerpos o inmunoglobulinas están constituidos en parte por glúcidos), anticoagulantes (heparina), enzimáticas (junto con proteínas forman las ribonucleasas) etc. _______________________________ EJERCICIOS PROPUESTOS EN LAS PRUEBAS DE ACCESO (P.A.U.) MONOSACÁRIDOS 1ª.- Defina qué son los monosacáridos [0’5] y explique su importancia biológica [0’6]. Haga una clasificación de los mismos [0’5]. Represente la fórmula desarrollada de la glucosa [0’4]. (2004 y 2006). En 2006 se reformula de la siguiente manera: Defina qué son los monosacáridos [0’5] y explique dos de sus funciones [0’6]. Haga una clasificación de los mismos indicando el criterio utilizado [0’5]. Represente la fórmula desarrollada de la glucosa [0’4]. (2006) DISACÁRIDOS. ENLACE GLUCOSÍDICO 2ª.- Describa el enlace O-glucosídico [0’5]. Proponga un ejemplo de enlace O-glucosídico utilizando las fórmulas de dos moléculas diferentes entre las que se a posible su formación [0’8]. Indique el tipo de molécula resultante [0’2]. (2002). POLISACÁRIDOS 3ª.- Explique las características estructurales [0’7] y funcionales [0’7] de los polisacáridos. Cite tres ejemplos de polisacáridos [0’6]. (2004) 4ª.- Nombre el polisacárido más abundante en las paredes de las células vegetales [0’2], enumere tres de sus propiedades biológicas [0’5] y explique el fundamento físico-químico de las mismas [0’5]. Justifique la diferencia en valor nutricional para las personas entre el almidón y el referido polisacárido [0’8]. (2005). 5ª.- En relación con la imagen adjunta, responda as siguientes cuestiones: a) ¿Qué tipo de molécula representa? [0’25]. Nombre el componente incluido en el recuadro [0’25] y el enlace señalado con la flecha [0’25], explique cómo se forma dicho enlace [0’25]. b) Nombre una biomolécula que contenga este tipo de cadena [0’25], explique su función biológica [0’5] e indique su distribución en los seres vivos [0’25]. (2005) Glúcidos 41 6ª.- Puede un animal digerir y aprovechar la celulosa? [0’5]. ¿Y el almidón [0’5]. Razone las respuestas. (2001). PREGUNTAS CON CONCEPTOS DE GLÚCIDOS EN GENERAL 7ª.- Explique La importancia biológica de los monosacáridos [0’5]. Represente la fórmula de un monosacárido indicando su nombre [0’5] y la fórmula de un disacárido señalando el nombre químico y el tipo de enlace que lo caracteriza [0’5]. Relacione entre sí los términos de las dos columnas que se muestran a continuación [0’5]: (2005) A. Desoxiazúcar B. Cetosa C. Disacárido. D. Aldosa E. Polisacárido 1. Glucosa 2. Celulosa 3. Desoxirribosa 4. Fructosa 5. Lactosa. 8ª.- Defina qué es un monosacárido y un polisacárido [0’5]. Haga una clasificación de polisacáridos [0’5]. Establezca un paralelismo entre polisacáridos del reino animal y vegetal en cuanto a su composición y función [0’5]. (2001). 9ª.- Indique qué es un enlace O-glucosídico [0’2] y que grupos funcionales participan en su formación [0’1]. Cite dos polisacáridos que se formen por polimerización de monosacáridos de configuración α [0’15] y uno por la de monosacáridos de configuración β [0’15]. Describa la estructura y función que desempeña cada uno de ellos [0’9]. (2002). 10ª.- Un polisacárido formado por restos de glucosa y localizado en un tejido vegetal, dio por hidrólisis un disacárido diferente del que se obtiene de la hidrólisis del glucógeno. Razone cuál es el polisacárido [1] (2003). 11ª.- Destaque la importancia biológica de los monosacáridos [0’5], describa las características del enlace O-glucosídico [0’25] y analice las características estructurales y funcionales de tres polisacáridos de interés biológico [0’75]. (2003). 12ª.- Proponga una explicación que justifique que los animales utilicen lípidos como moléculas de reserva energética y los vegetales glúcidos [1]. Razone la respuesta (2005). 13ª.- Defina qué son los monosacáridos 0’6]. Indique el nombre que reciben en función del número de átomos de carbono [0’5]. Cite dos funciones biológicas de los monosacáridos [0’4]. Nombre dos polisacáridos importantes y la función que realizan [0’5]. (2008). 14ª.- Indique dos funciones biológicas de los monosacáridos [0’4], describa el enlace Oglucosídico [0’4] y analice las características estructurales y funcionales de tres polisacáridos de interés biológico [1’2]. (2009). 15ª.- Defina monosacárido [0’5]. Realice una clasificación de los monosacáridos según el número de átomos de carbono [0’25]. Cite dos ejemplos de monosacáridos con cinco átomos de carbono y otros dos con seis [0’4]. Diferencia disacárido y polisacárido [0’25]. Cite dos funciones de los polisacáridos en los seres vivos indicando el nombre de un polisacárido que desempeñe cada función [0’6]. (2009). 16ª.- Explique la importancia biológica de los siguientes glúcidos: glucosa, ribosa, almidón y celulosa [2]. (2010). 17ª.- Defina qué son los monosacáridos [0’6]. Indique el nombre que reciben en función del número de átomos de carbono [0’5]. Cite dos funciones biológicas de los monosacáridos [0’4]. Nombre dos polisacáridos importantes y la función que realizan [0’5]. (2011). __________________________________