Principios de Enzimología
Anuncio
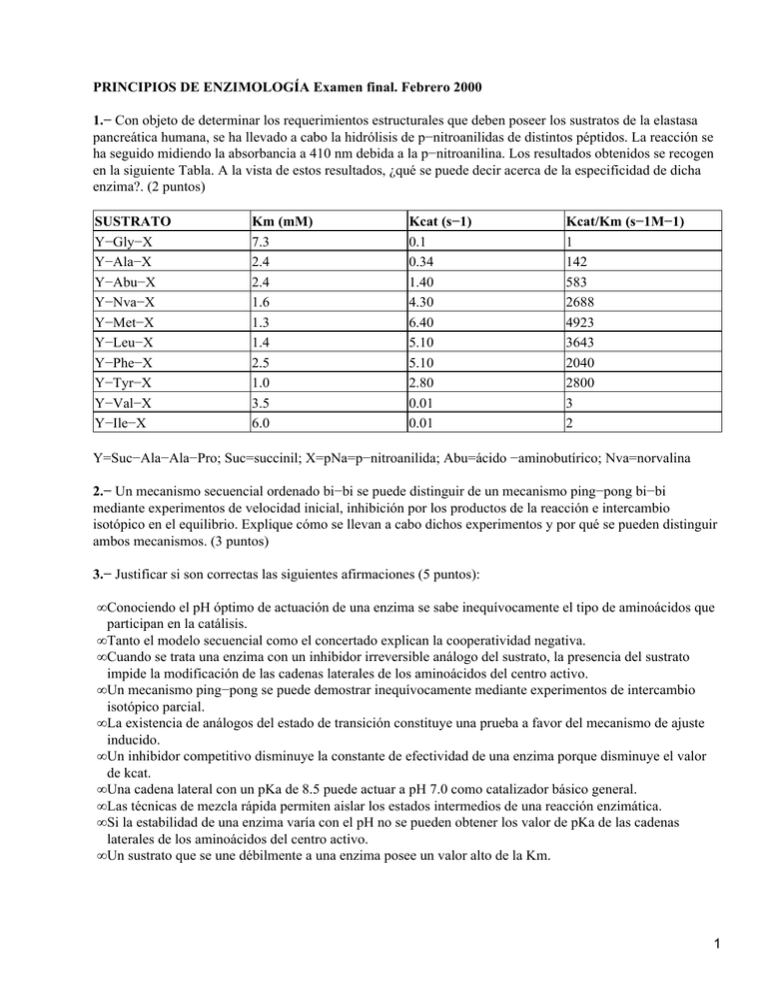
PRINCIPIOS DE ENZIMOLOGÍA Examen final. Febrero 2000 1.− Con objeto de determinar los requerimientos estructurales que deben poseer los sustratos de la elastasa pancreática humana, se ha llevado a cabo la hidrólisis de p−nitroanilidas de distintos péptidos. La reacción se ha seguido midiendo la absorbancia a 410 nm debida a la p−nitroanilina. Los resultados obtenidos se recogen en la siguiente Tabla. A la vista de estos resultados, ¿qué se puede decir acerca de la especificidad de dicha enzima?. (2 puntos) SUSTRATO Y−Gly−X Y−Ala−X Y−Abu−X Y−Nva−X Y−Met−X Y−Leu−X Y−Phe−X Y−Tyr−X Y−Val−X Y−Ile−X Km (mM) 7.3 2.4 2.4 1.6 1.3 1.4 2.5 1.0 3.5 6.0 Kcat (s−1) 0.1 0.34 1.40 4.30 6.40 5.10 5.10 2.80 0.01 0.01 Kcat/Km (s−1M−1) 1 142 583 2688 4923 3643 2040 2800 3 2 Y=Suc−Ala−Ala−Pro; Suc=succinil; X=pNa=p−nitroanilida; Abu=ácido −aminobutírico; Nva=norvalina 2.− Un mecanismo secuencial ordenado bi−bi se puede distinguir de un mecanismo ping−pong bi−bi mediante experimentos de velocidad inicial, inhibición por los productos de la reacción e intercambio isotópico en el equilibrio. Explique cómo se llevan a cabo dichos experimentos y por qué se pueden distinguir ambos mecanismos. (3 puntos) 3.− Justificar si son correctas las siguientes afirmaciones (5 puntos): • Conociendo el pH óptimo de actuación de una enzima se sabe inequívocamente el tipo de aminoácidos que participan en la catálisis. • Tanto el modelo secuencial como el concertado explican la cooperatividad negativa. • Cuando se trata una enzima con un inhibidor irreversible análogo del sustrato, la presencia del sustrato impide la modificación de las cadenas laterales de los aminoácidos del centro activo. • Un mecanismo ping−pong se puede demostrar inequívocamente mediante experimentos de intercambio isotópico parcial. • La existencia de análogos del estado de transición constituye una prueba a favor del mecanismo de ajuste inducido. • Un inhibidor competitivo disminuye la constante de efectividad de una enzima porque disminuye el valor de kcat. • Una cadena lateral con un pKa de 8.5 puede actuar a pH 7.0 como catalizador básico general. • Las técnicas de mezcla rápida permiten aislar los estados intermedios de una reacción enzimática. • Si la estabilidad de una enzima varía con el pH no se pueden obtener los valor de pKa de las cadenas laterales de los aminoácidos del centro activo. • Un sustrato que se une débilmente a una enzima posee un valor alto de la Km. 1











