LAS ENZIMAS
Anuncio

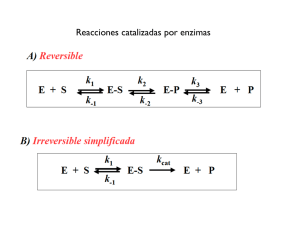
LAS ENZIMAS ENZIMAS ESTRUCTURA FUNCIÓN CLASIFICACIÓN Biocatalizadores Ligasas Isomerasas Liasas Hidrolasas Transferasas Oxidorreductasas puede ser Holoenzima Estrictamente proteica formada Cof actor Apoenzima naturaleza de naturaleza Inorgánica Energía activación velocidad reacción Orgánica llamados actúan como actúan Coenzimas por ejemplo Cinética Concent. sustrato Temperatura pH Inhibidores enzimática tipos Reversibles Irreversibles tipos Vitaminas se clasifican en No competitivos Hidrosolubles (B, C) Liposolubles (A, D, E, K) Competitivos ENZIMAS Los enzimas son proteínas que catalizan reacciones químicas en los seres vivos. Los enzimas son catalizadores, es decir, sustancias que, sin consumirse en una reacción, aumentan notablemente su velocidad. No hacen factibles las reacciones imposibles, sino que solamente aceleran las que espontáneamente podrían producirse. Eficiencia catalítica La mayoría de las reacciones catalizadas por enzimas son muy eficientes y transcurren desde 106 hasta 1014 veces más rápido que la misma reacción no catalizada. Típicamente, cada molécula de enzima es capaz de transformar cada segundo de 100 a 1000 moléculas de substrato en producto. El número de estas moléculas transformadas a producto por molécula de enzima en cada segundo, se conoce como el número de recambio. Eficiencia de las reacciones catalizadas por algunas enzimas Enzima Velocidad en ausencia de enzima Velocidad Rendimiento de reacción catalizada Anhidrasa carbónica 1.3 x 10-1 1.0 x 106 7.7 x 106 Corismato mutassa 2.6 X 10 –5 50 1.9 X 106 Triosafosfato isomerasa 4.3 X 10 –6 4300 1.0 X 109 Carboxipeptidasa A 3.0 X 10 –9 578 1.9X 1011 AMP nucleosidasa 1.0 X 10 –11 60 6.0 X 1012 Nucleasa estafilococal 1.7 X 10 -13 95 5.6 X 1014 ENZIMAS Catálisis Ea E a’ G G Reacción no catalizada Reacción catalizada ASPECTOS GENERALES Prácticamente todas las reacciones químicas que tienen lugar en los seres vivos están catalizadas por enzimas. Los enzimas son específicos: cada enzima tipo de reacción, y casi sobre un único sustrato o muy reducido de ellos. catalizadores cataliza un solo siempre actúa sobre un grupo ASPECTOS GENERALES En una reacción catalizada por un enzima: La sustancia sobre la que actúa el enzima se llama sustrato. El sustrato se une a una región concreta del enzima, llamada centro activo. El centro activo comprende: (1) un sitio de unión formado por los aminoácidos que están en contacto directo con el sustrato y (2) un sitio catalítico, formado por los aminoácidos directamente implicados en el mecanismo de la reacción Una vez formados los productos el enzima puede comenzar un nuevo ciclo de reacción ASPECTOS GENERALES Modelo llave-cerradura de la acción enzimática (Fisher): cada enzima se une a un único sustrato debido a que el lugar activo y el sustrato poseen estructuras complementarias. Modelo del ajuste inducido (D. Koshland). Se toma en cuenta la estructura flexible de las proteínas; el sustrato no se ajusta con precisión a un lugar activo rígido. ASPECTOS GENERALES Enzima y sustrato Unión al centro activo Formación de productos ASPECTOS GENERALES Los enzimas, a diferencia de los catalizadores inorgánicos catalizan reacciones específicas. Sin embargo hay distintos grados de especificidad. El enzima sacarasa es muy específico: rompe el enlace β-glucosídico de la sacarosa o de compuestos muy similares. Así, para el enzima sacarasa, la sacarosa es su sustrato natural, mientras que la maltosa y la isomaltosa son sustratos análogos. ASPECTOS GENERALES El enzima actúa con máxima eficacia sobre el sustrato natural y con menor eficacia sobre los sustratos análogos. Entre los enzimas poco específicos están las proteasas digestivas como la quimotripsina, que rompe los enlaces amida de proteínas y péptidos de muy diverso tipo. NOMENCLATURA Nombre sistemático: Grupo transferido ATP: hexosa fosfotransferasa Donador Aceptor Grupo Número sistemático Enzyme Comission Nombre común: Subgrupo EC 2.7.1.1 Hexokinasa Sub-subgrupo Enzima CLASIFICACIÓN DE LOS ENZIMAS En función de su acción catalítica específica, los enzimas se clasifican en 6 grandes grupos o clases: 1. 2. 3. 4. 5. 6. Oxido-Reductasas Transferasas Hidrolasas Liasas Isomerasas Ligasas 1.- OXIDORREDUCTASAS Catalizan reacciones de oxido-reducción, es decir, transferencia de hidrógeno (H) o electrones (e-) de un sustrato a otro, según la reacción general: AH2 + B Ared + Box A + BH2 Aox + Bred 1. OXIDORREDUCTASAS Nombre sistemático ALCOHOL: NAD+ OXIDO-REDUCTASA Donador Aceptor Nombre numérico E.C.1.1.1.1. Nombre común Alcohol deshidrogenasa 1. Oxido-reductasa 1. actúa sobre grupo –CHOH como donador de e1. NAD+ o NADP+ como aceptor de e1.- Etanol como sustrato específico 1. OXIDORREDUCTASA Los subgrupos se forman según la naturaleza del donador: 1.1 Actúan sobre el grupo alcohol 1.2 Actúan sobre el grupo aldehído 1.3 Actúan sobre el grupo CH - CH 1.4 Actúan sobre el grupo CH – NH2 1.5 Actúan sobre el grupo CH – NH 1.6 Actúan sobre el grupo NADH o NADPH etc. 1. OXIDORREDUCTASAS Los sub-subgrupos se forman según la naturaleza del aceptor: 1.1.1 NADH o NADPH como aceptor 1.1.2 Citocromos como aceptor 1.1.3 Oxígeno como aceptor 1.1.4 Disulfuro como aceptor 1.1.5 Quininas o compuestos similares Etc. 1.- OXIDORREDUCTASAS E.C.1.1.1.28 LA MAYOR PARTE DE LAS OXIDORREDUCTASAS SE CONOCEN COMO: 1. 2. 3. 4. 5. Deshidrogenasas Oxidasas Peroxidasas Oxigenasas Reductasas 2. TRANSFERASAS Catalizan reacciones en las que hay una transferencia de grupos de una molécula a otra. Ejemplos de estos grupos: amino, carboxilo, carbonilo, metilo, fosforilo y acilo (RC=O). Los nombres comunes triviales suelen incluir el prefijo trans. Entre los ejemplos están transcarboxilasas, transmetilasas y transaminasas. 2. TRANSFERASAS A-X + B A+B-X ATP: D-Hexosa-6- Fosfotransferasa Dador Aceptor grupo transferido Número sistemático EC.2.7.1.1. Nombre común Hexoquinasa 2. Transferasa 7. Transfiere grupos fosfato 1. grupo alcohólico como aceptor 1. D-hexosa 2. TRANSFERASAS Clasificación de subgrupos de transferasas 2.1 Grupos monocarbonados 2.2 Grupos aldehído o ceto 2.3 Acíltransferasas 2.4 Glicosiltransferasas 2.5 Alquil o Ariltransferasas 2.6 Grupos nitrogenados 2.7 Grupos fosfato 2.8 Grupos sulfato 3. HIDROLASAS Catalizan reacciones en las que se produce la ruptura de enlaces por la adición de agua (hidrólisis). Ejemplos: Esterasas, Fosfatasas y Peptidasas. A - B + H 2O A – OH + H – B No se suelen utilizar nombres sistemáticos en las hidrolasas. Muchas de ellas conservan su nombre primitivo: Tripsina, Pepsina, Quimotripsina, Papaína, etc. 3. HIDROLASAS E.C. 3.5.1.5. 3. HIDROLASAS 3.1.1.7 Acetilcolina hidrolasa 3. Hidrolasa 1. Actúa sobre enlaces ésteres 1. Actúa sobre ésteres carboxílicos 7. Actúa sobre acetilcolina como sustrato específico. 3. HIDROLASAS 3.1 Actúa sobre enlaces esteres Esterasas (Carboxilesterasas, Fosfoesterasas, sulfoesterasas) 3.2 Glicosidasas 3.3 Actúan sobre enlaces éteres (Éterhidrolasas) 3.4 Actúan sobre enlaces péptidicos (péptidohidrolasas) Etc. 4. LIASAS Catalizan reacciones en las que se eliminan grupos (por ejemplo: H2O, CO2 Y NH3) para formar un doble enlace o se añaden a un doble enlace. A=B + X COOCH CH COOFumarato (trans) H2O COOHO CH | CH 2 COOL-Malato ABX 4. LIASAS 4. LIASAS 4.1.1.1 Piruvato carboxilasa 4. Liasa 1. Rompe enlaces C-C 1. Separa el grupo CO2 1. Actúan sobre piruvato como sustrato específico 5. LIASAS EJEMPLOS DE LIASAS: Descarboxilasas Hidratasas Deshidratasas Desaminasas Sintasas 5. ISOMERASAS Catalizan varios tipos de reordenamientos intramoleculares. Las epimerasas catalizan la inversión de átomos de carbono asimétricos. Las mutasas catalizan la transferencia intramolecular de grupos funcionales. 1.1 rasemasas y epimerasas 1.2 cis-trans-isomerasas 1.3 oxidoreductasas intramoleculares 1.4 mutasas 1.5 otras liasas 5. ISOMERASAS 5. ISOMERASAS 5.3.1.1. D-Gliceraldehído-3-fosfato Ketoisomerasa (Trifosfato isomerasa) 5. Isomerasa (cataliza cambios moleculares) 3. Supone una oxidoreducción intramolecular 1. Interconversión entre aldosas y cetosas 1. Triosafosfato como sustrato específico 6. LIGASAS Catalizan la formación de un enlace entre dos moléculas de sustrato. La energía para estas reacciones la aporta siempre la hidrólisis del ATP. A + B + ATP A-B + ADP + Pi o bien C + D + ATP C-D + AMP + PPi 6. LIGASAS 6. LIGASAS 6.4.1.1. Piruvato: CO2 ligasa (piruvato carboxilasa) 6. Ligasa 4. Unión C-C 1. Reacción de carboxilación 1. Piruvato como sustrato específico 6. LIGASAS Los nombres de muchas ligasas incluyen el término sintetasa y otras se denominan carboxilasas Aminoacil tRNA-sintetasa Glutamina sintetasa Carboxilasas