Ingenieria biologica
Anuncio

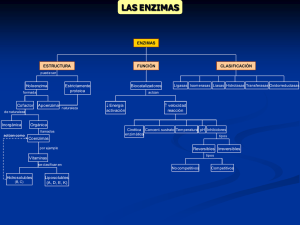
INGENIERIA BIOLOGICA Alvaro Díaz Estrada Ingeniero Agrónomo Carera de Agronomia Universidad Rural INGENIERIA BIOLOGICA • Es la rama de la ingeniería que se ocupa de la aplicación tecnológica de los sistemas biológicos y organismos vivos o sus derivados para la creación o modificación de productos o procesos para un uso específico. • Es una disciplina científica fundada sobre las ciencias biológicas • La ingeniería biológica Unidades del curso I) Química sanitaria y biología del medio ambiente – Enzimología – Metabolismo microbiano II) Problemática ambiental III) Perturbaciones ambientales de origen humano IV) Ecología ENZIMOLOGIA Enzimas • Son moléculas de naturaleza proteica que catalizan reacciones químicas. • Una enzima hace que una reacción química que es energéticamente posible, pero que transcurre a una velocidad muy baja, transcurra a mayor velocidad que sin la presencia de la enzima • • • • Lípidos Proteínas Carbohidratos Vitaminas y mineras. • No sería posible la vida que conocemos. • Todos los procesos metabólicos que cumplen los seres vivos se realizan a través de las Enzimas. – Fotosíntesis – Glucólisis – Ciclo de Krebs • Casi todos los procesos en las células necesitan enzimas para que ocurran a unas tasas significativas • En estas reacciones, las enzimas actúan sobre unas moléculas denominadas sustratos las cuales se convierten en moléculas diferentes denominadas productos. Sustrato •H2O2 Enzima Producto H 2O + O 2 • Las enzimas no alteran el balance energético de las reacciones, ni modifican, pero consiguen acelerar el proceso incluso millones de veces Dos propiedades fundamentales 1. Su poder catalítico. 2. Su especificidad. Son específicos para la reacción que catalizan y para el sustrato sobre el que actúan. 1. Especificidad de sustrato 2. Especificidad de acción Especificidad de sustrato • Especificidad absoluta: Se da cuando la enzima sólo actúa sobre un sustrato. • Especificidad de grupo: Se da cuando la enzima reconoce un determinado grupo de moléculas. • Especificidad de clase: Es la menos específica, dado que la actuación de la enzima no depende del tipo de moléculas, sino del tipo de enlace. CENTRO ACTIVO DE LA ENZIMA • Es la parte de la enzima donde se une el sustrato para ser modificado. • Es una pequeña porcion de la molecula enzimatica ( 3 a 4 aminoacidos). • No es un punto ni una línea, es una entidad tridimensional formada por grupos químicos procedentes de diferentes partes de lasecuencia lineal de aminoácidos. CENTRO ACTIVO DE LA ENZIMA • Las enzimas presentan dentro de su estructura proteica 2 regiones para la realización de su actividad catalítica. – Sitio de reconocimiento: reconoce y liga al sustrato – Sitio catalítico: una vez unido el sustrato, cataliza la reacción Dos hipótesis sobre formación de enzima-sustrato Modelo de fisher 1,894 1. La llave y la cerradura: El sitio de unión del sustrato existe preformado en la estructura de la enzima aún en ausencia del sustrato unido. Modelo de Coshland 1,958 2. Acoplamiento inducido: La molécula de sustrato induce un cambio conformacional en el sitio activo de la enzima de manera de quedar perfectamente acoplados. Energía libre de transición • La energía libre de activación, DG‡, se define como la cantidad de energía que se requiere para convertir una mol de sustratos (reactivos o reactantes) desde el nivel basal (el nivel de baja energía de una molécula) al estado de transición. Clasificación de las enzimas • Oxidoreductasa: Son aquellas enzimas que catalizan las reacciones de oxidorreducción, o sea, la transferencia de electrones o sus equivalentes entre un donante y un aceptor . Ejemplo Oxidasas, reductasas, deshidrogenasas. O •CH3-CH2-OH + NAD CH3-C-H + NADH + H+ Alcohol deshidrogenasa • Transferasas: Catalizan la transferencia de un grupo químico entre un donante y un aceptor; se excluyen aquéllas que transfieren electrones o sus equivalentes. Ejemplo transfosfatasas, transaminasas, kinasas, transacilasas. •CH2OPO32 •CH2OH •C=O •C=O •HO–C–H •+ ATP •H–C–OH •H–C–OH •H–C–OH •CH2OPO32 •HO–C–H •Fosfofructo kinasa •H–C–OH •CH2OPO32 •+ ADP • Hidrolasas: Catalizan la ruptura de enlaces químicos con la participación de las moléculas del agua. Las hidrolasas incluyen a las esterasas, fosfatasas, glucosidasas, lipasas y peptidasas. • Liasas: Catalizan reacciones en las cuales se produce la adición o sustracción de grupos químicos (e.g., H2O, CO2, y NH3) a dobles enlaces o para formar dobles enlaces. Ejemplos Decarboxilasas, hidratasas, dehidratasas, deaminasas • Isomerasas: Este es un grupo heterogéneo de enzimas. Las isomerasas catalizan varios tipos de rearreglos intramoleculares que llevan ese nombre. Ejemplo: Racemasas • Ligasas: Catalizan la unión covalente de 2 sustratos mediante la energía de hidrólisis de nucleósidos trifosfatados, generalmente el ATP. Los nombres de muchas ligasas incluyen el nombre sintetasa. Varias otras ligasas reciben el nombre de carboxilasas. Factores que afectan la función enzimática EFECTO DE LA TEMPERATURA EFECTO DE LA pH • Efecto de la concentración de sustrato Zimógenos • Es una molécula que necesita ser activada para convertirse en una enzima activa Cofactores y coenzimas • Algunas moléculas requieren la unión de moléculas no proteicas para su reacción • Cofactor. • Iones Metalicos (Fe2+, Cu2+, Mg2+ ) – Centro catalítico primario – Grupo puente para reunir el sustrato y la enzima – Agente estabilizante de la conformación de la proteína enzimática en su forma catalíticamente activa Coenzimas • Son moléculas orgánicas de tamaño pequeño. • Radica la actividad catalítica • Son termoestables. • NAD+(nicotín-adenín dinucleótido): transferencia de electrones y protones • Coenzima A: transferencia de grupos acetilo • Apoenzimas: La proteína que, cuando se encuentra aislada y separada de su cofactor, es inactiva enzimáticamente. • Una apoenzima junto con cofactor es denominada holoenzima (que es la forma activa) • Apoenzima radica la especificidad • Coenzima radica la actividad catalítica Enzimas Alostoricas • Generan un cambio en la conformación estructural de la enzima que repercute en el sitio activo, afectando así a la velocidad de reacción (inhiben o activan células) Ihibicion enzimatica • Los inhibidores son moléculas que regulan la actividad enzimática, inhibiendo su actividad. • Clasifican en dos: – Irreversibles – Reversibles Clasificación de Inhibición reversible • Inhibición competitiva • Inhibicion acompetitiva • Inhibición mixta GRACIAS !!!