IED ARBORIZADORA ALTA
Anuncio
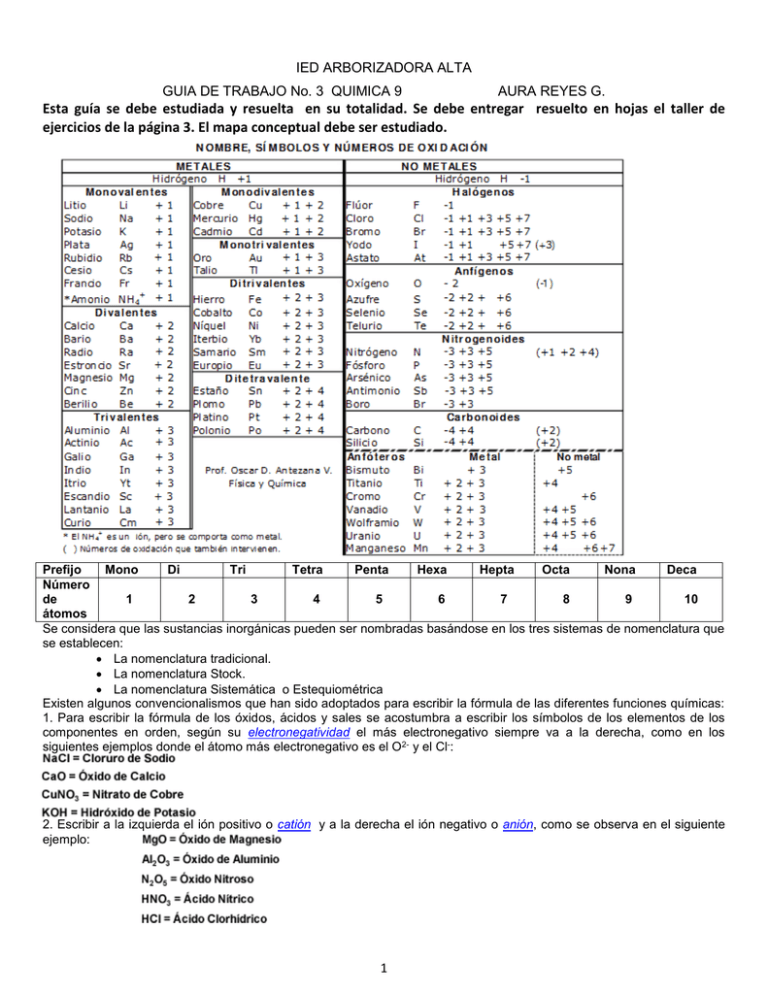
IED ARBORIZADORA ALTA GUIA DE TRABAJO No. 3 QUIMICA 9 AURA REYES G. Esta guía se debe estudiada y resuelta en su totalidad. Se debe entregar resuelto en hojas el taller de ejercicios de la página 3. El mapa conceptual debe ser estudiado. Prefijo Mono Di Tri Tetra Penta Hexa Hepta Octa Nona Deca Número de 1 2 3 4 5 6 7 8 9 10 átomos Se considera que las sustancias inorgánicas pueden ser nombradas basándose en los tres sistemas de nomenclatura que se establecen: La nomenclatura tradicional. La nomenclatura Stock. La nomenclatura Sistemática o Estequiométrica Existen algunos convencionalismos que han sido adoptados para escribir la fórmula de las diferentes funciones químicas: 1. Para escribir la fórmula de los óxidos, ácidos y sales se acostumbra a escribir los símbolos de los elementos de los componentes en orden, según su electronegatividad el más electronegativo siempre va a la derecha, como en los siguientes ejemplos donde el átomo más electronegativo es el O2- y el Cl-: 2. Escribir a la izquierda el ión positivo o catión y a la derecha el ión negativo o anión, como se observa en el siguiente ejemplo: 1 Compuestos inorgánicos binarios: ÓXIDO BÁSICO (METÁLICO): se forma al combinarse un metal con el oxígeno Para formular: Si los subíndices son divisibles por un mismo número es obligatorio simplificar. Ejemplo: Ca2O2 debe simplificarse a CaO Para nombrar los óxidos se utiliza la palabra óxido, seguida del nombre específico del metal, por ejemplo óxido de aluminio Para nombrar: Cuando un elemento presenta más de un número de oxidación como por ejemplo el cobre pueden aplicarse diferentes normas como se observa en el siguiente cuadro donde se aplican los 3 sistemas de nomenclatura: La nomenclatura tradicional, utiliza los sufijos ico y oso y los prefijos hipo y per de la siguiente manera: si el elemento presenta dos números de oxidación, se utiliza ico para el mayor número de oxidación del elemento que acompaña el oxígeno y oso para el menor. En el sistema Stock se escribe el nombre genérico, en este caso óxido, seguido por la preposición de y el nombre del elemento. Adicionalmente, entre paréntesis se escribe en número romanos el número de oxidación del elemento unido al oxígeno. Si el elemento tiene un solo número de oxidación, se omite el número romano dentro de un paréntesis Cu2O Oxido Cuproso Oxido de Cobre (I) Monóxido de dicobre En la nomenclatura sistemática para los óxidos se utiliza el prefijo numeral mono, di, tetra, penta, hexa, etc., para designar el número de oxígenos, seguido de la palabra óxido y el número de átomos del otro elemento. Cuando el elemento tenga un único estado de oxidación se puede nombrar sin poner ningún prefijo numeral ya que el óxido es único. Ejemplo: Na2O: monóxido de disodio u óxido de sodio ÓXIDO ÁCIDO (NO METÁLICO): se forma al combinarse un no metal con el oxígeno. Ejemplos: CO2; SO3 ; N2 O5; CO; SO2; NO2 HIDRUROS: son combinaciones de los metales con el hidrógeno. El hidrógeno en los hidruros funciona con -1. Esto nos indica que es más electronegativo que los metales por lo que al escribir lo fórmula debe situarse a la derecha. 2 Ejemplos: AlH3; LiH; CuH2; KH; FeH3; ZnH2 Metal a la izquierda Hidrógeno a la derecha Para formular: Fe H3 Intercambiar n os de oxidación (sin signo) HIDRUROS VOLÁTILES: son combinaciones de algunos no-metales con el hidrógeno. Estos no-metales son: C, Si, P, N, Ar, Sb. Los hidruros no metálicos no se nombran como tales, todos ellos tienen nombres especiales, no sistemáticos: CH4: Metano SiH4: Silano NH3: Amoniaco PH3: Fosfina AsH3: Arsina SbH3: Estibina HAGOLENUROS DE HIDROGENO (HIDRACIDOS) Las combinaciones binarias del hidrógeno con los no metales del grupo de los anfígenos y halógenos no se consideran hidruros. El halógeno o anfígeno, como son más electronegativos que el hidrógeno, funcionan con el estado de oxidación negativo y deberán situarse a la derecha a la hora de escribir la fórmula. Se nombran terminando en URO el nombre del halógeno o anfígeno. Los cuatro son gases y cuando se disuelven en agua se comportan como ácidos (ácidos hidrácidos) por lo que también pueden nombrase con la palabra ácido-nombre del elemento-terminación HIDRICO. HF: Fluoruro de hidrógeno o ácido fluorhídrico HCl: Cloruro de hidrógeno o ácido clorhídrico HBr: Bromuro de hidrógeno o ácido bromhídrico HI : Yoduro de hidrógeno o ácido yodhídrico H2S: Sulfuro de hidrógeno o ácido sulfhídrico TALLER EJERCICIOS: 1. De el nombre de los siguientes compuestos, con mínimo dos de los sistemas empleados No. 1 2 3 4 5 6 7 8 9 10 2. COMPUESTO BaO Na2O CoO MnO Mn2O3 NO NO2 CrO Cr2O3 CO TRADICIONAL STOCK Escriba las fórmulas de los compuestos que se dan a continuación: 3 ESTEQUIOMETRICA No. 1 2 3 4 5 6 7 8 9 10 NOMBRE óxido de cobre (II) óxido de dipotasio óxido estannoso óxido cobaltoso óxido áurico óxido de níquel (III) trióxido de difósforo óxido de cadmio trióxido de dinitrógeno heptaóxido de diyodo FÓRMULA 3. Escribir las fórmulas de los óxidos correspondientes a los siguientes metales y nombrarlos Li+, Ca+2, Al+3, Co+2, Co+3, Pb+2, Pb+4, Au+1, Au+3, Cr+3,Cr+6,Mn+4 4. Escribir las fórmulas de los óxidos correspondientes a los siguientes no-metales y nombrarlos C+2, C+4, N+3, N+4, N+5, S+4, S+6, Cl+7, I+5, Br+1 5. Dados los nombres de los siguientes compuestos, escribir su fórmula e indicar si se trata de óxidos ácidos (o no metálicos), óxidos básicos (o metálicos), oxácidos o hidrácidos: a) Pentaóxido de divanadio b) ácido bromhídrico c) ácido hipocloroso d) decaóxido de tetrafósforo e) trióxido de diarsénico f) óxido de niquel (III) g) ácido perbrómico h) dióxido de titanio 6. Nombrar los siguientes compuestos e indicar de qué tipo de sustancia se trata: a) K2O LiH b) FeO j) HgH2 c) Cr2O3 k) HI d) Cl2O e) N2O4 l) BaH2 m) BiH3 n) CaH2 7. Una con una línea la fila de la izquierda con el correspondiente de la derecha: CaH2 hidruro plúmbico FeH2 hidruro ferroso SnH4 trihidruro de fósforo PbH4 Borano BH3 hidruro cálcico PH3 hidruro estánnico 4 f) NH3 g) Cl2O3 ñ) RbH o) GeH4 h) Cl2O7 p) HI q) HF i)