FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS QUÍMICOS
Anuncio

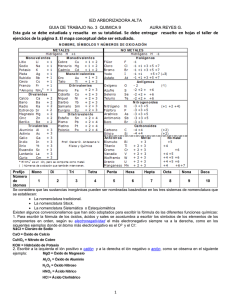
FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS QUÍMICOS MODELO SENCILLO DEL ATOMO electrones (‐) núcleo neutrones (0) protones (+) Un átomo neutro tiene igual número de p(+) que de e(-) Partículas subatómicas Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0 0 Protón ¿Cuál es el tamaño de un átomo? Volumen ocupado por electrones cargados negativamente. Aproximadamente 10‐10 m Protón (carga positiva) Neutrón (sin carga) Aproximadamente 10‐15 m 1Å =10‐10 m =10‐8 cm ¿Cuál es la masa de un átomo? Unidad de masa atómica uma = 1,67 x 10‐24 g Partícula Masa (g) Electrón 9.10939 10-28 Masa (uma) 5.486 x 10-4 Carga (Coulombs) Carga unitaria -1.6022 10-19 -1 +1 Protón 1.67262 10-24 1.0073 +1.6022 10-19 Neutrón 1.67493 10-24 1.0087 0 El núcleo concentra el 99,97 % de la masa 0 Número de protones presentes en el núcleo de un átomo. Define al elemento químico. Elemento: Z = nº p(+) Un átomo neutro tiene igual número de p(+) que de e (-). Número de protones más neutrones presentes en el núcleo de un átomo. Define la masa del elemento. A = nº p(+) + nº n(0) A=Z+N 12 6 C Número másico : A Número atómico: Z 14 6 12 6 C C Átomos de un mismo elemento con diferente número de neutrones en el núcleo. Tienen igual Z pero diferente A Núcleos de los isótopos del hidrógeno Hidrógeno Deuterio 1 protón 1 protón 1 neutrón Tritio 1 protón 2 neutrones 1 protón 1 neutrón 1 protón Isótopos del hidrógeno Hidrógeno 1 protón Helio 2 protones Litio 3 protones Ordenamiento de los elementos de acuerdo a su número atómico creciente Metales No metales METALES NO METALES Aspecto brillante Sin brillo Maleables y dúctiles Duros y quebradizos Buenos conductores del calor y electricidad Malos conductores del calor y la electricidad Forman óxidos iónicos y básicos Forman óxidos covalentes y ácidos Forman cationes en agua Forman oxoaniones en agua Semimetales Metales alcalinos Metales alcalinotérreos Halógenos Gases nobles Los elementos se unen entre sí para formar MOLÉCULAS. MOLÉCULA: Menor porción de sustancia que puede existir libre (conserva las propiedades de esa sustancia). Sustancia simple: formada por moléculas que contienen átomos un mismo elemento. Se presentan mediante el símbolo del elemento con un subíndice para indicar el número de átomos. Los gases nobles son monoatómicos: He, Xe, Rn, etc. Las moléculas de algunas sustancias que en condiciones de T y P ambiente se presentan en estado gaseoso: N2, H2, F2, O2, Cl2, etc. Los elementos que presentan estados alotrópicos (agrupación de distinto nro. de átomos): S8. Los metales se representan simplemente mediante el símbolo: Cu, Zn, Fe, Ag, etc. Los elementos se unen entre sí para formar MOLÉCULAS. MOLÉCULA: Menor porción de sustancia que puede existir libre (conserva las propiedades de esa sustancia). Compuesto: formado por moléculas que contienen átomos de elementos distintos. Ej.: HCl, H2O, Na2SO4, etc. Algunos compuestos están formados por IONES. CATIÓN: átomo con carga (+). IÓN: átomo con carga ANIÓN: átomo con carga (-). Metales alcalinos (+1) Metales alcalinotérreos (+2) Halógenos (‐1) NÚMERO DE OXIDACIÓN: carga asignada a un átomo que forma parte de una molécula. Reglas : 1.El número de oxidación de un elemento en una sustancia simple es CERO. Ej: Na, H2, O2, P4, etc. 2.El hidrógeno combinado con otros elementos generalmente tiene número de oxidación +1, excepto en los hidruros metálicos, en los que le corresponde el estado -1. 3.El oxígeno, cuando está combinado, por lo general tiene número de oxidación -2, excepto en los peróxidos, en los que le corresponde el estado -1. Reglas : 4.Los metales, cuando están combinados, siempre tienen número de oxidación positivos. 5.El número de oxidación de un ión monoatómico es igual a su carga. 6.La suma algebraica de los números de oxidación de los átomos de un compuesto es CERO. 7.La suma algebraica de los números de oxidación de un ión poliatómico es igual a la carga del ión. FORMULACIÓN Y NOMENCLATURA La parte más positiva se escribe primero, pero se nombra última FORMULACIÓN FÓRMULA MOLECULAR: Representación que indica los tipos de átomos y número de cada uno en una molécula. FORMULACIÓN DE COMPUESTOS BINARIOS En los compuestos formados solo por dos elementos, uno de los componentes actuará con estado de oxidación negativo y el otro lo hará con estado positivo, combinados en relación numérica tal que el compuesto sea neutro. Esto se indica en las fórmulas, colocando como subíndice de cada símbolo, el número de oxidación del otro elemento, escribiendo en primer término, el símbolo del que actúa con estado de oxidación positivo. FORMULACIÓN DE COMPUESTOS BINARIOS Escribir las fórmulas de los compuestos que forman los siguientes pares de elementos, cada uno actuando con el número de oxidación que se indica entre paréntesis. a) Hierro (+3) con azufre (‐2) b) Sodio (+1) con oxígeno (‐2) c) Cobre (+2) con azufre (‐2) d) Aluminio (+3) con nitrógeno (‐3) e) Cromo (+6) con oxígeno (‐2) f) Fósforo (+5) con cloro (‐1) Se utilizan prefijos numéricos griegos que indican el número de átomos de cada elemento presente en la molécula. Prefijo mono‐ di‐ tri‐ tetra‐ penta‐ hexa‐ hepta‐ octa‐ nona‐ deca‐ Nº de át. 1 2 3 4 5 6 7 8 9 10 Se utiliza el nombre genérico y al final, entre paréntesis se coloca el número de oxidación del elemento. Se agrega la terminación “oso” o “ico” al elemento según actúe con el menor o con el mayor estado de oxidación, respectivamente. Nro de oxidación FÓRMULA NOMBRE +1 +3 HClO HClO2 Ácido hipocloroso +5 HClO3 Ácido clórico +7 HClO4 Ácido perclórico Ácido cloroso NOMENCLATURA DE COMPUESTOS BINARIOS El elemento con estado de oxidación negativo se nombra primero aunque se coloca último en la fórmula del compuesto. En el caso de los compuestos binarios, se coloca la terminación “uro” al nombre del elemento. Excepto cuando se trata del oxígeno, en cuyo caso se indica como “óxido”. Luego se nombra el otro elemento colocando la preposición “de” entre ambos. EJERCICIO: nombrar los compuestos binarios formulados en el problema 1. Compuesto Sistemática Stock Tradicional Fe2S3 Trisulfuro de dihierro Sulfuro de hierro (III) Sulfuro férrico Na2O monóxido de disodio Óxido de sodio Óxido de sodio CuS Sulfuro de cobre Sulfuro de cobre (II) Sulfuro cúprico SnO2 Dióxido de estaño Óxido de estaño (IV) Óxido estánnico AlN Nitruro de aluminio Nitruro de aluminio (III) Nitruro de aluminio CrO3 Trióxido de cromo Óxido de cromo (VI) Óxido crómico PCl5 Pentacloruro de fósforo Cloruro de fósforo (V) Cloruro fosfórico Compuesto Sistemática Stock Tradicional K2O Óxido de potasio u óxido de dipotasio Óxido de potasio (I) Óxido potásico u u óxido de potasio óxido de potasio Fe2O3 trióxido de dihierro óxido de hierro (III) óxido férrico FeO monóxido de hierro óxido de hierro (II) óxido ferroso SnO2 dióxido de estaño óxido de estaño (IV) óxido estánnico Cl2O óxido de dicloro o monóxido de dicloro óxido de cloro (I) anhídrido hipocloroso SO3 trióxido de azufre óxido de azufre (VI) anhídrido sulfúrico Cl2O7 heptóxido de dicloro óxido de cloro (VII) anhídrido perclórico Los compuestos binarios donde el elemento electropositivo lo constituye el hidrógeno se nombran colocando la terminación “uro”, HBr bromuro de hidrógeno H2S sulfuro de hidrógeno HCl cloruro de hidrógeno HI yoduro de hidrógeno Cuando estos compuestos están en solución acuosa se comportan como “ácidos” por lo cual se nombra agregando la terminación “hídrico” al nombre del elemento electronegativo. SISTEMÁTICA HIDRÁCIDOS (en disolución acuosa) HF fluoruro de hidrógeno HF(aq) HCl cloruro hidrógeno HCl(aq) HBr bromuro de hidrógeno HBr(aq) HI yoduro de hidrógeno HI(aq) H2S sulfuro de hidrógeno H2S(aq) ácido fluorhídrico ácido clorhídrico ácido bromhídrico ácido yodhídrico ácido sulfídrico Los siguientes hidruros no metálicos (covalentes) poseen nombres propios que no se ajustan a ningún sistema de nomenclatura. NH3: amoníaco H2O: agua SiH4: silano AsH3: arsina B2H6: borano CH4: metano SbH3: estibina N2H4: hidrazina PH3: fosfina Son compuestos cuya porción negativa la constituye el ión OH‐ (oxidrilo o hidroxilo) el cual se combina con un catión metálico. Sistemática Stock Tradicional LiOH hidróxido de litio hidróxido de litio (I) o hidróxido de litio hidróxido de litio Pb (OH)2 dihidróxido de plomo hidróxido de plomo (II) hidróxido plumboso Al (OH)3 trihidróxido de aluminio hidróxido de aluminio (III) hidróxido de aluminio Compuesto Los oxácidos son compuestos formados por un elemento no metálico en estado de oxidación positivo, combinado con el oxígeno y el hidrógeno. En general, los elementos formadores de oxácidos poseen más de un estado de oxidación positivo, por lo cual la nomenclatura de estos compuestos debe indicar unívocamente de cuál se trata en cada caso. En el sistema de nomenclatura tradicional se escribe la palabra “ácido” seguido del nombre del elemento al que se le agrega la terminación “oso” o “ico” según actúe en su estado de oxidación inferior o superior. Nro de oxidación FÓRMULA NOMBRE +4 +6 H2SO3 H2SO4 Ácido sulfuroso +3 HNO2 Ácido nitroso +5 HNO3 Ácido nítrico Ácido sulfúrico Compuesto H2SO4 HClO4 H2SO2 Sistemática ácido tetraoxosulfúrico (VI) ácido tetraoxoclorato o tretraoxoclorato de hidrógeno ácido dioxosulfato o dioxosulfato de hidrógeno Stock Tradicional sulfato (VI) de hidrógeno ácido sulfúrico clorato (VII) de hidrógeno ácido perclórico sulfato (II) de hidrógeno ácido hiposulfuroso ANIONES PROVENIENTES DE LOS OXOÁCIDOS Se considera que el anión proviene de un ácido entonces se cambia la palabra “ácido” por ión y las terminaciones “oso”, “ico” e “hídrico” por ito, ato y uro, respectivamente. Si el anión contiene H se antepone la palabra hidrógeno, dihidrógeno, etc. ‐OSO ‐ICO ‐HÍDRICO ‐ITO ‐ATO ‐URO ANIONES PROVENIENTES DE LOS OXOÁCIDOS Compuesto Sistemática Tradicional SO4= tetraoxosulfato (VI) sulfato SO3= trioxosulfato (IV) sulfito ClO4- Tetraoxoclorato (VII) perclorato Las sales son el producto de la unión que se establece entre un catión (excepto el H+) y un anión (excepto el O2‐, HO‐ y H‐). Se nombra primero el anión y luego el catión, interponiendo la preposición “de”. En algunos casos el anión proveniente de un oxoácido puede contener uno o más hidrógenos. Las sales formadas por estos aniones hidrogenadas se denominan sales ácidas. Anteriormente, se las nombraba anteponiendo el prefijo “bi” al nombre del anión (‐HCO3, bicarbonato). Actualmente, se coloca la palabra “hidrógeno”antepuesta al nombre de la sal. SALES PROVENIENTES DE HIDRÁCIDOS Compuesto Sistemática Stock Tradicional CaF2 difluoruro de calcio fluoruro de calcio fluoruro cálcico FeCl3 tricloruro de hierro cloruro de hierro (III) cloruro férrico FeCl2 dicloruro de hierro cloruro de hierro (II) cloruro ferroso CoS monosulfuro de cobalto sulfuro de cobalto (II) sulfuro cobaltoso SALES PROVENIENTES DE OXOÁCIDOS Compuesto Sistemática Tradicional Na2SO3 Trioxosulfito (IV) de sodio Sulfito de sodio CuSO4 Tetraoxosulfato (IV) de cobre (II) Sulfato cúprico NaClO Monoxoclorato (I) de sodio hipoclorito de sodio NaClO3 Trioxoclorato (V) de sodio Clorato de sodio NaHSO4 hidrógeno tetraoxosulfato (VI) de sodio Hidrógeno sulfato de sodio KH2PO4 Dihidrógeno tetraoxofosfato (V) de potasio dihidrógeno fosfato de potasio Ca(HCO3)2 Hidrógeno trioxocarbonato(IV) de calcio Bicarbonato de calcio