FORMULACIÓN DE QUÍMICA INORGÁNICA BÁSICA
Anuncio

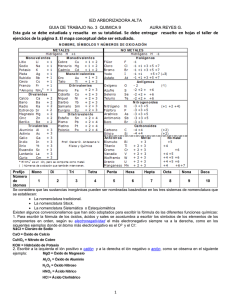
FORMULACIÓN DE QUÍMICA INORGÁNICA BÁSICA INTRODUCCIÓN La formulación y nomenclatura de los compuestos químicos está regida por una serie de normas establecidas por el organismo internacional denominado International Union of Pure and Applied Chemistry (IUPAC). Respecto a la formulación, los compuestos químicos se deben representar mediante una sola fórmula, en la que se incluirán los distintos átomos que forman el compuesto y la cantidad de cada uno, que se indicará con un número subíndice colocado después del símbolo del elemento químico correspondiente. En cuanto al nombre del compuesto, la IUPAC recomienda el uso de la nomenclatura sistemática aunque también considera válidas otras nomenclaturas. El uso de la nomenclatura tradicional (N.T.) se mantiene por su gran uso, sobre todo en ácidos y sales. La IUPAC admite también nombres comunes, por ejemplo amoníaco, agua…. SUFIJOS Y PREFIJOS EN LA N. T. La nomenclatura tradicional está basada en prefijos y sufijos relacionados con los estados de oxidación. Así: Elementos con un solo estado de oxidación Elementos con dos estados de oxidación Elementos con tres estados de oxidación Elementos con cuatro estados de oxidación Prefijos Ejemplo Nombre -ico Sodio sódico -ico (mayor e.o.) -oso (menor e.o.) -ico (mayor e.o.) -oso (siguiente) hipo- oso (menor) per- -ico (mayor) -ico (siguiente) -oso (siguiente) hipo- -oso (menor) Hierro Azufre Bromo férrico ferroso sulfúrico sulfuroso hiposulfuroso perbrómico brómico bromoso hipobromoso CLASIFICACIÓN DE LOS COMPUESTOS Los compuestos inorgánicos se agrupan en familias. Cada familia contiene uno, o un grupo de átomos, que da las propiedades físicas y químicas a sus componentes y de donde toman el nombre. Las familias principales son: Compuestos binarios 1.Óxidos. 2. Hidruros. 3.Ácidos hidrácidos 4. Sales derivadas de los ácidos hidrácidos Compuestos ternarios. 5. Hidróxidos o bases. 6. Ácidos oxácidos 7. Oxisales . 2 1. ÓXIDOS X2On Un óxido es un compuesto químico resultante de la combinación del oxígeno con cualquier otro elemento químico, del que recibe el nombre (en la n.t con los no metales se llamaban anhídridos; ahora no). La fórmula general de los óxidos es X2On siendo X el elemento que da nombre al óxido. Se intercambian las valencias y se ponen como subíndices. .Cuando n es un número par, la fórmula del óxido debe simplificarse Nomenclatura. La IUPAC admite nombres comunes para el agua, H2O. Agua oxigenada H2 O2 ; es un peróxido y no se simplifica. ÓXIDO FeO Fe2O3 CuO Na2O Cl2O Cl2O7 2. HIDRUROS IUPAC Monóxido de monohierro Trióxido de dihierro Monóxido de monocobre Óxido de sodio Monóxido de dicloro Heptaóxido de dicloro TRADICIONAL Óxido ferroso Óxido férrico Óxido cúprico Óxido sódico Óxido hipocloroso Óxido perclórico XHn Un hidruro resulta de la combinación del hidrógeno con cualquier otro elemento químico, del que recibe el nombre, excepto los que pertenecen a los grupos VIA y VIIA. La fórmula general de los hidruros es la siguiente: X Hn siendo X el elemento que da nombre al hidruro y n la valencia del elemento con el hidrógeno. Nomenclatura: Hidruro NaH BaH2 FeH2 FeH3 CuH CuH2 IUPAC Hidruro de sodio Hidruro de bario Dihidruro de hierro Trihidruro de hierro Monohidruro de cobre Dihidruro de cobre Hidruros con nombres comunes son: NH3 TRADICIONAL Hidruro sódico Hidruro bárico Hidruro ferroso Hidruro férrico Hidruro cuproso Hidruro cúprico amoníaco−trihidruro de nitrógeno;; PH3 fosfina −trihidruro de fósforo. 3.ÁCIDOS HIDRÁCIDOS Los ácidos hidrácidos son compuestos químicos resultantes de la combinación del hidrógeno con los elementos: flúor, cloro, bromo y iodo (con valencia 1) y azufre, selenio y teluro (valencia 2).La fórmula general de los ácidos hidrácidos es: HX o H2X No pueden ser considerados hidruros. ASUNCION CATALINA GÓMEZ-VALADÉS/COLEGIO N.SRA DEL CARMEN/CCNN 3 COMPUESTO H2S H2Se H2Te HF HCl HBr ÁCIDO Ácido sulfhídrico Ácido selenhídrico Ácido telurhídrico Ácido fluorhídrico Ácido clorhídrico Ácido bromhídrico SAL (HALURO) Sulfuro de hidrógeno Seleniuro de hidrógeno Telururo de hidrógeno Fluoruro de hidrógeno Cloruro de hidrógeno Bromuro de hidrógeno 4. SALES HIDRÁCIDAS Resultan de la sustitución de todos los hidrógenos del ácido hidrácido por un metal. La fórmula general de las sales hidrácidas es MeXn cuando X es halógeno y Me2Xn cuando X es del grupo VIA.Me es el metal que sustituye al hidrógeno del ácido y n es su subíndice. Se debe simplificar la fórmula si es posible. Nomenclatura COMPUESTO Na2S FeTe CaF2 NaCl KBr IUPAC Sulfuro de sodio Telururo de hierro Fluoruro de calcio Cloruro de sodio Bromuro de potasio TRADICIONAL Sulfuro sódico Telururo ferroso Fluoruro cálcico Cloruro sódico Bromuro potásico 5. HIDRÓXIDOS Los hidróxidos resultan de la combinación del grupo hidroxilo (OH−) con cualquier elemento metálico. El grupo hidroxilo presenta un estado de oxidación igual a 1−, yendo oxígeno siempre unido al hidrógeno, actuado como si de un solo elemento se tratase (este grupo hace la misma función que el hidrógeno en los hidruros). La fórmula general de los hidróxidos es la siguiente: Me(OH)n siendo n la valencia del metal Me.Cuando n es igual a 1 el grupo se puede escribir sin paréntesis: KOH. Nomenclatura: Hidróxido Fe(OH)2 Fe(OH)3 CuOH NaOH Ca(OH)2 IUPAC Dihidróxido de hierro Trihidróxido de hierro Monohidróxido de cobre Hidróxido de sodio Hidróxido de calcio TRADICIONAL Hidróxido ferroso Hidróxido férrico Hidróxido cúproso Hidróxido sódico Hidróxido cálcico 6. ÁCIDOS OXÁCIDOS Los ácidos oxácidos son compuestos cuya estructura está formada por hidrógeno, oxígeno y un elemento no metálico. Proceden de la reacción del óxido no metálico correspondiente con agua. Su fórmula general HaXOb pero es mejor que la deduzcas así: ÓXIDO NO METÁLICO (simplificado ya) + AGUA Ej ácido sulfúrico S2 O6 SO3 + H2 O ÁCIDO (y simplifica si se puede) H2 SO4 Los ácidos del fósforo son especiales porque se les puede añadir una, dos o tres moléculas de agua (con el prefijo meta, piro y orto respectivamente). ASUNCION CATALINA GÓMEZ-VALADÉS/COLEGIO N.SRA DEL CARMEN/CCNN 4 7. OXISALES Proceden de la sustitución de todos los átomos de hidrógeno del ácido por uno o más átomos de un elemento metálico. Se llaman sales neutras. Son Mea(XOb)c siendo X el no metal que da el nombre al ácido de procedencia, Me el metal que sustituye al hidrógeno. La fórmula tendrá que simplificarse si es posible. Si el ácido acaba en ICO-----------la sal acaba en ATO Si el ácido acaba en OSO---------la sal acaba en ITO Sal LiBrO3 Ni2(SO3)3 Ba(NO3)2 Fe2(SO4)3 Ni(ClO)2 Nomenclatura tradicional Bromato lítico Sulfito niquélico Nitrato bárico Sulfato férrico Hipoclorito niqueloso OBSERVACIÓN: para mayor agilidad en la formulación de estas sales es aconsejable que memorices algunos ácidos (nítrico, carbónico, sulfúrico, perclórico…..). ASUNCION CATALINA GÓMEZ-VALADÉS/COLEGIO N.SRA DEL CARMEN/CCNN