- Ninguna Categoria
Biomoléculas y solventes: Hoja de trabajo de Ciencias Naturales
Anuncio
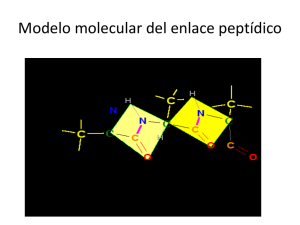
Tema Grado 11 ¿Qué otro solvente podría reemplazar al agua presente del mundo? Ciencias naturales Unidad 3 ¿Cómo se relacionan los componentes del mundo? Nombre: Curso: Las moléculas de la vida Todas las formas de vida estamos hechos de átomos, al igual de que una roca o un trozo de metal, ¿entonces cuál es la diferencia entre estos átomos y los de los seres vivos? La respuesta es simple y se divide en dos ramas de la química misma, la orgánica y la inorgánica. La química orgánica se basa en la química del carbono y como este interacciona con otros átomos y moléculas para formar compuestos más grandes y complejos; dentro de estos compuestos podemos reconocer un pequeño grupo llamado biomoléculas. Las biomoléculas son aquellas moléculas de las cuales estamos hechos todos los seres vivos, tiene particularidades y propiedades una de ellas y quizás de las más interesantes es que las biomoléculas solo se fabrican en organismos vivos pues es ahí donde tiene función. Sin embargo esto lleva a un dilema si se necesitan organismos vivos para que fabriquen biomoléculas, y los organismos vivos están hechos de estas ¿Cómo aparecieron en primer lugar? Figura 1. Recreación de un rayo cayendo en el océano primitivo Las biomoléculas están hechas en general de 5 elementos básicos: carbono, hidrogeno, oxigeno, nitrógeno y azufre, los cuales se sabe eran abundantes en la tierra primitiva o sea antes de que apareciera la vida. Durante muchos millones años el sol y los rayos sirvieron como catalizadores para que estos átomos reaccionaran entre sí formando moléculas al azar y estas a su vez reaccionan generando compuestos más complejos. Se cree que fue de este modo en que se originaron las primeras biomoléculas como los aminoácidos, los azucares y los lípidos, base fundamental de una célula primitiva. 1 ¿Qué otro solvente podría reemplazar al agua presente en las células? Actividad Introductoria Con base en lo anterior responde: 1. ¿Cuáles son las moléculas esenciales para la vida? 2. ¿Cómo se originaron? »» Analizar la complejidad en la estructura de las proteínas a partir de las propiedades fisicoquímicas del agua, la quiralidad de los átomos de carbono y las fuerzas de interacción intermolecular. Actividad 1: La vida en solución Como ya vimos la vida se originó mediante reacciones químicas hace millones de años, y es reacciones solos e pudieron dar gracias a que estos átomos estaba en solución o sea disueltos en agua, y es que agua es una molécula de características especiales. • • • • pH: 7 inodora, incolora, insípida. Densidad 1 g/mL Capacidad calórica 1cal/g.C° 2 ¿Qué otro solvente podría reemplazar al agua presente en las células? Además presenta enlaces covalentes lo que la hace neutra, sin embargo la electronegatividad diferencial de sus átomos, le da una carga parcial. (Figura 2) positiva hacia el polo de los hidrógenos y negativa hacia el polo del oxígeno. Esto hace que el agua sea capaz de interactuar con cualquier sustancia con carga o carga parcial. Figura 2. Molécula de agua mostrando las cargas parciales y el ángulo entre los hidrógenos. El agua fue capaz de interaccionar con las primeras biomoléculas entre ellas los aminoácidos que tienen la forma que se observa en la figura 3. Figura 3. Representaciones de un aminoácido El cual contiene dos grupos funcionales principales el amino NH2 y el carboxilo COOH, ambos en solución adquieren carga el amino NH3+ y el carboxilo COO- esto le permite a los aminoácidos por si solos ser disueltos en agua. Sin embargo aminoácidos hay varios 20 importantes para el ser humano (tabla 1) Nombre Alanina Contracción Imagen Ala 3 ¿Qué otro solvente podría reemplazar al agua presente en las células? Nombre Contracción Arginina Arg Asparagina Asn Ácido Aspártico Asp Cisteina Cys Glutamina Gln Imagen 4 ¿Qué otro solvente podría reemplazar al agua presente en las células? Nombre Contracción Acido glutámico Glu Glicina Gly Histidina His Isoleucina Ile Leucina Leu Imagen 5 ¿Qué otro solvente podría reemplazar al agua presente en las células? Nombre Contracción Lisina Lys Metionina Met Fenilalanina Phe Prolina Pro Serina Ser Imagen 6 ¿Qué otro solvente podría reemplazar al agua presente en las células? Nombre Contracción Treonina Trh Triptófano Trp Tirosina Tyr Valina Val Imagen Tabla 1: Lista de aminoácidos 7 ¿Qué otro solvente podría reemplazar al agua presente en las células? Ahora responde: a. Dibuja el radical sin el esqueleto de los siguientes aminoácidos: • • • Serina. Prolina. Tirosina. Radicales como: –OH (Hidroxilo) -COOH (Carboxilo) -NH〗_x (amino) -SH (Tiol) b. Dan carga parcial al amino acido, de acuerdo a esto nombra tres aminoácidos que por su cadena lateral sean solubles en agua. 1. 2. 3. c. Une con una flecha el nombre del aminoácido con su radical: • Leucina • Tirosina • Valina • Acido Glutámico • Fenilalanina • Alanina Actividad 2: Los péptidos Un polímero es una molécula de gran tamaño conformada por una molécula más pequeña o grupo de moléculas más pequeñas que se repiten indefinidamente, lo cual llamamos monómero, las proteínas son polímeros y sus monómeros son los aminoácidos, sin embargo existen “proteínas pequeñas” que llamamos péptidos. La diferencia entre proteína y péptido es la cantidad de residuos o aminoácidos que contiene se llama entonces: 8 ¿Qué otro solvente podría reemplazar al agua presente en las células? • • • Oligopéptido: de 2 a 10 aminoácidos. Polipéptido: entre 10 y 100 aminoácidos. Proteína: más de 100 aminoácidos. Los péptidos tiene una característica que los hace únicos, y es el enlace peptídico, el cual ocurre entre el grupo amino de un aminoácido y el carboxilo de otro. Figura 4. Formación del enalce peptidico En la figura 4 se observa como el –OH del carboxilo atrae el –H de del amonio, para convertirse en agua, luego los orbitales libres se atraen entre si y se une el carbono carboxílico con el nitrógeno para formar el enlace peptídico más agua. Dicho enlace tiene una geometría plana (figura 5) pues el carbono y el nitrógeno tienen una hibridación SP2 como se muestra en la figura 5. 9 ¿Qué otro solvente podría reemplazar al agua presente en las células? 116 ˚ 151 pm 133 pm 120,5 ˚ 123,5 ˚ 122 ˚ 124 pm 102 pm 146 pm Figura 5. A la izquierda ángulos de los enlaces en el enlace peptídico y distancia en pico metros, a la derecha geometría plana del enlace peptídico (gris: carbono, rojo: oxígeno, azul: nitrógeno, celeste: hidrogeno.) Además se tener esta hibridación el carbono carboxílico, el carbono alfa del aminoácidos es quiral, o asimétrico tal como aparece en la figura 6 Figura 6. Los dos isómeros ópticos del carbono asimétrico en los aminoácidos Esta asimetría forma isomería óptica así como vemos en la figura 6, el carbono de la derecha no se puede superponer al de la izquierda, por lo tanto son diferentes. Esto le puede conferir o quitar actividad biológica. Así pues el enlace se mantiene estable y esta estabilidad se mantiene gracias a que los electrones del doble enlace con el oxígeno están en resonancia con todo el enlace peptídico (figura 7) Figura 7. Movimiento electrónico del enlace peptídico. 10 ¿Qué otro solvente podría reemplazar al agua presente en las células? Ahora responde: 1. ¿Cuál es el Angulo de que tiene el Nitrógeno cuando forma el enlace peptídico?_______________________. 2. ¿Qué elementos reaccionan para formar el enlace? _________Y______________. 3. Y ¿qué se libera cuando se forma?___________________________. Recuerda un carbono asimétrico es aquel que todos sus sustituyentes son diferentes, de acuerdo a esto señala cuál de los carbonos en la siguiente molécula es asimétrico. Actividad 3: Las proteínas Como ya vimos una proteína es una secuencia de aminoácidos con más de 100 residuos, sin embargo para que estas proteínas tengan función o importancia biológica necesitan ser más que solo una cadena de moléculas, y este “algo más” se lo otorgan sus diferentes niveles estructurales. Estructura primaria Estructura secundaria Estructura terciaria Es la secuencia de aminoácidos de una proteína. Son plegamientos formados por la interacción de los puentes de hidrogeno en el enlace peptídico, existen dos tipos de plegamientos: las Hélices alfa y las láminas Beta. Se trata de toda la estructura tridimensional de la proteína, se ve afectada por la estructura primaria puesto que los aminoácidos hidrofóbicos se ubican en el interior de la proteína y los hidrofilicos en el exterior. Esta estructura define la actividad biológica de una proteína. 11 ¿Qué otro solvente podría reemplazar al agua presente en las células? Estructura cuaternaria Son proteínas que están compuestas por más de una sub-unidad o por más de una cadena de aminoácidos, presentan comportamientos complejos como el control alostérico. Tabla 2: Estructura de las proteínas Fuerzas intermoleculares: Como ya se mencionó el fenómeno responsable de la los plegamientos y las diferentes estructuras en las proteínas son las fuerzas intermoleculares como los puentes de hidrogeno y los puentes disulfuro (figura 8): Figura 8: formación de los puentes de hidrogeno (arriba) y los puentes disulfuro (abajo) El puente de hidrogeno se forma por una interacción no covalente entre un átomo muy electronegativo como lo es el oxigeno atrayendo a otro menos electronegativo como lo es el hidrogeno. El puente de disulfuro se forma cuando ambos azufres del grupo tiol en la cisteína se oxidan y se unen de manera covalente. Liberando hidrogeno Regulación alostérica: Se da principalmente en enzimas y es la regulación que se da a una proteína cuando una molécula se ubica en un sitio lejano al sitio catalítico y modifica la estructura de la proteína, lo cual puede aumentar o disminuir la afinidad por el sustrato 12 ¿Qué otro solvente podría reemplazar al agua presente en las células? Figura 9: forma gráfica de mostrar la regulación alosterica, en rojo el regulador alostérico, en amarillo la proteína o enzima y en naranja el sustrato de la enzima. Ahora responde: 1. ¿Cuál de los siguientes aminoácidos pueden formar puentes disulfuro? 2. Gracias a las Hélices alfa se forman por los puentes de hidrogeno. Une con una flecha una posible zona donde se formaría los puentes de hidrogeno (Val-Ser-Lys) 13 ¿Qué otro solvente podría reemplazar al agua presente en las células? 3. La hemoglobina es una proteína con 4 sub unidades, cada una de ellas tiene un grupo prostético (hemo) el cual atrapa el oxígeno, la primera sub unidad captura oxígeno, la siguiente sub unidad se vuelve más afín por la molécula. Así hasta que están saturadas las 4 sub unidades y la proteína pierde afinidad por el oxigeno. a. ¿Cómo se llama el fenómeno que vuelve mas afín a la hemoglobina por el oxígeno?______________________. b. ¿Qué nivel estructural tiene la hemoglobina?_________. c. ¿Qué ocurre cuando está saturada?_______________. Actividad 4: Obtención y eliminación Existen 20 aminoácidos vitales para el ser humano, los cuales podemos dividir en dos categorías los no esenciales y los esenciales (ver tabla 3), es un nombre confuso pero quiere decir que los esenciales son necesarios consumirlos en la dieta puesto que el organismo no los puede sintetizar, mientras los no esenciales son producidos por el organismo a partir de otras moléculas y por ello no es necesario su consumo directo. Escenciales No escenciales Alanina Arginina Valina Ácido Aspártatico Triptofano Cisteína Ácido glutámico Treonina Glutamina Fenilalanina Metionina Glicina Ornitina Lisina Prolina Leucina Isoleucina Tirosina Tabla 3: los 20 aminoácidos, divididos en los dos grupos dependiendo si es necesario o no consumirlos. 14 ¿Qué otro solvente podría reemplazar al agua presente en las células? Y ya que los aminoácidos son el monómero de las proteínas, la mejor forma de adquirir los aminoácidos esenciales es comiendo alimentos ricos en proteína (ver tabla 4): Alimento (100g) Soja Proteinas ( en g) 30 a 40 Alimento (100g) Proteinas ( en g) Pavo 19 Lentejas secas 24 Pollo sin hueso 20 Garbanzos 22 Bistec de ternera 19 Monchetas secas 21 Jamón serrano 21 Habas secas 23 Huevo 13 Guisantes secos 23 Bacalao fresco 17 Guisantes frescos 7 Bacalao seco 75 35 a 50 Merluza 17 Lomo de cerdo 19 Salmón 20 Codorniz y perdiz 24 Sardina 21 Conejo 22 Calamares 17 Levadura de cerveza Tabla 4: relación a 100g de alimento y la cantidad de proteína que se consume. De acuerdo a lo anterior responde: 1. 2. 3. 4. La Metionina es un aminoácido ________, y su consumo es_________. Las leguminosas tienen ________ contenido de proteína. El _______ es recomendado en la dieta sin embargo tiene alto contenido de colesterol. Los alimentos secos tienen_____ proteína que los frescos. Eliminación: o desnaturalización de las proteínas. Desnaturalización es cuando una molécula con actividad biológica pierde dicha actividad. En el caso de las proteínas es cuando pierde la estructura terciaria que es la que le da su actividad biológica, sin embargo una proteína desnaturalizada puede quedar solo con estructura primaria: 15 ¿Qué otro solvente podría reemplazar al agua presente en las células? Figura 10: diagrama de desnaturalización de una proteína Dicha desnaturalización se da cuando algo altera la interacción de la proteína con su solvente o sea el agua; dicha interaccion se puede alterar de muchas formas físicas o químicas: destro de las físicas esta cambios en la temperatura y dentro de las químicas están solutos como: el alcohol, la acetona, el cloruro de Guanidino, la urea y los detergentes. Por ejemplo observa la siguiente gráfica: Al aumentar la temperatura aumenta la cantidad de proteína desnaturalizada, el cambio es rápido como ver en los sectores de entre 40°C y 60°C. Ahora responde: 1. ¿Qué pasaría si sustituimos el agua de las células por otro solvente?__________________________. 2. Según la figura 10 ¿Qué puentes de interacción intermolecular se rompieron? __________________________. 16 ¿Qué otro solvente podría reemplazar al agua presente en las células? 3. De acuerdo a lo visto, ¿Qué sucede cuando cocinamos los alimentos?________________________. 4. ¿Cocinar los alimentos ayuda a la nutrición?_________________________________. 5. ¿El cuerpo humano necesita proteínas o aminoácidos?______________________________. Dibuja diez aminoácidos cinco esenciales y cinco no esenciales. Luego elabora un péptido de 15 aminoácidos mostrando el enlace peptídico. el péptido debe tener por lo menos dos cisteínas para elaborar un puente disulfuro. Consulta acerca de los siguientes temas. 1. ¿Por qué las personas que realizan levantamiento de pesas, toman suplementos proteicos? Y ¿por qué muchos de ellos son vegetarianos? 2. ¿Qué produce enfermedades como la Gota? Lista de referencias ASTURNATURADB, (2004 – 2015) AstroNatura. Rescatado de URL: http://www.asturnatura.com/ CESNUT NUTRICIÓN S.L. (©2007-2015) Consultoría nutricional: Barcelona España. Rescatado de URL: http:// cesnut.com/menusrestauracioncolectiva/dietasnutriciondieteticayalimentacion/ tablasdealimentosquetienen/alimentoscontienenproteinas/tabladealimentosricosenproteinas.html DAVID L. NELSON; (2007) Lehninger: Principios De Bioquimica, 5taEdición. Omega GONZALEZ J. (2015) Curso de Biomoléculas, Universidad del País Vasco: Trilonet. Rescatado de URL: http://www.ehu.eus/biomoleculas/peptidos/pep2.htm HERRÁEZ A. (2015) BIOMODEL. Universidad de Alcalá, Madrid España. Rescatado de URL: http://biomodel.uah.es 17 ¿Qué otro solvente podría reemplazar al agua presente en las células? Lista de imágenes Figura 1: Recreación de un rayo cayendo en el océano primitivo http://pixabay.com/static/uploads/ photo/2014/11/27/00/12/lightnings-547078_640.jpg Figura 2: molécula de agua mostrando las cargas parciales y el ángulo entre los hidrógenos. http://upload.wikimedia.org/wikipedia/commons/6/69/Watermolecule.png Figura 3: representaciones de un aminoácido http://upload.wikimedia.org/wikipedia/commons/7/74/ Alpha-amino-acid-general-2D.png Figura 4: formacion del enalce peptidico http://upload.wikimedia.org/wikipedia/commons/8/80/ EnlacePeptidico.jpg Figura 5: a la izquierda ángulos de los enlaces en el enlace peptídico y distancia en pico metros, a la derecha geometría plana del enlace peptídico (gris: carbono, rojo: oxígeno, azul: nitrógeno, celeste: hidrogeno.) http://upload.wikimedia.org/wikipedia/commons/c/cb/TransPeptide_Bond.png Figura 6: los dos isómeros ópticos del carbono asimétrico en los aminoácidos http://upload. wikimedia.org/wikipedia/commons/thumb/e/e8/Chirality_with_hands.svg/1280px-Chirality_ with_hands.svg.png Figura 7: los dos isómeros ópticos del carbono asimétrico en los aminoácidos http://www.ehu.eus/ biomoleculas/peptidos/jpg/resonance.gif Figura 8: formación de los puentes de hidrogeno (arriba) y los puentes disulfuro (abajo movimiento electrónico del enlace peptídico elaborada con el programa ACD Labs ChemBasic Figura 9: forma gráfica de mostrar la regulación alosterica, en rojo el regulador alostérico, en amarillo la proteína o enzima y en naranja el sustrato de la enzima http://upload.wikimedia. org/wikipedia/commons/thumb/4/47/Allosteric_Regulation.svg/320px-Allosteric_Regulation. svg.png 18 ¿Qué otro solvente podría reemplazar al agua presente en las células?
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados