Universidad Nacional Autonoma de Mexico UNAM
Access Provided by:
Williams Ginecología, 4e
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los
cordones sexuales
INTRODUCCIÓN
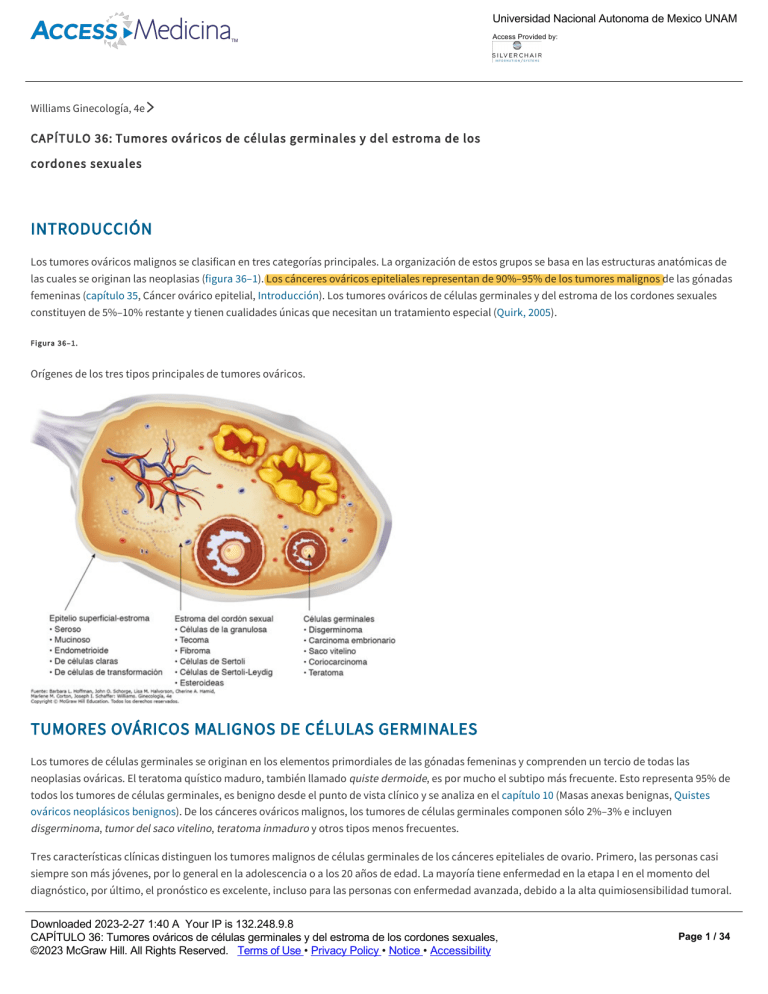
Los tumores ováricos malignos se clasifican en tres categorías principales. La organización de estos grupos se basa en las estructuras anatómicas de
las cuales se originan las neoplasias (figura 36–1). Los cánceres ováricos epiteliales representan de 90%–95% de los tumores malignos de las gónadas
femeninas (capítulo 35, Cáncer ovárico epitelial, Introducción). Los tumores ováricos de células germinales y del estroma de los cordones sexuales
constituyen de 5%–10% restante y tienen cualidades únicas que necesitan un tratamiento especial (Quirk, 2005).
Figura 36–1.
Orígenes de los tres tipos principales de tumores ováricos.
TUMORES OVÁRICOS MALIGNOS DE CÉLULAS GERMINALES
Los tumores de células germinales se originan en los elementos primordiales de las gónadas femeninas y comprenden un tercio de todas las
neoplasias ováricas. El teratoma quístico maduro, también llamado quiste dermoide, es por mucho el subtipo más frecuente. Esto representa 95% de
todos los tumores de células germinales, es benigno desde el punto de vista clínico y se analiza en el capítulo 10 (Masas anexas benignas, Quistes
ováricos neoplásicos benignos). De los cánceres ováricos malignos, los tumores de células germinales componen sólo 2%–3% e incluyen
disgerminoma, tumor del saco vitelino, teratoma inmaduro y otros tipos menos frecuentes.
Tres características clínicas distinguen los tumores malignos de células germinales de los cánceres epiteliales de ovario. Primero, las personas casi
siempre son más jóvenes, por lo general en la adolescencia o a los 20 años de edad. La mayoría tiene enfermedad en la etapa I en el momento del
diagnóstico, por último, el pronóstico es excelente, incluso para las personas con enfermedad avanzada, debido a la alta quimiosensibilidad tumoral.
La cirugía conservadora de la fertilidad es el tratamiento primario para las mujeres que buscan un embarazo futuro, aunque la mayoría requerirá
quimioterapia2023­2­27
después de
la intervención
Downloaded
1:40
A Your IP isquirúrgica.
132.248.9.8
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023
McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Epidemiología
Page 1 / 34
En Estados Unidos, la incidencia de los tumores ováricos malignos de células germinales, ajustada por edad, es mucho menor (0.4 por cada 100 000
disgerminoma, tumor del saco vitelino, teratoma inmaduro y otros tipos menos frecuentes.
Universidad Nacional Autonoma de Mexico UNAM
Provided de
by: ovario. Primero, las personas casi
Tres características clínicas distinguen los tumores malignos de células germinales de los cánceresAccess
epiteliales
siempre son más jóvenes, por lo general en la adolescencia o a los 20 años de edad. La mayoría tiene enfermedad en la etapa I en el momento del
diagnóstico, por último, el pronóstico es excelente, incluso para las personas con enfermedad avanzada, debido a la alta quimiosensibilidad tumoral.
La cirugía conservadora de la fertilidad es el tratamiento primario para las mujeres que buscan un embarazo futuro, aunque la mayoría requerirá
quimioterapia después de la intervención quirúrgica.
Epidemiología
En Estados Unidos, la incidencia de los tumores ováricos malignos de células germinales, ajustada por edad, es mucho menor (0.4 por cada 100 000
mujeres) que la de los carcinomas ováricos epiteliales (15.5) (Quirk, 2005). Smith y colaboradores (2006) analizaron 1262 casos de células germinales
ováricas malignas desde 1973 hasta 2002 y observaron que las tasas de incidencia habían disminuido 10% en los últimos 30 años. A diferencia de un
pequeño porcentaje de carcinomas ováricos epiteliales, los tumores de células germinales malignas no suelen considerarse hereditarios, aunque hay
informes de algunos casos familiares (Galani, 2005; Stettner, 1999).
Dichas tumoraciones son las neoplasias malignas ováricas que se diagnostican con mayor frecuencia en la infancia y la adolescencia, aunque sólo 1%
de todos los cánceres ováricos se desarrolla en estos grupos de pacientes. Sin embargo, a los 20 años de edad la incidencia de carcinoma ovárico
epitelial empieza a elevarse y rebasa a la de los tumores de células germinales (Young, 2003).
Diagnóstico
Cuadro clínico
Los signos y síntomas relacionados con estos tumores son diversos, pero en general la mayor parte se debe al crecimiento tumoral y a las hormonas
que la neoplasia produce. El síntoma inicial en 85% de las pacientes es el dolor abdominal subagudo, y refleja el crecimiento rápido de un tumor
unilateral grande cuya cápsula se distiende o experimenta hemorragia o necrosis. En 10% de los casos, la rotura de un quiste, su torsión o la presencia
de hemorragia intraperitoneal causan un cuadro abdominal agudo (Gershenson, 2007). En casos de enfermedad más avanzada puede ocurrir ascitis,
la cual es capaz de provocar distensión abdominal. Por los cambios hormonales que a menudo acompañan a estos tumores, la menstruación puede
tornarse abundante o irregular. Aunque la mayoría de las mujeres nota uno o más de estos síntomas, 25% permanece asintomático y se descubre una
masa pélvica inesperada durante la exploración física o un estudio ecográfico (Curtin, 1994).
Las pacientes casi siempre buscan atención en el mes siguiente al inicio de las molestias abdominales, aunque algunas notan un sutil ir y venir de los
síntomas durante más de un año. Son comunes los síntomas pélvicos inespecíficos durante la adolescencia por el inicio de la ovulación y por los
cólicos menstruales. Como consecuencia, pueden pasarse por alto los síntomas iniciales. Además, las mujeres jóvenes pueden guardar silencio con
respecto a los cambios en sus patrones normales debido a temor por su significado. La mayor parte de las mujeres jóvenes con estos tumores es
nuligesta y tiene menstruaciones normales, pero como se revisa más adelante, la disgenesia gonadal es un factor de riesgo conocido para el
desarrollo de tales neoplasias (Brown, 2014b). Por tanto, es necesario descartar disgenesia gonadal en adolescentes que presentan una masa pélvica y
menarca retrasada (capítulo 17, Amenorrea, Hipogonadismo hipergonadotrópico).
El hallazgo físico más frecuente durante la exploración pélvica es una masa palpable, sin embargo, en niñas y adolescentes es difícil realizar un
examen de este tipo o un estudio ecográfico transvaginal completo, lo cual a veces retrasa el diagnóstico. Por consiguiente, en ocasiones las pacientes
que aún no presentan la menarca requieren una exploración bajo anestesia para valorar en forma adecuada la sospecha de un tumor en los anexos. El
resto de la exploración física debe enfocarse a buscar signos de ascitis, derrame pleural y organomegalia.
Pruebas de laboratorio
En pacientes con sospecha de un tumor maligno de células germinales debe solicitarse la medición de los marcadores tumorales de gonadotropina
coriónica humana (hCG, human chorionic gonadotropin) sérica y α­fetoproteína (AFP), una biometría hemática completa y pruebas de función
hepática antes del tratamiento. Una alternativa es cuantificar la concentración del marcador tumoral apropiado en el quirófano si el diagnóstico no se
sospechó antes (cuadro 36–1). La identificación preoperatoria del cariotipo en mujeres jóvenes con amenorrea primaria y sospecha de tumor de
células germinales permite aclarar si deben extirparse ambos ovarios, como en el caso de aquéllas con disgenesia gonadal (Hoepffner, 2005).
Cuadro 36–1.
Marcadores tumorales séricos en tumores ováricos malignos de células germinales.
Histología
α­fetoproteína (AFP)
Gonadotropina coriónica humana (hCG)
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
CAPÍTULO
36: Tumores ováricos de células germinales y del estroma
de los cordones sexuales,
Disgerminoma
−
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Tumor del saco vitelino
+
±
−
Page 2 / 34
coriónica humana (hCG, human chorionic gonadotropin) sérica y α­fetoproteína (AFP), una biometría hemática completa y pruebas de función
Universidad Nacional Autonoma de Mexico UNAM
hepática antes del tratamiento. Una alternativa es cuantificar la concentración del marcador tumoral apropiado en el quirófano si el diagnóstico no se
Access Provided by:
sospechó antes (cuadro 36–1). La identificación preoperatoria del cariotipo en mujeres jóvenes con amenorrea primaria y sospecha de tumor de
células germinales permite aclarar si deben extirparse ambos ovarios, como en el caso de aquéllas con disgenesia gonadal (Hoepffner, 2005).
Cuadro 36–1.
Marcadores tumorales séricos en tumores ováricos malignos de células germinales.
Histología
α­fetoproteína (AFP)
Gonadotropina coriónica humana (hCG)
Disgerminoma
−
±
Tumor del saco vitelino
+
−
Teratoma inmaduro
±
−
Coriocarcinoma
−
+
Carcinoma embrionario
+
+
Tumor mixto de células germinales
±
±
Poliembrioma
±
±
Imágenes
En la mayoría de los casos, la ecografía puede mostrar de manera adecuada las cualidades que casi siempre caracterizan las masas ováricas benignas y
malignas (cuadro 10–2). Los quistes ováricos funcionales son mucho más frecuentes en mujeres jóvenes. Una vez que estos quistes hipoecoicos,
pequeños y de paredes lisas se identifican por vía ecográfica, es posible observarlos. Los teratomas quísticos maduros suelen presentar rasgos
característicos cuando se obtienen las imágenes (capítulo 10, Masas anexas benignas, Teratoma ovárico). En cambio, la apariencia de los tumores
malignos de células germinales difiere; es típico encontrar una masa ovárica compleja multilobulada (figura 36–2). Además, es posible observar flujo
sanguíneo prominente dentro de los tabiques fibrovasculares con la ecografía Doppler de flujo a color, lo cual sugiere malignidad (Kim, 1995). Con
base en la sospecha clínica, a veces se justifica realizar una tomografía computarizada o una imagen por resonancia magnética antes de la cirugía.
Según el diagnóstico, se realiza una radiografía torácica en busca de metástasis tumorales en los pulmones y el mediastino.
Figura 36–2.
Imagen por tomografía computarizada de un disgerminoma grande (asterisco). B, vejiga; U, útero.
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Procedimientos diagnósticos
Page 3 / 34
Según el diagnóstico, se realiza una radiografía torácica en busca de metástasis tumorales en los pulmones y el mediastino.
Universidad Nacional Autonoma de Mexico UNAM
Figura 36–2.
Access Provided by:
Imagen por tomografía computarizada de un disgerminoma grande (asterisco). B, vejiga; U, útero.
Procedimientos diagnósticos
Es necesaria la resección quirúrgica para establecer el diagnóstico histológico definitivo, la estadificación y el tratamiento. El cirujano debe solicitar la
valoración de un corte congelado para confirmar el diagnóstico, pero son frecuentes las discrepancias entre la interpretación de éste y de las
imágenes histológicas de los cortes finales incluidos en parafina (Kusamura, 2000). Además, a menudo es necesario emplear la tinción específica con
anticuerpos para resolver casos dudosos; por el contrario, la biopsia percutánea guiada por ecografía o por tomografía computarizada tiene
participación muy limitada en el tratamiento de mujeres seleccionadas con masas ováricas que hacen sospechar de malignidad.
Participación del médico general
La mayoría de las pacientes es atendida primero por médicos generales. Los síntomas iniciales en ocasiones sugieren un quiste ovárico funcional, que
es frecuente, sin embargo, las molestias persistentes o una masa pélvica creciente obligan a realizar un estudio ecográfico. Si se encuentra una masa
ovárica compleja con rasgos sólidos en este grupo de mujeres de menor edad, debe valorarse la concentración sérica de hCG y α­fetoproteína, además
de ser preferible enviar a las pacientes con un ginecólogo oncólogo para el tratamiento quirúrgico primario.
Cuando no se cuenta con un especialista, o el diagnóstico no se anticipa, las decisiones intraoperatorias son cruciales para que el tratamiento sea
adecuado y no se comprometa la fertilidad futura. Se realizan lavados peritoneales y el líquido se deja aparte antes de proceder con la disección de
cualquier tumoración sospechosa en los anexos. El fluido puede desecharse después si se descarta la malignidad. En principio, la decisión de realizar
una cistectomía o una ooforectomía depende de las circunstancias clínicas (capítulo 10, Masas anexas benignas, Tratamiento). En general, todo el
anexo debe extirparse una vez que se diagnostica un tumor ovárico maligno de células germinales. El ginecólogo general debe solicitar asistencia
transoperatoria de un oncólogo ginecólogo para la estadificación o derivar a la paciente después de la intervención quirúrgica si no hay un
especialista disponible de inmediato. Como mínimo, se inspecciona todo el abdomen y la pelvis, con una valoración especial del epiplón y el ovario
contralateral.
Patología
Clasificación e histogénesis
La clasificación modificada de la Organización Mundial de la Salud para los tumores ováricos de células germinales se presenta en el cuadro 36–2
(Kurman, 2014). Dichas neoplasias están compuestas por varios tipos tumorales histológicos distintos derivados de células germinales primordiales
de las gónadas embrionarias. Las dos categorías principales incluyen los tumores malignos primitivos de células germinales (disgerminomas) y los
teratomas, de los cuales casi todos son teratomas quísticos maduros.
Cuadro 36–2.2023­2­27 1:40 A Your IP is 132.248.9.8
Downloaded
CAPÍTULO
36: modificada
Tumores ováricos
de células germinales
delSalud
estroma
detumores
los cordones
sexuales,
Clasificación
de la Organización
Mundial dey la
de los
ováricos
de células germinales.
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Tumores de células germinales
Page 4 / 34
La clasificación modificada de la Organización Mundial de la Salud para los tumores ováricos de células
germinales
se presenta
en el de
cuadro
36–2
Universidad
Nacional
Autonoma
Mexico
UNAM
(Kurman, 2014). Dichas neoplasias están compuestas por varios tipos tumorales histológicos distintos
derivados de células germinales primordiales
Access Provided by:
de las gónadas embrionarias. Las dos categorías principales incluyen los tumores malignos primitivos de células germinales (disgerminomas) y los
teratomas, de los cuales casi todos son teratomas quísticos maduros.
Cuadro 36–2.
Clasificación modificada de la Organización Mundial de la Salud de los tumores ováricos de células germinales.
Tumores de células germinales
Disgerminoma
Tumores del saco vitelino (tumor del seno endodérmico)
Carcinoma embrionario
Coriocarcinoma no gestacional
Teratoma maduro
Sólido
Quístico (quiste dermoide)
Teratoma inmaduro
Tumor mixto de células germinales
Teratoma monodérmico y tipos altamente especializados que se originan de teratoma quístico maduro
Tumores tiroideos (estroma ovárico: benigno o maligno)
Carcinoide
Tumores neuroectodérmicos
Carcinomas (adenocarcinomas o epidermoides)
Tumores sebáceos
Durante la embriogénesis, las células germinales primitivas migran de la pared del saco vitelino a la cresta gonadal (figura 19–1). Como resultado, la
mayor parte de los tumores de células germinales se origina en la gónada. En casos raros, dichas tumoraciones pueden desarrollarse en sitios ajenos
a las gónadas, como el sistema nervioso central, el mediastino o la región retroperitoneal (Hsu, 2002).
Los tumores ováricos de células germinales tienen un patrón de diferenciación variable (figura 36–3). Los disgerminomas son neoplasias primitivas
que no tienen potencial para diferenciación adicional. Los carcinomas embrionarios están formados por células multipotenciales capaces de
diferenciarse aún más. Dichas lesiones son precursoras de varios tipos adicionales de tumores de células germinales extraembrionarios (neoplasias
del saco vitelino y coriocarcinomas) o embrionarios (teratomas). El proceso de diferenciación es dinámico y las tumoraciones resultantes pueden
estar formadas por distintos elementos en varias etapas de desarrollo (Teilum, 1965).
Figura 36–3.
Vía de diferenciación de los tumores de células germinales malignos.
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Page 5 / 34
estar formadas por distintos elementos en varias etapas de desarrollo (Teilum, 1965).
Universidad Nacional Autonoma de Mexico UNAM
Figura 36–3.
Access Provided by:
Vía de diferenciación de los tumores de células germinales malignos.
Disgerminoma
Debido a que su incidencia ha disminuido en casi 30% en las últimas décadas, hoy en día los disgerminomas sólo representan cerca de un tercio de
todos los tumores ováricos malignos de células germinales (Chan, 2008; Smith, 2006). De las neoplasias de esta categoría, los disgerminomas son los
que se detectan con mayor frecuencia durante el embarazo. Se cree que es una coincidencia relacionada con la edad y no se debe a la gestación.
Un 5% de los disgerminomas se descubre en pacientes con fenotipo femenino y con anomalías cariotípicas en las gónadas, en particular con un
cromosoma Y normal o anormal (Morimura, 1998). A menudo este grupo incluye a pacientes con mosaicismo del síndrome de Turner (45,X/46,XY), y
con síndrome de Swyer (46,XY, disgenesia gonadal pura) (capítulo 19, Trastornos anatómicos, Anomalías del desarrollo sexual). Las gónadas
disgenésicas de estas personas a menudo contienen gonadoblastomas, que son neoplasias benignas de células germinales. Dichos tumores pueden
degenerarse o sufrir transformación maligna, casi siempre a disgerminomas. Como alrededor de 40% de los gonadoblastomas en dichas pacientes
sufre transformación maligna, se extirpan ambos ovarios (Brown, 2014b; Hoepffner, 2005; Pena­Alonso, 2005).
Los disgerminomas son los únicos tumores malignos de células germinales con un índice significativo de compromiso ovárico bilateral, de 15%–20%.
La mitad de las pacientes con lesiones en ambos lados tiene compromiso macroscópico, mientras que en el otro 50% sólo se detecta el cáncer
mediante microscopia. En 5% de las mujeres se observan concentraciones altas de hCG producidas por la presencia de sincitiotrofoblastos
intercalados. De manera similar, la deshidrogenasa láctica (LDH, lactate dehydrogenase) sérica y las isoenzimas LDH­1 y LDH­2 pueden ser útiles para
la vigilancia de pacientes con recurrencia de la enfermedad (Pressley, 1992; Schwartz, 1988).
Los disgerminomas varían, pero en general se muestran como masas sólidas, lobuladas y de color rosa, bronceado o crema (figura 36–4). Como se
observa en la misma imagen, las células tumorales se parecen mucho a las células germinales primordiales embrionarias y en el estudio histológico
son idénticas a las de los seminomas testiculares.
Figura 36–4.
Disgerminoma. A . Fotografía durante la cirugía. B . Desde el punto de vista microscópico, el disgerminoma se caracteriza por una proliferación
relativamente monótona de células claras poliédricas grandes, redondeadas y ricas en glucógeno citoplásmico. Éstas contienen núcleos centrales
redondeados o de bordes cuadrados uniformes con uno o algunos nucleolos prominentes. Como en este caso, el tumor a menudo contiene tabiques
fibrosos, que se observan aquí como hebras eosinofílicas; dichos tabiques están infiltrados por células inflamatorias crónicas que incluyen linfocitos,
macrófagos y en ocasiones células plasmáticas. (Reproducida con autorización de Dr. Kelley Carrick).
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Page 6 / 34
relativamente monótona de células claras poliédricas grandes, redondeadas y ricas en glucógeno citoplásmico. Éstas contienen núcleos centrales
Universidad Nacional Autonoma de Mexico UNAM
redondeados o de bordes cuadrados uniformes con uno o algunos nucleolos prominentes. Como en este caso, el tumor a menudo contiene tabiques
Access Provided by:
fibrosos, que se observan aquí como hebras eosinofílicas; dichos tabiques están infiltrados por células inflamatorias crónicas que incluyen linfocitos,
macrófagos y en ocasiones células plasmáticas. (Reproducida con autorización de Dr. Kelley Carrick).
El tratamiento estándar de los disgerminomas casi siempre incluye un procedimiento quirúrgico que conserva la fertilidad con salpingooforectomía
unilateral (USO, unilateral salpingo­ooforectomy). En algunas circunstancias atenuantes puede considerarse la cistectomía ovárica (Vicus, 2010). La
estadificación quirúrgica casi siempre se extrapola del cáncer ovárico epitelial (cuadro 35–7), pero la linfadenectomía tiene gran importancia. De los
tumores malignos de células germinales, el disgerminoma tiene la tasa más alta de metástasis ganglionares, de aproximadamente 25%–30% (Kumar,
2008). Aunque las desviaciones de la estadificación no afectan la supervivencia, determinar de manera precisa la fase de la enfermedad permite aplicar
una estrategia de observación segura para los tumores en etapa IA (Billmire, 2004; Palenzuela, 2008).
La conservación del ovario contralateral da lugar a un disgerminoma “recurrente” en 5%–10% de las gónadas conservadas durante los dos años
siguientes. En muchos casos, este hallazgo se considera reflejo de la tasa elevada de enfermedad oculta en el ovario remanente, más que una
recurrencia verdadera. En realidad, al menos 75% de las recurrencias se desarrolla en el primer año del diagnóstico (Vicus, 2010). Otros sitios
frecuentes de reincidencia son la cavidad peritoneal y los ganglios linfáticos retroperitoneales. A pesar de esta recurrencia significativa, una técnica
quirúrgica conservadora no afecta la supervivencia a largo plazo por la sensibilidad de este tipo de cáncer a la quimioterapia (Liu, 2013).
Los disgerminomas tienen el mejor pronóstico de todas las variantes de tumores ováricos malignos de células germinales. Dos tercios se encuentran
en etapa I al momento del diagnóstico y la supervivencia a cinco años específica para dicha patología se aproxima a 99% (cuadro 36–3). Incluso en la
enfermedad avanzada, las tasas de supervivencia son altas después de la quimioterapia; por ejemplo, aquellas pacientes con enfermedad en etapas II
a IV tienen una tasa de supervivencia mayor de 98% con medicamentos basados en platino (Chan, 2008). Como resultado, el carboplatino quizá sea
preferible al cisplatino en estas pacientes debido a resultados equivalentes con una toxicidad reducida a largo plazo (Shah, 2018; Skalleberg, 2017).
Cuadro 36–3.
Supervivencia de pacientes con tumores ováricos malignos de células germinales frecuentes según la etapa en el momento del diagnóstico y
a cinco años.
Disgerminoma
Tumor del saco vitelino
Teratoma inmaduro
Etapa
I
66%
50%
72%
II­IV
34%
50%
28%
Etapa I
99%
95%
98%
Etapas II­IV
>98%
52%–97%
73%–88%
Supervivencia
Las fuentes de las cifras de supervivencia se citan en el texto.
Tumores del saco vitelino
Downloaded
1:40 A representan
Your IP is 132.248.9.8
Las neoplasias2023­2­27
del saco vitelino
de 10%–20% de todos los tumores ováricos malignos de células germinales. Antes, dichas lesiones se
Page 7 / 34
CAPÍTULO
36:
Tumores
ováricos
de células
estroma
de los cordones
sexuales,
llamaban tumores del seno endodérmico
, perogerminales
hace poco ysedel
revisó
la terminología.
Un tercio
de las pacientes aún no llega a la menarca en el
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
momento de la consulta. El compromiso de ambas gónadas es raro y el otro ovario casi siempre se invade sólo cuando se encuentran otras metástasis
en la cavidad peritoneal.
Las fuentes de las cifras de supervivencia se citan en el texto.
Universidad Nacional Autonoma de Mexico UNAM
Access Provided by:
Tumores del saco vitelino
Las neoplasias del saco vitelino representan de 10%–20% de todos los tumores ováricos malignos de células germinales. Antes, dichas lesiones se
llamaban tumores del seno endodérmico, pero hace poco se revisó la terminología. Un tercio de las pacientes aún no llega a la menarca en el
momento de la consulta. El compromiso de ambas gónadas es raro y el otro ovario casi siempre se invade sólo cuando se encuentran otras metástasis
en la cavidad peritoneal.
A simple vista, tales tumores forman masas sólidas más amarillas y friables que los disgerminomas. A menudo presentan necrosis y hemorragia focal,
con degeneración quística y rotura. La apariencia microscópica de los tumores del saco vitelino suele ser diversa. El aspecto más frecuente, el patrón
reticular, refleja la diferenciación extraembrionaria con formación de una red de espacios irregulares recubiertos por células epiteliales primitivas.
Los cuerpos de Schiller­Duval son patognomónicos cuando existen (figura 36–5), por lo general, tienen una papila única recubierta por células
tumorales, que contiene un vaso central. Dichos tumores a menudo producen α­fetoproteína; como resultado casi siempre contienen células reactivas
a la tinción inmunitaria dirigida a dicha proteína. Las concentraciones séricas representan un marcador tumoral confiable en la vigilancia posterior al
tratamiento.
Figura 36–5.
Cuerpo de Schiller­Duval. Dicha estructura consiste en un capilar central rodeado por células tumorales, presentes dentro de un espacio quístico que
puede estar recubierto por células tumorales planas o cuboides. Cuando existe, el cuerpo de Schiller­Duval es patognomónico de un tumor del saco
vitelino, aunque son conspicuos sólo en pocos casos. Los cuerpos de Schiller­Duval en ocasiones se encuentran en números pequeños, están
ausentes o tienen rasgos morfológicos atípicos. (Reproducida con autorización de Dr. Kelley Carrick).
Los tumores del saco vitelino son el tipo más mortal de las neoplasias ováricas malignas de células germinales. Como resultado, todas las pacientes
reciben quimioterapia, cualquiera que sea la etapa de la enfermedad. Por fortuna, más de la mitad presenta enfermedad en etapa I, que se asocia con
una tasa de supervivencia general a cinco años de alrededor de 95% (Nasioudis, 2017); por desgracia, los tumores del saco vitelino tienen mayor
propensión a un crecimiento rápido, diseminación peritoneal y diseminación hematógena distante a los pulmones. Como consecuencia, las personas
con enfermedad en etapas III a IV tienen una tasa de supervivencia a cinco años que varía de 52%–97%. De las pacientes con recurrencia tumoral, la
mayoría lo padecerá dentro del primer año y el tratamiento casi nunca es eficaz (Cicin, 2009).
Otros tumores primitivos de células germinales
Los subtipos más raros de tumores que no son disgerminomas casi siempre están mezclados con otras variantes más frecuentes y no suelen
encontrarse en forma pura.
Con el carcinoma embrionario es característico que las pacientes sean más jóvenes, con una edad promedio de 14 años, en comparación con aquellas
que tienen otro tumor de células germinales. Dichas neoplasias se forman de células epiteliales parecidas a las del disco embrionario. Son distintivas
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
las
hojas sólidas
desorganizadas
dede
grandes
anaplásicas,
espaciosdesemejantes
a lossexuales,
glandulares y estructuras capilares. Dichas características
Page 8 / 34
CAPÍTULO
36: Tumores
ováricos
célulascélulas
germinales
y del estroma
los cordones
permiten
la fácil identificación
estos tumores
raros
(Ulbright,
2005).
Aunque
los disgerminomas
©2023
McGraw
Hill. All Rightsde
Reserved.
Terms
of Use
• Privacy
Policy
• Notice
• Accessibility son los tumores de células germinales más
frecuentes derivados de la transformación maligna de los gonadoblastomas en mujeres con disgenesia gonadal, a veces también pueden formarse
tumores embrionarios “testiculares” (LaPolla, 1990). Los carcinomas embrionarios casi siempre producen hCG; 75% también secreta α­fetoproteína.
Otros tumores primitivos de células germinales
Universidad Nacional Autonoma de Mexico UNAM
Los subtipos más raros de tumores que no son disgerminomas casi siempre están mezclados con otras variantes más frecuentes y no suelen
Access Provided by:
encontrarse en forma pura.
Con el carcinoma embrionario es característico que las pacientes sean más jóvenes, con una edad promedio de 14 años, en comparación con aquellas
que tienen otro tumor de células germinales. Dichas neoplasias se forman de células epiteliales parecidas a las del disco embrionario. Son distintivas
las hojas sólidas desorganizadas de grandes células anaplásicas, espacios semejantes a los glandulares y estructuras capilares. Dichas características
permiten la fácil identificación de estos tumores raros (Ulbright, 2005). Aunque los disgerminomas son los tumores de células germinales más
frecuentes derivados de la transformación maligna de los gonadoblastomas en mujeres con disgenesia gonadal, a veces también pueden formarse
tumores embrionarios “testiculares” (LaPolla, 1990). Los carcinomas embrionarios casi siempre producen hCG; 75% también secreta α­fetoproteína.
Con el poliembrioma los tumores, de manera característica, contienen muchos cuerpos semejantes a un embrión. Cada uno tiene un pequeño “disco
germinal” central situado entre dos cavidades; uno simula la cavidad amniótica y el otro un saco vitelino. Es frecuente encontrar células gigantes
sincitiotrofoblásticas, sin embargo, para que pueda usarse la designación de poliembrioma, los elementos distintos a los cuerpos embrioides deben
constituir menos de 10% del tumor. Por concepto, estas neoplasias pueden considerarse un puente entre los tipos primitivos (disgerminoma) y los
diferenciados (teratoma) de los tumores de células germinales; por tal razón, los poliembriomas a menudo se consideran los teratomas más
inmaduros (Ulbright, 2005). Es posible que se encuentren elevadas las concentraciones séricas de α­fetoproteína o de hCG en estas pacientes, debido
a los componentes de saco vitelino y sincitio, respectivamente (Takemori, 1998).
El coriocarcinoma ovárico primario originado de una célula germinal es similar a un coriocarcinoma gestacional con metástasis ováricas (capítulo 37,
Enfermedad trofoblástica gestacional, Coriocarcinoma gestacional). Es importante hacer esta diferenciación porque los tumores no gestacionales
tienen peor pronóstico (Corakci, 2005). La detección de otros componentes de células germinales indica la presencia de un coriocarcinoma no
gestacional, mientras que un embarazo concomitante o próximo sugiere una forma gestacional (Ulbright, 2005). Las manifestaciones clínicas son
frecuentes y se deben a concentraciones altas de hCG, producida por estas neoplasias poco frecuentes. Tales concentraciones elevadas pueden
inducir precocidad sexual en niñas prepúberes o sangrado menstrual abundante e irregular en mujeres en edad reproductiva (Oliva, 1993).
Tumores mixtos de células germinales
Los tumores ováricos de células germinales tienen un patrón mixto de diferenciación celular en 25%–30% de los casos, aunque su incidencia también
ha disminuido en alrededor de 30% en las décadas pasadas (Smith, 2006). El disgerminoma es el componente más frecuente y casi siempre se
encuentra con tumor del saco vitelino, un teratoma inmaduro, o ambos. La frecuencia de compromiso ovárico bilateral depende de la presencia o la
ausencia de un componente de disgerminoma, y aumenta cuando éste existe; sin embargo, el tratamiento y el pronóstico dependen del componente
no germinomatoso (Low, 2000). En consecuencia, las concentraciones séricas altas de hCG, y en especial las de α­fetoproteína en una mujer con
supuesto disgerminoma puro, obligan a buscar otros componentes de células germinales con un estudio histológico más extenso (Aoki, 2003).
Teratomas inmaduros
Debido a un aumento de 60% en la incidencia en los últimos decenios, ahora los teratomas inmaduros son la variante más frecuente y representan de
40%–50% de todos los tumores ováricos malignos de células germinales (Chan, 2008; Smith, 2006). Están formados por tejidos que derivan de las tres
capas germinales: ectodermo, mesodermo y endodermo. Sin embargo, la presencia de estructuras inmaduras o embrionarias distingue a estas
lesiones de los teratomas quísticos maduros benignos (quistes dermoides), que son mucho más frecuentes. El compromiso ovárico bilateral es raro,
pero 10% de las pacientes tiene un teratoma maduro en el otro ovario. Los marcadores tumorales a menudo son negativos, a menos que el teratoma
inmaduro esté mezclado con otros tipos tumorales de células germinales. La α­fetoproteína, el antígeno canceroso 125 (CA125, cancer antigen 125), el
CA19­9 y el antígeno carcinoembrionario (CEA, carcinoembryonic antigen) pueden ser útiles en algunos casos (Li, 2002).
Con la inspección a simple vista, tales tumores se ven como grandes masas redondeadas o lobuladas, blandas o firmes. A menudo perforan la cápsula
ovárica y causan invasión local. El sitio de diseminación más frecuente es el peritoneo, y con mucho menor frecuencia los ganglios linfáticos
retroperitoneales. Con la intrusión local a menudo se forman adherencias alrededor, las cuales se cree que explican los índices bajos de torsión en
dichos tumores, en comparación con su contraparte madura benigna (Cass, 2001). En la superficie de corte, el interior casi siempre es sólido, con
áreas quísticas intermitentes, pero a veces se encuentra lo contrario, con nódulos sólidos presentes sólo en la pared del quiste (figura 36–6). Las
partes sólidas pueden corresponder a elementos inmaduros, cartílago, hueso o una combinación de éstos; por otra parte, las áreas quísticas están
llenas de líquido seroso, mucinoso o sebo.
Figura 36–6.
Teratoma inmaduro. A . Esta pieza quirúrgica abierta muestra la estructura característica, sólida y quística. Al igual que en los teratomas maduros, a
menudo se encuentran pelo y otros elementos cutáneos. B . Los teratomas inmaduros contienen una mezcla desordenada de tejidos maduros e
Downloaded
2023­2­27
1:40
A capas
Your IP
132.248.9.8
inmaduros derivados
de las
tres
deiscélulas
germinales (ectodermo, mesodermo y endodermo). De los elementos inmaduros, el neuroepitelio
Page 9 / 34
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
inmaduro es el más frecuente. En esta imagen, las células neuroepiteliales inmaduras están dispuestas en rosetas que yacen en el fondo de tejido
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
neural maduro. (Reproducida con autorización de Dr. Kelley Carrick).
llenas de líquido seroso, mucinoso o sebo.
Figura 36–6.
Universidad Nacional Autonoma de Mexico UNAM
Access Provided by:
Teratoma inmaduro. A . Esta pieza quirúrgica abierta muestra la estructura característica, sólida y quística. Al igual que en los teratomas maduros, a
menudo se encuentran pelo y otros elementos cutáneos. B . Los teratomas inmaduros contienen una mezcla desordenada de tejidos maduros e
inmaduros derivados de las tres capas de células germinales (ectodermo, mesodermo y endodermo). De los elementos inmaduros, el neuroepitelio
inmaduro es el más frecuente. En esta imagen, las células neuroepiteliales inmaduras están dispuestas en rosetas que yacen en el fondo de tejido
neural maduro. (Reproducida con autorización de Dr. Kelley Carrick).
El examen microscópico revela una mezcla desordenada de tejidos. De los elementos inmaduros, casi siempre predominan los tejidos
neuroectodérmicos y están dispuestos como túbulos primitivos y hojas de pequeñas células redondas malignas que pueden relacionarse con la
formación de glía. El diagnóstico siempre es difícil de confirmar en un corte congelado; la mayoría de las neoplasias se confirma sólo en el examen
patológico final (Pavlakis, 2009). Los tumores se clasifican de 1 a 3, sobre todo con base en la cantidad de tejido neural inmaduro que contienen.
O’Connor y Norris (1994) analizaron 244 teratomas inmaduros y notaron inconsistencias importantes en la asignación del grado por parte de distintos
observadores; por tal razón, propusieron cambiar el sistema a dos valores: bajo (antes grados 1 y 2) y alto (antes grado 3), sin embargo, esta práctica
no tiene aceptación universal.
En general, la forma más precisa de pronosticar la supervivencia es con base en el grado histológico del tumor, por ejemplo, casi 75% de los teratomas
inmaduros se encuentran en la etapa I cuando se diagnostican y tienen una tasa de supervivencia a cinco años de 98% (Chan, 2008). Las pacientes con
teratomas inmaduros grado 1 en etapa IA tienen un pronóstico excelente y no requieren quimioterapia adyuvante (Bonazzi, 1994; Marina, 1999). Las
mujeres con neoplasias en etapas II a IV tienen una tasa de supervivencia a cinco años de 73%–88% (Chan, 2008).
La salpingooforectomía unilateral es el tratamiento de elección para éstos y otros tumores malignos de células germinales en mujeres en edad
reproductiva. Sin embargo, Beiner y colaboradores (2004) trataron a ocho mujeres con teratoma inmaduro en etapa inicial mediante cistectomía
ovárica y quimioterapia adyuvante, y no encontraron recurrencias.
Los teratomas inmaduros pueden relacionarse con implantes de tejido maduro que tachonan el peritoneo, no aumentan la etapa del tumor ni
disminuyen la esperanza de vida. No obstante, estos injertos de elementos teratomatosos maduros, aunque sean benignos, son resistentes a la
quimioterapia y pueden crecer durante o después de ella. Se les conoce como síndrome de teratoma creciente, y requieren laparotomía de revisión y
resección para descartar recurrencia de la malignidad (Bentivegna, 2015).
Transformación maligna de teratomas quísticos maduros
Se trata de tumores poco frecuentes que son las únicas variantes de células germinales que suelen desarrollarse en posmenopáusicas. Las áreas
malignas casi siempre se encuentran como pequeños nódulos en la pared quística o como una masa polipoide dentro de la luz después de extirpar
todo el teratoma quístico maduro (Pins, 1996). El carcinoma epidermoide es el tipo más frecuente y se encuentra en casi 1% de los teratomas quísticos
maduros (figura 36–7). La quimioterapia basada en platino, con o sin radiación pélvica, es el tratamiento adyuvante más frecuente para la enfermedad
en etapa temprana (Dos Santos, 2007). Sin embargo, sin importar el tratamiento recibido, las mujeres con enfermedad avanzada tienen un mal
pronóstico (Gainford, 2010).
Figura 36–7.
La pieza quirúrgica abierta en la fotografía muestra transformación neoplásica del tipo carcinoma epidermoide maligno en un teratoma quístico
maduro.
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Page 10 / 34
Figura 36–7.
Universidad Nacional Autonoma de Mexico UNAM
Access Provided by:
La pieza quirúrgica abierta en la fotografía muestra transformación neoplásica del tipo carcinoma epidermoide maligno en un teratoma quístico
maduro.
Otros tumores malignos poco frecuentes que se han identificado incluyen carcinomas basocelulares, tumores sebáceos, melanomas malignos,
adenocarcinomas, sarcomas y tumores neuroectodérmicos. Además, en los teratomas quísticos maduros pueden encontrarse neoplasias de tipo
endocrino como el estruma ovárico (teratoma formado sobre todo por tejido tiroideo) y carcinoide.
Tratamiento
Cirugía
Por lo general se recomienda una incisión abdominal vertical si se sospecha de una neoplasia ovárica maligna. Sin embargo, los investigadores con
habilidades endoscópicas avanzadas han observado que la laparoscopia es una alternativa segura y eficaz para mujeres con pequeñas tumoraciones
ováricas y enfermedad en etapa I aparente (Shim, 2013).
Si hay ascitis, se evacua y se envía una muestra para su valoración citológica. De lo contrario, se hacen lavados de la pelvis y correderas parietocólicas
para su estudio antes de manipular el contenido intraperitoneal. Toda la cavidad peritoneal se explora de manera sistemática. Los ovarios se valoran
en cuanto a tamaño, compromiso tumoral, rotura capsular, excrecencias externas y adhesión a estructuras circundantes.
En todas las mujeres en edad reproductiva con diagnóstico de tumores ováricos malignos de células germinales debe practicarse una
salpingooforectomía unilateral con conservación de la fertilidad. En general tal estrategia conservadora no afecta la supervivencia (Park, 2017). No se
recomienda la biopsia ciega o la resección en cuña de un ovario contralateral de apariencia normal después de la salpingooforectomía unilateral. De
forma poco frecuente, la paciente habrá completado la maternidad y obtendría pocos beneficios de conservar un ovario, pero si ese fuera el caso,
sería apropiado realizar la histerectomía con salpingooforectomía bilateral (BSO, bilateral salpingo­oophorectomy) (Brown, 2014b). En cualquier caso,
después de extirpar el ovario afectado, procede la estadificación quirúrgica por laparotomía o laparoscopia, como se describió para el cáncer ovárico
epitelial (cuadro 35–7) (Gershenson, 2007). Por los patrones de diseminación tumoral, la linfadenectomía es muy importante para los disgerminomas,
mientras que las biopsias peritoneal y del epiplón para estadificación son muy valiosas en los tumores del saco vitelino y en los teratomas inmaduros
(Kleppe, 2014).
La cirugía de citorreducción se recomienda para los tumores ováricos de células germinales malignos no disgerminomatosos en estadio avanzado si
se puede lograr con una enfermedad residual mínima (Park, 2017). Los disgerminomas ováricos son tan quimiosensibles que casi nunca requieren
intentos intensivos de reducción de volumen. Se aplican los mismos principios generales que los descritos para el cáncer ovárico epitelial (capítulo 35,
Cáncer ovárico epitelial, Tratamiento del cáncer ovárico avanzado). La quimioterapia neoadyuvante es una alternativa razonable para la paciente
atípica de quien se cree que padece una enfermedad irresecable (Talukdar, 2014).
Muchas mujeres acuden con el oncólogo después de una salpingooforectomía unilateral por un tumor confinado al ovario extirpado, según criterios
clínicos. En estas pacientes, si la estadificación quirúrgica inicial fue incompleta, las opciones incluyen una segunda operación quirúrgica para
Downloaded
1:40 A Your
IP iso 132.248.9.8
estadificación2023­2­27
primaria, vigilancia
regular
quimioterapia adyuvante; por desgracia, hay pocos datos que apoyen una estrategia como preferible. Por
Page 11 / 34
CAPÍTULO
36:
Tumores
ováricos
de
células
germinales
del estroma
deatractiva
los cordones
sus cualidades de mínima invasión, la laparoscopia
es una yalternativa
muy
para lasexuales,
estadificación quirúrgica tardía luego de la resección
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
primaria; está demostrado que permite la detección precisa de las mujeres que necesitan quimioterapia (Leblanc, 2004). Sin embargo, la
estadificación quirúrgica después de esta resección es menos importante para situaciones en las que se aplicará quimioterapia, cualesquiera que
intentos intensivos de reducción de volumen. Se aplican los mismos principios generales que los descritos para el cáncer ovárico epitelial (capítulo 35,
Universidad Nacional Autonoma de Mexico UNAM
Cáncer ovárico epitelial, Tratamiento del cáncer ovárico avanzado). La quimioterapia neoadyuvante es una alternativa razonable para la paciente
Access Provided by:
atípica de quien se cree que padece una enfermedad irresecable (Talukdar, 2014).
Muchas mujeres acuden con el oncólogo después de una salpingooforectomía unilateral por un tumor confinado al ovario extirpado, según criterios
clínicos. En estas pacientes, si la estadificación quirúrgica inicial fue incompleta, las opciones incluyen una segunda operación quirúrgica para
estadificación primaria, vigilancia regular o quimioterapia adyuvante; por desgracia, hay pocos datos que apoyen una estrategia como preferible. Por
sus cualidades de mínima invasión, la laparoscopia es una alternativa muy atractiva para la estadificación quirúrgica tardía luego de la resección
primaria; está demostrado que permite la detección precisa de las mujeres que necesitan quimioterapia (Leblanc, 2004). Sin embargo, la
estadificación quirúrgica después de esta resección es menos importante para situaciones en las que se aplicará quimioterapia, cualesquiera que
sean los datos quirúrgicos. Ejemplos de ello son los tumores del saco vitelino en etapa I y teratomas inmaduros en etapa I de alta malignidad (Stier,
1996). En tales pacientes, la tranquilidad de que no hay hallazgos anómalos en las imágenes por tomografía computarizada a menudo es suficiente
antes de proceder con la quimioterapia adyuvante (Gershenson, 2007).
Vigilancia
Las pacientes con tumores ováricos malignos de células germinales deben vigilarse con cuidadosas valoraciones clínicas, radiológicas y serológicas
cada tres meses durante los primeros dos años después de completar el tratamiento (Morgan, 2016). Del total de las recurrencias, 90% se presenta en
este intervalo (Messing, 1992). No es necesaria la laparotomía de revisión al final del tratamiento en mujeres en las que se extirpó el tumor completo ni
en aquellas con tumor avanzado que no contiene teratoma. No obstante, el teratoma inmaduro extirpado incompleto es una circunstancia entre todos
los tipos de cáncer ovárico en la que las pacientes obtienen un beneficio definitivo con dicha laparotomía y con la resección de un tumor resistente a la
quimioterapia (Culine, 1996; Rezk, 2005; Williams, 1994).
Quimioterapia
Los disgerminomas en etapa IA y los teratomas inmaduros de grado 1 en etapa IA no requieren quimioterapia adicional. Por otro lado, la enfermedad
más avanzada y todos los demás tipos histológicos de tumores ováricos malignos de células germinales requieren quimioterapia combinada (Morgan,
2016). Sin embargo, se ha explorado la factibilidad de la cirugía seguida de vigilancia estrecha en niñas y adolescentes (Billmire, 2014). Como la
quimioterapia conserva su efectividad cuando se usa en una recidiva, algunos investigadores intentan identificar subgrupos en etapa inicial y con bajo
riesgo que puedan mantenerse en observación posoperatoria para evitar la toxicidad que causa el tratamiento (Bonazzi, 1994; Cushing, 1999; Dark,
1997). No obstante, antes de que esta estrategia se convierta en la práctica general, se necesitan más estudios extensos.
El régimen estándar es un ciclo de cinco días con bleomicina, etopósido y cisplatino (BEP) administrado cada tres semanas (Gershenson, 1990;
Williams, 1987). Las combinaciones modificadas de bleomicina, etopósido y cisplatino de tres días también son inocuas y eficaces (Chen, 2014;
Dimopoulos, 2004). El carboplatino y etopósido, administrados en tres ciclos, han demostrado ser una alternativa promisoria para pacientes selectos
(Williams, 2004). Para mujeres con enfermedad extirpada de manera incompleta, por lo general se recomiendan al menos cuatro ciclos de bleomicina,
etopósido y cisplatino (Morgan, 2016).
Radiación
La quimioterapia sustituyó a la radiación como tratamiento adyuvante de elección para todos los tipos de tumores ováricos malignos de células
germinales. Esta transición se impulsó sobre todo por la marcada sensibilidad de tales neoplasias a cualquiera de las dos modalidades, pero con
mayor probabilidad de conservar la función ovárica con la quimioterapia (Solheim, 2015). Las pacientes tratadas con radioterapia tienen mayores
probabilidades de desarrollar un segundo cáncer en los 10 años siguientes (Solheim, 2014). En ocasiones hay situaciones en que cabe considerar la
radioterapia como paliativo para los tumores de células germinales resistentes a la quimioterapia.
Recaída
La quimioterapia con bleomicina, etopósido y cisplatino es la alternativa de elección para los tumores ováricos de células germinales recurrentes en
mujeres que sólo se trataron con cirugía al inicio. Quienes alcanzaron una remisión clínica sostenida mayor de seis meses después de completar el
régimen de bleomicina, etopósido y cisplatino, u otro esquema de quimioterapia basada en platino, pueden tratarse de nuevo con bleomicina,
etopósido y cisplatino. Dichos tumores casi siempre tienen más capacidad de respuesta, por tanto, las pacientes “sensibles al platino” tienen un
pronóstico mejor. Sin embargo, las mujeres que no logran la remisión con quimioterapia con bleomicina, etopósido y cisplatino, o que recaen unos
cuantos meses después (menos de seis) se consideran “resistentes al platino” y sus opciones terapéuticas son limitadas. Los casos de disgerminoma o
teratoma inmaduro resistentes a la quimioterapia parecen tener un mejor pronóstico que otros subtipos, y algunas pacientes podrían beneficiarse
con el salvamento quirúrgico dirigido a eliminar cualquier enfermedad residual. (Li, 2007). Otras opciones paliativas para este grupo incluyen
vincristina, dactinomicina y ciclofosfamida (VAC) o paclitaxel (Morgan, 2016).
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
Pronóstico
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Page 12 / 34
Los tumores ováricos malignos de células germinales tienen un pronóstico excelente (cuadro 36–3) (Solheim, 2013, 2014). Además, el número de
etopósido y cisplatino. Dichos tumores casi siempre tienen más capacidad de respuesta, por tanto, las pacientes “sensibles al platino” tienen un
Universidad
Nacional
Autonoma
de recaen
Mexicounos
UNAM
pronóstico mejor. Sin embargo, las mujeres que no logran la remisión con quimioterapia con bleomicina,
etopósido
y cisplatino,
o que
Access Provided
cuantos meses después (menos de seis) se consideran “resistentes al platino” y sus opciones terapéuticas
son by:
limitadas. Los casos de disgerminoma o
teratoma inmaduro resistentes a la quimioterapia parecen tener un mejor pronóstico que otros subtipos, y algunas pacientes podrían beneficiarse
con el salvamento quirúrgico dirigido a eliminar cualquier enfermedad residual. (Li, 2007). Otras opciones paliativas para este grupo incluyen
vincristina, dactinomicina y ciclofosfamida (VAC) o paclitaxel (Morgan, 2016).
Pronóstico
Los tumores ováricos malignos de células germinales tienen un pronóstico excelente (cuadro 36–3) (Solheim, 2013, 2014). Además, el número de
casos con enfermedad a distancia y no estadificada ha tenido un descenso drástico, lo cual sugiere que los tumores de células germinales se
diagnostican de modo más oportuno. Las tasas de supervivencia han mejorado mucho para todos los subtipos, sobre todo con la eficacia demostrada
de los regímenes combinados basados en platino (Smith, 2006). El tipo celular histológico, el incremento de los marcadores séricos, la etapa
quirúrgica y la cantidad de tumor residual en la operación inicial son las variables que más influyen en el pronóstico (Murugaesu, 2006; Park, 2017).
Por lo general, los disgerminomas puros recurren antes de dos años y son muy susceptibles al tratamiento (Vicus, 2010), sin embargo, para los
tumores no disgerminomatosos, el pronóstico después de la recidiva es malo, y menos de 10% de las pacientes sobrevive un lapso prolongado
(Murugaesu, 2006).
La mayoría de las mujeres tratadas con medios quirúrgicos que permiten conservar la fertilidad, con o sin quimioterapia, reanuda la menstruación
normal y puede concebir (Park, 2017). Además, ninguno de los estudios publicados ha notado un aumento en el índice de defectos congénitos o
aborto espontáneo en quienes recibieron quimioterapia (Tangir, 2003; Zanetta, 2001).
Tratamiento durante el embarazo
Se detectan tumoraciones persistentes en los anexos en 1%–2% de todos los embarazos; por lo general, tales neoplasias se observan durante
procedimientos de ecografía obstétrica sistemática. En ocasiones, un aumento espectacular en las concentraciones séricas maternas de α­
fetoproteína (MSAFP, maternal serum alpha­fetoprotein) es el signo de presentación de un tumor maligno de células germinales (Horbelt, 1994). Los
teratomas quísticos maduros (quistes dermoides) comprenden un tercio de las neoplasias extirpadas durante el embarazo, por el contrario, los
disgerminomas representan sólo 1%–2% de tales tumoraciones, pero aún son la neoplasia maligna más frecuente durante el embarazo. El desarrollo
de otros tumores de células germinales es raro (Shimizu, 2003).
El tratamiento quirúrgico inicial que incluye estadificación es el mismo que para no embarazadas (Horbelt, 1994; Zhao, 2006), por fortuna, muy pocas
pacientes tienen enfermedad avanzada que amerite disección radical para citorreducción. La decisión de administrar quimioterapia durante el
embarazo es causa de controversia. Los tumores ováricos malignos de células germinales tienden a crecer con rapidez y es peligroso retrasar el
tratamiento hasta el parto. Parece que el régimen con bleomicina, etopósido y cisplatino es inocuo durante la gravidez, pero en algunos informes se
especula la posibilidad de complicaciones fetales (Elit, 1999; Horbelt, 1994); por tal razón, algunos sugieren retrasar el tratamiento hasta el puerperio
(Shimizu, 2003), por desgracia, faltan resultados de grandes estudios para resolver este dilema. Para los disgerminomas completamente resecados, la
administración de bleomicina, etopósido y cisplatino puede retrasarse hasta el puerperio, sin embargo, en pacientes con tumores no
disgerminomatosos (sobre todo tumores del saco vitelino y teratomas inmaduros) y aquellas con enfermedad resecada de manera incompleta, se
considera indispensable la administración de quimioterapia durante el embarazo.
TUMORES DEL ESTROMA DE LOS CORDONES SEXUALES OVÁRICOS
Los tumores del estroma de los cordones sexuales (SCST, sex cord­stromal tumors) son un grupo heterogéneo de neoplasias poco frecuentes que se
originan en la matriz ovárica. Las células en esta matriz tienen la capacidad de producir hormonas; casi 90% de las neoplasias ováricas que producen
dichas moléculas son tumores del estroma de los cordones sexuales. Como resultado, las mujeres con estos tumores por lo general se presentan con
signos y síntomas que incluyen exceso de estrógenos y andrógenos.
La resección quirúrgica es el tratamiento primario, y en el momento del diagnóstico los tumores del estroma de los cordones sexuales casi siempre se
limitan a un ovario. La mayoría tiene un patrón de crecimiento inconstante y un bajo potencial maligno, por estas razones, pocas pacientes requieren
quimioterapia basada en platino. Los tumores recurren con poca frecuencia, las recurrencias tienden a ser tardías y, por lo general, surgen en el
abdomen o la pelvis (Abu­Rustum, 2006). La enfermedad recurrente a menudo responde mal al tratamiento, pero las pacientes pueden vivir muchos
años debido a la progresión lenta característica del tumor.
El pronóstico general de los tumores del estroma de los cordones sexuales ováricos es excelente, sobre todo por la etapa inicial de la enfermedad al
momento del diagnóstico y la cirugía curativa. No obstante, la rareza de estas neoplasias limita la comprensión de su historia natural, su tratamiento y
el pronóstico.
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
Epidemiología
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Page 13 / 34
Los tumores del estroma de los cordones sexuales representan 3%–5% de los cánceres ováricos (Ray­Coquard, 2014). Estos tumores tienen una
probabilidad de más de dos veces de desarrollarse en mujeres de raza negra por razones que son poco claras (Quirk, 2005). A diferencia de los
abdomen o la pelvis (Abu­Rustum, 2006). La enfermedad recurrente a menudo responde mal al tratamiento, pero las pacientes pueden vivir muchos
Universidad Nacional Autonoma de Mexico UNAM
años debido a la progresión lenta característica del tumor.
Access Provided by:
El pronóstico general de los tumores del estroma de los cordones sexuales ováricos es excelente, sobre todo por la etapa inicial de la enfermedad al
momento del diagnóstico y la cirugía curativa. No obstante, la rareza de estas neoplasias limita la comprensión de su historia natural, su tratamiento y
el pronóstico.
Epidemiología
Los tumores del estroma de los cordones sexuales representan 3%–5% de los cánceres ováricos (Ray­Coquard, 2014). Estos tumores tienen una
probabilidad de más de dos veces de desarrollarse en mujeres de raza negra por razones que son poco claras (Quirk, 2005). A diferencia de los
cánceres ováricos epiteliales o los tumores malignos de células germinales, los tumores del estroma de los cordones sexuales típicamente afectan a
mujeres de todas las edades. El intervalo contiene una distribución bimodal que refleja la heterogeneidad inherente a los tumores. Por ejemplo, los
tumores de células de la granulosa de tipo juvenil, los tumores de las células de Sertoli­Leydig y los tumores estromales esclerosantes se encuentran
predominantemente en mujeres prepúberes y en mujeres en los primeros tres decenios de la vida (Schneider, 2005). Los tumores de células de la
granulosa de tipo adulto a menudo se desarrollan en mujeres de edad avanzada, en promedio a mediados de la sexta década de la vida (periodo
aproximado de entre los 50 y 59 años de edad) (van Meurs, 2013).
Los tumores del estroma de los cordones sexuales no tienen factores de riesgo probados, sin embargo, en un estudio de casos y controles generador
de hipótesis, se asoció la obesidad como estado hiperestrogénico de forma independiente, mientras que la paridad, el tabaquismo y el uso de
anticonceptivos orales mostraron ser protectores (Boyce, 2009).
En gran medida, la etiología de los tumores del estroma de los cordones sexuales se desconoce, sin embargo, una sola mutación recurrente del gen
FOXL2 está presente en prácticamente todos los tumores de células de la granulosa de tipo adulto (Schrader, 2009; Shah, 2009). Además, las mujeres
con una mutación de la línea germinal DICER1 están predispuestas a generar tumores del estroma de los cordones sexuales (Heravi­Moussavi, 2012).
Por último, los tumores del estroma de los cordones sexuales ováricos se desarrollan en asociación con varios trastornos hereditarios definidos con
una frecuencia que excede la mera posibilidad, dichos tumores incluyen la enfermedad de Ollier, que se caracteriza por múltiples neoplasias
cartilaginosas benignas pero desfigurantes, y el síndrome de Peutz­Jeghers, caracterizado por pólipos hamartomatosos intestinales (Stevens, 2005).
Diagnóstico
Datos de la paciente
La pubertad precoz isosexual es el signo de presentación en más de 80% de las niñas prepúberes en las que al final se diagnostica un tumor del
estroma de los cordones sexuales ovárico (Kalfa, 2005). Las adolescentes a menudo refieren amenorrea secundaria. Como resultado, estas jóvenes
con síntomas endocrinos tienden a diagnosticarse en etapas más tempranas. El dolor abdominal y la distensión son otras quejas frecuentes en este
grupo de edad (Schneider, 2003).
En mujeres adultas, los síntomas más frecuentes son sangrado menstrual abundante e irregular y hemorragia posmenopáusica. Además, el
hirsutismo leve que progresa en poco tiempo a la virilización franca obliga a realizar una valoración para descartar tales tumores. La presentación
típica es una posmenopáusica con estigmas de exceso androgénico que avanzan con rapidez, y una tumoración compleja en algún anexo; otros signos
y síntomas notificados son dolor abdominal y una masa que palpa la propia paciente (Chan, 2005).
El tamaño del tumor del estroma de los cordones sexuales es muy variable, pero por lo general se identifica una masa abdominal o pélvica en la
exploración, cualquiera que sea la edad de la paciente. Sin embargo, son raros el signo de onda líquida y otros hallazgos físicos que sugieren
enfermedad avanzada.
Procedimientos diagnósticos
Las concentraciones altas de testosterona, androstenediona o ambas son muy sugestivas de un tumor del estroma de los cordones sexuales ovárico
en una mujer virilizada. Es más probable que el hiperandrogenismo clínico se deba a síndrome de ovarios poliquísticos, pero las concentraciones
séricas de testosterona >150 ng/100 mL, o las concentraciones de sulfato de deshidroepiandrosterona (DHEAS, dehydroepiandrosterone) >8000 μg/L
sugieren una probabilidad muy alta de presentar un tumor secretor de andrógenos (Carmina, 2006). En la mayor parte de los casos no se solicitan
pruebas de marcadores tumorales, porque muchas veces no se sospecha el diagnóstico de tumor del estroma de los cordones sexuales ovárico.
Cuando éste se confirma, pueden medirse los marcadores tumorales apropiados durante o después de la intervención quirúrgica (cuadro 36–4).
Cuadro 36–4.
Marcadores tumorales para tumores ováricos del estroma de los cordones sexuales con potencial maligno.
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023Tumores
McGraw
All de
Rights
Reserved.
Use • Privacy Policy • Notice
• Accessibility
deHill.
células
la granulosa
(formaTerms
adulta of
y juvenil)
Inhibina
A y B, estradiol (no tan confiable)
Tumores de células de Sertoli­Leydig
Inhibina A y B, en ocasiones α­fetoproteína
Page 14 / 34
séricas de testosterona >150 ng/100 mL, o las concentraciones de sulfato de deshidroepiandrosterona (DHEAS, dehydroepiandrosterone) >8000 μg/L
Universidad Nacional Autonoma de Mexico UNAM
sugieren una probabilidad muy alta de presentar un tumor secretor de andrógenos (Carmina, 2006). En la mayor parte de los casos no se solicitan
Access Provided by:
pruebas de marcadores tumorales, porque muchas veces no se sospecha el diagnóstico de tumor del estroma de los cordones sexuales ovárico.
Cuando éste se confirma, pueden medirse los marcadores tumorales apropiados durante o después de la intervención quirúrgica (cuadro 36–4).
Cuadro 36–4.
Marcadores tumorales para tumores ováricos del estroma de los cordones sexuales con potencial maligno.
Tumores de células de la granulosa (forma adulta y juvenil)
Inhibina A y B, estradiol (no tan confiable)
Tumores de células de Sertoli­Leydig
Inhibina A y B, en ocasiones α­fetoproteína
Tumor del cordón sexual con túbulos anulares
Inhibina A y B
Tumores de células esteroideas, no especificados
Hormonas esteroideas elevadas antes del tratamiento
La apariencia macroscópica de un tumor del estroma de los cordones sexuales varía de una masa sólida multiquística grande a pequeña, lo cual
impide un diagnóstico radiográfico específico. Los tumores de células de la granulosa a menudo muestran características ecográficas semisólidas,
pero no son distinguibles de manera confiable de los tumores epiteliales (figura 36–8) (Sharony, 2001). Además, el endometrio quizá esté engrosado
por el aumento de la producción de estrógenos tumorales. La toma de muestras previa a la intervención quirúrgica de endometrio es razonable para
excluir hiperplasia endometrial comórbida o adenocarcinoma. Si bien las imágenes por tomografía computarizada o resonancia magnética se han
utilizado para aclarar ecografías indeterminadas de estos tumores, ningún estudio radiográfico definitivo permite un diagnóstico confiable (Jung,
2005).
Figura 36–8.
Tumor de las células de la granulosa de tipo adulto. A . La ecografía abdominal muestra una masa anexial grande con áreas quísticas y sólidas. Con la
aplicación de Doppler a color se observan gruesos tabiques vascularizados. B . Tomografía computarizada del mismo tumor. C . El tumor se abrió
después de la ablación y se observó que poseía una estructura mixta. (Reproducida con autorización de Dr. Christa Nagel).
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Page 15 / 34
Universidad Nacional Autonoma de Mexico UNAM
Access Provided by:
Es indispensable la extirpación quirúrgica para el diagnóstico definitivo del tejido, la estadificación y el tratamiento en mujeres con una masa ovárica
que despierte sospecha de ser maligna. La biopsia percutánea ecográfica o guiada por tomografía computarizada no tiene utilidad alguna. Además, la
laparoscopia diagnóstica o la laparotomía con valoración visual de la masa anexial sola es inadecuada. Después de la extracción, los tumores del
estroma de los cordones sexuales ováricos por lo general se pueden distinguir histológicamente de los tumores de células germinales, los cánceres de
ovario epiteliales u otras neoplasias de células fusiformes mediante inmunotinción para inhibina (Cathro, 2005; Schneider, 2005).
Participación del médico general
Antes de la operación, las pacientes con un tumor del estroma de los cordones sexuales ovárico potencialmente maligno deben ser referidas a un
ginecólogo oncólogo para su valoración. Sin embargo, a menudo los ginecoobstetras diagnostican la mayor parte de los tumores del estroma de los
cordones sexuales ováricos después de la resección de una masa de apariencia benigna, pero compleja, en mujeres con concentraciones normales de
CA125, si es que se midió de antemano. La operación quirúrgica inicial por lo regular se efectúa en un hospital general y sin la estadificación adecuada.
En tal situación, un patólogo con experiencia debe revisar y confirmar los resultados histopatológicos. Después de la consulta con un ginecólogo
oncólogo, a veces se indica la estadificación quirúrgica.
Patología
Clasificación
Los tumores del estroma de los cordones sexuales ováricos se originan de los cordones sexuales y de las células mesenquimáticas de las gónadas
embrionarias (capítulo 19, Trastornos anatómicos, Desarrollo del sistema de conductos). Las células de la granulosa y de Sertoli se desarrollan a partir
de los cordones sexuales y, por consiguiente, del epitelio celómico. En cambio, las células de la teca, las de Leydig y los fibroblastos provienen del
Downloaded
1:40
A Your
IP is 132.248.9.8
mesénquima.2023­2­27
Este estroma
gonadal
primitivo
tiene doble potencial sexual. Por tanto, los tumores que se desarrollan pueden estar formados por un
Page 16 / 34
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
tipo celular dirigido al sexo masculino (células de Sertoli o de Leydig) o uno dirigido al sexo femenino (células de la granulosa o de la teca). Aunque se
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
han definido distintas categorías de tumores del estroma de los cordones sexuales, los tumores mixtos son relativamente frecuentes (cuadro 36–5)
(Kurman, 2014). Por ejemplo, tumores de células de la granulosa ovárica pueden tener componentes de Sertoli mezclados. De igual manera, es posible
Clasificación
Universidad Nacional Autonoma de Mexico UNAM
Access Provided by:
Los tumores del estroma de los cordones sexuales ováricos se originan de los cordones sexuales y de las células mesenquimáticas de las gónadas
embrionarias (capítulo 19, Trastornos anatómicos, Desarrollo del sistema de conductos). Las células de la granulosa y de Sertoli se desarrollan a partir
de los cordones sexuales y, por consiguiente, del epitelio celómico. En cambio, las células de la teca, las de Leydig y los fibroblastos provienen del
mesénquima. Este estroma gonadal primitivo tiene doble potencial sexual. Por tanto, los tumores que se desarrollan pueden estar formados por un
tipo celular dirigido al sexo masculino (células de Sertoli o de Leydig) o uno dirigido al sexo femenino (células de la granulosa o de la teca). Aunque se
han definido distintas categorías de tumores del estroma de los cordones sexuales, los tumores mixtos son relativamente frecuentes (cuadro 36–5)
(Kurman, 2014). Por ejemplo, tumores de células de la granulosa ovárica pueden tener componentes de Sertoli mezclados. De igual manera, es posible
que las neoplasias con predominio celular de Sertoli o de Sertoli­Leydig contengan elementos menores de la granulosa. Se cree que tales
tumoraciones mixtas surgen de un linaje común con diferenciación variable y no representan dos entidades separadas concurrentes (McKenna, 2005;
Vang, 2004).
Cuadro 36–5.
Clasificación modificada de la Organización Mundial de la Salud para los tumores ováricos del estroma de los cordones sexuales.
Tumores puros del estroma
Fibroma/fibrosarcoma
Tecoma
Tumor estromal esclerosante
Tumor de células de Leydig
Tumor de células productoras de esteroides
Tumores puros de los cordones sexuales
Tumor de las células de la granulosa
Tipo adulto
Tipo juvenil
Tumor de células de Sertoli
Tumores de cordones sexuales con túbulos anulares
Tumores mixtos del estroma­cordón sexual
Tumores de células de Sertoli­Leydig
Tumores de cordones sexuales­estromales no especificados de otra forma
Se considera que todos los tumores ováricos de células de la granulosa tienen potencial maligno. Sin embargo, no hay un criterio definido para
establecer con claridad la malignidad o benignidad de la mayor parte de los otros subtipos de tumores del estroma de los cordones sexuales. Los
intentos de la gradación de estos tumores mediante las características nucleares o la actividad mitótica han tenido resultados inconsistentes (Chen,
2003).
Tumores de células de la granulosa
Tumores de células de la granulosa tipo adulto
El 70% de los tumores del estroma de los cordones sexuales ováricos son tumores de células de la granulosa (Colombo, 2007). Se cree que estos
tumores surgen de las células que rodean a las células germinales. Hay dos tipos clínicos y distintos desde el punto de vista histopatológico: la forma
adulta, que comprende 95% de los casos, y el tipo juvenil, que abarca 5%.
En el caso de los tumores de células de la granulosa de tipo adulto, la mayoría de las mujeres es diagnosticada después de los 30 años de edad; el
promedio de edad se acerca a los 55 años. Son frecuentes la metrorragia irregular y el sangrado posmenopáusico, lo que refleja exposición
endometrial prolongada a estrógenos. En relación con este exceso de hormonas, se han identificado alteraciones concomitantes (como hiperplasia
endometrial o adenocarcinoma) en 25%–30% de las pacientes con tumores de células de la granulosa de tipo adulto (van Meurs, 2013). De igual
manera, el crecimiento y la hipersensibilidad mamarios son quejas frecuentes relacionadas, y hay informes de amenorrea secundaria (Kurihara, 2004).
Otra posibilidad es que los síntomas se deban a las tumoraciones ováricas y no a las hormonas que producen (Ray­Coquard, 2014). Un tumor creciente
y con potencial hemorrágico en ocasiones causa molestia y distensión abdominales. El dolor pélvico agudo sugiere torsión del anexo; la rotura del
Downloaded
2023­2­27 1:40
A Your
IP isun132.248.9.8
tumor con hemoperitoneo
puede
simular
embarazo ectópico.
Page 17 / 34
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023
McGraw
Hill. All Rights
Reserved.
Terms
Use •de
Privacy
Policy
Notice • Accessibility
Si durante
la intervención
quirúrgica
se confirma
unoftumor
células
de la •granulosa
de tipo adulto, puede solicitarse la valoración de marcadores
tumorales. De éstos, la inhibina B (que parece ser más específica que la inhibina A) a menudo se eleva meses antes de la detección clínica de la
recurrencia (Mom, 2007); sin embargo, el valor diagnóstico de este marcador disminuye por su amplio intervalo fisiológico normal (Schneider, 2005).
promedio de edad se acerca a los 55 años. Son frecuentes la metrorragia irregular y el sangrado posmenopáusico, lo que refleja exposición
Universidad
Nacional
Autonoma
de Mexico
UNAM
endometrial prolongada a estrógenos. En relación con este exceso de hormonas, se han identificado
alteraciones
concomitantes
(como
hiperplasia
Access
by:
endometrial o adenocarcinoma) en 25%–30% de las pacientes con tumores de células de la granulosa
deProvided
tipo adulto
(van Meurs, 2013). De igual
manera, el crecimiento y la hipersensibilidad mamarios son quejas frecuentes relacionadas, y hay informes de amenorrea secundaria (Kurihara, 2004).
Otra posibilidad es que los síntomas se deban a las tumoraciones ováricas y no a las hormonas que producen (Ray­Coquard, 2014). Un tumor creciente
y con potencial hemorrágico en ocasiones causa molestia y distensión abdominales. El dolor pélvico agudo sugiere torsión del anexo; la rotura del
tumor con hemoperitoneo puede simular un embarazo ectópico.
Si durante la intervención quirúrgica se confirma un tumor de células de la granulosa de tipo adulto, puede solicitarse la valoración de marcadores
tumorales. De éstos, la inhibina B (que parece ser más específica que la inhibina A) a menudo se eleva meses antes de la detección clínica de la
recurrencia (Mom, 2007); sin embargo, el valor diagnóstico de este marcador disminuye por su amplio intervalo fisiológico normal (Schneider, 2005).
El estradiol tiene uso limitado en la vigilancia, esto es verdadero sobre todo en una mujer joven que desea conservar la fertilidad y en la que el ovario
contralateral queda in situ.
A simple vista, los tumores de células de la granulosa de tipo adulto son grandes, poliquísticos y a menudo miden más de 10 a 15 cm de diámetro
(figura 36–8). La superficie a menudo es edematosa y muy adherente a otros órganos pélvicos. Por tal razón, casi siempre se necesita una disección
más extensa que para los cánceres ováricos epiteliales o los tumores malignos de células germinales. Durante la escisión también son frecuentes la
rotura inadvertida y la hemorragia intraoperatoria del propio tumor.
El interior del tumor es muy variable; es probable que predominen los componentes sólidos, con grandes áreas de hemorragia y necrosis. Otra
posibilidad es que sea quístico, con muchas cámaras llenas de líquido seroso­sanguinolento o gelatinoso (Colombo, 2007). El estudio microscópico
muestra sobre todo células de la granulosa con núcleos pálidos y hendidos, en forma de “granos de café”. El rasgo histológico característico es el
cuerpo de Call­Exner, una roseta formada por células alrededor de un espacio lleno de líquido eosinofílico (figura 36–9).
Figura 36–9.
Tumor de las células de la granulosa en una mujer adulta. A . Típicamente, las células se encuentran apiñadas y contienen escaso citoplasma pálido; su
núcleo elongado puede tener pliegues longitudinales que les dan un aspecto en “grano de café”. B . Se identifican cuerpos de Call­Exner por su
aspecto en roseta. (Reproducida con autorización de Dr. Raheela Ashfaq).
Los tumores de células de la granulosa de tipo adulto son neoplasias de baja malignidad, casi siempre con crecimiento lento. En 95% de los casos es
unilateral y de 70%–90% está en etapa I al momento del diagnóstico (cuadro 36–6). La supervivencia a cinco años para pacientes con enfermedad en
etapa I es de 90%–95% (Colombo, 2007; Zhang, 2007); sin embargo, 15%–25% de las pacientes en etapa I recae al final. La mediana de tiempo hasta la
recurrencia es de 5 a 6 años, pero el periodo puede ser de varios decenios (Abu­Rustum, 2006; East, 2005). Por fortuna, estos tumores indoloros casi
siempre progresan despacio y la mediana de supervivencia después de la recaída es de otros seis años. Los escasos factores pronósticos comprenden
la etapa avanzada, el tamaño tumoral grande y la enfermedad residual (Seagle, 2017). Las pacientes con tumores en etapas II a IV tienen una tasa de
supervivencia a cinco años de 50%–80% (Seagle, 2017). La atipia celular y el recuento mitótico pueden ayudar a determinar el pronóstico, pero son
difíciles de cuantificar de forma reproducible (Miller, 2001).
Cuadro 36–6.
Supervivencia de pacientes con tumores ováricos frecuentes del estroma de los cordones sexuales, según la etapa.
Células de la granulosa de tipo adulto
Células de Sertoli­Leydig
Etapa al momento del diagnóstico
I
70%–90%
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
II­IV 36: Tumores ováricos de células germinales y del estroma de los
10%–20%
CAPÍTULO
cordones sexuales,
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Supervivencia a cinco años
97%
2%–3%
Page 18 / 34
siempre progresan despacio y la mediana de supervivencia después de la recaída es de otros seis años. Los escasos factores pronósticos comprenden
Universidad Nacional Autonoma de Mexico UNAM
la etapa avanzada, el tamaño tumoral grande y la enfermedad residual (Seagle, 2017). Las pacientes con tumores en etapas II a IV tienen una tasa de
Access Provided by:
supervivencia a cinco años de 50%–80% (Seagle, 2017). La atipia celular y el recuento mitótico pueden ayudar a determinar el pronóstico, pero son
difíciles de cuantificar de forma reproducible (Miller, 2001).
Cuadro 36–6.
Supervivencia de pacientes con tumores ováricos frecuentes del estroma de los cordones sexuales, según la etapa.
Células de la granulosa de tipo adulto
Células de Sertoli­Leydig
Etapa al momento del diagnóstico
I
70%–90%
97%
II­IV
10%–20%
2%–3%
Etapa I
90%–95%
90%–95%
Etapas II­IV
50%–80%
10%–20%
Supervivencia a cinco años
Las fuentes de las cifras de supervivencia se citan en el texto.
Tumores de células de la granulosa de tipo juvenil
Estas neoplasias poco frecuentes se desarrollan sobre todo en niñas y mujeres adultas jóvenes; 90% se diagnostica antes de la pubertad (Colombo
2007). La edad promedio al momento del diagnóstico es de 13 años, pero la edad de las pacientes varía desde el nacimiento hasta los 67 años (Young,
1984). Dichos tumores a veces se relacionan con la enfermedad de Ollier o el síndrome de Maffucci, caracterizado por la presencia de endocondromas
y hemangiomas (Young, 1984; Yuan, 2004).
Es probable que las mujeres afectadas tengan concentraciones elevadas de estrógenos, progesterona y testosterona, con supresión de
gonadotropinas. Como resultado, son frecuentes las irregularidades menstruales y la amenorrea. Las niñas prepúberes casi siempre presentan
pubertad precoz periférica isosexual, que se caracteriza por crecimiento mamario y aparición de vello púbico, de secreciones vaginales y de otros
caracteres sexuales secundarios. Tales tumores pocas veces secretan andrógenos, lo cual induce virilización. A pesar de estos signos endocrinos, es
frecuente el diagnóstico tardío de los tumores de células de la granulosa de tipo juvenil en niñas prepuberales y pospuberales, y se acompaña de un
riesgo alto de diseminación tumoral al peritoneo (Kalfa, 2005).
Además de cambios hormonales, las mujeres pueden presentar efectos del tumor. Por ejemplo, las pacientes mayores casi siempre buscan atención
médica por dolor o inflamación abdominales. La rotura preoperatoria con hemoperitoneo puede causar síntomas abdominales agudos en 5%–10%
de las pacientes; también se observa ascitis en 10% de los casos (Young, 1984).
A simple vista, los tumores de células de la granulosa de tipo juvenil se parecen a los de tipo adulto, con componentes variables sólidos y quísticos.
Pueden alcanzar un tamaño considerable y tener un diámetro promedio de 12 cm. Al microscopio, las características citológicas que distinguen a estos
tumores de los de tipo adulto son sus núcleos redondeados hipercromáticos sin hendiduras en forma de “grano de café”. Los cuerpos de Call­Exner
son raros, pero a menudo se encuentra un componente de células de la teca (Young, 1984).
El pronóstico es excelente, y el índice de supervivencia a cinco años es de 95%. Ambos tipos de tumores son unilaterales y se encuentran en etapa I al
momento del diagnóstico (Young, 1984). Sin embargo, el tipo juvenil es más agresivo en etapas avanzadas y el tiempo entre la recaída y la muerte es
mucho menor. Por lo general, las recurrencias aparecen en tres años. Las reincidencias más tardías son inusuales (Frausto, 2004).
Grupo tecoma­fibroma
Tecomas
Se trata de tumores del estroma de los cordones sexuales que el médico observa con relativa frecuencia y rara vez son malignos. Dichas neoplasias
Downloaded
2023­2­27
1:40siempre
A Yourse
IPdesarrollan
is 132.248.9.8
son únicas debido
a que casi
en posmenopáusicas de 60–70 años de edad; son poco frecuentes antes de los 30 años. Estas
Page 19 / 34
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
masas sólidas están entre los tumores del estroma de los cordones sexuales de mayor actividad hormonal y casi siempre producen exceso de
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
estrógenos. Como resultado, los signos y síntomas primarios son metrorragia anormal, masa pélvica, o ambas. Muchas mujeres también presentan
hiperplasia endometrial o adenocarcinoma concurrente (Aboud, 1997). Tales tumores están formados por células de estroma cargadas con lípidos, a
mucho menor. Por lo general, las recurrencias aparecen en tres años. Las reincidencias más tardías son inusuales (Frausto, 2004).
Universidad Nacional Autonoma de Mexico UNAM
Grupo tecoma­fibroma
Access Provided by:
Tecomas
Se trata de tumores del estroma de los cordones sexuales que el médico observa con relativa frecuencia y rara vez son malignos. Dichas neoplasias
son únicas debido a que casi siempre se desarrollan en posmenopáusicas de 60–70 años de edad; son poco frecuentes antes de los 30 años. Estas
masas sólidas están entre los tumores del estroma de los cordones sexuales de mayor actividad hormonal y casi siempre producen exceso de
estrógenos. Como resultado, los signos y síntomas primarios son metrorragia anormal, masa pélvica, o ambas. Muchas mujeres también presentan
hiperplasia endometrial o adenocarcinoma concurrente (Aboud, 1997). Tales tumores están formados por células de estroma cargadas con lípidos, a
veces luteinizadas; la mitad de estos tecomas luteinizados son hormonalmente inactivos o produce andrógenos.
Los tecomas son tumores sólidos cuyas células se asemejan a las de la teca que rodean los folículos ováricos normales (Chen, 2003). Por su textura, en
la ecocardiografía se ven como tumoraciones sólidas en los anexos y pueden simular leiomiomas extrauterinos.
El compromiso de ambos ovarios y la diseminación fuera de éstos son eventos raros; por fortuna, los tecomas ováricos tienen rasgos clínicos
benignos y la resección quirúrgica es curativa.
Fibromas
Los fibromas son variantes de tumores del estroma de los cordones sexuales que se observan con cierta frecuencia, sin actividad hormonal y que casi
siempre se desarrollan en perimenopáusicas y menopáusicas (Chechia, 2008). Estas neoplasias ováricas sólidas, por lo general benignas, se originan
en las células fusiformes productoras de colágeno del estroma. La mayoría de los fibromas se encuentra de manera incidental en la exploración o en la
ecografía pélvicas. Son tumores sólidos, redondos, ovales o lobulados, relacionados con líquido libre o, menos a menudo, con ascitis franca; su
vascularidad es de mínima a moderada (Paladini, 2009).
Quizá 1% de las mujeres se presenta con síndrome de Meigs, una tríada que incluye derrame pleural, ascitis y un tumor ovárico sólido (Siddiqui, 1995).
Los derrames pleurales casi siempre son del lado derecho; por lo general el líquido pleural y el fluido de ascitis que lo acompañan es un trasudado
que se resuelve después de extirpar el tumor (Majzlin, 1964). A pesar de la relación que hay entre la ascitis y los fibromas benignos, cuando la primera y
una masa pélvica coexisten, se debe suponer malignidad al realizar la valoración.
El pronóstico después de la escisión de los fibromas es el de cualquier tumor benigno; sin embargo, 10% presenta aumento de la celularidad y grados
variables de pleomorfismo y actividad mitótica, indicativos de un tumor mejor caracterizado como de bajo potencial maligno. En 1% de los casos se
encuentra transformación maligna a un fibrosarcoma.
Tumores estromales esclerosantes
Son neoplasias raras y representan menos de 5% de los tumores del estroma de los cordones sexuales. La edad promedio de las pacientes es de 20
años y 80% de los casos se desarrolla antes de los 30 años. Los tumores estromales esclerosantes tienen un comportamiento clínico benigno y por lo
general son unilaterales. Las irregularidades menstruales y el dolor pélvico son síntomas frecuentes (Marelli, 1998), pocas veces hay ascitis (a
diferencia de los fibromas). El tamaño de las tumoraciones varía; puede ser microscópico o llegar hasta a 20 cm. En el estudio histopatológico, los
rasgos distintivos son la presencia de pseudolobulación de áreas celulares separadas por tejido conjuntivo edematoso, aumento de la vascularidad y
áreas prominentes de esclerosis.
Tumores de células estromales y de Sertoli
Tumores de células de Sertoli
Los tumores ováricos de células de Sertoli se observan con poca frecuencia; representan menos de 5% de todos los tumores del estroma de los
cordones sexuales. La edad promedio de las pacientes al momento del diagnóstico es de 30 años, pero varía de los 2 a los 76 años. La cuarta parte de
las pacientes tienen manifestaciones estrogénicas o androgénicas, sin embargo, la mayoría de las neoplasias carece de funcionalidad en términos
clínicos.
Estas tumoraciones casi siempre son unilaterales, sólidas, amarillas, y miden entre 4 y 12 cm. Provienen del tipo celular que da origen a los túbulos
seminíferos y a menudo se organizan en túbulos que son característicos en términos histopatológicos (Young, 2005); sin embargo, los tumores de
células de Sertoli pueden simular a muchas neoplasias distintas; en estos casos, la tinción con anticuerpos específicos es invaluable para confirmar el
diagnóstico.
Más
de 80% de2023­2­27
los casos se
encuentra
I al momento del diagnóstico, y casi todos son benignos. La atipia celular moderada, la actividad
Downloaded
1:40
A Your en
IP etapa
is 132.248.9.8
mitótica enérgica
y la necrosis
de las
tumorales
sonyindicadores
potencialsexuales,
maligno. Estos datos se encuentran en 10% dePage
las 20 / 34
CAPÍTULO
36: Tumores
ováricos
decélulas
células
germinales
del estromadedemayor
los cordones
©2023 McGraw
Hill. All Rights
Reserved.
Terms ofde
Use
• Privacy
• Notice
Accessibility
personas
con enfermedad
en etapa
I y en la mayoría
aquéllas
conPolicy
tumores
en las •fases
II a IV. El riesgo de recidiva es mayor cuando se observan
dichas características (Oliva, 2005).
Estas tumoraciones casi siempre son unilaterales, sólidas, amarillas, y miden entre 4 y 12 cm. Provienen del tipo celular que da origen a los túbulos
Universidad Nacional Autonoma de Mexico UNAM
seminíferos y a menudo se organizan en túbulos que son característicos en términos histopatológicos (Young, 2005); sin embargo, los tumores de
Access Provided by:
células de Sertoli pueden simular a muchas neoplasias distintas; en estos casos, la tinción con anticuerpos específicos es invaluable para confirmar el
diagnóstico.
Más de 80% de los casos se encuentra en etapa I al momento del diagnóstico, y casi todos son benignos. La atipia celular moderada, la actividad
mitótica enérgica y la necrosis de las células tumorales son indicadores de mayor potencial maligno. Estos datos se encuentran en 10% de las
personas con enfermedad en etapa I y en la mayoría de aquéllas con tumores en las fases II a IV. El riesgo de recidiva es mayor cuando se observan
dichas características (Oliva, 2005).
Tumores de células de Sertoli­Leydig
Estos tumores representa sólo 5%–10% de los tumores del estroma de los cordones sexuales ováricos (Zhang, 2007). Su incidencia es semejante a la
de los tumores de células de Sertoli, y la edad promedio es de 25 años. Aunque se han identificado en niñas y mujeres posmenopáusicas, más de 90%
se desarrolla durante la edad reproductiva.
Con frecuencia, dichos tumores producen hormonas esteroideas sexuales, más a menudo andrógenos. Como resultado, hay virilización franca en un
tercio de las pacientes y otro 10% tiene manifestaciones clínicas de exceso de andrógenos (Young, 1985). También son frecuentes los trastornos
menstruales. Por consiguiente, debe sospecharse un tumor de células de Sertoli­Leydig antes de una operación quirúrgica en pacientes con una masa
palpable unilateral en algún anexo y manifestaciones androgénicas. En estas mujeres el aumento del índice sérico de testosterona­androstenediona
es muy sugestivo del diagnóstico.
Aunque tales efectos hormonales son frecuentes, la mitad de las pacientes tiene síntomas inespecíficos de una masa abdominal como única molestia.
Pocas veces hay ascitis (Outwater, 2000). Las anomalías tiroideas también coexisten con los tumores de células de Sertoli­Leydig, con una frecuencia
que rebasa la casualidad.
Dichos tumores suelen ser grandes al momento de la extirpación. En la mayor parte de los casos, los tumores de células de Sertoli­Leydig son
amarillos y lobulados; pueden ser sólidos y parcialmente o totalmente quísticos (figura 36–10). En el nivel microscópico, estos tumores contienen
proporciones variables de células parecidas a las células del epitelio o del estroma testicular. Existe una superposición considerable entre los cinco
subtipos de diferenciación (clara, intermedia, deficiente, retiforme y heteróloga). Los tumores bien diferenciados tienen un comportamiento clínico
benigno (Chen, 2003; Young, 2005).
Figura 36–10.
Tumor de células de Sertoli­Leydig (SLCT, Sertoli­Leydig cell tumor). A . Los tumores de células de Sertoli­Leydig muestran características
macroscópicas variables que dependen del grado de diferenciación y de la presencia de elementos heterólogos. Esta muestra quirúrgica abierta tenía
una superficie de corte predominantemente sólida con quistes focalizados de colores abigarrados amarillo­marrón, y focos de hemorragia. B . Tumor
de células de Sertoli­Leydig bien diferenciado compuesto de túbulos huecos mezclados con grupos de células de Leydig maduras. C . Este tumor de
células de Sertoli­Leydig de diferenciación intermedia contiene túbulos sólidos que parecen simular a los que se observan en el testículo fetal.
(Reproducida con autorización de Dr. Katja Gwin).
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Page 21 / 34
Universidad Nacional Autonoma de Mexico UNAM
Access Provided by:
En general, 15%–20% de los tumores de células de Sertoli­Leydig tiene un comportamiento clínico maligno. El pronóstico depende sobre todo de la
etapa y del grado de diferenciación tumoral en estas variantes malignas, por ejemplo, Young y Scully (1985) hicieron un análisis clinicopatológico de
207 pacientes e identificaron enfermedad en etapa I en 97% de ellos. La supervivencia a cinco años para las pacientes en etapa I es mayor de 90%
(Zaloudek, 1984). Se observaron características malignas en cerca de 10% de los tumores con diferenciación intermedia y en 60% de las neoplasias
poco distinguibles. Los elementos retiformes y heterólogos sólo se observan en tumores de células de Sertoli­Leydig con diferenciación intermedia o
escasa, y casi siempre conllevan un mal pronóstico. En general, 2%–3% de los pacientes con enfermedad en etapas II a IV tienen un pronóstico
sombrío (Young, 1985).
Tumores de los cordones sexuales con túbulos anulares
Estos tumores representan 5% de los tumores del estroma de los cordones sexuales y se caracterizan por túbulos con forma de anillo y elementos
celulares distintivos con rasgos histológicos intermedios entre los tumores de células de Sertoli y los de células de la granulosa. Se reconocen dos
tipos clínicos distintos: primero, un tercio de los casos es benigno desde el punto de vista clínico y aparece en personas con síndrome de Peutz­
Jeghers (PJS,2023­2­27
Peutz­Jeghers
); por
lo general, dichas neoplasias son pequeñas, multifocales, calcificadas, bilaterales y se diagnostican en
Downloaded
1:40syndrome
A Your IP
is 132.248.9.8
Page 22 / 34
forma incidental.
De las pacientes
síndrome
de Peutz­Jeghers,
15% también
desarrollasexuales,
adenoma maligno del cuello uterino, un adenocarcinoma
CAPÍTULO
36: Tumores
ováricoscon
de células
germinales
y del estroma
de los cordones
©2023
McGraw
Hill. All RightsEnReserved.
ofde
Use
Privacy Policy
• Notice • Accessibility
raro y muy
bien diferenciado.
cambio, dosTerms
tercios
los• tumores
no se relacionan
con síndrome de Peutz­Jeghers. Estas masas son más grandes,
unilaterales, sintomáticas y tienen un índice de malignidad clínica de 15%–20% (Young, 1982).
Tumores de los cordones sexuales con túbulos anulares
Universidad Nacional Autonoma de Mexico UNAM
Access Provided by:
Estos tumores representan 5% de los tumores del estroma de los cordones sexuales y se caracterizan
por túbulos con forma de anillo y elementos
celulares distintivos con rasgos histológicos intermedios entre los tumores de células de Sertoli y los de células de la granulosa. Se reconocen dos
tipos clínicos distintos: primero, un tercio de los casos es benigno desde el punto de vista clínico y aparece en personas con síndrome de Peutz­
Jeghers (PJS, Peutz­Jeghers syndrome); por lo general, dichas neoplasias son pequeñas, multifocales, calcificadas, bilaterales y se diagnostican en
forma incidental. De las pacientes con síndrome de Peutz­Jeghers, 15% también desarrolla adenoma maligno del cuello uterino, un adenocarcinoma
raro y muy bien diferenciado. En cambio, dos tercios de los tumores no se relacionan con síndrome de Peutz­Jeghers. Estas masas son más grandes,
unilaterales, sintomáticas y tienen un índice de malignidad clínica de 15%–20% (Young, 1982).
Tumores de células esteroideas
Menos de 5% de los tumores del estroma de los cordones sexuales son tumores de células esteroideas. La edad promedio al momento del diagnóstico
es de 25 años, pero el rango de edad es amplio. Tales neoplasias están compuestas en su mayor parte o en su totalidad por células parecidas a las
secretoras de hormonas esteroideas y se clasifican de acuerdo con la composición histológica de estas células.
Los luteomas estromales son tumores con comportamiento clínico benigno, que por definición se encuentran por completo dentro del estroma
ovárico. Por lo general se observan en posmenopáusicas. Los efectos estrogénicos son frecuentes, sin embargo, algunas pacientes experimentan
manifestaciones androgénicas.
Los tumores de células de Leydig también son benignos y de forma similar casi siempre se encuentran en posmenopáusicas. En el examen
microscópico se distinguen por inclusiones citoplasmáticas rectangulares parecidas a cristales, llamadas cristales de Reinke. Las células de Leydig
secretan testosterona y estos tumores por lo general tienen efectos androgénicos.
Los tumores de células esteroideas no especificados (NOS, not otherwise specified) son el subtipo más frecuente de este grupo y casi siempre se
presentan en mujeres más jóvenes, en edad reproductiva. Algunos son grandes luteomas estromales que crecieron hasta llegar a la superficie ovárica
o tumores de células de Leydig en los que no pueden identificarse los cristales de Reinke. Estas neoplasias casi siempre se acompañan de exceso de
andrógenos, aunque también hay informes de producción excesiva de estrógenos o de cortisol (p. ej., síndrome de Cushing). Un tercio de los tumores
de células esteroideas no especificados tiene comportamiento clínico maligno y un pronóstico sombrío (Oliva, 2005).
Tumores no clasificados del estroma de los cordones sexuales
Los tumores no clasificados representan 5% de los tumores del estroma de los cordones sexuales y no tienen un patrón predominante claro de
diferenciación testicular (células de Sertoli) u ovárica (células de la granulosa). Estas neoplasias mal definidas son muy frecuentes durante el
embarazo debido a las alteraciones de sus características clínicas y patológicas usuales (Young, 2005); pueden producir estrógenos, andrógenos o
carecer de función. El pronóstico es similar al de los tumores de células de la granulosa y de células de Leydig con grados similares de diferenciación.
Ginandroblastomas
Los ginandroblastomas son el tipo más raro de tumor del estroma de los cordones sexuales ovárico. Se presentan a una edad promedio de 30 años y
las pacientes por lo general tienen irregularidades menstruales o evidencias de exceso hormonal. Los tumores se caracterizan por células de la
granulosa entremezcladas con túbulos formados por células de Sertoli. Quizá haya células de la teca, células de Leydig o ambas en proporciones
variables. Los ginandroblastomas tienen bajo potencial maligno y sólo se ha informado una muerte (Martin­Jimenez, 1994).
Tratamiento
Cirugía
La base del tratamiento para pacientes con tumor del estroma de los cordones sexuales ovárico es la ablación quirúrgica completa; este grupo
muestra insensibilidad relativa a la quimioterapia adyuvante o a la radiación. Así, los objetivos terapéuticos son establecer un diagnóstico hístico
definitivo, determinar la extensión de la enfermedad y eliminar cualquier tumor macroscópico en pacientes, poco frecuentes, con enfermedad en
etapas avanzadas. Además, durante la planificación preoperatoria, los médicos deben considerar la edad de la paciente y su deseo de fertilidad a
futuro. Para las mujeres que ya no desean tener hijos se realiza histerectomía con salpingooforectomía bilateral, mientras que en aquellas que aún
desean tener hijos puede ser apropiada la salpingooforectomía unilateral con conservación del útero, en cuyo caso el ovario residual puede ser
apropiado en ausencia de diseminación evidente de la enfermedad hacia este órgano (Zanagnolo, 2004). Se lleva a cabo la obtención de muestras
endometriales, en especial si se planifica la cirugía con conservación de la fertilidad en mujeres con tumores de las células de la granulosa o con
tecomas. Esto ocurre porque muchas de las pacientes tendrán hiperplasia o adenocarcinoma coexistentes, lo que afecta la decisión de la
histerectomía.
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
Page 23 / 34
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
La
cirugía
laparoscópica
de mínima
invasiónTerms
tiene varias
relevantes.
En•algunos
casos, el diagnóstico de tumor del estroma de los
©2023
McGraw
Hill. All Rights
Reserved.
of Useaplicaciones
• Privacy Policy
• Notice
Accessibility
cordones sexuales no puede establecerse hasta que se extirpa la masa por vía laparoscópica y se envía para valoración de corte congelado. Entonces
puede proceder la estadificación quirúrgica laparoscópica. Si no se obtiene el diagnóstico hasta que se confirma el informe final de patología después
futuro. Para las mujeres que ya no desean tener hijos se realiza histerectomía con salpingooforectomía bilateral, mientras que en aquellas que aún
Universidad
Nacional
Autonoma
Mexico
desean tener hijos puede ser apropiada la salpingooforectomía unilateral con conservación del útero,
en cuyo caso
el ovario
residualde
puede
ser UNAM
by: a cabo la obtención de muestras
apropiado en ausencia de diseminación evidente de la enfermedad hacia este órgano (Zanagnolo, Access
2004).Provided
Se lleva
endometriales, en especial si se planifica la cirugía con conservación de la fertilidad en mujeres con tumores de las células de la granulosa o con
tecomas. Esto ocurre porque muchas de las pacientes tendrán hiperplasia o adenocarcinoma coexistentes, lo que afecta la decisión de la
histerectomía.
La cirugía laparoscópica de mínima invasión tiene varias aplicaciones relevantes. En algunos casos, el diagnóstico de tumor del estroma de los
cordones sexuales no puede establecerse hasta que se extirpa la masa por vía laparoscópica y se envía para valoración de corte congelado. Entonces
puede proceder la estadificación quirúrgica laparoscópica. Si no se obtiene el diagnóstico hasta que se confirma el informe final de patología después
de la operación quirúrgica, puede proponerse la estadificación laparoscópica para determinar si existe enfermedad metastásica; esto puede reducir la
morbilidad de una segunda cirugía (Shim, 2013).
La estadificación quirúrgica es esencial para determinar la extensión de la enfermedad y la necesidad de tratamiento adyuvante en la mayor parte de
las mujeres con subtipos potencialmente malignos de tumores del estroma de los cordones sexuales (figura 36–11). Se ha mencionado que en sólo
20% de los casos se completa la estadificación (Abu­Rustum, 2006; Brown, 2009). Los datos más recientes sugieren que debido a las vías de
diseminación superficial y hematógena, puede modificarse el procedimiento estándar para cáncer ovárico. Los lavados pélvicos, la exploración
abdominal, las biopsias peritoneales y la omentectomía parcial conservan su importancia, pero cada vez se cuestiona más la utilidad de la
linfadenectomía pélvica y paraaórtica como medida sistemática. En un estudio de National Cancer Database de 2680 tumores de células de la
granulosa ovárica, la mitad de ellos fue objeto de linfadenectomía, pero sólo 3% de los casos tenía ganglios positivos; por lo general, esos casos tenían
una enfermedad generalizada concurrente (Seagle, 2017). Además, la realización de una linfadenectomía no mejora las tasas de supervivencia en
aquellas pacientes con tumor del estroma de los cordones sexuales (Cheng, 2018).
Figura 36–11.
Estadificación de los tumores del estroma de los cordones sexuales. PJS, síndrome de Peutz­Jeghers.
La extirpación quirúrgica de tumores del estroma de los cordones sexuales productores de hormonas sexuales causa una caída inmediata de las altas
concentraciones preoperatorias de dichas moléculas. Sin embargo, la resolución parcial o completa de las manifestaciones físicas de dichas
concentraciones se alcanza en forma gradual.
Vigilancia
En general, las mujeres con tumores del estroma de los cordones sexuales ováricos en etapa I tienen un pronóstico posquirúrgico excelente y casi
siempre se vigilan en intervalos regulares sin necesidad de tratamiento adicional (Morgan, 2016). La vigilancia incluye un examen físico general,
valoración pélvica, el análisis de marcadores séricos si se encontraban elevados desde un inicio, y estudios de imagen según lo indiquen las
manifestaciones clínicas.
Quimioterapia
La decisión de administrar tratamiento posoperatorio depende de diversos factores (figura 36–12). Aunque casi siempre se tratan sólo con cirugía, los
tumores del estroma de los cordones sexuales ováricos en etapa I a veces necesitan quimioterapia adyuvante cuando el tumor es grande, el índice
mitótico es elevado, el tumor se rompe, la estadificación es incompleta, los resultados de patología son dudosos o si hay excrecencias capsulares. Se
Downloaded
2023­2­27
Your
is 132.248.9.8
cree que las mujeres
con 1:40
una oAmás
deIP
estas
características sospechosas tienen mayor riesgo de recaer y deben considerarse como candidatas para
Page 24 / 34
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
recibir quimioterapia basada en platino (Morgan, 2016). La enfermedad en etapas II a IV amerita tratamiento posquirúrgico. En general, los tumores
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
del estroma de los cordones sexuales tienen menor sensibilidad a la quimioterapia que otras neoplasias malignas ováricas, sin embargo, se
recomiendan los fármacos adyuvantes con base de platino (van Meurs, 2014).
Quimioterapia
Universidad Nacional Autonoma de Mexico UNAM
Access Provided by:
La decisión de administrar tratamiento posoperatorio depende de diversos factores (figura 36–12). Aunque casi siempre se tratan sólo con cirugía, los
tumores del estroma de los cordones sexuales ováricos en etapa I a veces necesitan quimioterapia adyuvante cuando el tumor es grande, el índice
mitótico es elevado, el tumor se rompe, la estadificación es incompleta, los resultados de patología son dudosos o si hay excrecencias capsulares. Se
cree que las mujeres con una o más de estas características sospechosas tienen mayor riesgo de recaer y deben considerarse como candidatas para
recibir quimioterapia basada en platino (Morgan, 2016). La enfermedad en etapas II a IV amerita tratamiento posquirúrgico. En general, los tumores
del estroma de los cordones sexuales tienen menor sensibilidad a la quimioterapia que otras neoplasias malignas ováricas, sin embargo, se
recomiendan los fármacos adyuvantes con base de platino (van Meurs, 2014).
Figura 36–12.
Tratamiento posoperatorio de los tumores del estroma de los cordones sexuales.
El régimen de cinco días de tratamiento con bleomicina, etopósido y cisplatino es la quimioterapia combinada de primera línea más utilizada
(Gershenson, 1996; Homesley, 1999). Para aquellas pacientes en quienes se extirpó el tumor completo, son suficientes tres cursos administrados cada
tres semanas. Se recomiendan cuatro ciclos para mujeres con resección incompleta del tumor (Homesley, 1999). Además de bleomicina, etopósido y
cisplatino, los taxanos han demostrado actividad moderada como medicamento único contra los tumores del estroma de los cordones sexuales
ováricos, pero la combinación de quimioterapia con paclitaxel y carboplatino parece más prometedora (Brown, 2004, 2005; Burton, 2016). A fin de
determinar el régimen más efectivo, hoy día se lleva a cabo un estudio prospectivo con asignación al azar que compara el paclitaxel y carboplatino con
bleomicina, etopósido y cisplatino en pacientes con tumor del estroma de los cordones sexuales ovárico recién diagnosticado (protocolo GOG #264).
Por desgracia, la relativa escasez de mujeres que tienen tumor del estroma de los cordones sexuales ovárico y luego reciben quimioterapia limita la
capacidad de realizar grandes estudios con asignación al azar.
Radiación
Hoy en día, la radioterapia posoperatoria está limitada en el tratamiento de los tumores del estroma de los cordones sexuales ováricos. Existe
evidencia que indica una mayor supervivencia al menos en algunas mujeres con enfermedad recién diagnosticada que recibieron radioterapia
abdominal total (Wolf, 1999). Sin embargo, la quimioterapia suele ser el tratamiento posoperatorio primario porque casi siempre es más tolerable,
más accesible y más fácil de administrar. Es mejor reservar la radioterapia para paliar síntomas locales (Dubuc­Lissoir, 2001).
Recurrencia
El tratamiento del tumor del estroma de los cordones sexuales ovárico recidivante depende de las circunstancias clínicas. La reducción quirúrgica
secundaria de volumen debe considerarse con seriedad por el patrón de crecimiento lento e indoloro, el intervalo libre de enfermedad casi siempre
prolongado después del tratamiento inicial y la insensibilidad inherente a la quimioterapia (Crew, 2005; Powell, 2001). La quimioterapia combinada de
fármacos basados en platino es el tratamiento de primera elección para la enfermedad recidivante, con o sin reducción quirúrgica de volumen (Uygun,
2003). De los regímenes disponibles, la combinación de bleomicina, etopósido y cisplatino es la que se usa con mayor frecuencia porque tiene el índice
Downloaded
2023­2­27
1:40 A (Homesley,
Your IP is 132.248.9.8
de respuesta más
alto conocido
1999).
Page 25 / 34
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023
McGraw
Hill. All Rights
Reserved.
Terms
Use • enfermedad
Privacy Policy
• Notice pese
• Accessibility
No existe
un tratamiento
estándar
para mujeres
queofsufran
progresiva
a la cirugía intensiva y quimioterapia con platino. De forma
reciente, el bevacizumab mostró una tasa de respuesta de 17% en un estudio de fase II (Brown, 2014a). El tratamiento hormonal tiene mínima
toxicidad, pero la experiencia clínica con este método es extremadamente limitada (Hardy, 2005). El acetato de medroxiprogesterona y la leuprorelina,
Universidad Nacional
de quirúrgica
Mexico UNAM
El tratamiento del tumor del estroma de los cordones sexuales ovárico recidivante depende de las circunstancias
clínicas.Autonoma
La reducción
Access
Provided
by:
secundaria de volumen debe considerarse con seriedad por el patrón de crecimiento lento e indoloro, el intervalo libre de enfermedad casi siempre
prolongado después del tratamiento inicial y la insensibilidad inherente a la quimioterapia (Crew, 2005; Powell, 2001). La quimioterapia combinada de
fármacos basados en platino es el tratamiento de primera elección para la enfermedad recidivante, con o sin reducción quirúrgica de volumen (Uygun,
2003). De los regímenes disponibles, la combinación de bleomicina, etopósido y cisplatino es la que se usa con mayor frecuencia porque tiene el índice
de respuesta más alto conocido (Homesley, 1999).
No existe un tratamiento estándar para mujeres que sufran enfermedad progresiva pese a la cirugía intensiva y quimioterapia con platino. De forma
reciente, el bevacizumab mostró una tasa de respuesta de 17% en un estudio de fase II (Brown, 2014a). El tratamiento hormonal tiene mínima
toxicidad, pero la experiencia clínica con este método es extremadamente limitada (Hardy, 2005). El acetato de medroxiprogesterona y la leuprorelina,
un agonista de la hormona liberadora de gonadotropinas (GnRH, gonadotropin­releasing hormone), tienen actividad demostrada para detener el
crecimiento de los tumores del estroma de los cordones sexuales ováricos recidivantes (Fishman, 1996; Homesley, 1999). Sin embargo, es probable
que los antagonistas de GnRH no sean tan efectivos (Ameryckx, 2005).
Además de los fármacos habituales, el descubrimiento de la mutación FOXL2 402C>G (exclusiva de todos los tumores de células de la granulosa de tipo
adulto) podría conducir al desarrollo de tratamientos dirigidos para las mujeres con enfermedad avanzada o recidivante. Hoy en día, FOXL2 no es un
objetivo farmacológico perfecto como factor de transcripción; el conocimiento sobre su función y sus efectos subsiguientes podrían identificar
alteraciones moleculares en estos tumores (Kobel, 2009).
Pronóstico
En general, los tumores del estroma de los cordones sexuales ováricos tienen un pronóstico mucho mejor que los carcinomas ováricos epiteliales,
sobre todo porque la mayoría de las mujeres con tumores del estroma de los cordones sexuales se diagnostican en la etapa I de la enfermedad. Los
tumores en etapas II a IV son raros, pero las pacientes con estos cánceres tienen un mal pronóstico, similar al de sus contrapartes con enfermedad
epitelial. Por desgracia, las tasas de supervivencia para los tumores del estroma de los cordones sexuales ováricos no han mejorado durante los
últimos decenios (Chan, 2006). De los factores pronósticos, la edad más joven, la etapa quirúrgica, el tamaño del tumor y la enfermedad residual son
los más importantes (Lee, 2008; Seagle, 2017; Zanagnolo, 2004).
Tratamiento durante el embarazo
Raras veces se detectan tumores del estroma de los cordones sexuales ováricos durante el embarazo (Okada, 2004). Los tumores de células de la
granulosa son los tumores del estroma de los cordones sexuales más frecuentes, pero sólo 10% se diagnostica durante el embarazo (Hasiakos, 2006).
La presencia de tumores del estroma de los cordones sexuales se diagnostica en un tercio de las embarazadas en forma incidental durante la
operación cesárea, un tercio presenta dolor o inflamación abdominal y el resto puede presentarse con hemoperitoneo, virilización o hemorragia
vaginal (Young, 1984). El tratamiento quirúrgico debe ser el mismo que para una paciente no embarazada. En la mayor parte de los casos, el
procedimiento primario es conservador con salpingooforectomía unilateral y estadificación quirúrgica, aunque la histerectomía y la
salpingooforectomía bilateral están indicadas en algunas circunstancias (Young, 1984). En la institución donde ejercen los autores, la quimioterapia
posoperatoria casi siempre se pospone hasta después del parto porque los tumores del estroma de los cordones sexuales tienen un patrón de
crecimiento lento.
REFERENCIAS
Aboud E: A review of granulosa cell tumours and thecomas of the ovary. Arch Gynecol Obstet 259:161, 1997 [PubMed: 9271834]
Abu­Rustum NR, Restivo A, Ivy J, et al: Retroperitoneal nodal metastasis in primary and recurrent granulosa cell tumors of the ovary. Gynecol Oncol
103:31, 2006 [PubMed: 16537089]
Ameryckx L, Fatemi HM, De Sutter P, et al: GnRH antagonist in the adjuvant treatment of a recurrent ovarian granulosa cell tumor: a case report.
Gynecol Oncol 99:764, 2005 [PubMed: 16112181]
Aoki Y, Kase H, Fujita K, et al: Dysgerminoma with a slightly elevated alpha­fetoprotein level diagnosed as a mixed germ cell tumor after recurrence.
Gynecol Obstet Invest 55:58, 2003 [PubMed: 12624554]
Beiner ME, Gotlieb WH, Korach Y, et al: Cystectomy for immature teratoma of the ovary. Gynecol Oncol 93:381, 2004 [PubMed: 15099949]
Bentivegna E, Azaïs H, Uzan C, et al: Surgical outcomes after debulking surgery for intraabdominal ovarian growing teratoma syndrome: analysis of
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
38 cases. Ann
Surg
Oncol 22(3
suppl):S964,
2015
[PubMed:y26033179]
Page 26 / 34
CAPÍTULO
36:
Tumores
ováricos
de células
germinales
del estroma de los cordones sexuales,
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Billmire D, Vinocur C, Rescorla F, et al: Outcome and staging evaluation in malignant germ cell tumors of the ovary in children and adolescents: an
intergroup study. J Pediatr Surg 39:424, 2004 [PubMed: 15017564]
Aoki Y, Kase H, Fujita K, et al: Dysgerminoma with a slightly elevated alpha­fetoprotein level diagnosed as a mixed germ cell tumor after recurrence.
Universidad Nacional Autonoma de Mexico UNAM
Gynecol Obstet Invest 55:58, 2003 [PubMed: 12624554]
Access Provided by:
Beiner ME, Gotlieb WH, Korach Y, et al: Cystectomy for immature teratoma of the ovary. Gynecol Oncol 93:381, 2004 [PubMed: 15099949]
Bentivegna E, Azaïs H, Uzan C, et al: Surgical outcomes after debulking surgery for intraabdominal ovarian growing teratoma syndrome: analysis of
38 cases. Ann Surg Oncol 22(3 suppl):S964, 2015 [PubMed: 26033179]
Billmire D, Vinocur C, Rescorla F, et al: Outcome and staging evaluation in malignant germ cell tumors of the ovary in children and adolescents: an
intergroup study. J Pediatr Surg 39:424, 2004 [PubMed: 15017564]
Billmire DF, Cullen JW, Rescorla FJ, et al: Surveillance after initial surgery for pediatric and adolescent girls with stage I ovarian germ cell tumors:
report from the Children’s Oncology Group. J Clin Oncol 32(5):465, 2014 [PubMed: 24395845]
Bonazzi C, Peccatori F, Colombo N, et al: Pure ovarian immature teratoma, a unique and curable disease: 10 years’ experience of 32 prospectively
treated patients. Obstet Gynecol 84:598, 1994 [PubMed: 7522313]
Boyce EA, Costaggini I, Vitonis A, et al: The epidemiology of ovarian granulosa cell tumors: a case­control study. Gynecol Oncol 115:221, 2009
[PubMed: 19664811]
Brown J, Brady WE, Schink J, et al: Efficacy and safety of bevacizumab in recurrent sex cord­stromal ovarian tumors: results of a phase 2 trial of the
Gynecologic Oncology Group. Cancer 120(3):344, 2014a
Brown J, Friedlander M, Backes FJ, et al: Gynecologic Cancer Intergroup (GCIG) consensus review for ovarian germ cell tumors. Int J Gynecol Cancer
24(9 Suppl 3):S48, 2014b
Brown J, Shvartsman HS, Deavers MT, et al: The activity of taxanes compared with bleomycin, etoposide, and cisplatin in the treatment of sex cord–
stromal ovarian tumors. Gynecol Oncol 97:489, 2005 [PubMed: 15863149]
Brown J, Shvartsman HS, Deavers MT, et al: The activity of taxanes in the treatment of sex cord–stromal ovarian tumors. J Clin Oncol 22:3517, 2004
[PubMed: 15337800]
Brown J, Sood AK, Deavers MT, et al: Patterns of metastasis in sex cord­stromal tumors of the ovary: can routine staging lymphadenectomy be
omitted? Gynecol Oncol 113:86, 2009 [PubMed: 19162310]
Burton ER, Brady M, Homesley HD, et al: A phase II study of paclitaxel for the treatment of ovarian stromal tumors: an NRG Oncology/Gynecologic
Oncology Group Study. Gynecol Oncol 140(1):48, 2016 [PubMed: 26616224]
Carmina E, Rosato F, Janni A, et al: Extensive clinical experience: relative prevalence of different androgen excess disorders in 950 women referred
because of clinical hyperandrogenism. J Clin Endocrinol Metab 91:2, 2006 [PubMed: 16263820]
Cass DL, Hawkins E, Brandt ML, et al: Surgery for ovarian masses in infants, children, and adolescents: 102 consecutive patients treated in a 15­year
period. J Pediatr Surg 36:693, 2001 [PubMed: 11329568]
Cathro HP, Stoler MH: The utility of calretinin, inhibin, and WT1 immunohistochemical staining in the differential diagnosis of ovarian tumors. Hum
Pathol 36:195, 2005 [PubMed: 15754297]
Chan JK, Cheung MK, Husain A, et al: Patterns and progress in ovarian cancer over 14 years. Obstet Gynecol 108:521, 2006 [PubMed: 16946210]
Chan JK, Tewari KS, Waller S, et al: The influence of conservative surgical practices for malignant ovarian germ cell tumors. J Surg Oncol 98:111,
2008 [PubMed: 18563734]
Chan JK, Zhang M, Kaleb V, et al: Prognostic factors responsible for survival in sex cord stromal tumors of the ovary: a multivariate analysis. Gynecol
Oncol 96:204, 2005 [PubMed: 15589602]
Chechia A, Attia L, Temime RB, et al: Incidence, clinical analysis, and management of ovarian fibromas and fibrothecomas. Am J Obstet Gynecol
199:473e1, 2008
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
Page 27 / 34
CAPÍTULO
de células
germinales
y deletoposide
estroma de
cordones
sexuales,
Chen CA, Lin36:
H,Tumores
Weng CS,ováricos
et al: Outcome
of 3­day
bleomycin,
andlos
cisplatin
chemotherapeutic
regimen for patients with malignant ovarian
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
germ cell tumours: a Taiwanese Gynecologic Oncology Group study. Eur J Cancer 50(18):3161, 2014 [PubMed: 25459394]
Universidad
Nacional
Autonomaanalysis.
de Mexico
UNAM
Chan JK, Zhang M, Kaleb V, et al: Prognostic factors responsible for survival in sex cord stromal tumors
of the ovary:
a multivariate
Gynecol
Access Provided by:
Oncol 96:204, 2005 [PubMed: 15589602]
Chechia A, Attia L, Temime RB, et al: Incidence, clinical analysis, and management of ovarian fibromas and fibrothecomas. Am J Obstet Gynecol
199:473e1, 2008
Chen CA, Lin H, Weng CS, et al: Outcome of 3­day bleomycin, etoposide and cisplatin chemotherapeutic regimen for patients with malignant ovarian
germ cell tumours: a Taiwanese Gynecologic Oncology Group study. Eur J Cancer 50(18):3161, 2014 [PubMed: 25459394]
Chen VW, Ruiz B, Killeen JL, et al: Pathology and classification of ovarian tumors. Cancer 97:2631, 2003 [PubMed: 12733128]
Cheng H, Peng J, Yang Z, et al: Prognostic significance of lymphadenectomy in malignant ovarian sex cord stromal tumor: a retrospective cohort
study and meta­analysis. Gynecol Oncol 148(1):91, 2018 [PubMed: 29107349]
Cicin I, Saip P, Guney N, et al: Yolk sac tumours of the ovary: evaluation of clinicopathological features and prognostic factors. Eur J Obstet Gynecol
Reprod Biol 146:210, 2009 [PubMed: 19419810]
Colombo N, Parma G, Zanagnolo V, et al: Management of ovarian stromal cell tumors. J Clin Oncol 25:2944, 2007 [PubMed: 17617526]
Corakci A, Ozeren S, Ozkan S, et al: Pure nongestational choriocarcinoma of ovary. Arch Gynecol Obstet 271:176, 2005 [PubMed: 14991382]
Crew KD, Cohen MH, Smith DH, et al: Long natural history of recurrent granulosa cell tumor of the ovary 23 years after initial diagnosis: a case report
and review of the literature. Gynecol Oncol 96:235, 2005 [PubMed: 15589608]
Culine S, Lhomme C, Michel G, et al: Is there a role for second­look laparotomy in the management of malignant germ cell tumors of the ovary?
Experience at Institut Gustave Roussy. J Surg Oncol 62:40, 1996 [PubMed: 8618400]
Curtin JP, Morrow CP, D’Ablaing G, et al: Malignant germ cell tumors of the ovary: 20­year report of LAC­USC Women’s Hospital. Int J Gynecol Cancer
4:29, 1994 [PubMed: 11578382]
Cushing B, Giller R, Ablin A, et al: Surgical resection alone is effective treatment for ovarian immature teratoma in children and adolescents: a report
of the Pediatric Oncology Group and the Children’s Cancer Group. Am J Obstet Gynecol 181:353, 1999 [PubMed: 10454682]
Dark GG, Bower M, Newlands ES, et al: Surveillance policy for stage I ovarian germ cell tumors. J Clin Oncol 15:620, 1997 [PubMed: 9053485]
Dimopoulos MA, Papadimitriou C, Hamilos G, et al: Treatment of ovarian germ cell tumors with a 3­day bleomycin, etoposide, and cisplatin regimen:
a prospective multicenter study. Gynecol Oncol 95:695, 2004 [PubMed: 15581984]
Dos Santos L, Mok E, Iasonos A, et al: Squamous cell carcinoma arising in mature cystic teratoma of the ovary: a case series and review of the
literature. Gynecol Oncol 105:321, 2007 [PubMed: 17240432]
Dubuc­Lissoir J, Berthiaume MJ, Boubez G, et al: Bone metastasis from a granulosa cell tumor of the ovary. Gynecol Oncol 83:400, 2001 [PubMed:
11606104]
East N, Alobaid A, Goffin F, et al: Granulosa cell tumour: a recurrence 40 years after initial diagnosis. J Obstet Gynaecol Can 27:363, 2005 [PubMed:
15937611]
Elit L, Bocking A, Kenyon C, et al: An endodermal sinus tumor diagnosed in pregnancy: case report and review of the literature. Gynecol Oncol 72:123,
1999 [PubMed: 9889045]
Fishman A, Kudelka AP, Tresukosol D, et al: Leuprolide acetate for treating refractory or persistent ovarian granulosa cell tumor. J Reprod Med
41:393, 1996 [PubMed: 8799913]
Frausto SD, Geisler JP, Fletcher MS, et al: Late recurrence of juvenile granulosa cell tumor of the ovary. Am J Obstet Gynecol 1:366, 2004
Gainford MC, Tinker A, Carter J, et al: Malignant transformation within ovarian dermoid cysts: an audit of treatment received and patient outcomes.
An Australia New
Zealand1:40
Gynaecological
Group (ANZGOG) and Gynaecologic Cancer Intergroup (GCIG) study. Int J Gynecol Cancer 20:75,
Downloaded
2023­2­27
A Your IP isOncology
132.248.9.8
Page 28 / 34
CAPÍTULO
36:
Tumores
ováricos
de
células
germinales
y del estroma de los cordones sexuales,
2010 [PubMed: 20130506]
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Galani E, Alamanis C, Dimopoulos MA: Familial female and male germ cell cancer: a new syndrome? Gynecol Oncol 96:254, 2005 [PubMed: 15589612]
Fishman A, Kudelka AP, Tresukosol D, et al: Leuprolide acetate for treating refractory or persistent ovarian granulosa cell tumor. J Reprod Med
Universidad Nacional Autonoma de Mexico UNAM
41:393, 1996 [PubMed: 8799913]
Access Provided by:
Frausto SD, Geisler JP, Fletcher MS, et al: Late recurrence of juvenile granulosa cell tumor of the ovary. Am J Obstet Gynecol 1:366, 2004
Gainford MC, Tinker A, Carter J, et al: Malignant transformation within ovarian dermoid cysts: an audit of treatment received and patient outcomes.
An Australia New Zealand Gynaecological Oncology Group (ANZGOG) and Gynaecologic Cancer Intergroup (GCIG) study. Int J Gynecol Cancer 20:75,
2010 [PubMed: 20130506]
Galani E, Alamanis C, Dimopoulos MA: Familial female and male germ cell cancer: a new syndrome? Gynecol Oncol 96:254, 2005 [PubMed: 15589612]
Gershenson DM: Management of ovarian germ cell tumors. J Clin Oncol 25:2938, 2007 [PubMed: 17617525]
Gershenson DM, Morris M, Burke TW, et al: Treatment of poor­prognosis sex cord–stromal tumors of the ovary with the combination of bleomycin,
etoposide, and cisplatin. Obstet Gynecol 87:527, 1996 [PubMed: 8602303]
Gershenson DM, Morris M, Cangir A, et al: Treatment of malignant germ cell tumors of the ovary with bleomycin, etoposide, and cisplatin. J Clin
Oncol 8:715, 1990 [PubMed: 1690272]
Hardy RD, Bell JG, Nicely CJ, et al: Hormonal treatment of a recurrent granulosa cell tumor of the ovary: case report and review of the literature.
Gynecol Oncol 96:865, 2005 [PubMed: 15721440]
Hasiakos D, Papakonstantinou K, Goula K, et al: Juvenile granulosa cell tumor associated with pregnancy: report of a case and review of the
literature. Gynecol Oncol 100(2):426, 2006 [PubMed: 16256182]
Heravi­Moussavi A, Anglesio MS, Cheng SW, et al: Recurrent somatic DICER1 mutations in nonepithelial ovarian cancers. N Engl J Med 366(3):234,
2012 [PubMed: 22187960]
Hoepffner W, Horn LC, Simon E, et al: Gonadoblastomas in 5 patients with 46,XY gonadal dysgenesis. Exp Clin Endocrinol Diabetes 113:231, 2005
[PubMed: 15891960]
Homesley HD, Bundy BN, Hurteau JA, et al: Bleomycin, etoposide, and cisplatin combination therapy of ovarian granulosa cell tumors and other
stromal malignancies: a Gynecologic Oncology Group study. Gynecol Oncol 72:131, 1999 [PubMed: 10021290]
Horbelt D, Delmore J, Meisel R, et al: Mixed germ cell malignancy of the ovary concurrent with pregnancy. Obstet Gynecol 84:662, 1994 [PubMed:
9205440]
Hsu YJ, Pai L, Chen YC, et al: Extragonadal germ cell tumors in Taiwan: an analysis of treatment results of 59 patients. Cancer 95:766, 2002 [PubMed:
12209720]
Jung SE, Rha SE, Lee JM, et al: CT and MRI findings of sex cord–stromal tumor of the ovary. AJR Am J Roentgenol 185:207, 2005 [PubMed: 15972425]
Kalfa N, Patte C, Orbach D, et al: A nationwide study of granulosa cell tumors in pre­ and postpubertal girls: missed diagnosis of endocrine
manifestations worsens prognosis. J Pediatr Endocrinol Metab 18:25, 2005 [PubMed: 15679066]
Kim SH, Kang SB: Ovarian dysgerminoma: color Doppler ultrasonographic findings and comparison with CT and MR imaging findings. J Ultrasound
Med 14:843, 1995 [PubMed: 8551550]
Kleppe M, Amkreutz LC, Van Gorp T, et al: Lymph­node metastasis in stage I and II sex cord stromal and malignant germ cell tumours of the ovary: a
systematic review. Gynecol Oncol 133(1):124, 2014 [PubMed: 24440833]
Kobel M, Gilks CB, Huntsman DG: Adult­type granulosa cell tumors and FOXL2 mutation. Cancer Res 69:9160, 2009 [PubMed: 19996294]
Kumar S, Shah JP, Bryant CS, et al: The prevalence and prognostic impact of lymph node metastasis in malignant germ cell tumors of the ovary.
Gynecol Oncol 110:125, 2008 [PubMed: 18571705]
Kurihara S, Hirakawa T, Amada S, et al: Inhibin­producing ovarian granulosa cell tumor as a cause of secondary amenorrhea: case report and review
Downloaded
2023­2­27
A Your
is 132.248.9.8
of the literature.
J Obstet1:40
Gynaecol
ResIP30:439,
2004 [PubMed: 15566459]
Page 29 / 34
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Kurman RJ, Carcangiu ML, Herrington CS, et al (eds): WHO Classification of Tumours of Female Reproductive Organs, 4th ed. Lyon, International
Agency for Research on Cancer, 2014
Kobel M, Gilks CB, Huntsman DG: Adult­type granulosa cell tumors and FOXL2 mutation. Cancer Res 69:9160, 2009 [PubMed: 19996294]
Universidad Nacional Autonoma de Mexico UNAM
Access Provided by:
Kumar S, Shah JP, Bryant CS, et al: The prevalence and prognostic impact of lymph node metastasis
in malignant germ cell tumors of the ovary.
Gynecol Oncol 110:125, 2008 [PubMed: 18571705]
Kurihara S, Hirakawa T, Amada S, et al: Inhibin­producing ovarian granulosa cell tumor as a cause of secondary amenorrhea: case report and review
of the literature. J Obstet Gynaecol Res 30:439, 2004 [PubMed: 15566459]
Kurman RJ, Carcangiu ML, Herrington CS, et al (eds): WHO Classification of Tumours of Female Reproductive Organs, 4th ed. Lyon, International
Agency for Research on Cancer, 2014
Kusamura S, Teixeira LC, dos Santos MA, et al: Ovarian germ cell cancer: clinicopathologic analysis and outcome of 31 cases. Tumori 86:450, 2000
[PubMed: 11218184]
LaPolla JP, Fiorica JV, Turnquist D, et al: Successful therapy of metastatic embryonal carcinoma coexisting with gonadoblastoma in a patient with
46,XY pure gonadal dysgenesis (Swyer’s syndrome). Gynecol Oncol 37:417, 1990 [PubMed: 2190872]
Leblanc E, Querleu D, Narducci F, et al: Laparoscopic restaging of early stage invasive adnexal tumors: a 10­year experience. Gynecol Oncol 94:624,
2004 [PubMed: 15350350]
Lee YK, Park NH, Kim JW, et al: Characteristics of recurrence in adult­type granulosa cell tumor. Int J Gynecol Cancer 18:642, 2008 [PubMed:
17868338]
Li H, Hong W, Zhang R, et al: Retrospective analysis of 67 consecutive cases of pure ovarian immature teratoma. Chin Med J (Engl) 115:1496, 2002
[PubMed: 12490095]
Li J, Yang W, Wu X: Prognostic factors and role of salvage surgery in chemorefractory ovarian germ cell malignancies: a study in Chinese patients.
Gynecol Oncol 105:769, 2007 [PubMed: 17459461]
Liu Q, Ding X, Yang J, et al: The significance of comprehensive staging surgery in malignant ovarian germ cell tumors. Gynecol Oncol 131(3):551, 2013
[PubMed: 24007946]
Low JJ, Perrin LC, Crandon AJ, et al: Conservative surgery to preserve ovarian function in patients with malignant ovarian germ cell tumors: a review
of 74 cases. Cancer 89:391, 2000 [PubMed: 10918171]
Majzlin G, Stevens FL: Meigs’ syndrome. Case report and review of literature. J Int Coll Surg 42:625, 1964 [PubMed: 14209105]
Marelli G, Carinelli S, Mariani A, et al: Sclerosing stromal tumor of the ovary: report of eight cases and review of the literature. Eur J Obstet Gynecol
Reprod Biol 76:85, 1998 [PubMed: 9481554]
Marina NM, Cushing B, Giller R, et al: Complete surgical excision is effective treatment for children with immature teratomas with or without
malignant elements: a Pediatric Oncology Group/Children’s Cancer Group Intergroup study. J Clin Oncol 17:2137, 1999 [PubMed: 10561269]
Martin­Jimenez A, Condom­Munro E, Valls­Porcel M, et al: [Gynandroblastoma of the ovary: review of the literature.] French. J Gynecol Obstet Biol
Reprod (Paris) 23:391, 1994 [PubMed: 8051366]
McKenna M, Kenny B, Dorman G, et al: Combined adult granulosa cell tumor and mucinous cystadenoma of the ovary: granulosa cell tumor with
heterologous mucinous elements. Int J Gynecol Pathol 24:224, 2005 [PubMed: 15968196]
Messing MJ, Gershenson DM, Morris M, et al: Primary treatment failure in patients with malignant ovarian germ cell neoplasms. Int J Gynecol Cancer
2:295, 1992 [PubMed: 11576272]
Miller BE, Barron BA, Dockter ME, et al: Parameters of differentiation and proliferation in adult granulosa cell tumors of the ovary. Cancer Detect Prev
25:48, 2001 [PubMed: 11270421]
Mom CH, Engelen MJ, Willemse PH, et al: Granulosa cell tumors of the ovary: the clinical value of serum inhibin A and B levels in a large single center
cohort. Gynecol Oncol 105:365, 2007 [PubMed: 17306349]
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
Page 30 / 34
CAPÍTULO
Tumores ováricos
de células
germinales
y del estroma
de los cordones
sexuales,
Morgan RJ 36:
Jr, Armstrong
DK, Alvarez
RD, et al:
Ovarian cancer,
version 1.2016,
NCCN clinical
practice guidelines in oncology. J Natl Compr Canc Netw
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
14(9):1134, 2016 [PubMed: 27587625]
Universidad
Nacional
Autonoma
de Mexico
UNAM
Miller BE, Barron BA, Dockter ME, et al: Parameters of differentiation and proliferation in adult granulosa
cell tumors
of the
ovary. Cancer
Detect
Prev
Access Provided by:
25:48, 2001 [PubMed: 11270421]
Mom CH, Engelen MJ, Willemse PH, et al: Granulosa cell tumors of the ovary: the clinical value of serum inhibin A and B levels in a large single center
cohort. Gynecol Oncol 105:365, 2007 [PubMed: 17306349]
Morgan RJ Jr, Armstrong DK, Alvarez RD, et al: Ovarian cancer, version 1.2016, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw
14(9):1134, 2016 [PubMed: 27587625]
Morimura Y, Nishiyama H, Yanagida K, et al: Dysgerminoma with syncytiotrophoblastic giant cells arising from 46,XX pure gonadal dysgenesis. Obstet
Gynecol 92:654, 1998 [PubMed: 9764651]
Murugaesu N, Schmid P, Dancey G, et al: Malignant ovarian germ cell tumors: identification of novel prognostic markers and long­term outcome after
multimodality treatment. J Clin Oncol 24:4862, 2006 [PubMed: 17050871]
Nasioudis D, Chapman­Davis E, Frey MK, et al: Management and prognosis of ovarian yolk sac tumors; an analysis of the National Cancer Data Base.
Gynecol Oncol 147(2):296, 2017 [PubMed: 28803748]
O’Connor DM, Norris HJ: The influence of grade on the outcome of stage I ovarian immature (malignant) teratomas and the reproducibility of grading.
Int J Gynecol Pathol 13:283, 1994 [PubMed: 7814189]
Okada I, Nakagawa S, Takemura Y, et al: Ovarian thecoma associated in the first trimester of pregnancy. J Obstet Gynaecol Res 30:368, 2004
[PubMed: 15327450]
Oliva E, Alvarez T, Young RH: Sertoli cell tumors of the ovary: a clinicopathologic and immunohistochemical study of 54 cases. Am J Surg Pathol
29:143, 2005 [PubMed: 15644771]
Oliva E, Andrada E, Pezzica E, et al: Ovarian carcinomas with choriocarcinomatous differentiation. Cancer 72:2441, 1993 [PubMed: 8402461]
Outwater EK, Marchetto B, Wagner BJ: Virilizing tumors of the ovary: imaging features. Ultrasound Obstet Gynecol 15:365, 2000 [PubMed: 10976475]
Paladini D, Testa A, Van Holsbeke C, et al: Imaging in gynecological disease (5): clinical and ultrasound characteristics in fibroma and fibrothecoma of
the ovary. Ultrasound Obstet Gynecol 34:188, 2009 [PubMed: 19526595]
Palenzuela G, Martin E, Meunier A, et al: Comprehensive staging allows for excellent outcome in patients with localized malignant germ cell tumor of
the ovary. Ann Surg 248:836, 2008 [PubMed: 18948812]
Park JY, Kim DY, Suh DS, et al: Analysis of outcomes and prognostic factors after fertility­sparing surgery in malignant ovarian germ cell tumors.
Gynecol Oncol 145(3):513, 2017 [PubMed: 28372870]
Pavlakis K, Messini I, Vrekoussis T, et al: Intraoperative assessment of epithelial and non­epithelial ovarian tumors: a 7­year review. Eur J Gynaecol
Oncol 30:657, 2009 [PubMed: 20099498]
Pena­Alonso R, Nieto K, Alvarez R, et al: Distribution of Y­chromosome­bearing cells in gonadoblastoma and dysgenetic testis in 45,X/46,XY infants.
Mod Pathol 18:439, 2005 [PubMed: 15475933]
Pins MR, Young RH, Daly WJ, et al: Primary squamous cell carcinoma of the ovary: report of 37 cases. Am J Surg Pathol 20:823, 1996 [PubMed:
8669530]
Powell JL, Connor GP, Henderson GS: Management of recurrent juvenile granulosa cell tumor of the ovary. Gynecol Oncol 81:113, 2001 [PubMed:
11277661]
Pressley RH, Muntz HG, Falkenberry S, et al: Serum lactic dehydrogenase as a tumor marker in dysgerminoma. Gynecol Oncol 44:281, 1992 [PubMed:
1541442]
Quirk JT, Natarajan N: Ovarian cancer incidence in the United States, 1992–1999. Gynecol Oncol 97:519, 2005 [PubMed: 15863154]
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
Page Cancer
31 / 34
CAPÍTULO
Tumores
ováricos
células germinales
y del estroma
los cordones
sexuales,
Ray­Coquard36:
I, Brown
J, Harter
P, de
Gynecologic
Cancer InterGroup
(GCIG)de
consensus
review
for ovarian sex cord stromal tumors. Int J Gynecol
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
24(9 Suppl 3):S42, 2014 [PubMed: 25341579]
Rezk Y, Sheinfeld J, Chi DS: Prolonged survival following salvage surgery for chemorefractory ovarian immature teratoma: a case report and review of
11277661]
Universidad Nacional Autonoma de Mexico UNAM
Access Provided by:
Pressley RH, Muntz HG, Falkenberry S, et al: Serum lactic dehydrogenase as a tumor marker in dysgerminoma.
Gynecol Oncol 44:281, 1992 [PubMed:
1541442]
Quirk JT, Natarajan N: Ovarian cancer incidence in the United States, 1992–1999. Gynecol Oncol 97:519, 2005 [PubMed: 15863154]
Ray­Coquard I, Brown J, Harter P, Gynecologic Cancer InterGroup (GCIG) consensus review for ovarian sex cord stromal tumors. Int J Gynecol Cancer
24(9 Suppl 3):S42, 2014 [PubMed: 25341579]
Rezk Y, Sheinfeld J, Chi DS: Prolonged survival following salvage surgery for chemorefractory ovarian immature teratoma: a case report and review of
the literature. Gynecol Oncol 96:883, 2005 [PubMed: 15721445]
Schneider DT, Calaminus G, Harms D, et al: Ovarian sex cord–stromal tumors in children and adolescents. J Reprod Med 50:439, 2005 [PubMed:
16050568]
Schneider DT, Calaminus G, Wessalowski R, et al: Ovarian sex cord–stromal tumors in children and adolescents. J Clin Oncol 21:2357, 2003 [PubMed:
12805338]
Schrader KA, Gorbatcheva B, Senz J, et al: The specificity of the FLXL2 c.402G>G somatic mutation: a survey of solid tumors. PLoS One 4(11):e7988,
2009 [PubMed: 19956657]
Schwartz PE, Morris JM: Serum lactic dehydrogenase: a tumor marker for dysgerminoma. Obstet Gynecol 72:511, 1988 [PubMed: 3405571]
Seagle BL, Ann P, Butler S, et al: Ovarian granulosa cell tumor: a National Cancer Database study. Gynecol Oncol 146(2):285, 2017 [PubMed:
28532858]
Shah R, Xia C, Krailo M, et al: Is carboplatin­based chemotherapy as effective as cisplatin­based chemotherapy in the treatment of advanced­stage
dysgerminoma in children, adolescents and young adults? Gynecol Oncol 150(2):253, 2018 [PubMed: 29884437]
Shah SP, Kobel M, Senz J, et al: Mutation of FOXL2 in granulosa­cell tumors of the ovary. N Engl J Med 360:2719, 2009 [PubMed: 19516027]
Sharony R, Aviram R, Fishman A, et al: Granulosa cell tumors of the ovary: do they have any unique ultrasonographic and color Doppler flow
features? Int J Gynecol Cancer 11:229, 2001 [PubMed: 11437930]
Shim SH, Kim DY, Lee SW, et al: Laparoscopic management of early­stage malignant nonepithelial ovarian tumors: surgical and survival outcomes.
Int J Gynecol Cancer 23(2):249, 2013 [PubMed: 23318909]
Shimizu Y, Komiyama S, Kobayashi T, et al: Successful management of endodermal sinus tumor of the ovary associated with pregnancy. Gynecol
Oncol 88:447, 2003 [PubMed: 12648602]
Siddiqui M, Toub DB: Cellular fibroma of the ovary with Meigs’ syndrome and elevated CA­125: a case report. J Reprod Med 40:817, 1995 [PubMed:
8592321]
Skalleberg J, Solheim O, Fosså SD, et al: Long­term ototoxicity in women after cisplatin treatment for ovarian germ cell cancer. Gynecol Oncol
145(1):148, 2017 [PubMed: 28202195]
Smith HO, Berwick M, Verschraegen CF, et al: Incidence and survival rates for female malignant germ cell tumors. Obstet Gynecol 107:1075, 2006
[PubMed: 16648414]
Solheim O, Gershenson DM, Tropé CG, Prognostic factors in malignant ovarian germ cell tumours (The Surveillance, Epidemiology and End Results
experience 1978–2010). Eur J Cancer 50(11):1942, 2014 [PubMed: 24857045]
Solheim O, Kaern J, Tropé CG, et al: Malignant ovarian germ cell tumors: presentation, survival and second cancer in a population based Norwegian
cohort (1953–2009). Gynecol Oncol 131(2):330, 2013 [PubMed: 24001518]
Solheim O, Tropé CG, Rokkones E, et al: Fertility and gonadal function after adjuvant therapy in women diagnosed with a malignant ovarian germ cell
Downloaded
2023­2­27
1:40
A Yourera.”
IP isGynecol
132.248.9.8
tumor (MOGCT)
during the
“cisplatin
Oncol 136(2):224, 2015
Page 32 / 34
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Stettner AR, Hartenbach EM, Schink JC, et al: Familial ovarian germ cell cancer: report and review. Am J Med Genet 84:43, 1999 [PubMed: 10213045]
Stevens TA, Brown J, Zander DS, et al: Adult granulosa cell tumors of the ovary in two first­degree relatives. Gynecol Oncol 98:502, 2005 [PubMed:
experience 1978–2010). Eur J Cancer 50(11):1942, 2014 [PubMed: 24857045]
Universidad Nacional Autonoma de Mexico UNAM
Access Provided by:
Solheim O, Kaern J, Tropé CG, et al: Malignant ovarian germ cell tumors: presentation, survival and
second cancer in a population based Norwegian
cohort (1953–2009). Gynecol Oncol 131(2):330, 2013 [PubMed: 24001518]
Solheim O, Tropé CG, Rokkones E, et al: Fertility and gonadal function after adjuvant therapy in women diagnosed with a malignant ovarian germ cell
tumor (MOGCT) during the “cisplatin era.” Gynecol Oncol 136(2):224, 2015
Stettner AR, Hartenbach EM, Schink JC, et al: Familial ovarian germ cell cancer: report and review. Am J Med Genet 84:43, 1999 [PubMed: 10213045]
Stevens TA, Brown J, Zander DS, et al: Adult granulosa cell tumors of the ovary in two first­degree relatives. Gynecol Oncol 98:502, 2005 [PubMed:
15992917]
Stier EA, Barakat RR, Curtin JP, et al: Laparotomy to complete staging of presumed early ovarian cancer. Obstet Gynecol 87:737, 1996 [PubMed:
8677077]
Takemori M, Nishimura R, Yamasaki M, et al: Ovarian mixed germ cell tumor composed of polyembryoma and immature teratoma. Gynecol Oncol
69:260, 1998 [PubMed: 9648599]
Talukdar S, Kumar S, Bhatla N, et al: Neo­adjuvant chemotherapy in the treatment of advanced malignant germ cell tumors of ovary. Gynecol Oncol
132(1):28, 2014 [PubMed: 24145115]
Tangir J, Zelterman D, Ma W, et al: Reproductive function after conservative surgery and chemotherapy for malignant germ cell tumors of the ovary.
Obstet Gynecol 101:251, 2003 [PubMed: 12576247]
Teilum G: Classification of endodermal sinus tumour (mesoblastoma vitellinum) and so­called “embryonal carcinoma” of the ovary. Acta Pathol
Microbiol Scand 64:407, 1965 [PubMed: 5318716]
Ulbright TM: Germ cell tumors of the gonads: a selective review emphasizing problems in differential diagnosis, newly appreciated, and controversial
issues. Mod Pathol 18 (Suppl 2):S61, 2005 [PubMed: 15761467]
Uygun K, Aydiner A, Saip P, et al: Clinical parameters and treatment results in recurrent granulosa cell tumor of the ovary. Gynecol Oncol 88:400,
2003 [PubMed: 12648593]
van Meurs HS, Bleeker MC, van der Velden J, et al: The incidence of endometrial hyperplasia and cancer in 1031 patients with a granulosa cell tumor
of the ovary: long­term follow­up in a population­based cohort study. Int J Gynecol Cancer 23(8):1417, 2013 [PubMed: 24257556]
van Meurs HS, Buist MR, Westermann AM, et al: Effectiveness of chemotherapy in measurable granulosa cell tumors: a retrospective study and review
of literature. Int J Gynecol Cancer 24(3):496, 2014 [PubMed: 24469325]
Vang R, Herrmann ME, Tavassoli FA: Comparative immunohistochemical analysis of granulosa and Sertoli components in ovarian sex cord–stromal
tumors with mixed differentiation: potential implications for derivation of Sertoli differentiation in ovarian tumors. Int J Gynecol Pathol 23:151, 2004
[PubMed: 15084844]
Vicus D, Beiner ME, Klachook S, et al: Pure dysgerminoma of the ovary 35 years on: a single institutional experience. Gynecol Oncol 117:23, 2010
[PubMed: 20097412]
Williams SD, Birch R, Einhorn LH, et al: Treatment of disseminated germ cell tumors with cisplatin, bleomycin, and either vinblastine or etoposide. N
Engl J Med 316:1435, 1987 [PubMed: 2437455]
Williams SD, Blessing JA, DiSaia PJ, et al: Second­look laparotomy in ovarian germ cell tumors: the Gynecologic Oncology Group experience. Gynecol
Oncol 52:287, 1994 [PubMed: 8157184]
Williams SD, Kauderer J, Burnett AF, et al: Adjuvant therapy of completely resected dysgerminoma with carboplatin and etoposide: a trial of the
Gynecologic Oncology Group. Gynecol Oncol 95:496, 2004 [PubMed: 15581952]
Wolf JK, Mullen J, Eifel PJ, et al: Radiation treatment of advanced or recurrent granulosa cell tumor of the ovary. Gynecol Oncol 73:35, 1999
Downloaded
2023­2­27 1:40 A Your IP is 132.248.9.8
[PubMed: 10094877]
Page 33 / 34
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Young JL Jr, Wu XC, Roffers SD, et al: Ovarian cancer in children and young adults in the United States, 1992–1997. Cancer 97:2694, 2003 [PubMed:
12733134]
Oncol 52:287, 1994 [PubMed: 8157184]
Universidad Nacional Autonoma de Mexico UNAM
Access Provided by:
Williams SD, Kauderer J, Burnett AF, et al: Adjuvant therapy of completely resected dysgerminoma
with carboplatin and etoposide: a trial of the
Gynecologic Oncology Group. Gynecol Oncol 95:496, 2004 [PubMed: 15581952]
Wolf JK, Mullen J, Eifel PJ, et al: Radiation treatment of advanced or recurrent granulosa cell tumor of the ovary. Gynecol Oncol 73:35, 1999
[PubMed: 10094877]
Young JL Jr, Wu XC, Roffers SD, et al: Ovarian cancer in children and young adults in the United States, 1992–1997. Cancer 97:2694, 2003 [PubMed:
12733134]
Young RH: Sex cord–stromal tumors of the ovary and testis: their similarities and differences with consideration of selected problems. Mod Pathol
18:S81, 2005 [PubMed: 15502809]
Young RH, Dudley AG, Scully RE: Granulosa cell, Sertoli–Leydig cell, and unclassified sex cord–stromal tumors associated with pregnancy: a
clinicopathological analysis of thirty­six cases. Gynecol Oncol 18:181, 1984 [PubMed: 6735262]
Young RH, Scully RE: Ovarian Sertoli–Leydig cell tumors: a clinicopathological analysis of 207 cases. Am J Surg Pathol 9:543, 1985 [PubMed: 3911780]
Young RH, Welch WR, Dickersin GR, et al: Ovarian sex cord tumor with annular tubules: review of 74 cases including 27 with Peutz­Jeghers syndrome
and four with adenoma malignum of the cervix. Cancer 50:1384, 1982 [PubMed: 7104978]
Yuan JQ, Lin XN, Xu JY, et al: Ovarian juvenile granulosa cell tumor associated with Maffucci’s syndrome: case report. Chin Med J 117:1592, 2004
[PubMed: 15498394]
Zaloudek C, Norris HJ: Sertoli­Leydig tumors of the ovary: a clinicopathologic study of 64 intermediate and poorly differentiated neoplasms. Am J
Surg Pathol 8:405, 1984 [PubMed: 6731664]
Zanagnolo V, Pasinetti B, Sartori E: Clinical review of 63 cases of sex cord stromal tumors. Eur J Gynaecol Oncol 25:431, 2004 [PubMed: 15285297]
Zanetta G, Bonazzi C, Cantu M, et al: Survival and reproductive function after treatment of malignant germ cell ovarian tumors. J Clin Oncol 19:1015,
2001 [PubMed: 11181664]
Zhang M, Cheung MK, Shin JY, et al: Prognostic factors responsible for survival in sex cord stromal tumors of the ovary—an analysis of 376 women.
Gynecol Oncol 104:396, 2007 [PubMed: 17030354]
Zhao XY, Huang HF, Lian LJ, et al: Ovarian cancer in pregnancy: a clinicopathologic analysis of 22 cases and review of the literature. Int J Gynecol
Cancer 16:8, 2006 [PubMed: 16445603]
Downloaded 2023­2­27 1:40 A Your IP is 132.248.9.8
CAPÍTULO 36: Tumores ováricos de células germinales y del estroma de los cordones sexuales,
©2023 McGraw Hill. All Rights Reserved. Terms of Use • Privacy Policy • Notice • Accessibility
Page 34 / 34










