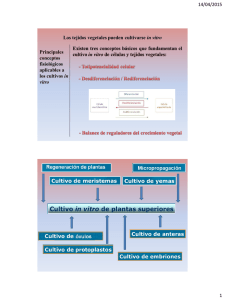
Programa de la asignatura: Cultivo de tejidos vegetales II U1 Principios de micro-propagación Ciencias de la Salud Biológicas y Ambientales | Ingeniería en Biotecnología U1 Cultivo de tejidos vegetales II Principios de micro-propagación Índice Presentación de la unidad ......................................................................................................... 2 Propósitos de la unidad ............................................................................................................. 2 Competencia específica ............................................................................................................ 3 1.1. Introducción ........................................................................................................................ 3 1.1.1. Meristemos de brotes apicales ....................................................................................... 4 1.1.2. Cultivo de brotes y nodos (nudos) .................................................................................. 8 1.2. Proceso de micro-propagación .......................................................................................... 9 1.2.1. Etapa 0. Preparación del explante ................................................................................ 11 1.2.2. Etapa 1. Establecimiento de un cultivo aséptico ........................................................... 11 1.2.3. Etapa 2. Proliferación de brotes axilares ...................................................................... 13 1.2.4. Etapa 3. Enraizamiento ................................................................................................. 15 1.2.5. Etapa 4. Invernadero ..................................................................................................... 17 1.3. Organogénesis ................................................................................................................. 17 1.3.1. Introducción ................................................................................................................... 18 1.3.2. Desdiferenciación .......................................................................................................... 21 1.3.3. Inducción ....................................................................................................................... 21 1.3.4. Diferenciación ................................................................................................................ 23 1.4. Embriogénesis .................................................................................................................. 29 1.4.1. Introducción ................................................................................................................... 29 1.4.2. Atributos del cultivo embriogénico ................................................................................ 33 1.4.3. Iniciación de células embriogénicas .............................................................................. 35 1.4.4. Desarrollo embrionario .................................................................................................. 37 1.4.5. Germinación y desarrollo de plantas ............................................................................. 42 Actividades .............................................................................................................................. 43 Autorreflexiones....................................................................................................................... 44 Cierre de la unidad .................................................................................................................. 44 Para saber más ....................................................................................................................... 45 Fuentes de consulta ................................................................................................................ 46 Universidad Abierta y a Distancia de México 1 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Presentación de la unidad Bienvenidos(as) a Cultivo de tejidos vegetales II, esta unidad, propone describir aspectos teóricos relacionados con la micro-propagación. Se retomarán inicialmente conocimientos sobre la estructura general de un brote meristemático y la forma de cómo obtenerlos para su uso en micro-propagación. Se estudiará cada una de las etapas de la micro-propagación, con el fin de dar entrada en la próxima unidad al estudio de protocolos, los cuales son necesarios para desarrollar la micro-propagación de plantas en laboratorio. Finalmente se involucrará en el conocimiento de cuatro alternativas para alcanzar el objetivo de obtener una planta completa: proliferación mejorada de brotes axilares, cultivo de brotes, el cultivo de nodos o nudos, la formación de novo de brotes adventicios a través de la organogénesis y la embriogénesis no cigótica. Propósitos de la unidad Al finalizar la unidad podrás: • • Identificar en cada protocolo de trabajo las etapas que involucra un cultivo in vitro. Identificar los procesos de desarrollo en la propagación de tejidos no meristemáticos. Universidad Abierta y a Distancia de México 2 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Competencia específica Identificar las etapas de la micro-propagación para evaluar las técnicas empleadas en el cultivo in vitro analizando la propagación y desarrollo de cultivos de tejidos vegetales. 1.1. Introducción La micro-propagación es definida como la propagación pura de genotipos selectos usando técnicas de cultivo in vitro, esto es, cada planta conserva sus caracteres individuales de una a otra generación, existiendo cuatro métodos básicos usados para propagar plantas in vitro. Dependiendo de las especies y condiciones de cultivo, la propagación in vitro puede ser alcanzada por (Kane, 2005): • • • • Proliferación mejorada de brotes axilares (cultivo de brotes). Cultivo de nodos o nudos. Formación de novo de brotes adventicios a través de la organogénesis. Embriogénesis no cigótica. El método más frecuentemente empleado de micro-propagación para producción comercial, utiliza la proliferación de brotes axilares a parir del cultivo de meristemos. Este método provee estabilidad genética y es fácilmente alcanzable para muchas especies de plantas: de manera consecuente, el método de cultivo de brotes ha jugado un papel importante en el desarrollo de la industria alrededor del mundo que produce más de 350 millones de plantas anualmente. Al lado de la propagación, los brotes meristemáticos son cultivados in vitro por otras dos razones: la producción de plantas libres de patógenos y la preservación de germoplasma libre de patógenos (Kane, 2005). Universidad Abierta y a Distancia de México 3 U1 Cultivo de tejidos vegetales II Principios de micro-propagación 1.1.1. Meristemos de brotes apicales Es importante retomar nuevamente y de manera breve la estructura general de un brote meristemático, recordando que el crecimiento de brotes en una planta se restringe a regiones especializadas que muestran una pequeña diferenciación, y en el cual las células retienen la capacidad embriónica de división ilimitada. Estas regiones, llamadas meristemos apicales, están localizadas en los ápices de yemas principales y laterales de la planta; las células derivadas a partir de estos meristemos apicales bajo diferenciación subsecuente forman el tejido del cuerpo de la planta. Debido a su alta estructura organizacional, los meristemos apicales tienden a ser genéticamente estables. Existen diferencias significantes en la forma y tamaño de brotes meristemáticos apicales entre las diferentes taxonomías de grupos de plantas (Fahn, 1974). Un típico brote meristemático apical dicotiledóneo consiste de un domo estratificado de células en división activas localizados en la punta extrema del brote, midiendo entre 0.1 a 0.2 mm de diámetro y de 0.2 a 0.3 mm de longitud aproximadamente. El meristemo apical no tiene conexión con el sistema vascular del tallo; bajo el meristemo apical, se localizan áreas de división celular y elongación representando sitios de recién desarrollo de primordios de hoja (ver Figura 1). Las yemas laterales, contienen cada una un meristemo apical, desarrollando dentro de las axilas (cavidades) las futuras hojas. En la planta intacta, el crecimiento de las yemas laterales es generalmente inhibido por la dominancia apical del extremo del brote terminal. La organización del crecimiento del brote a partir del meristemo apical de plantas es potencialmente ilimitada e indeterminada; sin embargo, el brote apical meristemático puede llegar a estar comprometido en la formación de determinados órganos tales como flores. Universidad Abierta y a Distancia de México 4 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Figura 1. Representación esquemática de un extremo de brote de dicotiledónea. El extremo del brote comprende el meristemo apical, los primordios de hojas y yemas laterales. Tomado de: Kane, 2005. Hay básicamente dos tipos de cultivo meristemáticos, mismos que a continuación se describen. Cultivo in vitro de brotes meristemáticos El potencial del crecimiento ilimitado de brotes fue reconocido inmediatamente, pero sin éxito en su cultivo, en donde se desarrollaron intentos de cultivo aislado y asépticos de brotes meristemáticos en la década de 1920. Pero fue a mediados de la década de 1940, que se sostuvo el crecimiento y se mantuvo la organización del cultivo de brotes meristemáticos a través de repetidos subcultivos para diferentes especies. Ball E.A. (1946), sin embargo proveyó del primer procedimiento detallado para la aislación y producción de plantas a partir del cultivo de extremos de brotes meristemáticos y la transferencia exitosa de plántulas enraizadas al suelo. Ball es llamado el “padre de la micropropagación” ya que su procedimiento de cultivo de extremos de brotes es el más ampliamente usado para la micro-propagación en laboratorios comerciales hoy en día. Universidad Abierta y a Distancia de México 5 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Aunque los estudios de Ball demostraron la factibilidad de la regeneración de brotes a partir del cultivo de extremos de brotes, los procedimientos típicos no proveyeron la diversificación de brotes. Muchos de los hallazgos que se hicieron después facilitaron la aplicación de las técnicas de cultivo in vitro para la propagación clonal a gran escala a partir de meristemos: el descubrimiento, de que plantas libres de virus pueden ser generados a partir de cultivos de meristemos guiaron a la aplicación del procedimiento rutinario para la erradicación de patógenos fúngicos y bacteriales (Morel y Martin, 1952; Styer y Chin, 1984). La demostración de la rápida producción de orquídeas a partir de cultivo de extremos de brotes, proveyó la posibilidad de la propagación clonal rápida en otros cultivos; sin embargo la propagación in vitro en muchas orquídeas no ocurre vía proliferación de brotes axilares, sino más bien a través de cultivo de meristemos, los cuales llegan a ser cuerpos esferoidales semejantes a protocormos desorganizados (embriones no cigóticos). El descubrimiento más reciente fue la elucidación del papel de las citocininas en la inhibición de la dominancia apical (Wickson y Thimann, 1958). Este descubrimiento fue eventualmente aplicado para mejorar la producción de brotes axilares in vitro: la aplicación de este método fue acelerado por el desarrollo de medios de cultivo mejorados que sostenían la propagación de una amplia diversidad de especies de plantas (Murashige y Skoog, 1962; Lloyd y McCown,1980). Cultivo de meristemos y puntas (extremos) meristemáticas A pesar de que no se usa directamente para la micro-propagación, el cultivo de meristemos y extremos de meristemos se describe brevemente, ya que estos procedimientos son usados para generar brotes libres de patógenos que subsecuentemente son propágulos para la propagación in vitro. El cultivo de solamente meristemos apicales (domo) (ver Figura 2) a partir de, ya sea yemas terminales o laterales, para propósitos de eliminación de patógenos, es conceptualizado como cultivo de meristemos. En realidad, el verdadero cultivo de meristemos es raramente empleado, ya que el meristemo apical aislado de muchas especies exhiben bajas tasas de supervivencia e incrementan los riesgos de variabilidad genética siguiendo la formación de callos e indirectamente la organogénesis de brotes. Universidad Abierta y a Distancia de México 6 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Figura 2. Etapas de micro-propagación para la producción de un cultivo de brotes. Tomado de: Kane, 2005. La eliminación de patógenos puede frecuentemente ser realizado por cultivo de explantes relativamente grandes de extremos de meristemos (0.2 – 0.5 mm de largo), obtenidos de plantas que han sido sometidas a termo o quimioterapia. El extremo del meristemo consta de un meristemo apical más uno o más primordios de hojas (ver Figura 2), este procedimiento es por lo tanto conceptualizado como cultivo de extremos de meristemos. Debe de tenerse cuidado cuando se interpretan muchas de las publicaciones recientes de éxitos de cultivos de “meristemos” ya que en muchas ocasiones, el extremo del meristemo o mejor dicho, explantes de grandes extremos de brotes son actualmente empleados. El término meristemming, es usado comúnmente en la literatura de orquídeas, pero es igualmente ambiguo. Universidad Abierta y a Distancia de México 7 U1 Cultivo de tejidos vegetales II Principios de micro-propagación 1.1.2. Cultivo de brotes y nodos (nudos) Aunque no es el procedimiento más efectivo, la propagación a partir de brotes axilares ha demostrado ser un método confiable para la propagación de un gran número de especies. Dependiendo de la especie, puede emplearse ya sea el cultivo de brotes o nodos, aunque ambos métodos se basan en la estimulación del crecimiento del brote axilar proveniente de las yemas laterales seguido de la disrupción de la dominancia apical del ápice del brote. Cultivo de brote El cultivo de brote (cultivo de extremo del brote) se refiere a la propagación in vitro por repetidas formaciones de brotes axilares a partir de extremos de brotes o yemas laterales cultivados en medio suplementado con reguladores de crecimiento, generalmente una citocinina (George, 1993). Los brotes axilares producidos son entonces subdivididos a segmentos nodales o de extremos de brotes, los cuales sirven como explantes secundarios para una posterior proliferación o ser tratados con micro-cortes para posteriormente enraizarse. En algunas especies, los órganos de almacenamiento tales como tubérculos miniaturizados o cormos son desarrollados bajo condiciones de cultivo inducido a partir de brotes axilares o rizomas y pueden servir como propágulos para ya sea, plantarse directamente o para almacenamiento a largo plazo. Cuando cualquier reserva verificada de plantas libres de patógenos es usada o cuando la eliminación de patógenos no es de interés, pueden ser usados extremos de brotes o de explantes primarios de yemas laterales relativamente grandes (1-20 mm), para establecer el cultivo y subsecuentemente el cultivo de brotes (ver Figura 2). La ventaja del uso de grandes extremos de brotes incluye mayor supervivencia, una respuesta más rápida del crecimiento y la presencia de más yemas axilares; sin embargo, estos grandes explantes son más difíciles para esterilizar completamente su superficie, ya que puede albergar infecciones microbianas sistémicas latentes e indetectadas. Comparados con otros métodos de micro-propagación, el cultivo de brotes tienen las siguientes características: Universidad Abierta y a Distancia de México 8 U1 Cultivo de tejidos vegetales II Principios de micro-propagación • • • Proveen tasas confiables. Consistencias de multiplicación seguidas por la estabilización del cultivo. Son menos susceptibles a la variación genética. El cultivo de nodos, una forma simple del cultivo de brotes, es otro método para la producción de meristemos pre-existentes, pero muchas plantas como la papa (Solanum tuberosum L.) no responden adecuadamente a la estimulación por citocininas para la proliferación de brotes axilares; aunque el crecimiento de brotes axilares es promovido por el cultivo de ya sea brotes intactos (a partir del cultivo de extremos meristemáticos) colocados horizontalmente sobre el medio (estratos in vitro) o por segmentos nodales simples o múltiples. Por lo general, los brotes no ramificados alargados e individuales, compuestos por varios nodos, se producen con rapidez. Estos brotes (micro-cortes) son enraizados o aclimatados a condiciones ex vitro o repetidamente subdividido a cortes nodales para iniciar cultivos adicionales. A pesar de que el cultivo de nodos es un método simple, éste está asociado con pocas variaciones genéticas. 1.2. Proceso de micro-propagación El principal objetivo de la micro-propagación no es solo el producir micro-plantas puras y saludables a un precio accesible, sino que también concierne el desarrollo post vitrium de la progenie de plantas, conocidas como, calidad de flores, frutos, rendimiento de tubérculos, etc., factores que contribuyen a la calidad deseada. Mientras la micro-propagación es convenientemente dividida en “etapas”, debe enfatizarse que se trata de un proceso, teniendo cuidado cuando se optimicen las etapas individuales. Existen cinco etapas (0-4) críticas para el éxito de la micro-propagación, que no solo describen los pasos procedimentales en el proceso de micro-propagación, sino también representan puntos en el cual el medioambiente del cultivo es alterado. Este sistema ha sido adoptado por muchos laboratorios comerciales y de investigación, de esta forma se simplifica el calendario de producción, de contabilidad y análisis de costos. La tabla 1, muestra las principales características de las etapas por las que pasa la micropropagación. Universidad Abierta y a Distancia de México 9 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Tabla 1. Etapas en micro-propagación. Etapas 1-4 según Murashige T., (1974) y etapas 0 a 3a según Debergh P.C. y Maene L.J. (1981). Etapa Etapa 0 Etapa 1 Actividad Selección de plantas donadoras; erradicar patógenos, mantenidas bajo condiciones de cuarentena. Establecimiento de cultivo aséptico, confirmación de ser libre de bacterias a partir de cultivo de microorganismos. Etapa 1a Uso de cultivo de meristemos y/o quimio o termoterapia in vitro para eliminar patógenos. Etapa 2 Propagación clonal en masa. Etapa 3a Preparación para el enraizado. Etapa 3b Preparación para el retorno al medioambiente (formación). Etapa 4 Establecimiento de la microplanta. Notas Para certificación de cultivos libres de patógenos, ésta debe ser llevada usando directrices oficiales. Es aconsejable que el cultivo sea establecido a partir de explantes de meristemos para eliminar patógenos y contaminantes bacterianos. Es importante seguir el correcto procedimiento en la selección de químicos antimicrobianos y su uso correcto. Para propósitos de certificación las plantas deben de ser re-establecidas y regresadas a la Etapa 0 para su clasificación. Es esencial emplear una estrategia de clonación estable. Algunos brotes in vitro pueden ser beneficiados por el tratamiento con ácido giberélico para elongar el tallo antes de la Etapa 3b. Las estrategias son variables, algunos micro-brotes son autoenraizados, y otros necesitan ser transferidos a un medio de enraizamiento. Las plantas pueden requerir sombra y nebulosidad, y especial atención para evitar enfermedades a causa de la humedad. La formación se refiere a la adaptación de la fisiología de micro-planta a las condiciones medioambientales. Generalmente las etapas 1 a 3 son seguidas; sin embargo, la etapa I y/o 3 es omitida algunas veces. Retomado de Cassells, 2005. Universidad Abierta y a Distancia de México 10 U1 Cultivo de tejidos vegetales II Principios de micro-propagación A continuación se describen a detalle cada una de las etapas de micro-propagación. 1.2.1. Etapa 0. Preparación del explante El proceso de micro-propagación inicia con la selección y mantenimiento de una reserva de plantas (plantas madre), las cuales deben ser seleccionadas como representativas del genotipo (variedad) y de buen vigor. Éstas deben ser colocadas en una instalación aislada, preferiblemente en cuarentena, en el cual no existan riesgos de enfermedades o entrada de vectores patógenos, de no ser posible, pueden ser mantenidas en bolsas de plástico ventiladas, con el fin de facilitar el intercambio gaseoso. Las plantas grandes pueden ser mantenidas en jaulas de muselina o algo similar, tomando en cuenta que es importante evitar la propagación de alguna infección durante el mantenimiento del cultivo, para ello se pueden tomar algunas precauciones, por ejemplo, mantener un buen drenado con el fin de evitar la transmisión de patógenos por gotas de agua en instrumentos, los cuales deben estar estériles antes de desplazarlos de una planta a otra. Varias prácticas son también empleadas para incrementar la receptividad del explante, modificando el estatus fisiológico de la reserva de plantas, y pueden incluir (Cassells, 2005 y Kane, 2005): • • • Recortes para estimular el crecimiento lateral de brotes. Pretratamiento con rociados, conteniendo citocininas o ácido giberélico. Uso de soluciones aceleradoras conteniendo 2% de sacarosa y 200 mg/l de citrato 8-hidroxiquinoleina (8-hydroxyquinoline citrate) para la inducción de yemas y adición de reguladores de crecimiento a tejidos proveedores de explantes. Una vez el explante listo, se puede dar lugar a la siguiente etapa. 1.2.2. Etapa 1. Establecimiento de un cultivo aséptico Las plantas en la naturaleza, además de ser infectadas produciendo síntomas con patógenos latentes, también pueden ser contaminadas de manera sistemática, o aleatoria de manera intracelular endofíticamente o epifítamente con bacterias del medioambiente, y de manera menos común con hongos, especialmente levaduras. Estos patógenos no son generalmente aislados de manera específica de plantas, pero pueden ser patógenos oportunistas, ellos pueden generalmente crecer sobre medios de cultivo de tejidos de plantas y pueden mostrarse en la etapa 1, sobre explantes establecidos o acumularse en los tejidos con el riesgo de emerger posteriormente en la producción cuando muchos gastos se han realizado, o incluso post vitrium, causando problemas económicos. Estos pueden ser: incluir patógenos de otros cultivos o de humanos, aunque el riego de esto último es probablemente muy bajo. Universidad Abierta y a Distancia de México 11 U1 Cultivo de tejidos vegetales II Principios de micro-propagación La iniciación, establecimiento aséptico (erradicación de patógenos) de explantes de brotes laterales meristemáticos son el objetivo de esta etapa. El explante primario obtenido a partir de la planta madre es tratado con una esterilización superficial del brote apical meristemático o de extremos meristemáticos con el objetivo de eliminar patógenos, el explante puede ser también extremos de brotes obtenidos de yemas terminales o laterales (ver Figura 2). La estrategia comúnmente usada por micro-propagadores para eliminar patógenos y endófitas es el de introducir plantas a cultivos, empleando una escisión de “puntas” meristemáticas. La base de esta propuesta es que muchas endófitas patogénicas o no patogénicas no penetran el extremo o punta de la planta, por estar en contacto con el sistema vascular se diferencian detrás del extremo apical; existen dos factores importantes para el éxito, primeramente es el de obtener el más pequeño extremo posible a ser escindido y que el patógeno o contaminante no contamine el explante. En general, se recomienda que el domo apical y el primer par de primordios de hoja sean escindidos. En casos difíciles, estos pueden ser injertados como plántulas asépticas in vitro con el fin de ayudar en el establecimiento de pequeños explantes. Existe sin embargo, el riesgo en el uso de otros explantes, tales como yemas laterales, internodos etc., cuyos contaminantes latentes pueden ser introducidos al cultivo. La escisión meristemática es un proceso estresante para el tejido de la planta y frecuentemente resulta en la producción de compuestos fenólicos (polifenoles), los cuales pueden formar una barrera entre el explante y el medio de cultivo. La acumulación de estos productos de oxidación por polifenoles, pueden eventualmente matar el explante, pero para evitar este problema, el explante puede ser reposicionado sobre el medio o incorporar al medio antioxidante o agentes de enlace al fenol, tales como ácido ascórbico o polivinilpirrolidona (polyvinylpyrrolidone) y cultivar con luz reducida u obscuridad. Claramente, no existe un medio universal para el establecimiento de todas las especies; sin embargo, las modificaciones de la formulación al medio basal de Murashige y skoog (MS) son frecuentemente empleadas. Las citocininas o auxinas son frecuentemente adicionadas al medio en la etapa 1, con el fin de mejorar la sobrevivencia del explante y el desarrollo de brotes. El tipo y nivel de reguladores de crecimiento de plantas (RCP) empleados en el medio situado en la etapa 1 depende de la especie, genotipo y tamaño del explante. El conocimiento de los sitios específicos de biosíntesis de fitohormonas en plantas intactas, proveen una mayor comprensión en la relación entre el tamaño del explante y la dependencia de reguladores de crecimiento exógeno en el medio. Las citocininas y auxinas endógenas son sintetizadas principalmente en extremos de raíces y primordios de hojas respectivamente. Consecuentemente, explantes pequeños, especialmente cultivo de domos de meristemos apicales, muestran gran dependencia sobre los Universidad Abierta y a Distancia de México 12 U1 Cultivo de tejidos vegetales II Principios de micro-propagación suplementos del medio con citocininas y auxinas exógenas para maximizar la sobrevivencia y desarrollo. Los grandes explantes de extremos de brotes generalmente no requieren de la adición de auxinas en el medio de establecimiento de la etapa 1. El enraizamiento adventicio rápido de explantes de extremos de brotes frecuentemente proporciona una fuente primaria de citocinina endógena, y muchos medios empleados en la etapa 1 son solidificados con agar y suplementados con al menos una citocinina. Las citocininas más frecuentemente ampleadas son la N6-benziladenina (BA), cinetina (CIN) y N6-(2-isopentenil)-adenina (2iP). Debido a su bajo costo y alta efectividad, la citocinina BA es la más empleada. Sustitutos de compuestos de urea, tales como el tidiazuron, muestran una fuerte actividad tal como una citocinina y ha sido empleada para facilitar el cultivo de brotes de especies maderables recalcitrantes. Muchos tipos de auxinas son empleadas como el ácido 3-indol acético (AIA), la auxina que se encuentra de forma natural es la menos activa, sin embargo, el componente más estable y fuerte es el ácido α-naftalen acético (ANA), una auxina sintética y el ácido 3indol butírico (AIB), una auxina natural, son las más frecuentemente usadas. La selección de niveles de RCP en medios empleados en la etapa 1 y combinaciones de éstos, promueven el establecimiento de explantes y el crecimiento de brotes, sin embargo limitan la formación de callos y la formación de brotes adventicios. Una idea errónea y común es que el explante primario muestra inmediatamente una respuesta de crecimiento predecible seguida de la inoculación. Para muchas especies, particularmente herbáceas y leñosas perennes, consistentemente la tasa de crecimiento y la multiplicación de brotes es obtenida después de múltiples subcultivos sobre el medio de la etapa 1. La estabilización fisiológica puede requerir de entre 3 a 24 meses y de 4 a 6 subcultivos. En muchos laboratorios comerciales, los cultivos estabilizados, verificados para patógenos específicos y libres de contaminantes cultivables, son frecuentemente mantenidos en medios que limitan la producción de brotes para mantener su estabilidad genética. Estos cultivos, llamados bloque madre, sirven como fuentes de extremos de brotes o de segmentos nodales para la iniciación de nuevos cultivos de la etapa 2 (ver Figura 2). 1.2.3. Etapa 2. Proliferación de brotes axilares La propagación en la etapa 2, es caracterizada por la repetida formación de brotes axilares a partir de extremos de brotes o de yemas laterales cultivadas en un medio suplementado con un relativo alto nivel de citocininas con el fin de perturbar la dominancia apical del extremo del brote. Un subcultivo con intervalos de 4 semanas, incrementa tres a ocho veces el número de brotes comúnmente en muchos cultivos propagados por cultivo Universidad Abierta y a Distancia de México 13 U1 Cultivo de tejidos vegetales II Principios de micro-propagación de brotes, dada esta tasa de multiplicación, de manera conservadora, más de 4.3x107 brotes pueden ser producidos anualmente a partir de un explante simple de inicio. Los cultivos en esta etapa son rutinariamente subdivididos en pequeños grupos de extremos de brotes o segmentos nodales que sirven como propágulos para su posterior proliferación (ver Figura 3). Adicionalmente, los grupos de brotes axilares pueden ser cosechados como micro-corte(s) individual(es) sin raíz o como agregados de brotes para enraizamiento ex vitro y aclimatación (ver Figura 2). Claramente, la etapa 2 representa una de las más costosas etapas en los procesos de producción. Ambas fuentes (esto es, los extremos de brotes o segmentos nodales) y su orientación pueden afectar la etapa en la proliferación de brotes axilares. Subcultivos inoculados con explantes que han sido ápices de brotes en los subcultivos previos frecuentemente presentan más altas tasas de multiplicación que los explantes de yemas laterales. En algunas especies, los explantes invertidos de brotes, sobre una posición vertical en el medio, pueden doblar o triplicar el número de brotes axilares producidos por periodo de cultivo. El número de subcultivos posibles requeridos previo a la iniciación de un nuevo cultivo en la etapa 2, a partir de un bloque madre, depende de la especie a cultivar y es una habilidad inherente para mantener aceptable las tasas de multiplicación mientras que exhiben una variación genética y variaciones atípicas mínimas. Algunas especies pueden ser mantenidas con subcultivos mensuales que van desde los 8 a 48 meses en etapa 2. En contraste, para algunos helechos (Nephrolepsis), solo tres subcultivos son posibles antes que la frecuencia atípica se incremente a niveles inaceptables. La selección del tipo de citocininas y su concentración en esta etapa, es hecha con base en la tasa de multiplicación de brotes, longitud de brotes y frecuencia de la variación genética; sin embargo, la proliferación de brotes es mejorada a altas concentraciones de citocininas, los brotes producidos son generalmente pequeños y muchos pueden producir hiperhidricidad. Dependiendo de la especie, las auxinas exógenas pueden o no mejorar la proliferación de brotes axilares inducidos por citocininas. La adición de auxinas en el medio frecuentemente mitigan los efectos inhibitorios de citocininas sobre la elongación de brotes, de esa forma se incrementa el número de brotes útiles de longitud suficiente para enraizamiento. Estos beneficios deben sopesarse contra el incremento de posibilidades de formación de callos. Similarmente, la elongación de brotes en cultivos de la etapa 2, pueden ser mejorados por la adición de ácido giberélico al medio. Una vez la sobrevivencia verificada de las plántulas, se da lugar a la siguiente etapa. Universidad Abierta y a Distancia de México 14 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Figura 3a. Multiplicación de brotes en la etapa 2, la cual es mejorada por repetidas formaciones de grupos de brotes axilares a partir de explantes conteniendo yemas laterales (Aronia arbutifolia L.). Dependiendo de la especie, micro-cortes individuales de grupos de brotes pueden ser enraizados y aclimatados en condiciones ex vitro. Escala de la barra = 1 cm. 3b. Para sobrevivencia máxima, el enraizado en la etapa 3 puede ser requerido antes de la aclimatación a condiciones ex vitro. 3c. En raizado y aclimatación de plántulas en etapa 4. Tomado de: Kane, 2005. 1.2.4. Etapa 3. Enraizamiento La etapa 3, involucra la transferencia a un medio modificado, referido generalmente como una “etapa de enraizado” o pretransplante, sin embargo, cuando es posible, los laboratorios comerciales han desarrollado procedimientos para la transferencia de microcortes de la etapa 2 a suelo, evitando así la etapa 3 de enraizamiento. Hay varias razones para eliminar el enraizamiento. Estimando costos, los intervalos van del 35 al 75% de los costos totales de producción. Esto refleja la importante aportación de mano de obra y materiales necesarios para completar la etapa de enraizamiento. El ahorro de costos considerables pueden ser realizados si la etapa 3 es eliminada, además, se ha observado que el sistema radicular formado in vitro en gran parte no funciona, y las plantas mueren después del trasplante. Esto da lugar a un retraso en el crecimiento del trasplante antes de la producción de nuevas raíces adventicias. Por varias razones, no puede ser siempre factible trasplantar micro-cortes de la etapa 2 directamente al suelo. Dadas las limitaciones antes mencionadas del enraizado (Deberg y Maene, 1981) se propuso usar únicamente la etapa 3 para alargar los grupos de brotes de la etapa 2 antes de la separación y enraizado ex vitro; ya que los brotes alargados pueden ser posteriormente pretratados en una solución acuosa de auxina antes del trasplante. Generalmente, el enraizado de plantas herbáceas puede ser mejorado en medio con ausencia de auxinas; sin embargo, para muchas especies leñosas, la adición de una Universidad Abierta y a Distancia de México 15 U1 Cultivo de tejidos vegetales II Principios de micro-propagación auxina (AIB o ANA) en el medio de la etapa 3 es requerida para realizar el enraizamiento adventicio y el desarrollo de plantas ex vitro. La concentración óptima de auxina es determinada con base en el porcentaje de enraizamiento, el número de raíces y longitud (ver Figura 4). Es crítico que las raíces no permitan alargarse para prevenir daño en raíces durante el trasplante. Debe tenerse mucho cuidado en la selección de una auxina. Por ejemplo, comparado con AIB, el uso de ANA para la etapa 3 de enraizado, se ha demostrado un decremento en la tasa de sobrevivencia o supresión del crecimiento pos-trasplante. Figura 4. Efectos del AIB sobre la etapa 3 de enraizado de micro-cortes de 10 mm de Aronia arbutifolia después de 28 días de cultivo. El incremento de la concentración de AIB mejora el porcentaje de enraizamiento, pero inhibe la elongación radicular. Tomado de: Kane, 2005. Universidad Abierta y a Distancia de México 16 U1 Cultivo de tejidos vegetales II Principios de micro-propagación 1.2.5. Etapa 4. Invernadero Esta etapa también es conocida como “transferencia a medioambiente natural”. El éxito final del cultivo de brotes o nodos (in vitro) depende de la habilidad al transferirse y restablecerse como una planta de crecimiento vigoroso en condiciones de invernadero (ver Figura 3). Lo anterior involucra la aclimatización o endurecimiento de plántulas a condiciones de muy baja humedad relativa y alta intensidad luminosa. Aunque cuando el proceso de aclimatación sea cuidadosamente seguido, son frecuentemente encontradas, pobres tasas de sobrevivencia. Las plantas micro-propagadas son difíciles a trasplantar por dos razones principales: el modo de nutrición heterotrófica, y un pobre control de pérdida de agua. Las plantas cultivadas in vitro en presencia de sacarosa y bajo condiciones de luz limitada e intercambio de gases, no muestran capacidad fotosintética o lo hacen de manera muy reducida. Durante la aclimatación, se espera que existan plantas que hagan una rápida transición del estado heterotrófico a una fotoautótrofo para sobrevivir. Desafortunadamente, esta transición no es inmediata, por ejemplo, en la coliflor, no hay un aumento neto en la absorción de CO2 hasta después de los 14 días del trasplante. Un análisis de las características anatómicas y fisiológicas de plantas producidas in vitro demuestra que bajo un 100% de humedad relativa, revelan una limitada capacidad para regular la pérdida de agua inmediatamente seguida del trasplante a suelo. Estas características incluyen la reducción de cera epicuticular, mesófilo pobremente diferenciado, función anormal de estomas y pobre conexión vascular entre brotes y raíces. Para superar estas limitaciones, las plántulas son trasplantadas a un bien drenado y estéril medio de crecimiento y mantenido inicialmente a una alta humedad relativa y luz reducida (40-160 µM x m-2 x s-1) a 20-27 ºC. Los trasplantes son aclimatados por reducción gradual de la humedad relativa en un periodo de 1 a 4 semanas. Las plantas se mueven incrementando la intensidad luminosa para promover un crecimiento vigoroso. 1.3. Organogénesis La organogénesis, es la habilidad de tejidos de plantas para formar varios órganos de novo, y ha sido durante mucho tiempo objeto de interés y utilidad práctica. En la China antigua se clonaban con éxito genotipos selectos de árboles forestales a través del proceso organogénico de enraizamiento adventicio de estacas leñosas (Schwarz, et al., 2005). El proceso de organogénesis provee las bases para la propagación asexual de plantas a partir de tejidos somáticos no meristemáticos. En muchos de los jardines públicos y Universidad Abierta y a Distancia de México 17 U1 Cultivo de tejidos vegetales II Principios de micro-propagación tiendas de jardinería, gran parte de las plantas en venta se propagan casi en su totalidad por vía asexual. La clonación de estos genotipos selectos probablemente incluyó la formación de órganos de novo sobre el estacado; la multiplicación in vitro de brotes meristemáticos pre-existentes seguidos por la formación de raíces de novo sobre el microtallo resultante, o posiblemente la regeneración de novo de brotes en un explante de tejido cultivado in vitro, seguido del enraizado adventicio de los microtallos (Schwarz, et al., 2005). Ya sea cumplida la novo génesis de órganos de plantas por medio in vivo o in vitro, empleando ya sea tejidos meristemáticos o no meristemáticos, se define ampliamente este proceso como organogénesis. Para ésta unidad se especificará la “organogénesis in vitro” sobre tejidos de planta no meristematicos y es solo una parte de la información científica disponible (Schwarz, et al., 2005). 1.3.1. Introducción En su sentido más amplio, “el desarrollo” es el proceso que permite como resultado un organismo maduro y funcional. De acuerdo con Fosket (1994), incluye a este concepto “todos aquellos eventos producidos durante la vida de una planta o animal, proveyendo la capacidad para obtener alimento, reproducirse y de explotar las oportunidades y de hacer frente a los peligros de su medioambiente”. La organogénesis es un proceso de desarrollo, que es en cierto modo único de plantas. En el caso de células animales, estos siguen rutas de desarrollo que normalmente implican la diferenciación irreversible hacia una célula específica o tipo de tejido. En otras palabras las células animales y tejidos permanecen estructural y funcionalmente comprometidos a un punto final de desarrollo inicial. Las células de plantas, sin embargo, pueden tener la habilidad a desdiferenciarse de su estado estructural y funcional actual y comenzar una nueva ruta de desarrollo hacia otro punto final morfogenético. Los tejidos de plantas in vitro pueden producir muchos tipos de primordios, incluyendo aquellos que podrán eventualmente diferenciarse a embriones, flores, hojas y raíces. Aunque la definición botánica de un órgano es bastante restrictiva, en este análisis se considera que el desarrollo de cualquiera de los primordios antes mencionados estará comprendido en la definición de organogénesis. Estos primordios se originan de novo a partir de un proceso de desdiferenciación celular seguido por la iniciación de una serie de eventos que resulta en su formación. Se cree que la célula o células, por el hecho de ser progenitores directos, de alguna manera están estimuladas para someterse a un número de divisiones celulares rápidas que conducen a la formación de un meristemoide. Universidad Abierta y a Distancia de México 18 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Los meristemoides, se caracterizan por ser un agregado de células de tipo meristemáticas (esto es, pequeñas, isodiamétricas, de paredes delgadas, células micro-vacuoladas con núcleos teñidos densos y con citoplasma). Al principio de su desarrollo, se cree que los meristemoides son morfogenéticamente plásticos y capaces de desarrollarse en un número de diferentes primordios (raíz, brotes, etc.). Esta flexibilidad de desarrollo único, ha sido ampliamente usada por propagadores de plantas. Dos eventos organogénicos comprenden un evento común para la propagación de plantas in vitro. El primer evento, es el de regenerar múltiples meristemos de brotes; seguido por su crecimiento y desarrollo en micro-brotes de un tamaño adecuado para el segundo evento, que es la inducción de la producción de novo de meristemo de raíz. Se cree que bajo condiciones de cultivo in vitro, estos eventos organogénicos pueden ser el resultado de dos diferentes rutas ontogénicas. De acuerdo con Hicks (1980), existen dos secuencias que dirigen a la organogénesis (estas difieren en la presencia o ausencia de la etapa de callos en la secuencia de eventos organogénicos). Una secuencia de desarrollo que involucra una intervención de etapa de callo, se denomina organogénesis indirecta. Explante primario Callos Meristemoides Primordio de órganos La formación de órganos de novo vía organogénesis indirecta puede incrementar la posibilidad de introducir variación en la constitución cromosomal (por ejemplo, cambio de ploidía) de las células en el estado de callos y, por lo tanto, la posibilidad de variación tanto fisiológica y morfogenética en los órganos resultantes. Este tipo de variación ha sido conceptualizada como variación somaclonal. Aunque algunas plantas son más propensas a este problema que otras, una regla general para la propagación de plantas es minimizar cualquier etapa de la secuencia organogénica, que contenga el crecimiento de callos “no organizado”. Para la investigación científica destinada a determinar el mecanismo físicoquímico conductor del proceso organogénico, hay una segunda razón de importancia para evitar o al menos minimizar este tipo de eventos en el desarrollo. La presencia de una etapa de proliferación de callos tiene el potencial de complicar en gran medida el análisis de los eventos moleculares que acompañan y quizás impulsan la producción de órganos de novo. Aquellas células o grupos de células destinadas a convertirse en organogénicas son en un número relativamente pequeño entre la masa mucho mayor de la división de células de callos, lo que reduce la capacidad de analizar su particular composición química y fisiológica. Universidad Abierta y a Distancia de México 19 U1 Cultivo de tejidos vegetales II Principios de micro-propagación En la organogénesis directa no existe la intervención del estado de callo. Para la organogénesis de novo (esto es, brote, raíz y flores), la secuencia de eventos es descrita como sigue: Explante primario Meristemoide Primordio de órgano La mayor diferencia entre estas dos rutas de novo, es la presencia o ausencia de un estado primario discernible de callo en la secuencia morfogénica de eventos. El tejido de callo, que contiene células que han sido desdiferenciadas, en una forma menos determinada, morfológicamente más flexible, sirven como el punto de inicio para la organogénesis de novo. En la ausencia del estado intermedio de callo, las células presentes dentro del explante, tienen la capacidad de actuar como un precursor directo del nuevo primordio. Los investigadores han utilizado el proceso organogénico como un sistema modelo para hacer preguntas acerca de los eventos causales que dirigen la producción de brotes o raíz y, por generalización, otros procesos morfogénicos. En un solo modelo, el proceso de organogénesis ha sido dividido en varias fases, como se muestra en el diagrama siguiente. Competencia Determinación + + Explante → órgano 1 2 3 (Desdiferenciación) (Inducción) (Diferenciación) Los puntos clave de interés para la biología de desarrollo, son las dos fases iniciales que preceden la fase de desdiferenciación. Estas fases abarcan eventos que comienzan con la desdiferenciación, que se traduce en el logro de “competencia”, seguida por la inducción, la cual culmina con el estado completamente “determinado”. La diferenciación morfológica y desarrollo del brote o raíz naciente, procede eventualmente en un órgano funcional. Las primeras dos fases del modelo abarca aquellos eventos que ocurren previo a la morfogénesis. Pueden ser usados como explantes primarios los embriones, partes de plántulas, meristemos apicales, primordios de órganos, capas celulares a partir de órganos maduros, fragmentos complejos a partir de órganos maduros, órganos intactos y protoplastos. Universidad Abierta y a Distancia de México 20 U1 Cultivo de tejidos vegetales II Principios de micro-propagación 1.3.2. Desdiferenciación El proceso de desdiferenciación involucra reversión a un estado de desarrollo menos comprometido, más flexible o estado de desarrollo plástico que pueda o no, dar lugar a tejido de callo. En el caso de organogénesis directa, las células competentes que no han producido tejido de callo, se cree que son los únicos progenitores de órganos, lo que implica que se someten al proceso de desdiferenciación y proceden de forma individual o tal vez en pequeños grupos para producir nuevos primordios. Por ejemplo, explantes de hoja de Convolvulus arvensis L. producen raíces o brotes vía la ruta de organogénesis indirecta que involucra un proceso de desdiferenciación que ocasiona un crecimiento de callo limitado a partir del cual se generan nuevos órganos. El resultado de terminación de esta primera fase es que el explante primario adquiere un estado de competencia, que se define por su habilidad para responder al estímulo organogénico. El logro de la competencia de tejidos no siempre es un proceso de una sola etapa que implica, por ejemplo, la aplicación de Reguladores de Crecimiento de Plantas (RCP). Los callos de alfalfa (Medicago sativa L.), cuando se cultivan por 4 días, con altos niveles de cinetina y bajos niveles de 2,4-diclorofenoxiacético (2,4-D) y posteriormente son movidos a un medio libre de RCP, producen raíces. Los brotes son producidos cuando los callos son tratados en el mismo régimen de cultivo, excepto que el medio contenga altos niveles de 2,4-D y bajos niveles de cinetina; sin embargo, el pretratamiento con RCP, seguido por una transferencia a medio basal, el medio libre de RCP no es suficiente para llevar a todos los tejidos a través de una segunda fase (inducción) que es requerida para una eventual producción de raíces o brotes. Un requisito de tamaño adicional, impuesto como límite inferior de tamaño diametral es de 105 µm para agregados celulares de callos, para ser competentes en la inducción morfogenética. Los agregados celulares, dejados crecer a tamaños mínimos llegan a ser competentes para la inducción organogénica y formación de raíz o brote. 1.3.3. Inducción La fase de inducción se produce entre el momento en que el tejido llega a ser competente y el momento en que llega a plenamente determinarse para la producción de primordios. Esta fase ha mostrado que abarca un número de momentos “fenocríticos”, y postula que el resultado a partir de la función de una ruta integrada de genes, guía el proceso de desarrollo y antecede la diferenciación morfológica. Launder (1958) sugirió que ciertos estímulos químicos y físicos pueden interrumpir una determinada ruta de desarrollo genético, modificando el resultado morfogenético, el cual produce un fenotipo tal como un mutante o “fenocopias”. Christianson y Warnick (1984) han identificado varios agentes químicos que intervienen durante la fase de inducción de C. arvensis; los agentes que inducen la producción de fenocopias son llamados agentes fenocopiadores. Durante Universidad Abierta y a Distancia de México 21 U1 Cultivo de tejidos vegetales II Principios de micro-propagación ciertos momentos determinados experimentalmente, estos agentes fenocopiadores han mostrado ser solo efectivos durante la fase de inducción. Estos momentos fenocríticos fueron postulados para definir pasos claves en la ruta genética para organizar el proceso de desarrollo. Los agentes fenocopiadores, o inhibidores específicos de la etapa, fueron pensados para bloquear, de alguna manera directa, la acción de un gen o producto génico de un “gen organizador” activo. En el sistema de C. arvensis, significaba bloquear la organogénesis de brotes, produciendo el fenotipo modificado (esto es, una fenocopia); en este caso, callos. El final del proceso de inducción se define como el punto en el que una célula o grupo de células llegan a estar completamente comprometidas con la producción de brotes o raíces. Operacionalmente, este punto final es alcanzado cuando el tejido del explante puede ser removido del medio inductor de raíz o brote; pudiendo ser colocado sobre un medio basal sin RCP, conteniendo sales minerales, vitaminas y una fuente de carbono y se puede proceder a la producción de órganos deseados. Una vez que el tejido ha completado el proceso de inducción, puede ser considerado completamente determinado. Existe otro término de interés que ha sido usado para describir o quizá medir el grado de compromiso de desarrollo hacia un punto final particular (ejemplo, formación de brotes) que un tejido ha alcanzado durante la fase de inducción. Este término es la “canalización” y es definido por Waddington (1940) como “la propiedad de rutas de desarrollo para alcanzar un fenotipo estándar a pesar de disturbios genéticos o medioambientales”. Por ejemplo, explantes de tejidos de C. arvensis que han llegado a ser completamente canalizados para la producción de brotes, pueden ser colocados sobre medios diseñados para inducir raíces y todavía formar brotes. Si el explante es removido de un medio inductor de brotes antes de que quede completamente canalizado, la producción de brotes será severamente inhibida, con un punto final de producción de raíces. Esta flexibilidad de desarrollo ilustra el grado de plasticidad de morfegénesis que puede ser mostrado por el tejido de plantas bajo condiciones de cultivo in vitro. La medida en que los tejidos de explantes llegan a ser competentes y eventualmente determinados es, en parte, una función del medioambiente físico y químico en los que han sido expuestos, bajo condiciones de cultivo in vitro las propiedades del medio y medioambiente del cultivo asociado, juega un papel central en la liberación de estas señales organogénicas. Skoog y Miller (1957) demostraron primero que el sistema clave para la regulación química de la organogénesis in vitro era la relación de auxinas/citocininas presentes en el medio de cultivo. Ellos resumieron su descubrimiento concluyendo, “estos tienden a mostrar que las interacciones cuantitativas entre los factores de crecimiento, especialmente entre AIA y cinetinas, así como entre estos y otros factores, constituyen un mecanismo común para la regulación de todos los tipos de crecimiento investigados a partir del alargamiento de células a la formación de órganos”. Universidad Abierta y a Distancia de México 22 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Otras muchas variables importantes, tales como alargamiento diario, calidad y cantidad de luz, edad del tejido del explante, tamaño, genotipo y nutrición mineral, por mencionar algunas, han mostrado su efecto en la habilidad de regeneración. Existen ideas en las que se sugiere que la falta de capacidad de respuesta del tejido organogénico, bajo cualquier arreglo particular de condiciones experimentales es el resultado del fracaso de los tejidos de explantes para alcanzar el estado de competencia para la inducción. 1.3.4. Diferenciación De las tres fases propuestas por el modelo (eventos de diferenciación), la tercera fase conocida como diferenciación es la más documentada, es en esta fase que la diferenciación morfogénica y de desarrollo del órgano naciente inicia. Describiendo los eventos iniciales de diferenciación de la iniciación de órganos, McDaniel (1984) establece que, “la imagen general que surge es que la iniciación de órganos implica un cambio abrupto en la polaridad seguido por un relajación de este cambio en una organización radialmente simétrica y crecimiento simultáneo a lo largo del nuevo eje para formar la protuberancia característica de la organogénesis”. Estos eventos iniciales y los acontecimientos que condujeron a la formación de la yema, se muestran en las Figuras 5, 6 y 7. Ha habido un gran debate en la literatura científica sobre estos eventos de diferenciación inicial con respecto a los tipos de tejidos implicados y, tal vez más significativamente, el número exacto de células que intervienen en la iniciación del meristemo. Al analiza este debate, no parece existir una respuesta absoluta. Christianson (1987), basa sus comentarios sobre sus propios experimentos y los de Marcotrigiano y Gouin (1984a; 1984b), quienes usaron quimeras de plantas, demostrando que “los brotes formados in vitro pueden surgir de más de una célula en un explante, pero por lo general no lo hacen”. Basados en una extensiva investigación citológica de los eventos celulares que rodean la iniciación de brotes organogénicos sobre embriones inmaduros cigóticos de girasol (Helianthus annus L.), concluyeron que los brotes fueron desarrollados a partir de “divisiones simultáneas de varias células” y, por lo tanto, eran multicelulares en origen. La epidermis y otras capas del cortex de embriones inmaduros se encontraron, que contribuían a estas células germinales (Bronner, et al., 1994). El origen del tejido y el número de células involucradas en estos muy tempranos eventos de diferenciación parecen depender de varias variables pobremente entendidas. Centros reconocibles de división celular pueden ocurrir profundamente dentro del tejido del explante o, como se acaba de describir para el girasol, pueden ser más superficiales en origen. Se pueden seguir a través del uso cuidadoso del microscopio, los cambios estructurales, superficiales e histológicos que ocurren durante la fase de diferenciación del proceso Universidad Abierta y a Distancia de México 23 U1 Cultivo de tejidos vegetales II Principios de micro-propagación organogénico (ver Figuras 5, 6 y 7), en este caso se presenta la secuencia morfológica del pino Americano (Pinus oocarpa Schiede). Esta serie es representa como un ejemplo típico del proceso de organogénesis. Tenga en mente que es un ejemplo singular, ya que toda forma de variación sobre el tema de desarrollo se ha descrito para especies de plantas cultivadas in vitro; sin embargo, la secuencia de eventos que dirigen la formación de yemas organogénicas en los cotiledones de esta conífera es probablemente aplicable en su generalidad a la mayoría de las especies de plantas productoras de yemas adventicias. La fase final de diferenciación de la organogénesis provee la primera oportunidad de observar la génesis estructural del nuevo órgano, hecho posible por el programa de desarrollo que se puso en marcha durante la anterior fase de inducción. La secuencia de los eventos morfogénicos observados en la formación de novo de yemas en cotiledones de P. oocarpa incluyeron cambios en la morfología superficial, la apariencia de meristemoides, expansión vertical y/o horizontal de la región meristemática, protuberancia de la región meristemática por sobre la epidermis que la rodea, la apariencia de un meristemo organizado con primordios foliares, y desarrollo completo de una yema adventicia. El explante fue colocado en un medio de inducción conteniendo el RCP benziladenina (BA) durante 10-14 días y transferido a una medio basal sin RCP para el resto del experimento. En este experimento particular, el proceso de organogénesis fue observado por aproximadamente 40 días. Universidad Abierta y a Distancia de México 24 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Figura 5. Micrografía histológica de las diferentes fases de la formación de una yema adventicia en explantes de cotiledonarios de plántulas de un pino de América Central (Pinus oocarpa). (A) Sección transversal del explante cotiledonario antes de la exposición a un medio de inducción de yemas. La epidermis tiene una apariencia regular y bien ordenada sobre los tres lados. El tejido mesofílico más central es compacto y tiene un pequeño espacio intercelular. Barra = 46 µm. (B) Después de tres días sobre un medio de inducción conteniendo hormonas, las células de la superficie epistomática se han vuelto irregulares en tamaño y forma, lo que resulta en una superficie desigual cotiledonaria. Barra = 46 µm. (C) La presencia de meristemoides son fácilmente observadas después de 13-18 días y es notado por la tinción oscura del núcleo en el grupo de pequeñas células agrupadas en el centro superior de la microfotografía. Barra = 28 µm. (D) La región meristemática incrementa rápidamente en tamaño. En este caso el crecimiento inicial del meristemoide se extiende hacia abajo en el tejido mesofílico. Barra = 28 µm. (E) El crecimiento meristemático también puede ocurrir lateralmente a lo largo de la superficie plana del explante. Barra = 28 µm. (F) Rápido desarrollo del brote meristemático comienza a sobresalir por encima de la epidermis que la rodea. Barra = 46 µm. (G) Las células en división de las regiones meristemáticas algunas veces no involucran la epidermis. Estas regiones pueden o no convertirse en meristemos de yemas funcionales. (H) Un domo o cúpula meristemática con varios primordios foliares sobresales por encima de la epidermis que la rodea. Note las numerosas divisiones anticlinales en la epidermis justo a la izquierda del centro de la cúpula y la división periclinal justo a la derecha del centro de la cúpula. Barra = 25 µm. (I) Yema adventicia desarrollada completamente, con hojas primordiales exteriores. Note las hebras protocambiales en el área de primordios foliares (flechas). Tomado de: Schwarz, et al., 2005. Universidad Abierta y a Distancia de México 25 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Figura 6. Exploración con micrografía electrónica (SEMs) de la fase de diferenciación de formación de una yema adventicia sobre un explante cotiledonario de una plántula de un pino de Centro América (Pinus oocarpa), mostrando eventos de desarrollo antes de la protuberancia meristemática (domo o cúpula). (A) SEM del explante antes a la exposición al medio de inducción de yemas. Los estomas se presentan en filas de dos y tres rodeadas de pequeñas células subsidiarias. Filas de células epidérmicas rectangulares alargadas se intercalan entre las filas de los estomas. Barra = 83 µm. (B) Explante después de tres días de exposición al medio de inducción. El lado abaxial con casi sin estomas y uno de los lados epistomáticos con sus numerosos estomas están empezando a reflejar los cambios que ya se han iniciado en el tejido de la superficie de un ligero aumento en la rugosidad de la superficie epidérmica. Barra = 114 µm. (C) Las células de la epidermis ha empezado a dividirse, causando una disrupción obvia de las filas regulares de células entre las filas de los estomas. . Barra = 96 µm. (D) Superficie del explante se ha convertido en nodular y desigual. La interrupción de las filas regulares ha aumentado a medida que las zonas meristemáticas aumentan de tamaño. Se muestra producción de nódulos. Barra = 192 µm. Tomado de: Schwarz, et al., 2005. Universidad Abierta y a Distancia de México 26 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Figura 7.Exploración con microfotografía electrónica de la fase de diferenciación de la formación de yemas adventicias sobre explantes cotiledonarios de plántulas de un pino de Centro América (Pinus oocarpa), mostrándose el proceso desde la saliente de la cúpula meristemático hasta la formación de una yema adventicia bien desarrollada. (A) Cúpulas meristemáticas sobresaliendo muy por encima de la epidermis que rodea al explante, 2 a 3 semanas después de haber iniciado la exposición al medio de inducción de yemas. Note la continuidad de la superficie epidérmica sobre la cúpula entera. Barra = 83 µm. (B) Ápice de brote un poco más diferenciado. Barra = 71 µm. (C) Yemas con numerosos primordios foliares y elongación de hojas después de 5 semanas después del cultivo de iniciación. La letra “L” indica primordio foliar, “A” indica ápice del brote. Barra = 156 µm. (D) Yema completamente desarrollada. La letra “B” indica cercado de hojas primordiales exteriores. Se aprecia el estiramiento a lo largo del eje central de la yema. Las flechas indican otra yema en una estadía temprana de desarrollo. Tomado de: Schwarz, et al., 2005. Secciones histológicas de cotiledones recién cultivados a partir del día 0, ilustran la anatomía de tejidos control, o tratados por medio de las figuras antes indicadas. En una sección transversal (ver Figura 6a), los cotiledones son triangulares en su contorno, y las células de la epidermis son regulares en la conformación de los tres lados del cotiledón. Las células redondas del mesófilo que rodea el tejido vascular central son compactas y exhiben muy poco espacio intracelular. Micrografías exploratorias de microscopía electrónica (SEM) del día 0 del tejido cotiledonario, control (ver Figura 7a) eco de la regularidad de su superficie y de los tejidos cercanos a la superficie se muestran en las secciones histológicas. Incluso las filas de células largas rectangulares, de superficie lisa, que se encuentran entre las hileras dobles y triples irregulares de los estomas. Las células auxiliares que rodean los estomas son perceptiblemente más pequeñas en área de Universidad Abierta y a Distancia de México 27 U1 Cultivo de tejidos vegetales II Principios de micro-propagación superficie que las largas filas de células entre las filas dobles y triples de células epidérmicas. Después de 3 días en medio de inducción, las células epidérmicas de las superficies cotiledonarias epistomaticas se vuelven irregulares (Figura 5b). Pequeños grupos de meristemoides, principalmente agrupados en o justo bajo la apidermis, son evidentes en 15 a 18 días (ver Figuras 5a, 5c, 5d, 5e y 5g). Estas zonas meristemáticas se agrandan tanto perpendicular como paralelamente a la superficie del cotiledón, tomando una apariencia nodular. Durante este tiempo, como un resultado de la actividad mitótica, los células de la epidermis pierden gran parte de su regularidad y se muestran una longitud irregular, formando pequeños grupos celulares (ver Figuras 6c y 6d). Estas áreas localizadas de actividad meristemática inician formando cúpulas meristemáticas (ver Figuras 5f y 5h) que eventualmente sobresalen de la superficie del explante (ver Figura 7a). En este esquema organogénico, la ontogenia (ontogénesis) del desarrollo de las estructuras en forma de domo involucra la incorporación de células de la epidermis. En algunas coníferas, los domos meristemáticos han sido observados que empujan a través de la superficie de la capa epidérmica, causando la ruptura. El domo pronto alcanza un alto grado de organización y comienza a producir primordios foliares (ver Figura 7b). Existen divisiones periclinales y anticlinales a la derecha e izquierda de la porción del centro apical del meristemo de nuevo desarrollo, lo que permite la sucesiva producción de primordios foliares (ver Figura 5h). El ápice continúa creciendo, dando lugar a numerosos primordios foliares y culminando en la formación de una yema adventicia (ver Figuras 5i y 7c). Las zonas cito-histológicas típicamente asociadas con domos apicales de plántulas de coníferas y domos meristemáticos apicales en el desarrollo de embriones de coníferas están claramente reflejadas en este completo desarrollo de yemas in vitro (ver leyenda en Figura 5i) producido por organogénesis de novo. El desarrollo simultáneo de numerosos meristemoides en un explante simple (ver Figura 7d) no es poco común en sistemas de cultivo in vitro organogénico. El grado de diferenciación de estos meristemos de yemas nacientes es muy variable. Brotes en etapas tempranas de madurez pueden estar presentes en un explante simple (ver Figura 7d). Esta serie de eventos morfogénicos narrados para P. oocarpa parece encajar en el modelo presentado para organogénesis vía ruta de desarrollo directo. En la práctica, yemas bien desarrolladas son removidas de los cotiledones y son colocados en un medio formulado para promover su crecimiento y desarrollo continuo. Brotes alargados, de 5 mm para P. oocarpa ó 1 cm para otras especies de Pinus, son transferidos acondiciones in vitro o ex vitro designados para promover el enraizamiento adventicio completando por lo tanto la regeneración de plántulas. Universidad Abierta y a Distancia de México 28 U1 Cultivo de tejidos vegetales II Principios de micro-propagación 1.4. Embriogénesis El evento de la fertilización es desencadenado por la división y desarrollo de la célulahuevo (después de la fertilización es llamada cigoto) hasta un embrión (el proceso de desarrollo del embrión es llamado embriogénesis). Sin embargo, la fertilización no es siempre esencial para estimular la célula-huevo a sufrir la embrogénesis. Como sucede en la partenogenésis, se puede inducir a la célula-huevo a sufrir el desarrollo embriogénico, ya sea por la sola polinización, o por la aplicación simple de algunos RCP. Sin embargo, no es un monopolio de la célula-huevo el de formar embriones, cualquier célula del gametofito femenino (saco embrionario), o aún los tejidos esporofiticos alrededor del saco embrionario pueden dar origen a un embrión (Bhojwani S.S. y Razdan M.K., 1996). En términos generales, la embriogénesis somática es un proceso por el cual las células somáticas (esto es, células no gaméticas) sufren diferenciación para formar estructuras bipolares conteniendo ejes de raíz y brote. Estos embriones somáticos son similares a los embriones cigóticos, ya que pueden madurar y germinar posteriormente (Smith, 2013). 1.4.1. Introducción Un embrión puede ser definido como la etapa multicelular reconocible más temprana de un individuo que se produce antes de que se hayan desarrollado las estructuras u órganos característicos de una especie dada. En muchos organismos, los embriones son entidades morfológicamente distintas que funcionan como un estado intermedio entre la transición al ciclo de vida gametofítica a esporofítica (ver Figura 8). Universidad Abierta y a Distancia de México 29 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Cigoto 2n Embriogénesis Gametogénesis + fusión Esporofito 2n Gametofito 1n Meiosis Figura 8. Ciclo de vida típico de angiospermas mostrando su papel natural de embriogénesis en el desarrollo esporofítico. La flecha no punteada indica la generación gametofítica, mientras que la flecha punteada indica la generación esporofítica. Tomado de: Gray, 2005. Por ejemplo, en plantas superiores, en donde se está más familiarizado con los embriones que se desarrollan dentro de semillas; estos embriones suelen surgir de productos de fusión gamética (cigotos) siguiendo la reproducción sexual, aunque los embriones transmitidos por semillas también pueden desarrollar apomixis (esto es, sin reproducción sexual); sin embargo, las plantas son únicas en las que morfológica y funcionalmente correcta los embriones no cigóticos también pueden ocurrir a partir de diferentes tipos de células y de tejidos ampliamente dispares en un número de diferentes puntos de fases tanto en ciclos de vida gametofíticas como en la esporofítica (ver Figura 9). Universidad Abierta y a Distancia de México 30 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Figura 9. Fuentes de células embriogénicas, tipos de embriogénesis y plantas obtenidas vía cultivo in vitro de plantas superiores. Tomado de: Gray, 2005. La primera demostración en la que plantas podían producir embriones no cigóticos in vitro fue publicado en 1958 por Steward et al. Subsecuentemente, Reinert (1959) observó embriones bipolares al diferenciar un cultivo de raíces de zanahoria después de la transferencia de un medio a otro; mientras la zanahoria fue la primera especie en la cual la embriogénesis no cigótica in vitro fue reportada, en los años subsecuentes muchas especies de angiospermas y gimnospermas han sido añadidas a la lista de éxitos. De hecho, las demostraciones de embriogénesis no cigótica son tan generalizadas que puede ser considerada coma una capacidad universal de las plantas superiores. Una abundancia de terminologías ha surgido para designar embriones no cigóticos que originalmente se denominaron “embrioides” para denotar diferencias significativas a partir de embriones cigóticos. Sin embargo, las diferencias en los orígenes de células embriogénicas (a pesar de las distinciones entre embriones cigóticos y no cigóticos), se difumina a medida que nuestra comprensión aumenta sobre el desarrollo del embrión. Los embriones no cigóticos no demuestran que son funcionalmente equivalentes a los embriones cigóticos, por lo que el subfijo “oide” debe ser retirado. Otros términos para Universidad Abierta y a Distancia de México 31 U1 Cultivo de tejidos vegetales II Principios de micro-propagación embriones no cigóticos están basados principalmente en las diferencias de sus sitios específicos de origen y, a menudo intercambiables, lo que conduce a algunas inconsistencias en la literatura. Por ejemplo, embriones no cigóticos pueden surgir a partir de células vegetativas de plantas, de tejidos reproductivos, de embriones cigóticos, o de células de callos derivados de estas. Estos “embriones somáticos” crecen a partir de células somáticas; “embriones haploides o de polen” son derivados a partir de granos de polen o de microsporas de células madre; “embriones nucelares” son formados a partir de tejidos de semillas nucelares no cigóticas; “embriones secundarios directos” desarrollados a partir de embriones previamente formados. Muchos de estos embriones cigóticos y no cigóticos comparten la característica común de ser capaces de ser manipulados a través de cultivo in vitro. Cada sistema de cultivo embriogénico forman la base para muchos enfoques biotecnológicos con el fin de mejorar plantas, ya que permiten no sólo la propagación clonal de plantas, sino también los cambios específicos que se pueden introducir individuos deseables, de élite por ingeniería genética de células somáticas. Células y embriones individuales y modificados pueden multiplicarse eficientemente in vitro a un número muy elevado, previo al desarrollo de la planta. Este enfoque de la mejora genética elude las consecuencias no deseadas de la reproducción sexual (recombinación genética masiva y ciclos necesarios de selección) inherente a la tecnología de la reproducción convencional. Para mayor comodidad, y debido a muchas cosas en común exhibidas por estos tipos de embriones, así como a los diferentes métodos disponibles para estudiar y manipularlos, aquí sólo se empleará el término “embrión no cigótico” para designar a los embriones que se desarrollan en cultivo in vitro, independientemente del origen. Por lo tanto, los procesos de desarrollo y los procedimientos experimentales descritos tenderán a ser aplicables a muchos de los tipos de embriones mencionados anteriormente. Condiciones de crecimiento in vivo contra condiciones de crecimiento in vitro En semillas, tejidos nutritivos encierran directamente el embrión en desarrollo. A principios de la embriogénesis, las sustancias nutritivas entran en el embrión cigótico a través del suspensor o cuerpo del embrión (ver Figura 10a). La dependencia relativa del embrión en desarrollo sobre la obtención de la nutrición a través del suspensor contra el endospermo varía ostensiblemente dependiendo de la especie, en contraste, los embriones no cigóticos desnudos en su desarrollo, no encerrados en el endospermo de la semilla, no están sometidos a altas regulaciones de regímenes nutricionales especializados (Gray y Purohit,. 1991). Frecuentemente, un suspensor es el único enlace entre el embrión y el medio de cultivo (ver Figura 10b). Esto demuestra que el suspensor puede servir como la ruta para toda la nutrición necesaria y que el endospermo no es absolutamente necesario para la embriogénesis y que ocurra la germinación. Universidad Abierta y a Distancia de México 32 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Figura 10. Comparación de un embrión cigótico típico desarrollado en semilla (A) con un embrión no cigótico desarrollado a partir de callos (B). El embrión cigótico típico desarrollado dentro de tejidos de semillas (áreas sombreadas) es conectado a la planta madre por un suspensor (flecha). En contraste, embriones no cigóticos frecuentemente desarrollados sobresaliendo sobre un tejido subtendido, la única fuente de nutrición es el suspensor estrechado. Tomado de: Gray, 2005. Con base en lo anterior, se presenta a continuación el proceso para obtener células embriogénicas. 1.4.2. Atributos del cultivo embriogénico Dada la variedad de diferentes explantes, las condiciones de cultivo y medios usados para iniciar y mantener un cultivo embriogénico, ciertas generalidades pueden ser hachas observando la metodología básica. El uso de reguladores de crecimiento de plantas (RCP), los cuales son necesarios en la mayoría de los casos, es discutido en la sección de iniciación de células embrionarias. La elección del genotipo y explante es a menudo crucial en la obtención de una respuesta embriogénica. Por ejemplo, con el maíz solo un intervalo limitado de genotipos son capaces de producir cultivos embriogénicos y, con pocas excepciones, solo explantes de embriones inmaduros son usados. En el maíz, la edad de los embriones inmaduros también es importante ya que los embriones que son muy jóvenes no sobreviven al cultivo, y aquellos que son muy viejos no producen callo embriogénicos. Curiosamente, muchas de las especies ensayadas hasta la fecha, pueden ser inducidas a producir cultivos embriogénicos de al menos algunos genotipos y tejidos. Además, la respuesta embriogénica es heredable, de manera que puede ser generado a partir de líneas embriogénicas en líneas no embriogénicas vía hibridización sexual, aunque con un cierto grado de dificultad y la transferencia de otros rasgos a través de la hibridación sexual, a menudo indeseables. Universidad Abierta y a Distancia de México 33 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Los requerimientos medioambientales para un cultivo de crecimiento óptimo frecuentemente son muy específicos, pero no inusuales. Los cultivos pueden requerir crecimiento ya sea oscuridad o luz o una combinación de ambos, a lo largo del tiempo, la optimización de los cuales se puede cuantificar experimentalmente. El cultivo en oscuridad puede ser necesario con el fin de prevenir el efecto de activación de la luz para muchos procesos biológicos en plantas que puede afectar adversamente el crecimiento de poblaciones de células embriogénicas, además suprime la diferenciación de tejidos no deseados en el tejido de explante, por ejemplo, la limitación del desarrollo de plástidos en cloroplastos. De manera similar, las condiciones de oscuridad pueden inhibir la germinación precoz de embriones jóvenes. Los requerimientos de temperatura también son específicos, pero tienden a estar en un intervalo de “temperatura ambiente” (esto es, 23-27 oC). A pesar de la similitud en los requerimientos de cultivo, las mejoras en el desarrollo embrionario y maduración no cigótica se obtienen por la optimización de la composición del medio de cultivo. Origen de embriones no cigóticos Es comúnmente aceptado que, como los embriones cigóticos, los embriones no cigóticos se forman a partir de una célula individual, en contraste con la formación de yemas (gemación) que se forman a partir de una masa celular. Esta distinción es importante en la consideración de la ingeniería genética eficiente ya que la modificación de una sola célula embriogénica podría eventualmente resultar en una planta modificada, en comparación con la modificación genética de una célula dentro de una yema, que se traduce en una planta quimérica. El crecimiento de embriones no cigóticos a partir de células aisladas, tales como microsporas o protoplastos, son claramente desarrollados a partir de células individuales. Sin embargo, el origen de embriones no cigóticos desarrollados a partir de explantes de tejido primario complejo o callos, es más difícil de resolver ya que la acción de células individuales microscópicas no pueden ser fácilmente seguidas. Los embriones no cigóticos frecuentemente desarrollan un aparato suspensor bien definido, idéntico a los embriones cigóticos, sugiriendo un poco que el origen es una célula individual; mientras que otras pueden desarrollarse con un amplio apego basal, sugiriendo un fenómeno de gemación multicelular. Universidad Abierta y a Distancia de México 34 U1 Cultivo de tejidos vegetales II Principios de micro-propagación 1.4.3. Iniciación de células embriogénicas En explantes complejos, los embriones no cigóticos típicamente pueden ser iniciados solo a partir de tejidos juveniles o meristemáticos. Por ejemplo, los embriones cigóticos inmaduros o cotiledones de embriones cigóticos e hipocotilos diseccionados a partir de semillas no germinadas son comúnmente empleados como explantes. Las hojas jóvenes, extremos de brotes o aún de raíces de plantas establecidas, algunas veces se utilizan para iniciar cultivos embriogénicos; sin embargo, la respuesta del explante es altamente dependiente del genotipo, por lo que, para algunas especies dadas, solo un cierto tipo o gama de explantes pueden ser usados para iniciar cultivos embriogénicos. Existen varios mecanismos por el que células de planta no cigóticas se conviertan en embriones iniciales. Hay casos en los que el explante consiste de tejido embrionario no diferenciado, tales como un embrión cigótico inmaduro, la iniciación y mantenimiento de un callo embriogénico es similar al cultivo y propagación en complejo pro-embrional preexistente. Así, las células embriogénicas presentes en el tejido del explante antes del cultivo de iniciación son propagadas de manera simple y manipulada in vitro; sin embargo, en muchos casos, las células embriogénicas son inducidas a partir de células no embriogénicas, esto representa un cambio dramático en su presunto destino. El cambio en el patrón de desarrollo involucra una diferenciación lejana a partir de las células con destino “normal” seguido por la redeterminación hacia un tipo de célula embriogénica. Por ejemplo, las células en explantes de hoja, que normalmente se desarrollarían en constituyentes de tejidos parenquimatosos de relativamente corta vida, se conviertan en embriogénicas bajo ciertas condiciones. Este es un cambio fundamental en el desarrollo ya que las células que normalmente serían capaces de pocas divisiones, antes de la senescencia, llegar a redirigirse para ser totipotentes y capaces de divisiones posiblemente ilimitadas, tales células embriogénicas llegan a ser inmortales en el sentido de que reincorporan la línea germinal al ser capaces de desarrollar individuos maduros y reproductibles. El hecho de que las células somáticas aisladas puedan desarrollarse normalmente en embriones demuestra irrevocablemente que el programa de desarrollo de la embriogénesis está contenido dentro y controlado por la propia célula y no por factores externos, no obstante, la naturaleza exacta de los mecanismos de activación de la embriogénesis, ya sea por una serie de eventos físicos, bioquímicos y/o genéticos, se desconoce. Universidad Abierta y a Distancia de México 35 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Figura 11. Comparación de la embriogénesis cigótica típica que ocurre en las semillas (A) con la embriogénesis no cigótica proliferativa que ocurre in vitro (B). La embriogénesis cigótica es caracterizada por estar bien regulada, de tal manera que los embriones pasen de forma sincrónica a través de distintos estadíos de desarrollo; mientras que la embriogénesis no cigótica suele ser no uniforme, con muchos estadíos presentes en un tiempo dado. Los embriones no cigóticos pueden evitar la maduración y desorganizarse, añadiéndose a la masa de tejido proembrionario. Tomado de: Gray, 2005. Inducción por reguladores de crecimiento de plantas (RCP) En la práctica, la iniciación de células embriogénicas requiere del cultivo in vitro de un explante apropiado sobre un medio que contenga RCP específicos. De hecho un predominio de reportes de cultivos de iniciación de cultivos embriogénicos emplea muy estrechos intervalos de RCP, que típicamente son adicionados al medio de cultivo. En la mayoría de los protocolos reportados, las auxinas sintéticas, notablemente 2,4diclorofenoxiacético (2,4-D), son adicionadas al medio. Auxinas similares son usadas, incluyendo dicamba, ácido indolbutírico (AIB), ácido naftoxiacético (NOA, por sus siglas en inglés), picloram y otros. Además varias auxinas débiles, tales como ácido indolacético Universidad Abierta y a Distancia de México 36 U1 Cultivo de tejidos vegetales II Principios de micro-propagación (AIA), una hormona natural de planta y ácido naftalenacético (ANA) han sido empleados en pocos sistemas de cultivo. Las auxinas sirven para inducir la formación de células embriogénicas posibilitando por iniciación, la activación de genes diferenciales, como se señaló anteriormente, también parecen promover el incremento de poblaciones de células embriogénicas a través de divisiones celulares repetidas, mientras que suprime simultáneamente la diferenciación celular y el crecimiento de embriones; sin embargo, una auxina frecuentemente no es requerida en los casos en que el explante consista de células embriogénicas pre-existentes, posiblemente porque no se requiere un paso de inducción discreta. Los RCP tipo auxinas y las citocininas son requeridas para inducir la embriogénesis en muchas especies dicotiledóneas. En algunos casos, solo se requiere una citocinina para causar el desarrollo de cultivos embriogénicos, siendo la benciladenina (BA) la más comúnmente empleada, pero otros tales como el tidiazuron (TDZ) y cinetina, y la citocinina natural, zeatina también son utilizadas. La concentración de RCP es importante para una respuesta óptima ya que las concentraciones que son muy bajas, pueden no desencadenar el evento inductivo, y concentraciones que son muy altas, particularmente cuando se consideran fenoxiauxinas, pueden llegar a ser tóxicas. Típicamente, siguiendo el periodo de inducción, el material de cultivo resultante es transferido a un medio sin RCP, el cual remueve la supresión inducida por la auxina del desarrollo embrionario y permite que ocurra la embriogénesis; sin embargo, no todos los sistemas de cultivo requieren estos dos pasos del proceso. Por ejemplo, ciertas especies no requieren ningún paso de inducción como los otros, especialmente monocotiledóneas poáceas, que llegan a inducir embriogénesis completa en la presencia continua de auxina. 1.4.4. Desarrollo embrionario La transición física observable, a partir de una célula no embriogénica a una embriogénica puede ocurrir cuando la célula progenitora sufre una división desigual, resultando en una gran célula vacuolada y una pequeña célula citoplasmática densa. Las células embriogénicas son rápidamente distinguidas por su pequeño tamaño, su forma isodiamétrica y apariencia citoplasmática densa (ver Figura 12). Este tipo de inadecuadas divisiones celulares densas son idénticas a las observadas en cigotos y pueden ser una primera indicación de desarrollo polar. Universidad Abierta y a Distancia de México 37 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Figura 12. Células embriogénicas típicas de uva. Note que el estado embrionario de tres células en la parte central superior de la masa de células. Tomado de: Gray, 2005. La célula embriogénica se divide irregularmente para formar un complejo pro-embrionario, o dividirse en una manea altamente organizada hasta formar el embrión somático (ver Figuras 9, 10 y 11). Sin embargo, una diferencia frecuentemente indeseable exhibida por embriones no cigóticos, es que con frecuencia se desvían del patrón normal de desarrollo, ya sea mediante la producción de callos sufriendo una embriogénesis secundaria o germinación precoz. Esta tendencia hacia el desarrollo errático claramente es debido a los factores medioambientales. Embriones cigótios y no cigóticos comparten el mismo patrón bruto de desarrollo, ambos pasan por etapas normales: globular, escutelar y coleoptilar para monocotiledóneas o por etapas: globular, corazón, torpedo y cotiledonaria para dicotiledóneas y coníferas. Generalmente, la anatomía y morfología de embriones bien desarrollados no cigóticos es fiel al tipo correspondiente de embrión cigótico, de tal manera que pueda ser fácilmente identificado (ver Figura 13). Por ejemplo, los embriones no cigóticos de especies de pasto y cereales poseen típicamente un escutelo, coleoptilo y ejes embrionarios, los cuales son órganos distintivos embriogénicos de monocotiledóneas (ver Figura 14a). Los embriones de especies dicotiledóneas tienen hipocotilos y cotiledones distintivos (generalmente dos) Universidad Abierta y a Distancia de México 38 U1 Cultivo de tejidos vegetales II Principios de micro-propagación (ver Figura 14b); los de coníferas también exhiben un hipocotilo y numerosos cotiledones (ver Figura 14c). Figura 13. Embriones somáticos de uva en las etapas tipo corazón y etapas tempranas cotiledonarias. Tomado de: Gray, 2005. Figura 14. Comparación de embriones no cigóticos monocotiledóneos (A), dicotiledóneos (B), y de gimnospermas (C). Exploración con microfotografías electrónicas, con estereomicrofotografías correspondientes (insertos). (A) Embrión somático de dáctilo (Dactylis glomerata) creciendo en callo embriogénico. Note el coleóptilo y la muesca que sobresale, a través del cual las primeras hojas emergerán después de la germinación. El cuerpo prominente largo y aplanado del embrión es el escutelo. (B) Embrión somático de uva creciendo a partir de un callo embriogénico. Note dos cotiledones aplanados e hipocotilos que subtienden. (C) Embrión somático de abeto rojo (Picea abies). Note los múltiples cotiledones e hipocotilos alargados. Tomado de: Gray, 2005. El desarrollo del embrión se produce a través de una excepcional secuencia organizada de la división celular, alargamiento y diferenciación. Durante el desarrollo temprano, el embrión asume una forma globular claviforme, siendo esencialmente una masa Universidad Abierta y a Distancia de México 39 U1 Cultivo de tejidos vegetales II Principios de micro-propagación indiferenciada pero organizada de células que se dividen con una epidermis bien definida. Subsecuente etapa de corazón a través de etapas tempranas de tipo torpedo se caracterizan por diferenciación celular y crecimiento polarizado, en particular la elongación e iniciación de cotiledones rudimentarios en dicotiledóneas (ver Figura 13) y desarrollo del escutelo con iniciación de la hendidura coleoptilar en poáceas monocotiledóneas. En el mismo momento que inicia el desarrollo del embrión, la obvia diferenciación de tejidos, inicia con el desarrollo de vasculatura embrionaria (ver Figura 15) y acumulación de sustancias de almacenamiento intracelular. Figura 15. Sección longitudinal de un embrión somático de uva, mostrando su sistema vascular típico. Tomado de: Gray, 2005. Las etapas finales de desarrollo hacia la maduración son distinguidas por el alargamiento en general, el aumento de tamaño de los cotiledones en dicotiledóneas (ver Figura 16) y coleoptilar en monocotiledóneas, al mismo tiempo que el eje embrionario se desarrolla cada vez más. En dicotiledóneas, el meristemo apical de raíz se establece bien, incrustado en el tejido localizado encima del aparato suspensor y en la base del Universidad Abierta y a Distancia de México 40 U1 Cultivo de tejidos vegetales II Principios de micro-propagación hipocotilo, sin embargo el meristemo apical del brote se desarrolla externamente entre los cotiledones. Figura 16. Embriones somáticos en estados cotiledonarios de melón cantalupo. Note que el fino suspensor es la única conexión al explante. Tomado de: Gray, 2005. En monocotiledóneas, el eje embrionario se desarrolla lateralmente y paralelo al escutelo. El meristemo apical radicular está incrustado y el meristemo apical del brote se desarrolla externamente, pero es protegido por el coleoptilo. Todos los eventos del desarrollo embrionario ocurren en concierto unos con otros de una manera esencialmente idéntica a la de los embriones. Pero por varias razones, como se describe a continuación, los embriones no cigóticos a menudo difieren algo de sus contrapartes cigóticos en la morfología y desempeño. Una diferencia obvia en la morfología macroscópica entre embriones no cigóticos creciendo in vitro y embriones cigóticos en semillas es causado simplemente por la restricción física en embriones cigóticos impuestos por el desarrollo de la testa (cubierta de la semilla), frecuentemente haciendo que se comprima y/o aplane en una forma o tamaño diferente para una especie o variedad dada (ver Figura 17). Los embriones cigóticos extirpados de semillas, suelen exhibir una forma muy comprimida, ya que los embriones se aplanan durante el desarrollo. En contraste, los embriones no cigóticos tienden a ser más grandes y tienen hipocotilos y cotiledones carnosos más amplios. Es posible que la presión ejercida por la cubierta de la semilla contribuya entre otros aspectos al desarrollo del embrión ya que esta se carece durante la embriogénesis no cigótica. Universidad Abierta y a Distancia de México 41 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Figura 17. Comparación de embriones cigóticos de uva, comprimido y aplanado por el desarrollo dentro de una semilla (izquierda), con un embrión somático de uva, el cual no es aplanado (derecha). Tomado de: Gray, 2005. Figura 18. Desarrollo de embrión asincrónico y anormal a partir de callos embriogénicos de uva. Incrementos de niveles de desarrollo (haca la derecha desde la parte inferior del embrión globular) son evidentes en un solo grupo de embriones. Además, cotiledones normales en número de dos (parte inferior central del embrión) contrastan con el desarrollo de cotiledones suplementarios de tres y cuatro sobre dos embriones superiores. Tomado de: Gray, 2005. Una vez concluido el estudio del desarrollo embrionario, nos remitiremos al proceso de recuperación de plantas. 1.4.5. Germinación y desarrollo de plantas La obtención de plantas a partir de embriones no cigóticos frecuentemente es más difícil de lo que se espera. La literatura temprana relacionada con los primeros reportes de Universidad Abierta y a Distancia de México 42 U1 Cultivo de tejidos vegetales II Principios de micro-propagación embriogénesis no cigótica para muchas especies o cultivos frecuentemente no incluye información de recuperación de plantas. Cuando las plantas son obtenidas, la tasa de recuperación es muy baja o no es reportada, sugiriendo que una mayoría de embriones no cigóticos eran anormales para germinar. La recuperación de plantas típica para embriones no cigóticos se encuentran en los intervalos de 0 a 50%, esto es muy bajo cuando se comparan con embriones cigóticos en semillas comerciales, en el que la germinación y el desarrollo de la planta exceden típicamente en un 90% en suelo. En pocos casos, el desarrollo de embriones no cigóticos es pobre cuando se plantan en tierra de forma similar a una semilla; recientemente se han llevado investigaciones para elevar las tasas de recuperación de plantas. Los avances en la metodología del cultivo se ha traducido en un mejor desarrollo y germinación de embriones no cigóticos. Como se ha mencionado anteriormente en relación con la maduración, los tratamientos con pulsos con varios aminoácidos, ósmosis, y RCP, particularmente ABA, han resultado en embriones no cigóticos con mejor maduración, incluyendo la habilidad a ser deshidratados y a almacenarse como semillas, así como la mejora de las características de germinación. Esto demuestra que la atención cuidadosa a las condiciones de cultivo y nutrición, en especial en lo que respecta a los pulsos de ciertos factores, dan como resultado tasas de recuperación de plantas a partir de embriones no cigóticos equivalentes a aquellos embriones cigóticos. En general, se puede concluir que las condiciones que favorecen la maduración del embrión también favorecen la recuperación de plantas. Después del evento de germinación, el embrión inicia el desarrollo a planta. Típicamente, las reservas de almacenamiento presente (lípidos, proteínas y/o almidón, dependiendo de la especie) se agotan, con el concomitante inicio del aumento de la actividad mitótica en meristemos de brotes y de raíz y eventualmente, se desarrolla una joven planta competente fotosintéticamente, la cual puede ser gradualmente aclimatad a condiciones ambientales. Actividades La elaboración de las actividades estará guiada por tu docente en línea, mismo que te indicará, a través de la Planeación didáctica del docente en línea, la dinámica que tú y tus compañeros (as) llevarán a cabo, así como los envíos que tendrán que realizar. Para el envío de tus trabajos usarás la siguiente nomenclatura: BCTV2_U1_A1_XXYZ, donde BCTV2 corresponde a las siglas de la asignatura, U1 es la etapa de conocimiento, A1 es el número de actividad, el cual debes sustituir considerando la actividad que se realices, XX son las Universidad Abierta y a Distancia de México 43 U1 Cultivo de tejidos vegetales II Principios de micro-propagación primeras letras de tu nombre, Y la primera letra de tu apellido paterno y Z la primera letra de tu apellido materno. Autorreflexiones Para la parte de autorreflexiones debes responder las Preguntas de Autorreflexión indicadas por tu docente en línea y enviar tu archivo. Cabe recordar que esta actividad tiene una ponderación del 10% de tu evaluación. Para el envío de tu autorreflexión utiliza la siguiente nomenclatura: BCTV2_U1_ATR _XXYZ, donde BCTV2 corresponde a las siglas de la asignatura, U1 es la unidad de conocimiento, XX son las primeras letras de tu nombre, y la primera letra de tu apellido paterno y Z la primera letra de tu apellido materno Cierre de la unidad Has concluido gran parte de los aspectos teóricos relacionados con el Cultivo de tejidos vegetales, claro está que esta información será un parte aguas para aquel o aquella persona que desee involucrarse más en este tipo de aspectos biotecnológicos. Tenemos entonces que: • • • • Las células meristemáticas de los brotes conservan la capacidad embriónica para divisiones ilimitadas. Los pequeños explantes meristemáticos aislados requieren para sobrevivir de un medio de cultivo más complejo, cuando se comparan con explantes grandes, sin embargo, un explante pequeño (meristemo o extremos meristemáticos) son adecuados para erradicar enfermedades de plantas. Las citocininas rompen la dominancia apical y mejoran la producción de brotes axilares. Al incrementar la concentración de auxinas, se incrementa el porcentaje de enraizamiento y número de raíces, pero hace decrece la elongación radicular. La unidad que continúa establece los protocolos necesarios para el trabajo en laboratorio, incidiendo en productos finales en especies específicas de plantas. Universidad Abierta y a Distancia de México 44 Cultivo de tejidos vegetales II U1 Principios de micro-propagación Para saber más Para fortalecer y complementar los conocimientos adquiridos en esta unidad, se te sugiere consultar: • La página de internet del Instituto de Investigación agrícola de Estonia. Galería fotográfica de procesos de micro-propagación (información en inglés). https://www.maainfo.ee/index.php?page=3538 • La revista en línea de Rache-Cardenal L y colaboradores (2008). Revigorización y clonación de yemas adultas de árboles de olivo. http://www.redalyc.org/articulo.oa?id=85720107 • Revista de biología tropical en línea de Sanghamitra Samantaray & Satyabrata Maiti (2011).Factors influencing rapid clonal propagationofChlorophytum arundinaceum (Liliales: Liliaceae), an endangered medicinal plant. http://www.scielo.sa.cr/scielo.php?script=sci_arttext&pid=S003477442011000100037#fig2 • El glosario en línea de términos botánicos. Website de Filogenia de angiospermas, versión 13. Missouri Botanical Garden: Stevens, P. F. (2001 onwards). Angiosperm Phylogeny Website. Version 13. http://www.mobot.org/mobot/research/apweb/ • Cob, José y col. (2010) Potencial de la organogénesis como estrategia para la masificación in vitro de Persea lingue en la zona centro-sur de Chile. Bosque 31(3):202-208. http://mingaonline.uach.cl/scielo.php?pid=S071792002010000300004&script=sci_arttext Universidad Abierta y a Distancia de México 45 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Fuentes de consulta Ball E.A. (1946). Develoment in sterile culture of shoot tips and subjacent regions of Tropaeolum majus L. and of Lupinus albus L. Amer. J. Bot. 33:301-318. Bhojwani S.S. y Razdan M.K. (1996). Plant Tissue Culture: theory and practice. E.U.A.: Elsiever. Broner R.G., Jeannin G. y Hahne G. (1994). Early celular events during organogénesis and somatic embryogenesis induce don inmature zygotic embryos of sunflower (Halianthus annus). Can. J. Bot. 72:239-248. Cassells A.C. (2005). Principles of micropropagation. En Murch S.J. y Saxena P.K. (Eds.) Journey a single cell to a plant. USA: Science Publisher, Inc. Christianson M.L. (1987). Causal events in morphogenesis. En: Alan R. Liss (Ed.) Plant tissue and cell culture. New York, 45-55. Christianson M.L. y Warnick D.A. Phenocritical times in the process of in vitro shoot organogenesis [en línea]. 1984. National Center for Biotechnology Information. Debergh P.C. y Maene L.J. A scheme for comercial propagation of ornamental plants by tissue culture. 1981, volume 14 número 4. ScienceDirect. Fahn A. (1974). Plant anatomy. New York: Pergamon Press. Fosket D.E. (1994). Plant growth and development: a molecular approach. E.U.A.: Universidad de Michigan. George E.F., 1993. Plant Propagation by tissue culture, Part 1: The technology. Exegetics, Ltd., London Universidad Abierta y a Distancia de México 46 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Gray D.J. (2005). Propagation from nonmeristematic tissues: nonzygotic embryogenesis. En Trigiano R.N. y Gray D.J. (Ed.). Plant development and biotechnology. USA: CRC Press. Gray D.J. y Purohit A. Somatic embryogenesis and the development of synthetic seed technology. Critical Reviews in Plant Sciences [en línea]. Volumen 1, 1991 [diciembre 2008]. Hicks G.S. (1980). Patterns of organ development in tissue culture and the problema of organ determiantion. En: Cronquist A. (Ed.). The botanical review, Vol. 46. New York Botanical Garden, New York. 1-23. Kane, M.E. (2005). Shoot culture procedures. En Trigiano R.N. y Gray D.J. (Eds.). Plant development and biotechnology. USA: CRC Press. Launder W. (1958). On phenocopies, their developmental phsiology and genetic meaning. Amer. Nat. 92:201-213. Lloyd G. y McCown B. (1980). Commercially-feasible micropropagation of Mountain laurel, Kalmia latifolia, by use of shoot-tip culture. Intl. Plant Prop. Soc. Proc. 30:421-427. Marcotrigiano M. y Gouin F.R. (1984a). Experimentally synthesized plant chimeras. 1. In vitro recovery of Nicotiana tabacum L. chimeras from mixed callus cultures. Ann. Bot. 54:503-511. Marcotrigiano M. y Gouin F.R. (1984b). Experimentally synthesized plant chimeras. 2. A comparison of in vitro and in vivo techniques for the production of interspecific Nicotiana chimeras. Ann. Bot. 54:513-521. McDaniel C.N. (1984). Competence, determination and induction in plant development. En: Malacinski G.M.y Bryant S.V. (Ed.). Pattern formation, a primer in developmental biology. Macmillan, New York. 393-411. Morel G. y Martin C. (1952). Guerison de Dahlias atteints d’une maladie à virus. C.R. Acad. Sci. Ser. D. 235:1324-1325. Murashige T. Plant propagation through tissue culture. Annual Reviews of Plant Physiology [en línea]. Volumen 25 [junio 1974]. Murashige T. y Skoog F. A revised médium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum [en línea]. Volúmen 15 [Julio 1962]. Universidad Abierta y a Distancia de México 47 U1 Cultivo de tejidos vegetales II Principios de micro-propagación Reinert, J. (1959). Uebert die kontrolle der morphogenese und die induction von adventiveembryonen an gewebekulturen aus karotten. Planta 53:318-333. Schwarz O.J., Sharma A.R. y Beaty R.M. (2005). Propagation from nonmeristematic tissues: organogénesis. En Trigiano R.N. y Gray D.J. (Ed.). Plant development and biotechnology. USA: CRC Press. Smith, R.H. (2013). Plant Tissue Culture: techniques and experiments. USA: Academic Press. Skoog F. y Miller C.O. Chemical regulation of growth and organ formation in plant tissues cultured in vitro [en línea] 1957 National Center for Biotechnology Information. Steward F.C., Mapes M.O. y Mears K. (1958). Growth and organized development of cultured cells. II. Organization in cultures grown from freely suspended cells. Amer. J. Bot. 45:705-708. Styer D.J. y Chin C.K. (1984). Meristem and shoot-tip culture for propagation, pathogen elimination, and germoplasm preservation. Hor. Rev. 5:221-277. Waddington C.H. (1940). The genetic control of wing development of Drosophila. J. Genet. 41:75-139. Wickson M. y Thimann K.V. The antagonism of auxin and kinetin in apical dominance. Physiologia Plantarum [en línea]. Volúmen 11 [Junio 1958]. Universidad Abierta y a Distancia de México 48