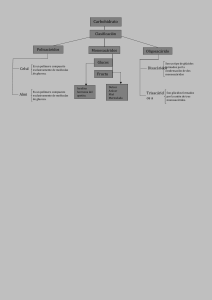
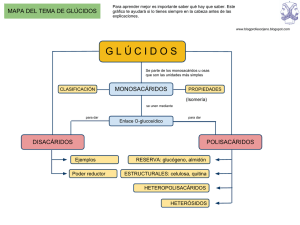
Monosacáridos Los monosacáridos son sustancias blancas, con sabor dulce, cristalizables y solubles en agua. Se oxidan fácilmente, transformándose en ácidos, por lo que se dice que poseen poder reductor (cuando ellos se oxidan, reducen a otra molécula). Los monosacáridos son moléculas sencillas que responden a la fórmula general (CH2O)n. Están formados por 3, 4, 5, 6 ó 7 átomos de carbono. Químicamente son polialcoholes, es decir, cadenas de carbono con un grupo -OH cada carbono, en los que un carbono forma un grupo aldehído o un grupo cetona. Se clasifican atendiendo al grupo funcional (aldehído o cetona) en aldosas, con grupo aldehído, y cetosas, con grupo cetónico. Cuando aparecen carbonos asimétricos, presentan distintos tipos de isomería. Algunos de ellos pueden presentar su estructura ciclada. Los monosacáridos se nombran atendiendo al número de carbonos que presenta la molécula: Triosas: tres carbonos Tetrosas: cuatro carbonos Pentosas: cinco carbonos Hexosas: seis carbonos Heptosas: siete carbonos Ejemplos de monosacáridos relevantes en el metabolismo son la glucosa, la fructosa, la ribosa o la desoxirribosa, entre otros muchos. Ciclación En disolución, los monosacáridos pequeños se encuentran en forma lineal, mientras que las moléculas más grandes ciclan su estructura. La estructura lineal recibe el nombre de Proyección de Fischer; la estructura ciclada de Proyección de Haworth. En la representación de Haworth la cadena carbonada se cicla situada sobre un plano. Los radicales de la cadena se encuentran por encima o por debajo de ese plano. La estructura ciclada se consigue en aldopentosas y hexosas. El enlace de ciclación se genera entre el carbono que posee el grupo funcional y el carbono asimétrico más alejado del grupo funcional. Cuando el carbono tiene un grupo aldehído, como grupo funcional, el enlace recibe el nombre de hemiacetálico. Cuando el carbono tiene un grupo cetona, como grupo funcional, el enlace recibe el nombre de hemicetálico. La molécula ciclada puede adquirir el aspecto de un pentágono o de un hexágono. Los monosacáridos ciclados con aspecto de pentágono reciben el nombre de Furanosas. Los monosacáridos ciclados con aspecto de hexágono reciben el nombre de Piranosas Isomería La isomería es una característica que aparece en aquellas moléculas que tienen la misma fórmula empírica, pero presentan características físicas o químicas que las hacen diferentes. A estas moléculas se las denomina isómeros. En los monosacáridos podemos encontrar isomería de función, isomería espacial e isomería óptica. Isomería de función Los isómeros se distinguen por tener distintos grupos funcionales. Las aldosas son isómeros de las cetosas. Isomería espacial Los isómeros espaciales, o estereoisómeros, se producen cuando la molécula presenta uno o más carbonos asimétricos. Los radicales unidos a estos carbonos pueden disponerse en el espacio en distintas posiciones. Cuantos más carbonos asimétricos tenga la molécula, más tipos de isomería se presentan. El carbono asimétrico más alejado del grupo funcional sirve como referencia para nombrar la isomería de una molécula. Cuando el grupo alcohol de este carbono se encuentra representado a su derecha en la proyección lineal se dice que esa molécula es D. Cuando el grupo alcohol de este carbono se encuentra representado a su izquierda en la proyección lineal se dice que esa molécula es L. Los isómeros especulares, llamados también enantiómeros, o enantiomorfos, o isómeros quirales, son moléculas que tienen los grupos -OH de todos los carbonos asimétricos, en posición opuesta, reflejo de la otra molécula isómera. Se consideran epímeros a las moléculas isómeras que se diferencian en la posición de un único -OH en un carbono asimétrico. Isomería óptica Cuando se hace incidir un plano de luz polarizada sobre una disolución de monosacáridos que poseen carbonos asimétricos el plano de luz se desvía. Si la desviación se produce hacia la derecha se dice que el isómero es dextrógiro y se representa con el signo (+). Si la desviación es hacia la izquierda se dice que el isómero es levógiro y se representa con el signo ( - ). Propiedades de un monosacárido Retomando la idea de monosacárido, son hidratos de carbono que, al ser sometidos a una hidrólisis, no se descomponen. Conocidos como azúcares simples, están considerados como los carbohidratos más sencillos. Un monosacárido dispone de entre tres y siete átomos de carbono. Uno de esos átomos se une a un grupo carbonilo, mientras que todos los restantes se vinculan a un grupo alcohol. Los monosacáridos son monómeros (moléculas con una masa molecular reducida). La unión de varios monosacáridos en un proceso de polimerización da lugar a los polímeros nombrados como polisacáridos. Otras características Otra de las características de los monosacáridos es que su cadena carbonada no se ramifica, y que tan sólo uno de sus diversos átomos de carbono no tiene en su contenido un grupo alcohol. Se entiende por cadena carbonada el esqueleto de casi cualquier compuesto orgánico; consiste en un grupo de átomos de carbono de unión covalente carbono-carbono, a la cual pueden agregarse o unirse más átomos, como ser de nitrógeno, oxígeno o hidrógeno. Como se menciona más arriba, el átomo diferente al resto se une a un grupo carbonilo, un concepto que también se conoce como grupo funcional carbonílico y se trata de un grupo funcional formado por un átomo de carbono y uno de oxígeno, unidos por un doble enlace. Si el grupo carbonilo se encuentra en la punta de la cadena, entonces se habla de grupo aldehído y el monosacárido se denomina aldosa. En cambio, cuando el carbono se encuentra en otra posición, se llama cetona y el monosacárido, cetosa. https://definicion.de/monosacarido/ https://www.asturnatura.com/articulos/glucidos/monosacaridos.php http://recursos.cnice.mec.es/biosfera/alumno/2bachillerato/biomol/contenidos6.htm EL ENLACE GLICOSÍDICO Compuestos con grupos OH, NH2 y SH pueden reaccionar con el OH hemiacetálico del carbono anomérico de un monosacárido, con pérdida de una molécula de agua para formar los compuestos llamados generalmente glicósidos. El enlace acetálico establecido se llama enlace glicosídico. La figura inferior muestra la formación de etilglucósido (un O-glicósido) a partir de glucosa y etanol. Según la naturaleza del grupo reaccionante se distinguen O-glicósidos (a partir de un OH, figura superior), N-glicósidos (a partir de un NH2) y S-glicósidos (a partir de un SH) Hay una serie de compuestos naturales denominados C-glicósidos. El antibiótico aquayamicina (tabla superior) pertenece a este grupo. Estrictamente hablando, no poseen un enlace glicosídico, ya que la sustitución del oxígeno del carbono anomérico elimina el grupo acetal del carbono anomérico y la molécula se hace resistente a los ácidos, lo que la diferencia del resto de glicósidos. Desde el punto de vista químico, el glicósido consta de: glicona: es el componente glicídico, que normalmente aporta solubilidad a la molécula aglicona o genina: es el componente que reacciona con el OH anomérico de la glicona y que suele ser responsable de su actividad La glicona no tiene que ser necesariamente un monosacárido. En muchos casos es un disacárido o un trisacárido. Compuestos con grupos OH, NH2 y SH pueden reaccionar con el OH hemiacetálico del carbono anomérico de un monosacárido, con pérdida de una molécula de agua para formar los compuestos llamados generalmente glicósidos. El enlace acetálico establecido se llama enlace glicosídico. La figura inferior muestra la formación de etilglucósido (un O-glicósido) a partir de glucosa y etanol. Según la naturaleza del grupo reaccionante se distinguen O-glicósidos (a partir de un OH, figura superior), N-glicósidos (a partir de un NH2) y S-glicósidos (a partir de un SH) (figuras de la tabla inferior). El nucleósido guanosina es un N-glicósido La sinigrina (obtenida de la mostaza negra) es un S-glicósido el antibiótico aquayamicina es un C-glicósido Hay una serie de compuestos naturales denominados C-glicósidos. El antibiótico aquayamicina (tabla superior) pertenece a este grupo. Estrictamente hablando, no poseen un enlace glicosídico, ya que la sustitución del oxígeno del carbono anomérico elimina el grupo acetal del carbono anomérico y la molécula se hace resistente a los ácidos, lo que la diferencia del resto de glicósidos. Desde el punto de vista químico, el glicósido consta de: glicona: es el componente glicídico, que normalmente aporta solubilidad a la molécula aglicona o genina: es el componente que reacciona con el OH anomérico de la glicona y que suele ser responsable de su actividad La glicona no tiene que ser necesariamente un monosacárido. En muchos casos es un disacárido o un trisacárido. Cuando la aglicona es otro monosacárido, se trata de un glicósido holósido, y si es un compuesto distinto, es un glicósido heterósido. Al formarse un enlace glicosídico: el carbono anomérico pierde su carácter reductor se estabiliza la forma anomérica (a o b) del monosacárido en la forma en que reaccionó y ya no se puede observar el fenómeno de mutarrotación. Se puede hablar por tanto de a-glicósidos y b-glicósidos. aumenta la solubilidad de la aglicona, facilitando así la eliminación por la orina de compuestos poco solubles en agua El enlace glicosídico es susceptible a la hidrólisis ácida y a la acción de las enzimas llamadas glicosidasas. El enlace glucosídico es aquel mediante el cual un glúcido se enlaza con otra molécula, que puede ser o no ser otro glúcido. En caso de unirse entre sí dos o más monosacáridos formando disacáridos o polisacáridos utilizando un átomo de oxígeno como puente entre ambas moléculas (un éter), su denominación correcta es enlace O-glucosídico. Análogamente, también existen enlaces S, N y C glucosídicos. En el enlace O-glucosídico reacciona el grupo OH (hidroxilo) del carbono anomérico del primer monosácarido con un OH unido a un carbono (anomérico o no) del segundo monosacárido. Se forma un disacárido y una molécula de agua. El proceso es realmente una condensación, se denomina deshidratación por la característica de la pérdida de la molécula de agua, al igual que ocurre en la formación del enlace peptídico. Si la reacción de los OH provienen de los dos carbonos anómericos, el disacárido será dicarbonílico y no tendrá poder reductor. Sin embargo, si en el enlace participan los OH de un carbono anomérico y de otro carbono no anomérico, el disacárido será monocarbonílico y tendrá poder reductor (ya que queda un grupo OH libre en el otro carbono anómerico). NOMENCLATURA Para nombrar los disacáridos se considera la posición del enlace respecto al carbono anomérico, componiendo el nombre de la siguiente forma: ⦁ 1. Se indica la configuración del carbono anomérico que une los monómeros ⦁ 2. Se añade el enantiómero (D o L) de cada uno ⦁ 3. Se indica la estructura del anillo de cada monómero (furano o pirano) ⦁ 4. Se añade la terminación -osil al primer monosacárido ⦁ 5. Entre paréntesis se coloca el número del carbono del primer monómero unido por el enlace, una flecha y el número del carbono del segundo (X → X`) ⦁ 6. Se escribe el segundo monosacárido siguiendo las reglas anteriores. Si el enlace es dicarbonílico termina en -ósido; si el enlace es monocarbonílico termina en -osa. Proyección de Haworth y Fischer Cuando se lee literatura química y bioquímica, es posible que encuentre diferentes convenciones para dibujar moléculas en tres dimensiones, depende en el contexto de la discusión. Mientras químicos orgánicos prefieren usar la convención de líneas continuas y descontinuas para representar estereoquímica, bioquímicos seguido usan proyecciones llamadas Fischer y Haworth para discutir y comparar la estructura de azucares. Proyecciones Fisher muestran azucares en sus posiciones de silla abierta. En una proyección Fischer, el átomo de carbón de una molécula de azúcar esta conectada verticalmente por líneas solidas, mientras enlaces de carbón-oxigeno y carbónhidrogeno son mostradas horizontalmente. Información estereoquímica es seguida por una regla simple: enlaces verticales van dentro de el plano de la pagina, mientras enlaces horizontales van afuera de el plano de la pagina. En seguida hay dos representaciones diferentes de (R)- gliceraldehído, la molecula de azúcar mas pequeña (también llamada D- gliceraldehído en la nomenclatura estereoquímica usada por bioquímicos) Abajo hay tres representaciones de la forma abierta de D-glucosa: en la proyección Fischer (A), in la “estructura linear” variaciones de la proyección Fisher en la cual carbón y hidrogeno no son mostrados, y finalmente en el estilo “zigzag” (C) la cual los químicos orgánicos prefieren. Cuando se ‘traduce’ proyecciones Fischer a ‘zigzag’ hay que tener cuidado – es muy fácil equivocarse en la estereoquímica. Probablemente la mejor manera de convertirlos es asignar las configuraciones R/S, y proceder de allí. Para decidir si el estereocentro es R o S en la proyección Fischer , note que el hidrogeno, en un enlace horizontal, esta dirigido hacia ti – por lo tanto, un circulo en contra del reloj significa R, y una rotación con el reloj significa S (lo opuesto cuando el hidrogeno esta alejándose de usted). Proyecciones Fischer son útiles cuando se estas viendo diferentes estructuras de azucares diastereoméricas, porque de esta manera uno puede notar las diferencias estereoquímicas basado en que si el grupo hidroxilo esta en la derecha u izquierda. Mientras proyecciones Fischer son usadas para la posición de silla abierta, proyecciones Haworth son usadas para ver azucares en su forma cíclica. El diastereómero beta de la forma cíclica de glucosa es mostrada abajo en tres diferentes representaciones, con la proyección Haworth en el medio. A pesar que la proyección Haworth es una manera conveniente de mostrar estereoquímica, no provee una representación de la confirmación. Para mostrar ambos, configuración y estereoquímica, debe de dibujar el anillo en la configuración de silla, como la figura C de arriba. Este convenio se usa para representar en el plano la configuración tridimensional de los monosacáridos en su forma cíclica. El anillo se coloca con el carbono anomérico a la derecha y el átomo de oxígeno atrás. Los átomos de C y enlace dibujados en la parte inferior del anillo están delante, los dibujados en la parte superior están atrás. Según esto, al pasar de la forma lineal a la cíclica: los sustituyentes que estaban hacia la derecha quedan por debajo del plano medio del anillo; los sustituyentes que estaban hacia la izquierda quedan por encima del plano medio del anillo; el grupo CH2OH más alejado del carbonilo, si es un d-monosacárido queda por encima del anillo (si fuera un l- quedaría por debajo) (justificación). Nomenclatura α, β de los anómeros: Una vez dispuesta la estructura de este modo, se comparan en la proyección de Fischer inicial las posiciones del -OH del carbono anomérico y el -OH del último carbono quiral: si coinciden sus orientaciones, se nombra como anómero alfa; si no, como beta. Referencia: IUPAC Gold Book enlace a web Es decir, los monosacáridos de la serie d- son α- cuando el OH anomérico queda hacia abajo en la proyección de Haworth (derecha en la de Fischer, al igual que d-) Sin embargo, los de la serie l- son α- cuando el OH anomérico queda hacia arriba en la proyección de Haworth (izquierda en la de Fischer, al igual que l-) https://espanol.libretexts.org/Quimica/Libro%3A_Quimica_Organica_con_enfasis_Bi ologico_(Soderberg)/03%3A_Conformaciones_y_estereoquimica/3.09%3A_Proyecci ones_Fischer_y_Haworth#:~:text=Mientras%20proyecciones%20Fischer%20son%2 0usadas,proyecci%C3%B3n%20Haworth%20en%20el%20medio. https://biomodel.uah.es/model6/Haworth.htm https://aprendiendoquimicaorganica.wordpress.com/2015/03/26/proyeccion-dehaworth/ Pirano y Furano En química el pirano es un compuesto heterocíclico formado por cinco átomos de carbono y un átomo de oxígeno y que presenta dos dobles enlaces. La fórmula molecular es C5H6O. Existen dos tipos de isómeros, los cuales difieren en la localización de los dobles enlaces. En el 2H-pirano, el carbono saturado está en la posición 2, mientras que en el 4H-pirano se encuentra en la posición 4. El 4H-pirano fue aislado y caracterizado en 1962 vía pirólisis del 2-acetoxi-3,4dihidro-2H-pirano.1 Se constató que era muy inestable, particularmente en presencia de aire. Aunque los piranos tienen poca importancia en la química, una variedad de sus derivados son importantes biomoléculas, como los piroflavonoides. El término pirano a menudo también se aplica al anillo saturado tetrahidropirano. En este contexto los monosacáridos que contienen un anillo hexagonal son conocidos como anillos piranosos. De ahí que la forma de anillo hexagonal de la D-glucosa sea conocida como D-glucopiranosa. El furano es un compuesto orgánico heterocíclico aromático de cinco miembros, que incluye un átomo de oxígeno. Es un líquido claro, incoloro, altamente inflamable y muy volátil, con un punto de ebullición cercano al de la temperatura ambiente. Es tóxico y puede ser carcinógeno. Cuando una aldohexosa forma una estructura cíclica de 6 miembros se conoce como piranosa, cuando el ciclo es de 5 miembros (independientemente de que la molécula cuente con 6 Carbonos), se denomina furanosa. Tanto las piranosas como las furanosas pueden tener isómeros a y b. Las piranosas pueden adquirir la configuración de bote o de silla, al igual que el ciclohexano. Las furanosas por el contrario, tienen una configuración planar en el espacio. Cuando se forma la estructura cíclica, la molécula puede adquirir dos tipos de configuración diferentes: En el caso de las cetosas, el grupo carbonilo del Carbono 2, reacciona con el hidroxilo, del Carbono 5 dando origen a una estructura cíclica de 5 miembros (furanosa), al nuevo compuesto La fórmula molecular es C5H6O. Existen dos tipos de isómeros, los cuales difieren en la localización de los dobles enlaces. En el 2H-pirano, el carbono saturado está en la posición 2, mientras que en el 4H-pyran se encuentra en la posición 4. Aunque los pirano tienen poca importancia en la química, una variedad de sus derivados son importantes biomoléculas. El término pirano es también a menudo aplicado al anillo saturado tetrahidropirano. En este contexto los monosacáridos que contienen un anillo hexagonal son conocidos como anillos piranosos. De ahí que la forma de anillo hexagonal sea conocida como D-glucopiranosa. Furano Para las sustancias semejantes a las dioxinas, véase Dibenzofurano. El furano es un compuesto orgánico heterocíclico. Es un líquido claro, incoloro, altamente inflamable y muy volátil, con un punto de ebullición cercano al de la temperatura ambiente. Es tóxico y puede ser carcinógeno. Historia El nombre furano viene del Latín furfur que significa salvado.4 El primer derivado del furano fue descripto como ácido 2-furoico, por Carl Wilhelm Scheele en 1780. Otro derivado importante, el furfural fue descripto por Johann Wolfgang Döbereiner en 1831 y caracterizado nueve años después por John Stenhouse. El pirano es un compuesto heterocíclico formado por cinco átomos de carbono y un átomo de oxígeno y que presenta dos dobles enlaces El furano es un compuesto orgánico heterocíclico aromático de cinco miembros, que incluye un átomo de oxígeno. Es un líquido claro, incoloro, altamente inflamable y muy volátil https://www.monografias.com/docs/Piranosa-y-FuranosaF3E2STFJ8UNY#:~:text=Cuando%20una%20aldohexosa%20forma%20una,Carbon os)%2C%20se%20denomina%20furanosa. https://cns.ipicyt.edu.mx/index.php/2020/09/22/los-grupos-funcionales-de-furanos-ypiranos-impulsaron-la-superficie-de-las-esponjas-de-nanofibras-con-nitrogeno/ http://dspace.uan.mx:8080/jspui/bitstream/123456789/1868/3/QU%C3%8DMICA%2 0ORG%C3%81NICA%20Introducci%C3%B3n%20a%20la%20Qu%C3%ADmica%2 0Heteroc%C3%ADclica.pdf Disacáridos Son oligosacáridos formados por dos monosacáridos. Son solubles en agua, dulces y cristalizables. Pueden hidrolizarse y ser reductores cuando el carbono anomérico de alguno de sus componentes no está implicado en el enlace entre los dos monosacáridos. La capacidad reductora de los glúcidos se debe a que el grupo aldehído o cetona puede oxidarse dando un ácido. Maltosa.- Es el azúcar de malta. Grano germinado de cebada que se utiliza en la elaboración de la cerveza. Se obtiene por hidrólisis de almidón y glucógeno. Posee dos moléculas de glucosa unidas por enlace tipo ALPHA.gif (842 bytes)(1-4). Isomaltosa.- Se obtiene por hidrólisis de la amilopectina y glucógeno. Se unen dos moléculas de glucosa por enlace tipo ALPHA.gif (842 bytes)(1-6) Los disacáridos o azúcares dobles son un tipo de hidratos de carbono, o carbohidratos, formados por la condensación de dos monosacáridos iguales o distintos mediante enlace O-glucosídico, mono o dicarbonílico, que además puede ser α o β en función del -OH hemiacetal. Los disacáridos más comunes son: Sacarosa: Formada por la unión de una glucosa y una fructosa. A la sacarosa se le llama también azúcar común. Lactosa: Formada por la unión de una glucosa y una galactosa. Es el azúcar de la leche. Maltosa, Isomaltosa, Trehalosa, Celobiosa: Formadas todas por la unión de dos glucosas, son diferentes dependiendo de la unión entre las glucosas. La fórmula empírica de los disacáridos es C12H22O11. El enlace covalente entre dos monosacáridos provoca la eliminación de un átomo de hidrógeno de uno de los monosacáridos y de un grupo hidroxilo del otro monosacárido. En la mucosa del tubo digestivo del hombre existen unas enzimas llamadas disacaridasas, que hidrolizan el enlace glucosídico que une a los dos monosacáridos, para su absorción intestinal. Otros tipos de hidratos de carbono o carbohidratos Monosacáridos. Oligosacáridos. Polisacáridos. Principales intolerancias a los disacáridos Intolerancia a la lactosa Intolerancia a la sacarosa Intolerancia a la trehalosa Estructura de los disacáridos Los disacáridos se producen cuando se combinan químicamente dos monosacáridos. Consideremos tres de los más importantes disacáridos: la maltosa, la lactosa y la sacarosa. La hidrólisis de estos tres disacáridos produce diferentes combinaciones de monosacáridos: maltosa glucosa + glucosa lactosa glucosa + galactosa sacarosa glucosa + fructosa Los disacáridos, también llamados ósidos, son un tipo de glúcidos formados por la condensación (unión) de dos monosacáridos mediante un enlace O-glucosídico (con pérdida de una molécula de agua) pues se establece en forma de éter siendo un átomo de oxígeno el que une cada pareja de monosacáridos, mono o dicarbonílico, que además puede ser α o β en función del -OH hemiacetal o hemicetal. Los disacáridos y polisacáridos se pueden hidrolizar. Los disacáridos más comunes son: Sacarosa: formada por la unión de una glucosa y una fructosa. A la sacarosa se le llama también azúcar común. No tiene poder reductor. Lactosa: formada por la unión de una glucosa y una galactosa. Es el azúcar de la leche. Tiene poder reductor . Maltosa, isomaltosa, trehalosa y celobiosa: formadas todas por la unión de dos glucosas, son diferentes dependiendo de la unión entre las glucosas. Todas ellas tienen poder reductor, salvo la trehalosa. El carácter reductor se da en un disacárido si uno de los monosacáridos que lo forman tiene su carbono anomérico (o carbonílico) libre, es decir, si este carbono no forma parte del enlace O-glucosídico. Dicho de otra forma, si el enlace Oglucosídico es monocarbonílico el disacárido resultante será reductor (maltosa, celobiosa, etc.), mientras que si el enlace O-glucosídico es dicarbónílico el disacárido resultante será no reductor (sacarosa, trehalosa). Ya que los monosacáridos (exceptuando el glicoaldehído) poseen capacidad de ciclización, y, estando en su forma de cadena abierta tienen la capacidad de oxidarse, explicándose así su carácter reductor. La fórmula molecular de los disacáridos es C12H22O11. El enlace covalente entre dos monosacáridos provoca la eliminación de un átomo de hidrógeno de uno de los monosacáridos y de un grupo hidroxilo del otro monosacárido, de forma que se elimina una molécula de agua (H2O) que pasa al medio de reacción. En la mucosa del tubo digestivo del ser humano existen unas enzimas llamadas disacaridasas, que hidrolizan el enlace glucosídico que une a los dos monosacáridos, para su absorción intestinal. https://www.um.es/molecula/gluci04.htm https://www.asturnatura.com/articulos/glucidos/disacaridos.php https://www.quimica.es/enciclopedia/Disac%C3%A1rido.html Polisacáridos Están formados por la unión de muchos monosacáridos, de 11 a cientos de miles. Sus enlaces son O-glucosídicos con pérdida de una molécula de agua por enlace. Características Peso molecular elevado. No tienen sabor dulce. Pueden ser insolubles o formar dispersiones coloidales. No poseen poder reductor. Sus funciones biológicas son estructurales (enlace BETA.gif (851 bytes)Glucosídico) o de reserva energética (enlace ALPHA.gif (842 bytes)-Glucosídico). Puede ser: a) Homopolisacáridos: formados por monosacáridos de un solo tipo. - Unidos por enlace ALPHA.gif (842 bytes) tenemos el almidón y el glucógeno. - Unidos por enlace BETA.gif (851 bytes) tenemos la celulosa y la quitina. b) Heteropolisacárido: el polímero lo forman mas de un tipo de monosacárido. - Unidos por enlace ALPHA.gif (842 bytes) tenemos la pectina, la goma arábiga y el agar-agar. 5.1. Almidón. Es un polisacárido de reserva en vegetales. Se trata de un polímero de glucosa, formado por dos tipos de moléculas: amilosa (30%), molécula lineal, que se encuentra enrollada en forma de hélice, y amilopectina (70%), molécula ramificada. Procede de la polimerización de la glucosa que sintetizan los vegetales en el procesos de fotosintesis, almacenandose en los amiloplastos. Se encuentra en semillas, legumbres y cereales, patatas y frutos (bellotas y castañas). En su digestion intervienen dos enzimas: ALPHA.gif (842 bytes)-amilasa (rompe enlaces 1-4) y la ALPHA.gif (842 bytes) (1,6) glucosidasa para romper las ramificaciones. Al final del proceso se libera glucosa 5.2. Glucógeno. Es un polisacárido de reserva en animales, que se encuentra en el hígado (10%) y músculos (2%). Presenta ramificaciones cada 8-12 glucosas con una cadena muy larga (hasta 300.000 glucosas). Se requieren dos enzimas para su hidrólisis (glucógenofosforilasa) y ALPHA.gif (842 bytes) (1-6) glucosidasa, dando lugar a unidades de glucosa. Dado que los seres vivos requieren un aporte constante de energía, una parte importante del metabolismo de los azúcares está relacionado con los procesos de formación de almidón y glucógeno y su posterior degradación 5.3.Celulosa. Polisacárido estructural de los vegetales en los que constituye la pared celular. Es el componente principal de la madera (el 50% es celulosa) algodón, cáñamo etc. El 50 % de la Materia Orgánica de la Biosfera es celulosa. Es un polímero lineal de celubiosa. Sus glucosas se unen por puentes de Hidrógeno dando microfibrillas, que se unen para dar fibrillas y que a su vez producen fibras visibles. Observa su estructura. 5.4. Quitina. Forma el exoesqueleto en artrópodos y pared celular de los hongos. Es un polímero no ramificado de la N-acetilglucosamina con enlaces 5.5. Pectina. Es un heteropolisacárido con enlace ALPHA. Junto con la celulosa forma parte de la pared vegetal. Se utiliza como gelificante en industria alimentaría (mermeladas). 5.6. Agar-Agar. Es un heteropolisacárido con enlace ALPHA. Se extrae de algas rojas o rodofíceas. Se utiliza en microbiología para cultivos y en la industria alimentaria como espesante. En las etiquetas de productos alimenticios lo puedes encontrar con el código E-406. Están constituidos por un gran número de monosacáridos unidos mediante enlaces glucosídicos, formando largas cadenas. Los polisacáridos pueden ser homopolímeros, cuando la unidad repetitiva es un solo tipo de monosacárido, o heteropolímeros, cuando las unidades repetitivas están constituidas al menos por dos monómeros diferentes, un ejemplo es el ácido hialurónico, formado por los monómeros N-acetilglucosamina y el ácido glucurónico. El ácido hialurónico se encuentra en el tejido conectivo donde actúa como pegamento para mantener unidas las células, es de importancia para el ensamble en el tejido conjuntivo y óseo. Los polisacáridos son biomoléculas que se encuentran conformadas por la unión de una importante cantidad de monosacáridos, que son los azúcares más simples, más sencillos y que se caracterizan por no hidrolizarse, o sea, no se descomponen en otros compuestos. Entre las principales funciones que saben cumplir se destacan las de aportar reservas energéticas y asimismo estructurales, es decir, desarrollan estructuras orgánicas, almacenan energía y se erigen en protectores del organismo ante la aparición de determinados fenómenos. Por caso es que a los polisacáridos se los puede distinguir en polisacáridos de reserva (se ocupan de almacenar el azúcar, fuente de energía) y polisacáridos estructurales (aquellos glúcidos que intervienen en la construcción de estructuras orgánicas). Cabe destacarse que a los polisacáridos se los incluye dentro del grupo conocido popularmente como hidratos de carbono, glúcidos o carbohidratos. Entre los polisacáridos más notables nos encontramos con: celulosa, almidón, glucógeno y quitina. La celulosa podría decirse que es el polisacárido por excelencia ya que es el más presente en nuestro planeta. Su intervención se encuentra en la pared de las células vegetales, participa en el proceso de digestión de los seres humanos y se lo utiliza a la hora de producir barniz, papel, entre otros. Por su parte, la quitina, está manifestada en el exoesqueleto de diferentes insectos, en los órganos de algunos animales y en las paredes de las células de los hongos. En tanto, industrias como la farmacéutica y la alimenticia la emplean para fabricar algunos de sus productos. El almidón se encuentra presenta presente en las plantas, especialmente en sus semillas, tallos y raíces, aportándoles reservas de energía. Mientras tanto, el consumo del almidón por parte de las personas es realmente alto, aportándonos más de un 70 % de calorías. Y el glucógeno es el polisacárido más abundante en el hígado de los seres humanos, en los músculos y en muchos de nuestros tejidos orgánicos. Los polisacáridos pueden descomponerse a partir del proceso denominado como hidrólisis que consiste en la reacción química entre una molécula de agua y otra, dividiéndose en dos la molécula de agua. Principales usos de los polisacáridos en alimentos ● Estabilizadores a través de sus interacciones con agua ● Emulsionantes ● Gelificantes ● Estabilizan o forman espumas ● Mejoran la textura dándole "cuerpo al alimento ● Espesantes y agentes de viscosidad ● Encapsulación de sabores artificiales, fijación de sabores ● Estabilizan sistemas donde hay ciclos de congelamiento y descongelamiento ● Controlan la cristalización de azúcares, sales y agua ● Forman películas resistentes ● Agentes de suspensión de sólidos en líquidos ● Agentes adhesivos ● Espesantes en alimentos dietéticos bajos en calorías ● Agentes floculantes ● Reducen el daño estructural del alimento causado por el congelamiento Los almidones por ejemplo son los polímeros donde se unen un gran número de monosacáridos de glucosa. Los almidones tienen la fórmula general (C6H10O5), donde n depende del tipo de almidón formado. Por ejemplo, el glucógeno es un almidón animal que se compone de aproximadamente 60.000 unidades de glucosa. El glucógeno es importante como fuente de almacenamiento de energía tanto en el hígado como en los músculos. Cuando un organismo necesita que las enzimas de la energía, la degradación de liberar las unidades de glucosa. Observe en el siguiente diagrama cómo las moléculas de glucosa están unidas en glucógeno. Glucosa Glucógeno Los polisacárido se encuentran como cadenas lineales, o bien, ramificadas, que a su vez pueden estar integradas por un solo tipo de monosacárido (homopolisacarido), como por ejemplo el almidón y la celulosa, o también por varios tipos de monosacáridos (heteropolisacarido), como es el caso de la mayoría de las gomas. De cualquier manera, sus componentes siempre están unidos regularmente con una secuencia y estructura repetitivas, representando polímeros con un alto grado de ordenación. https://www.textoscientificos.com/quimica/carbohidratos/polisacaridos https://www.definicionabc.com/ciencia/polisacaridos.php https://e1.portalacademico.cch.unam.mx/alumno/quimica2/unidad2/carbohidratos/pol isacaridos