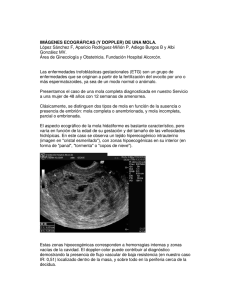
26-6-2020 ISEM HOSPITAL MATERNO PERINATAL “MONICA PRETELINI SAENZ” ENFERMEDAD TROFOBLÁSTICA GESTACIONAL DRA KARINA GUADALUPE HERNÁNDEZ CHÁVEZ RESIDENTE DE PRIMER AÑO DE LA ESPECIALIDAD DE GINECOLOGÍA Y OBSTETRICIA DEL HOSPITAL MATERNO PERINATAL MONICA PRETELINI SAENZ INTRODUCCIÓN La enfermedad trofoblástica gestacional (ETG) es definida como un grupo heterogéneo de lesiones interrelacionadas las cuales surgen a partir del epitelio trofoblástico de la placenta después de una fertilización normal o anormal. Las células placentarias trofoblásticas poseen la habilidad de proliferar, invadir tejido huésped, evadir la respuesta inmune e incluso metastatizar. En condiciones normales, el tejido trofoblástico sano invade agresivamente el endometrio y desarrolla una rica vasculatura uterina, lo que genera una íntima conexión entre el feto y la madre, conocida como la placenta. La invasión es una de las características distintivas de las enfermedades malignas; afortunadamente, el comportamiento maligno está estrictamente controlado en un tejido trofoblástico sano. Sin embargo, en la enfermedad trofoblástica gestacional los mecanismos de regulación fallan, lo que resulta en tumores altamente invasivos, metastásicos y muy vascularizados. Comprende un espectro de entidades clínicas que van desde molares no invasivos, hasta neoplasia trofoblástica gestacional metastásica y se caracteriza por un marcador tumoral distinto (Subunidad β de la gonadotropina coriónica humana, β HCG). Hipócrates fue probablemente el primero en describir la gestación. enfermedad trofoblástica alrededor del año 400 aC en su descripción de hidropesía del útero. La enfermedad trofoblástica gestacional consta de seis entidades clinicopatológicas distintas: mola hidatiforme completa (CHM), mola hidatiforme parcial (PHM), que son de cierta manera benignas, y está la mola invasiva (IM), coriocarcinoma (CCA), tumores trofoblásticos de localización placental (PSTT), y tumores trofoblásticos epitelioides (ETT), de carácter maligno. Sin embargo, la clasificación actual de la OMS de ETD es presentado de la siguiente manera: Clasificación de las enfermedades trofoblásticas gestacionales. 1) 2) 3) 4) 5) 6) 7) Molas hidatiformes: a) Mola hidatiforme completa (CHM) b) Mola hidatiforme parcial (PHM) Mola hidatiforme invasiva Coriocarcinoma gestacional (CCa) Tumor trofoblástico del sitio placentario (PSTT) Tumor trofoblástico epitelioide (ETT) Condiciones similares a tumores: a) Reacción exagerada del sitio placentario (EPS) b) Nódulo de sitio placentario (PSN) Lesiones trofoblásticas no clasificadas Estos tumores abarcan menos del 1% de los tumores ginecológicos y todos producen gonadotropina coriónica humana, que se puede utilizar como marcador tumoral para el diagnóstico, el monitoreo de los efectos de la terapia y el seguimiento para la detección de la recaída. El término neoplasia trofoblástica gestacional (NTG) se ha aplicado colectivamente para lo que es: mola invasiva, coriocarcinoma, PSTT y ETT. Las características histopatológicas permiten hacer el diagnóstico diferencial de la diversidad de las presentaciones de la enfermedad trofoblástica gestacional. En el coriocarcinoma la invasión vascular ocurre tempranamente resultando en metástasis hacia el pulmón, vagina, cerebro, riñón, hígado y aparato gastrointestinal. El tratamiento dependerá del cuadro clínico y el reporte histopatológico pudiendo ser quirúrgico o incluso diversos esquemas de quimioterapia. 1 EPIDEMIOLOGIA La incidencia y los factores etiológicos que contribuyen al desarrollo de la enfermedad trofoblástica gestacional han sido difíciles de caracterizar. La mola hidatiforme es la forma más común de la ETG y corresponde aproximadamente a un 80%. Los estudios epidemiológicos han reportado una amplia variación regional en la incidencia de mola hidatiforme. Siendo esta la enfermedad trofoblástica más prevalente, estimaciones de estudios demuestran que Norte América, Australia, Nueva Zelanda y Europa han mostrado una incidencia de un rango de 0.57-1.1 por cada 1 000 embarazos, mientras que estudios en el sureste de Asia y Japón sugieren una incidencia tan alta como 2.0 por cada 1 000 embarazos. En los paíseas de altos ingresos, la incidencia de CHM es de aproximadamente 1-3 por 1 000 y de PHM de 3 por 1 000 de los embarazos. La información respecto a las tasas de incidencia del CCA es incluso más limitada debido a la rareza del mismo y la dificultad en la distinción clínica entre la CCA y la IM. En Europa y Norteamérica afecta aproximadamente a 1 en 20,000 a 40, 000 embarazos y 1 de 40 molas hidatiformes, mientras que en el Sureste de Asia y Japón las tasas de CCA son mayores, de 9.2 y 3.3 por cada 40 000 embarazos, respectivamente. Las tasas de incidencia de la CHM y el CCA han disminuido en los últimos 30 años en todas las poblaciones. La incidencia de la ETG como vimos varía según la zona geográfica. En México es de 2.4 cada 1000 embarazos. La incidencia de IM ocurre en 1 de cada 40 embarazos molares y en 1 de cada 150 000 embarazos normales. Se puede presentar posterior a un embarazo molar, un embarazo normal, aborto o embarazo ectópico. 2 FACTORES DE RIESGO La edad materna parece ser el mayor riesgo para el desarrollo de mola hidatiforme, especialmente para embarazos de CHM. Las mujeres en ambos extremos del espectro de edad reproductiva son las más vulnerables, (<15 años y > 45 años). El riesgo aumenta después de los 35 años y las mujeres mayores de 45 años tienen de 5-10 veces mayor riesgo, y aquellas mayores de 50 años tienen una posibilidad de 1 en 3 de tener un embarazo molar. Aquellas con una edad menor a 16 años tienen seis veces más riesgo de mola hidatiforme que aquellas con una edad entre 16 y 40 años. Otro factor de riesgo identificado es la historia de un embarazo molar previo, lo cual confiere un 1.8% de aumento en el riesgo que es cerca de 20 veces más que el riesgo en la población general. Un estudio transversal de 255 embarazos molares y más de 105 000 nacimientos vivos demostró que la etnia o raza es un factor de riesgo para el desarrollo de una CHM o PHM. El efecto de la etnia fue más significativo para las mujeres asiáticas, las cuales tuvieron más del doble de probabilidad que las mujeres blancas de desarrollar una CHM, y mucho menos probabilidad que las blancas de desarrollar una PHM. Al igual que las asiáticas, las mujeres hispanas y afroamericanas tienen menor probabilidad que las blancas de desarrollar PHM. Las mujeres hispánicas y las blancas tuvieron riesgo similar de CHM; sin embargo, al hacer un ajuste de la edad las hispánicas tuvieron un riesgo significativamente menor de desarrollar esta condición. La diete deficiente de beta carotenos y grasa animal se considera un factor etiológico para CHM pero no para PHM. En la siguiente tabla se pueden observar los principales factores de riesgo para la enfermedad trofoblástica gestacional. TABLA 1. FACTORES DE RIESGO EXTREMOS DE EDAD REPRODUCTIVA, ETNIA MULTIPARIDAD GRUPO SANGUÍNEO ABO ANTECEDENTE ESPONTÁNEO PATOLÓGICO DE ABORTO TOXINAS AMBIENTALES ESTRÓGENOS ENDÓGENOS TABACO DIETA ALTA EN BETA CAROTENOS CONSUMO DE ALCOHOL DIETA ALTA EN GRASA ANIMAL ESTATUS SOCIOECONÓMICO Y EXPOSICIÓN A HIERBICIDAS 3 ENTIDADES CLINICO- PATOLÓGICAS MOLA HIDATIFORME El nombre de mola hidatiforme es derivado de la combinación de la palabra griega hydatisia lo que significa gotas de agua y la palabra latina mola que significa falsa concepción. Es una enfermedad que resulta del crecimiento atípico de las células trofoblásticas que normalmente se desarrollan en la placenta; no es una desviación de lo que de otra manera hubiera sido un embarazo normal. Esta empieza al momento de la fertilización debido a una unión defectuosa entre el óvulo y el espermatozoide, lo que causa una proliferación aberrante del tejido trofoblástico que rápidamente llena la cavidad uterina. Las vellosidades placentarias se llenan de fluido y se vuelven edematosas, como estructuras similares a uvas. Un embarazo molar se clasifica como mola completa o mola parcial. MOLA HIDATIFORME COMPLETA La mola completa ocurre cuando un espermatozoide haploide fertiliza un óvulo vacío. Como resultado, el material genético del espermatozoide se replica a sí mismo, el tejido resultante es de origen completamente paternal, usualmente con un cariotipo 46XX. Las características de una CHM consisten en vellosidades hidrópicas con vesículas semitransparentes de tamaños variables con ausencia de placenta normal, debido a una hiperplasia generalizada e hinchazón del tejido trofoblástico, con una marcada atipia del tejido trofoblástico en el sitio de implantación. No hay tejido fetal identificable en la mola completa. Fig 1. CHM, muestra macroscópica. Figuras 2.A, B. Espécimen de mola completa con vesículas que tienen apariencia de racimo de uvas y muestra patológica de las vellosidades con proliferación circunferencial del tejido trofoblástico. Tomado de Vitthalrao, S., Aher, V., Gadhiya, S., & Sunil, S. (2017). Histológicamente la CHM tiene formación de cisterna florida, proliferación trofoblástica y ausencia de partes fetales, la atipia citológica significativa y las figuras mitóticas son comunes. En el primer trimestre, las vellosidades pueden no estar agrandadas, pero tienen una apariencia polipoide distinta con cambios estromales vellosos anormales e hiperplasia trofoblástica leve a moderada. 4 MOLA HIDATIFORME INCOMPLETA O PARCIAL La mola parcial es el resultado de la fertilización entre un óvulo normal y dos espermatozoides. El componente genético del tejido contiene material cromosómico tanto materno como paterno, pero la replicación de las células resulta en un cariotipo triploide, usualmente 69XXY. El tejido trofoblástico tiene únicamente áreas difusas de hiperplasia trofoblástica e hinchazón, con una atipia leve de las células trofoblásticas en el sitio de implantación. La PHM tiene tejido fetal identificable asociado; sin embargo, el feto que se desarrolla no es viable y exhibe anomalías congénitas asociadas con la triploidía. Aquí las características histológicas están menos marcadas. Un diagnostico diferencial de la PHM es el aborto espontáneo hidrópico que tienen a imitar la apariencia de este, sin embargo, este tiene una genética 46 XX o XY. La citogenética puede ayudar a diferenciar la CHM de la PHM y del aborto espontáneo hidrópico. Esto es en base a que el inhibidor de la quinasa dependiente de ciclina p57 está codificado por el gen impreso por vía materna y expresado por vía materna, y por lo tanto, está ausente en la CHM (ya que no hay genoma materno). A diferencia de la PHM y la gestación anormal no molar en donde el genoma materno tiene una fuerte tinción nuclear de p57, que puede usarse para excluir CHM, pero no para PHM de las gestaciones normales. Figuras 3. A, B. Espécimen de mola parcial y muestra microscópica de las vellosidades con proliferación trofoblástica focal. Tomado de Vitthalrao, S., Aher, V., Gadhiya, S., & Sunil, S. (2017) NEOPLASIA TROFOBLÁSTICA GESTACIONAL. La neoplasia trofoblástica gestacional (NGT) es el término utilizado para describir lesiones malignas que se originan en las vellosidades coriónicas y el trofoblasto extravilloso. Esta designación incluye cuatro entidades clínicas diferentes, cada uno con diferentes grados de proliferación, invasión y diseminación: mola invasivo (IM), coriocarcinoma (CCA), tumor placentero trofoblástico del sitio placentario (PSTT) y epitelioide tumor trofoblástico (ETT) . Estas condiciones pueden ocurrir después de un embarazo molar o normal. La NTG es caracterizada por el tejido trofoblástico que invade el miometrio, y que tiene el potencial para entrar en los vasos sanguíneos uterinos y metastatizar a otras áreas del cuerpo. Alrededor del 50% de todos los casos de neoplasia trofoblástica gestacional ocurren en gestaciones postmolar, 25% después de abortos o embarazos ectópicos y 25%, después de embarazos de término o prematuros. El tumor trofoblástico del sitio placentario (PSTT) y el Tumor trofoblástico epitelioide (ETT) sin embargo, se desarrollan posteriores a un embarazo de término o abortos no molares en el 95% de los casos. 5 La mayoría de los casos de NGT son la IM y el CCA. La CHM y la PHM puede progresar igual a alguna NTG en un 1520% y un 0.5%. 5% respectivamente. Estas enfermedades se caracterizan por presentar altos niveles de coriónica humana. La gonadotropina (hCG) es altamente sensible a la quimioterapia y tienen tasas de curación superiores al 90%. En contraste, los PSTT y ETT que tienen niveles de hCG bajo y son relativamente resistentes a la quimioterapia. Por lo tanto, el tratamiento de primera línea en estos casos es la cirugía. MOLA INVASIVA. La proliferación del tejido trofoblástico de la mola invasiva lleva a que las vellosidades coriónicas edematosas se extiendan directamente al miometrio. Las molas invasivas raramente hacen metástasis más allá del útero. Esta condición ocurre tras la evacuación de una mola hidatiforme completa en aproximadamente 20% de las pacientes, aunque también puede ocurrir después de otros embarazos, lo que es menos común.5 CORIOCARCINOMA. En términos generales, es un tumor voluminoso con áreas hemorrágicas y necróticas, que aparte del útero se encuentra en trompas, ovarios, pulmón, bazo, hígado, riñones, intestino o cerebro. Es caracterizado por una mezcla de células trofoblásticas mononucleadas alternadas con láminas de sincitiotrofoblasto. Histológicamente, la CCA muestra ausencia de vellosidades coriónicas y presencia de explosión trofoblástica y citotrofoblástica intermedia anormal bordeada con sincitiotrofoblastos con áreas de necrosis y hemorragia. Se han informado cariotipos altamente complejos y en la mayoría se observa una composición de cromosomas sexuales XX. Se desarrolla cuando el tejido trofoblástico anormal evoluciona en una malignidad epitelial, lo cual ocurre en aproximadamente 1 en 20 000 - 40 000 embarazos. Hay una alta incidencia de invasión vascular, lo que resulta en un alto riesgo de metástasis sistémicas tempranas. El sitio más común de metástasis del CCA (80%) es en pulmón, el siguiente en riesgo es la vagina (30%) y el cerebro e hígado acumulan un 10% de riesgo. Aproximadamente el 50% de los casos de coriocarcinomas surgen de un embarazo molar, el 25% de un aborto involuntario o embarazo ectópico, y el 25% de un embarazo término o pretérmino. Figuras 4, A,B. Espécimen de coriocarcinoma y muestra patológica con evidencia de las células tumorales. TUMORES TROFOBLÁSTICOS DE LOCALIZACIÓN PLACENTAL (DEL SITIO PLACENTARIO) Es una rara forma de neoplasia trofoblástica gestacional, este tumor surge del sitio de implantación placentaria y puede ocurrir después de cualquier embarazo, ya sea intrauterino o ectópico, o tras un aborto espontáneo o inducido. 6 En términos generales, PSTT aparece como masas nodulares de color blanco a amarillo que varían de 1 a 10 cm (promedio de 5 cm) en el endomiometrio con la mitad de casos que invaden profundamente en el miometrio. Histológicamente, deriva de la transformación neoplásica de las células del trofoblasto intermedio mononuclear en el lado materno del lecho placentaria. Las células tumorales tienen membranas nucleares irregulares, núcleos hipercromáticos, y citoplasma denso eosinófilo o anfofílico. La mayoría de los tumores tienen un recuento mitótico bajo. Este tipo de tumor no contiene vellosidades coriónicas. Puede ocurrir después de cualquier evento gestacional, pero a diferencia del CCA es más frecuente después de un embarazo a término o no molar. Las células tumorales expresan difusamente el lactógeno placentario humano (hPL), MUC-4, HSD3B1, HLA-G y MelCAM (CD146). PSTT muestra desequilibrios genéticos raros. TUMORES TROFOBLÁSTICOS EPITELIOIDES. Es una forma muy rara pero distintiva de NTG también derivado de las células intermedias. Microscópicamente el tumor se compone de una población relativamente uniforme de células trofoblásticas intermedias mononucleadas que forman nidos y masas sólidas. En términos generales, el tumor aparece como nódulos discretos de color blanco bronceado a marrón o masas hemorrágicas quísticas que invaden profundamente los tejidos circundantes. Casi la mitad surge en el cuello uterino o el segmento inferior del útero y algunos en el fondo y ligamento ancho. Histológicamente las células se asemejan a las trofoblásticas en el corion, y por lo tanto se designan como “trofoblasto intermedio de tipo coriónico”. Son islas de células trofoblásticas intermedias con una cantidad moderada de eosinófilos para eliminar el citoplasma y los núcleos redondos están rodeados de necrosis extensa y están asociados con una matriz hialina. El recuento mitótico varía de 0 a 9 por 10 HPF. La necrosis extensa o "geográfica" a menudo está presente. ETT puede coexistir con otras neoplasias trofoblásticas No es raro que se diagnostique mucho después de un antecedente de embarazo, aunque también se puede presentar un tumor trofoblástico epitelioide extrauterino sin evidencia de enfermedad trofoblástica gestacional previa en el útero. Los tumores trofoblásticos de localización placental y los tumores trofoblásticos epitelioides son derivados de trofoblasto extravelloso y están compuestos casi exclusivamente de trofoblasto intermedio. Los de localización placentaria surgen del trofoblasto intermedio y tienen un patrón de crecimiento e invasión similar al del trofoblasto intermedio normal. Por su parte, los tumores epitelioides se desarrollan del trofoblasto intermedio de tipo coriónico presente en otras partes de la placenta (membranas fetales, placa coriónica, islas celulares). En contraste con el sitio normal de implantación donde la invasión del trofoblasto extravelloso (intermedio) está estrictamente regulada y confinada al tercio interior del miometrio, las células del PSTT y el ETT son altamente invasivas e infiltran profundamente en el miometrio. 7 FISIOPATOLOGIA Estos tumores se derivan del feto, no de la madre. Con la única excepción de la mola parcial, todas las lesiones que abarcan esta enfermedad van a ser compuestas en su totalidad o en una parte, por material genético paterno, en un proceso llamado androgénesis. El trofoblasto humano es derivado del trofectodermo, la capa más externa del blastocisto. El citotrofoblasto (la capa de células más temprana del trofectodermo), alinea el blastocisto y sirve como célula madre para las otras capas de trofoblasto en desarrollo. Inmediatamente después de la implantación, el citotrofoblasto en su función de célula madre, se diferencia en una masa sincicial (trofoblasto prevelloso). El citotrofoblasto temprano, es la capa germinativa que prolifera y se diferencia en dos vías distintas. Primero, en la superficie vellosa incipiente se fusiona en células de sincitiotrofoblasto, una línea de células diferenciadas que pierde su capacidad proliferativa pero secreta hormonas incluido el lactógeno placentario humano (hPL), la gonadotropina coriónica humana (hCG), y otras proteínas paracrinas. Estas proteínas regulan el microambiente de sitio de implantación y establecen la interface vellosa con la sangre materna, permitiendo así la transferencia feto-materna de oxígeno y dióxido de carbono, así como la nutrición y el intercambio de productos metabólicos. En segundo lugar, el trofoblasto extravelloso o citotrofoblasto, se diferencia en trofoblasto intermedio. Esta es una población de células heterogénea que puede ser subcategorizada según su localización anatómica (ya sea del sitio de implantación o del corion). En el mesénquima intravelloso, el citotrofoblasto evoluciona a trofoblasto intermedio del sitio de implantación (ISIT). Este ISIT pierde su habilidad proliferativa, pero es capaz de invadir la decidua materna y el miometrio, mediante la disección a través de las fibras de músculo liso; y por tropismo migra e invade las arterias espirales maternas. El ISIT cubre la superficie del endotelio vascular con matriz extracelular, lo que genera una incompetencia de las válvulas arteriales, que a su vez resulta en un muy bajo entorno de resistencia lo que facilita la transferencia de oxígeno y residuos entre la madre y el feto. En un embarazo normal temprano, el ISIT invade la decidua materna, pero es estrictamente controlado en tiempo y espacio, envolviendo solamente la decidua y a lo mucho el 30% interno del miometrio únicamente debajo del sitio de implantación. Más adelante, en un embarazo normal, este trofoblasto intermedio del sitio de implantación se fusiona en células multinucleadas con la consecuente pérdida de sus características migratorias e invasivas. Las distintas formas de GTD están relacionadas con errores patológicos discretos que ocurren en las diferentes etapas de diferenciación del trofoblasto. Algunas de estas lesiones son neoplasmas (CCA, PSTT, ETT), mientras que sus contrapartes benignas (embarazo molar) son mejor descritas como placentas anormales con el potencial de desarrollar lesiones placentarias malignas. 8 PRESENTACIÓN CLÍNICA PRESENTACION CLÍNICA DEL EMBARAZO MOLAR. Debido al uso rutinario del ultrasonido y medición de hCG, las pacientes con CHM generalmente se diagnostican temprano en el embarazo y son usualmente asintomáticas al momento del diagnóstico. Los síntomas que se presentan normalmente incluyen: Sangrado transvaginal, usualmente entre las semanas 6-16 de gestación (46%) Abortos de primer trimestre Un tamaño uterino grande para la fecha (24%) Hiperémesis (14%). Dolor o presión pélvica, secundario al aumento del tamaño uterino y/o a la presencia de quistes tecaluteínicos. Las complicaciones posteriores tradicionalmente reportadas en el embarazo molar son la anemia, preeclampsia, hipertiroidismo y distrés respiratorio (por afectación pulmonar), las cuales son raras actualmente, debido a que normalmente el diagnóstico se realiza en el primer trimestre. FIGURA 5. A Aumento del volumen uterino. B. Histerectomía con presencia de HCM. Las pacientes con PHM tienen menos probabilidades de ser diagnosticadas antes de la evacuación uterina y el diagnóstico es usualmente hecho con el análisis histológico de las muestras del legrado luego de un aborto incompleto. Al igual que con las molas completas, la mayoría de pacientes con molas parciales (75%) se presentan con sangrado vaginal pero más tardíamente que en el caso de las CHM. Las HCM se asocian comúnmente con niveles marcadamente elevados de hCG. Aproximadamente 50% de las pacientes con mola completa tienen niveles de hCG pre evacuación mayores a 100 000 mIU/mL. Por otro lado, esos niveles elevados de hCG ocurren en menos del 10% de las pacientes con mola parcial. PRESENTACION CLÍNICA DE LA NEOPLASIA TROFOBLASTICA GESTACIONAL La presentación clínica de NTG es variable y depende del evento gestacional que originó la enfermedad, así como en su extensión e histología diagnóstica. 9 Entre los síntomas que se pueden encontrar están: Útero agrandado Sangrado vaginal irregular después de la evacuación de un embarazo molar Persistencia de quistes tecaluteínicos en los ovarios, que son indicativos de una probable neoplasia trofoblástica. Sin embargo, más del 50% de los pacientes con NTG no tienen hallazgos clínicos, y usualmente es diagnosticada por la vigilancia de las concentraciones de la hCG sérica, que pueden persistir o ir en aumento durante el seguimiento postmolar después de la evacuación uterina y en pacientes asintomáticas. Tras la evacuación de la mola, los niveles de hCG deberían disminuir y a estos niveles se les debe de dar seguimiento para confirmar así el tratamiento exitoso. Las pacientes con NTG no molar pueden presentarse con sangrado uterino anormal por meses o años después del parto, lo que ocurre muy frecuentemente en el caso de PSTT y en ETT. En el caso del CCA que no está asociado con un embarazo molar anterior, los signos y síntomas se asocian en mayor frecuencia con metástasis distante: metástasis en cerebro que puede asociarse con cefalea, convulsiones y hemiplejía; metástasis pulmonares se asocia con disnea, tos, hemoptisis y dolor de pecho. A continuación, en la siguiente tabla se puede observar las principales características clínicas de cada una de las presentaciones clínico-patológicas de la Enfermedad Trofoblástica Gestacional. TABLA 2. CARACTERISTICAS CLÍNICAS DE LA ENFERMEDAD TRAFOBLÁSTICA GESTACIONAL Los niveles de hCG están usualmente elevados en el CCA y sólo modestamente elevados o incluso normales en los PSTT y ETT. Las metástasis de NTG ocurren por diseminación hematógena a los pulmones (80%), vagina (30%), cerebro (10%) y hígado (10%). En la metástasis vaginal los nódulos son más frecuentes en los fórnices y región suburetral. Pueden causar leucorrea purulenta y sangrado difícil de controlar, ya que estás ricamente vascularizados. La perfusión de las neoplasias trofoblásticas implica anomalías y una circulación aberrante con vasos frágiles que tienden sangrar. Por lo que no se recomiendan biopsias del sitio metastásico por el alto riesgo de sangrado. 10 DIAGNÓSTICO DIAGNÓSTICO DEL EMBARAZO MOLAR El diagnóstico de confirmación de mola hidatiforme se realiza mediante el estudio anatomopatológico o genético. Actualmente en nuestro medio, la sospecha más frecuente de enfermedad molar hidatiforme previa a la evacuación uterina viene dada por la imagen ecográfica. Un análisis en suero para hCG es una prueba diagnóstica que puede ser útil en la identificación de un embarazo molar. Sin embargo, el uso de los niveles de hCG como un indicador específico del embarazo molar es limitado ya que estos niveles en mujeres con PHM rara vez se elevan por encima de los valores normales del embarazo. FIG.6. USG PELVICO CON HCM CON PATRON VESCULAR LA ECOGRAFÍA es un estándar de atención en la evaluación del CARACTERISTICO, “TORMENTA DE NIEVE”. sangrado precoz del embarazo y un método no invasivo de diagnóstico de un embarazo molar. Al inicio de la gestación, es probable que el ultrasonido muestre una masa endometrial ecogénica tanto para embarazos molares completos como parciales. Puede observarse tejido fetal identificable con una PHM. Sin embargo, una CHM demuestra características únicas cuando el ultrasonido se realiza en el segundo trimestre. En este momento, las vellosidades hinchadas y la hiperplasia trofoblástica aparecen como un clásico "patrón de tormenta de nieve". Figura 7. A. Imagen intrauterina en “snowstorm” sin desarrollo fetal, en las molas completas. Fig B Imagen heterogénea correspondiente a la masa trofoblástica con imagen de embrión concomitante, en las molas. Las CHM precoces pueden ser sutiles en sus características morfológicas y pueden diagnosticarse erróneamente como una mola parcial o un aborto hidrópico no molar. Con una pérdida temprana del embarazo, los productos de la concepción deben enviarse a patología para una evaluación más exhaustiva, un examen histológico es crucial para determinar las características morfológicas específicas del tipo de mola. Otras exploraciones complementarias: - Analítica: Hemograma, grupo sanguíneo, coagulación, función hepatorrenal y determinación de ß-HCG. - Radiografía de tórax basal preevacuación. 11 - Función tiroidea (TSH i T4) si existe sospecha clínica de afectación de la misma (en forma de taquicardia, hipertensión, hiperreflexia, temblores, que se presentan en < 10% de los pacientes. -Gasometría y tomografía computarizada (TC) pulmonar si hay sospecha clínica de embolia trofoblástica a nivel pulmonar. La evaluación genética también puede ser necesaria para distinguir entre una mola completa o parcial, ya que la completa se diagnosticará cuando no haya un componente genético materno. TABLA 3. DIAGNÓSTICO DIFERENCIAL DE LA PHM Y LA CHM DIAGNÓSTICO DE LA NEOPLASIA TROFOBLÁSTICA GESTACIONAL En estas lesiones malignas también la concentración en suero de la hCG es el pilar diagnóstico para este tipo de neoplasias postmolares. Hay una variedad de criterios de hCG que se han utilizado para diagnosticar la GTN postmolar; los más aceptados son aquellos desarrollados por la Federación Internacional de Ginecología y Obstetricia (FIGO) los cuales se presentan a continuación en la siguiente tabla. Tabla 4. Criterios de FIGO para el diagnóstico de NTG postmolar, adaptado de Shaaban, A., et al. (2017). Gestational Trophoblastic Disease: Clinical and Imaging Features. RadioGraphics: The journal of continuing medical education in radiology , 37 (2), 681-700 12 El Centro de Enfermedades Trofoblásticas Charing Cross comenta que debe incluirse como criterio de diagnóstico de la NTG los siguientes hallazgos: Sangrado vaginal abundante Signos de hemorragia intraperitoneal o gastrointestinal Evidencia de metástasis cerebral, hepática o gastrointestinal Opacidades radiológicas > 2 cm en la radiografía de tórax. LA ECOGRAFÍA TRANSVAGINAL también es una herramienta fundamental para el diagnóstico de éstas identidades, pero las diferentes enfermedades pueden presentar imágenes similares en el estudio. El hallazgo más común es una masa miometrial, que puede ser hipo o hiperecoica, o un complejo incluso multiquístico. Pueden haber espacios intramiometriales anecoicos resultantes de una hemorragia y necrosis tisular o espacios vasculares. En la enfermedad extensa, la imagen puede revelar un gran útero heterogéneo y lobulado o una masa pélvica indiferenciada. El ultrasonido Doppler color puede demostrar vascularidad caótica intensa y pérdida discreta de la vascularidad. LA RADIOGRAFÍA DE TÓRAX es el método de imagen recomendado por la FIGO para evaluar las metástasis pulmonares. Sin embargo, más del 41% de los pacientes con metástasis pulmonares por tomografía computarizada (TC) tienen una radiografía pulmonar normal. Las micrometástasis pulmonares se evalúan mejor con la TC, pero su uso es cuestionable porque la presencia de micrometástasis no parece afectar la supervivencia a largo plazo. Otros estudios de imagen, como la resonancia magnética imagenológica (MRI) y CT, no son parte de la evaluación de rutina de las NTG y se usan solo en casos equívocos o cuando se sospecha enfermedad metastásica. LA TC es el método más adecuado para evaluar los sitios comunes de metástasis, excepto vaginal y lesiones cerebrales, que se detectan con precisión utilizando MRI. Aunque pocos estudios han investigado a fondo, la emisión de positrones CT parece ser capaz de la detección de sitios de enfermedad metabólicamente activa no encontrado en otros estudios de imagen. Además, puede ser útil para diferenciar cicatrices uterinas de fibrosis de enfermedad activa El CCA, el tipo histopatológico más común de NTG, puede presentarse con signos y síntomas inespecíficos, lo que dificulta el diagnóstico; esto con frecuencia explica una demora en el diagnóstico que a menudo afecta negativamente el pronóstico. Por lo tanto, debe considerarse una NTG y realizarse una prueba de hCG en cualquier mujer en el grupo de edad reproductiva que presente sangrado uterino anormal o enfermedad metastásica inexplicable y posteriormente realizar estudios de imagen para descartan metástasis. 13 ESTADIFICACIÓN Y PRONÓSTICO Debido a la necesidad de un lenguaje universal, criterios de tratamiento comunes y un sistema de estadificación aceptado en todo el mundo, la FIGO publicó un nuevo sistema de clasificación para NTG en 2002 (Tabla ). El sistema combinó su antiguo sistema de estadificación anatómica con un sistema de puntuación modificado con factores de riesgo definidos por la Organización Mundial de la Salud (OMS), lo que permitió un enfoque de evaluación y tratamiento recomendado de manera internacional. Table 5 Esta clasificación excluyó el tipo de sangre de la lista de factores de riesgo, se les asignó una puntuación de cuatro en lugar de tres a las metástasis hepáticas, y excluyó el grupo de neoplasia de moderado riesgo. Según este sistema, los tumores pueden ser clasificado en dos grupos: NTG de bajo riesgo, si el puntaje ≤6; y de alto riesgo, si el puntaje ≥7. La anotación de estadificación usa un número romano seguido de un número arábigo que indican estadificación anatómica de la FIGO y la puntuación modificada de la OMS respectivamente. PSTT y ETT son clasificadas por separado. Table 6 14 TRATAMIENTO TRATAMIENTO DEL EMBARAZO MOLAR El tratamiento del embrazo molar es la evacuación por succión y el legrado, los cuales deben ser idealmente realizados bajo guía de ultrasonido, es el método preferido de evacuación de un embarazo molar independientemente del tamaño uterino si se desea mantener la fertilidad, además se disminuye la posibilidad de perforación uterina. Se recomienda usar una cánula de 12-14 mm y que se inicie una infusión de oxitocina intravenosa al comienzo del legrado por succión y se continúe durante varias horas después de la operación para mejorar la contractilidad uterina. Debido al riesgo de sangrado aumenta con el tamaño uterino, la sangra para transfusión debe estar disponible cuando el útero es mayor de 16 semanas de gestación. La ig D debe administrarse a mujeres RH negativas en el momento de la evacuación molar. Si No se utilizan métodos como la maduración cervical o los agentes de inducción del parto debido a que las contracciones uterinas pueden llevar a una embolia trofoblástica. Esto puede causar dificultad respiratoria o diseminación sistémica de la enfermedad trofoblástica. Para las pacientes que han completado su procreación, una histerectomía con preservación de los anexos es otra opción de tratamiento. Comparado con la dilatación y la evacuación, este procedimiento reduce el riesgo de secuelas postmolares. Sin embargo, incluso después de una histerectomía, todavía hay un ligero riesgo para el desarrollo de NTG. Las mujeres que opten por este método de tratamiento deben someterse a un seguimiento postoperatorio cercano para descartar un GTD persistente. Si no hay sangrado persistente, una segunda evacuación por lo general no es necesario. La administración profiláctica de Metrotexate o Actinomicina D en el momento o inmediatamente después de la evacuación molar se asocia con una reducción de la incidencia de NTG posmolar de 3%- 8%. Sin embargo debe limitarse a situaciones especiales en las que el riesgo de NTG posmolar es mayor de lo normal o que el seguimiento adecuado no hCG no sea posible. TRATAMIENTO DE LA NEOPLASIA TROFOBLÁSTICA GESTACIONAL Todas las mujeres que están en riesgo de desarrollar NTG deben ser monitoreadas de cerca con la medición en serie de los niveles de hCG. Si esta patología no se diagnostica y se trata apropiadamente, hay mayor riesgo de metástasis sistémica. A medida que la enfermedad se vuelve más invasiva, existe un mayor riesgo de un mal resultado. Hace medio siglo, antes de la introducción de quimioterapia (ChT) en el manejo de NTG, las tasas de mortalidad asociadas con molas invasivas alcanzaban un 15%, debido a hemorragia, sepsis, fenómenos embólicos o complicaciones quirúrgicas. En presencia de metástasis, el CCA tenía una tasa de mortalidad del 100% y de aproximadamente el 60% cuando se realizaba la histerectomía para tratar la aparente enfermedad no metastásica. Actualmente, las tasas de curación son superiores al 90% incluso en la enfermedad metastásica generalizada. TRATAMIENTO DE LA NTG DE BAJO RIESGO Que incluye enfermedad no metastásica (Estadio I) y enfermedad metastásica con puntaje < 7. Más de 14 tipos de regímenes quimioterapéuticos (ChT)se han descrito para este tipo de neoplasia, pero no se ha alcanzado un consenso sobre la primera línea de tratamiento de preferencia. 15 Existe evidencia para recomendar el tratamiento primario con monoterapia con agentes como el Metrotexate (MTX) o la Actinomicina D (Act D) en pacientes con bajo riesgo. Este tipo de drogas tiene tasas de inducción de remisión de un 50-90%. Los tres regímenes más comunes son: 1. Semanal a dosis baja de MTX intramuscular (IM). El régimen semanal MTX 30–50 mg / m2, tiene la ventaja de bajo costo y toxicidad, pero tiene una tasa baja de respuesta completa entre todos los demás regímenes, y no es apropiado para el tratamiento de enfermedad metastásica o coriocarcinoma. 2. Dosis pulsadas de ActD cada dos semanas ActD se ha utilizado como terapia primaria en caso de insuficiencia renal, compromiso hepático, contraindicación de MTX y como terapia secundaria cuando el paciente desarrolla resistencia a MTX. Sin embargo, tiene más efectos secundarios (náuseas, alopecia) que MTX y tiene el riesgo de lesión local del tejido en caso de extravasación durante la infusión intravenosa. Los regímenes más efectivos: ActD 10–12 mg / kg IV diariamente durante cinco días cada dos semanas, o una dosis única de 1.25 mg / m2 IV cada dos semanas. 3. Varias otras dosis de regímenes de MTX con o sin ácido folínico (FA) La variabilidad de respuesta primaria resulta de diferencias en las dosis de los fármacos, el tiempo y la vía de administración, así como la selección de los pacientes, ya que depende también el deseo de la paciente de preservar la fertilidad para escoger el mejor tratamiento. Se recomienda histerectomía y quimioterapia adyuvante simple para paciente con maternidad completa. Un estudio prospectivo aleatorizado reciente realizado por el Grupo de Oncología Ginecológica encontró que ActD 1,25 mg / m 2 IV cada dos semanas fue significativamente superior a MTX 30 mg / m2 IM cada semana, con completa tasas de respuesta del 70 y 53% (p = 0.01). Sin embargo, ambos regímenes fueron menos efectivos cuando el puntaje GTN fue cinco o seis, o cuando hubo un diagnóstico histológico de coriocarcinoma. La Tabla 7 muestra las tasas de remisión primaria según al régimen de ChT. Aunque el sistema de estadificación FIGO / OMS es útil para definir el tipo de ChT que se utilizará, varios autores han sugerido que se aclaren algunos puntos, como los puntajes asignados de acuerdo con la concentración de hCG antes del tratamiento. Un estudio reciente encontró que la resistencia a la primera línea de ChT puede desarrollarse cuando el puntaje FIGO / OMS es 6 o cuando hCG es > 100,000 IU /L. En base a estos hallazgos, los autores sugirieron un cambio en el punto de corte para enfermedades de bajo riesgo de 6 a 5, o la asignación de una puntuación de 6, y no de 4, a pacientes con hCG > a 100,000 UI / L antes del tratamiento. 16 La evidencia sugiere que los pacientes con hCG > 400,000 IU/L deberían comenzar ChT con múltiples agentes debido a la resistencia significativamente mayor a solo con un agente ChT. Independientemente de qué régimen de ChT de agente único sea utilizado, la ChT debería continuar hasta que hCG vuelva a la normalidad, y al menos tres ciclos más de ChT deben ser administrado después del primer resultado normal. Se debe reemplazar todo medicamento por otro cuando se mantengan las mesetas de hCG o cuando la toxicidad impida el uso de dosis apropiadas. Se debe usar ChT multiagente cuando haya una elevación significativa de la concentración de hCG, aparición de metástasis o resistencia secuencial al agente único. TRATAMIENTO DE LA NTG DE ALTO RIESGO Pacientes con NTG de alto riesgo (Estadios de FIGO II y III, puntuación >7) deben ser tratados con quimioterapia multiagente con o sin cirugía adyuvante y radioterapia. La terapia multiagente de elección ha cambiado con el paso de los años. En las décadas de 1970 y 1980, el MTX, la ActD y ciclofosfamida o clorambucilo (MAC) fueron la primera línea de tratamiento y las tasas de curación alcanzaron 63 a 71%. En el principio de la década de 1980, los estudios encontraron que el régimen con ciclofosfamida, hidroxiurea, ActD, MTX / FA, vincristina y doxorrubicina (CHAMOCA) aumentaron la remisión primaria al 82%. Sin embargo, CHAMOCA tuvo menor tasa de remisión primaria sostenida, así como una mayor toxicidad, que el régimen MAC. En 1980, se encontró que el etopósido era un agente muy efectivo, los regímenes que usaron esta droga en combinación con dosis altas de MTX, FA, Act D, ciclofosfamida y vincristina (EMA-CO) resultaron en altas tasas de remisión y supervivencia. El régimen EMACO se convirtió en la primera opción de tratamiento para NTG de alto riesgo debido a su baja toxicidad y alta respuesta completa. Los pacientes diagnosticados con NTG de alto riesgo deben ser manejados por un oncólogo que tenga experiencia en el tratamiento de esta enfermedad. Estas mujeres requerirán una terapia agresiva con agentes quimioterapéuticos y pueden necesitar radioterapia. La tasa de supervivencia a 5 años es del 86%. La histerectomía primaria o secundaria no es efectiva en reducir la necesidad de ChT o mejorar las tasas de remisión en mujeres con NTG metastásico de alto riesgo, probablemente debido a la mayor carga de enfermedad extra uterina encontrada en estos pacientes. Las tasas de remisión primaria para el régimen EMA-CO van en un rango de 54 a 91%. Aunque EMA-CO es el régimen de uso común en el tratamiento de pacientes con NTG de alto riesgo, la evidencia actual no es concluyente, ya que no hay estudios de alta calidad en la literatura para apoyar la superioridad de este régimen en comparación con otros regímenes de ChT multiagente. La inducción de ChT con EP (etopósido 100 mg /m2 y cisplatino 20 mg / m2 ) para uno o dos cursos antes del inicio de EMA-CO para pacientes seleccionados de alto riesgo (hCG> 100,000 UI / L y FIGO / OMS> 12) parece aumentar la supervivencia general y disminuir las muertes tempranas. En la siguiente tabla se mencionan los protocolos de manejo más usados para la terapia multiagente para tratar la NTG de alto riesgo. 17 Table 8 ActD: actinomycin (Cosmegan); EMA-CO: etoposide, actinomycin D, methotrexate, cyclophosphamide, vincristine; EMA-EP: etoposide, methotrexate, actinomycin D, cisplatin; FA: folinic acid; IM: intramuscular; IVP: intravenous push; MTX: methotrexate; PO: by mouth. TRATAMIENTO DE LA PSTT Y ETT Debido a la rareza de los tumores trofoblástico del sitio placentario y de los tumores trofoblásticos epitelioides, su tratamiento se basa en los hallazgos de series de casos pequeños descritos retrospectivamente. Estos tumores son relativamente resistentes a ChT y tienden a la propagación linfática. Por lo tanto, histerectomía con o sin disección de ganglios linfáticos y salpingooforectomía bilateral juega un papel principal en el tratamiento cuando la enfermedad está confinada al útero y es curativo en dos tercios de los casos. Puede haber una respuesta al EMA-EP o al régimen de paclitaxel, cisplatino-paclitaxel, etopósido (TE-TP) protocolos indicados para pacientes con enfermedad metastásica o con factores pronósticos desfavorables. ENFERMEDAS RESISTENTE O RECURRENTE. La NTG es resistente a ChT cuando los niveles de hCG se estabilizan o aumentan, independientemente de si se desarrollan nuevas metástasis, mientras el paciente está en tratamiento. Por el contrario se realiza un diagnóstico de recurrencia cuando hay dos elevaciones de las concentraciones de hCG en ausencia de embarazo después de un resultado normal de hCG . Ambas condiciones son un desafío en el tratamiento de la NTG. Datos recientes indican que el número de consolidación ChT administrado, un diagnóstico clínico e histológico de CCA, una alta concentración de hCG pre tratamiento, diseminación de la enfermedad (cerebro, hígado y gastrointestinal) y un alto puntaje de la OMS están asociados con aumento de las tasas de enfermedad resistente. Alrededor del 5% de los pacientes con NTG de bajo riesgo sin metástasis y del 10% al 15% de los que tienen metástasis desarrollan resistencia primaria a la ChT. Para enfermedades de bajo riesgo, un régimen diferente de agente único (por ejemplo, ActD después de ChT con MTX) suele ser suficiente cuando los niveles de hCG se estabilizan. Cuando no hay respuesta a la terapia secuencial de un solo agente, la ChT multiagente debe iniciarse, y el régimen EMA-CO es el protocolo más comúnmente utilizado en estos casos. La resistencia a ChT y la enfermedad recurrente son más frecuente en pacientes con NTG de alto riesgo, Alrededor de 20 al 30% de los pacientes de alto riesgo tienen una incompleta respuesta a la primera línea ChT o recurrencia después de la remisión y eventualmente necesita salvamento con agentes alternativos, particularmente aquellos que contienen cisplatino, son necesarios después del fracaso inicial con ChT combinado. 18 Debido a los pocos casos de resistencia a ChT, la mayoría de los estudios con este tipo de pacientes son retrospectivos y basado en series de casos. Existen varios regímenes de salvamento que se usan en todo el mundo, y no está claro cuáles son más efectivos y menos tóxicos, pero el régimen EPEMA es preferido y recomendado por el FIGO. La tasa de BOX1 SALVAGE THERAPIES. respuesta completa a este régimen es mayor entre los pacientes que desarrollan resistencia (81.8%) que en aquellos con recurrencia de la enfermedad (42,9%), y los efectos secundarios más comunes son mielosupresión, náuseas, vómitos y hepatotoxicidad. Con resultados divergentes, Powles y col. encontraron una supervivencia general a 5 años del 93% para pacientes con enfermedad recurrente y 43% para aquellos con enfermedad quimiorresistente. Además de la ChT, los procedimientos asociados, tales como histerectomía, resección quirúrgica de sitios de enfermedad resistente, radioterapia y quimio embolización son técnicas de tratamiento para estos pacientes. SEGUIMIENTO Una vez que se sospecha o se establece el diagnóstico de NTG, se debe realizar un estudio para determinar el alcance de la enfermedad. La selección del tratamiento apropiado se basa tanto en el Sistema de Estadificación Anatómica adoptado por FIGO como en el Sistema de Puntuación Pronóstico adoptado por la Organización Mundial de la Salud (WHO). El seguimiento adecuado debe incluir: • Historia clínica, examen físico, nivel basal de hCG cuantitativo en suero (pretratamiento), hemograma completo, pruebas de función hepática y renal. • Revisión de todas las muestras patológicas disponibles. • Ecografía pélvica para detectar el alcance y la naturaleza de la afectación uterina, para ayudar a identificar pacientes que se beneficiarían de una histerectomía. • Radiografía de tórax para determinar la presencia de metástasis pulmonares. Si la radiografía de tórax es negativa, se puede obtener una tomografía computarizada (TC) del tórax ya que aproximadamente el 40% de los pacientes con radiografías de tórax negativas tienen lesiones metastásicas en la TC. Existe controversia en cuanto a la importancia de estas micrometástasis con respecto a la respuesta del paciente a la quimioterapia. En ausencia de metástasis torácicas, es posible que no se necesiten imágenes de otros órganos. • Resonancia magnética (MRI) del cerebro y TC abdomino-pélvica, para identificar lesiones en cerebro, hígado y otros órganos abdominales. Si la radiografía o TC de tórax indican la presencia de metástasis pulmonares. • Repetir el legrado después de la evacuación molar no está indicado a menos que exista un sangrado uterino excesivo asociado con tejido molar retenido. Existe controversia sobre si la dilatación repetitiva y el legrado reducen la incidencia de NTG. La proporción de hCG cerebroespinal/plasma a veces se usa para confirmar compromiso cerebral. • Imágenes adicionales como la tomografía por emisión de positrones con 18F-fluorodesoxiglucosa (FDG-PET) puede ser útil para identificar con precisión sitios de enfermedad metabólicamente activa o metástasis viables y para ayudar a determinar el potencial de resecabilidad del tumor. 19 BIBLIOGRAFÍAS UPDATE ON THE DIAGNOSIS AND MANAGEMENT OF GESTATIONAL TROPHOBLASTIC DISEASE. HEXTAN Y.S. NGAN ET AL. INTERNATIONAL JOURNAL OF GYNECOLOGY & OBSTETRICS PUBLISHED BY JOHN WILEY & SONS LTD ON BEHALF OF INTERNATIONAL FEDERATION OF GYNECOLOGY AND OBSTETRICS. 2018; 143 (SUPPL. 2): 79–85 ENFERMEDAD TROFOBLASTICA GESTACIONAL. DURÓN GONZÁLEZ RODRIGO Y BOLAÑOS MORERA PAMELA. VOL. 35 (1) MARZO 2018. ISSN 1409-0015. MEDICINA LEGAL DE COSTA RICA EDICIÓN VIRTUAL. SEOM CLINICAL GUIDELINES IN GESTATIONAL TROPHOBLASTIC DISEASE (2017). A. SANTABALLA ET AL. CLINICAL GUIDES IN ONCOLOGY. CLIN TRANSL ONCOL (2018) 20:38–46. PROTOCOLO: MANEJO DE LA MOLA HIDATIFORME. R. PASCAL, E. MIRÓ, M. MUÑOZ, M. PALACIO, MD GÓMEZ ROIG . 2018. HOSPITAL CLÍNIC | HOSPITAL SANT JOAN DE DÉU | UNIVERSITAT DE BARCELONA. PROTOCOLS MEDICINA MATERNOFETAL HOSPITAL CLÍNIC- HOSPITAL SANT JOAN DE DÉU- UNIVERSITAT DE BARCELONA. WWW.MEDICINAFETALBARCELONA.ORG GESTATIONAL TROPHOBLASTIC DISEASE JP DEEP 1, LB SEDHAI 1 , J NAPIT 1 AND J PARIYAR 2. JOURNAL OF CHITWAN MEDICAL COLLEGE 2013; 3(4): 4-11 AVAILABLE ONLINE AT: WWW.JCMC.CMC.EDU.NP DIAGNOSIS, CLASSIFICATION AND TREATMENT OF GESTATIONAL TROPHOBLASTIC NEOPLASIA. ANDRESSA BISCARO. ET AL. REV BRAS GINECOL OBSTET. 2015; 37(1):42-51. . GESTATIONAL TROPHOBLASTIC NEOPLASIA. VERSIO NCCN CLINICAL PRACTICE GUIDELINES IN ONCOLOGY. 2019. DIAGNOSTICO Y TRATAMIENTO DE ENFERMEDAD TROFOBLASTICA GESTACIONAL. GUÍA DE PRACTICA CLINICA.2009 ENFERMEDAD TROFOBLÁSTICA GESTACIONAL . KHANNA JIMÉNEZ PRIYANKA. REVISTA MEDICA DE COSTA RICA Y CENTROAMERICA LXXIII (618) 173-178, 2016. 20