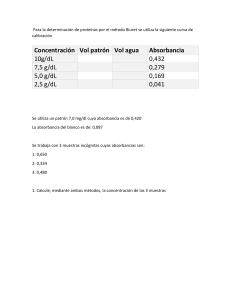
METODOLOGÍA Por medio de conceptos, datos y resultados adjuntos de laboratorios anteriores de espectrofotometría interpuestos por el docente son analizadas y comparadas las absorciones de tres colorantes diferentes como lo son el rojo Congo, azul de metileno y verde malaquita en concentraciones a partir de una solución de 0,1 M donde a partir de estas muestras se deriva una serie de diluciones (5) 1/10 con etanol, las cuales son utilizadas para el análisis de las curvas de calibración de cada colorante al emplear la ecuación de regresión lineal donde se interponen los cálculos de forma en que la recta de ajuste tendrá por ecuación y = a x + b, donde los coeficientes a y b se calculan teniendo en cuenta que la recta debe pasar por “x” punto y la separación de los puntos de la gráfica de dispersión con respecto a la recta de regresión debe ser mínima (Hiru, 2021). Teniendo en cuenta que este proceso nos alberga un proceso más rápido y mejor en la lectura de la gráfica. Así mismo, la ley de Lambert-Beer resume esta relación con la ecuación: A = ε b c , donde c es la concentración de la disolución y se expresa en mol/L, b es la longitud del camino óptico (anchura de la célula que contiene la disolución de la sustancia) y se expresa en cm, y ε es la absortividad molar o coeficiente de extinción molar; propiedad característica de cada sustancia que por ser correspondiente a la cantidad de radiación que absorbe a una longitud de onda determinada por unidad de concentración, siendo sus unidades L/mol *. Donde puntualmente se describe que el colorante Rojo Congo tiene un ɛ equivalente a 45 000 L/ (mol*cm) (Merck, 2011). El colorante Azul de metileno tiene un ɛ equivalente a 65 000 L/ (mol*cm) (D´ Alessio et al., 1980). El colorante Verde malaquita tiene un ɛ equivalente a 29 300 L/ (mol*cm) (Castillo, 2010). Sin embargo, al desarrollar la concentración de las soluciones problemas y comparar la solución Stock para los resultados de ambos modelos matemáticos se hace la inferencia de cual de las dos ecuaciones interviene mejor en el resultado de los datos. Resultados Los resultados que se presentaran a continuación contienen datos aportados por el docente que se obtuvieron de laboratorios anteriores. 1. Determinación espectros de absorción Tabla 1: absorbancia de la concentración stock de los colorantes Los datos de concentración de solución Stock de los colorantes fueron dados por el docente. Concentración Stock Colorante Absorbancia Rojo Congo 0,93 Azul de metileno 0,95 Verde malaquita 0,025 A partir de estas concentraciones se calculó el pico máximo de absorción de los colorantes a través de longitudes de onda arrojando la siguiente gráfica. A B C Gráfica 1: Picos de absorción de cada uno de los colorantes. A. Rojo Congo. B. Verde malaquita. C.Azul de metileno. Para el rojo Congo el pico máximo de absorbancia es de +/- 500 nm, en el caso del Verde malaquita el pico máximo de absorción de la solución es de 530nm y para el Azul de metileno 680nm. A partir de las absorbancias de cada disolución se obtuvieron las siguientes tablas (2, 3 y 4). Donde se relaciona la concentración de cada disolución con el valor de la absorbancia obtenido por espectrofotometría. Los valores de concentración son obtenidos por medio de cálculos matemáticos encontrados en la sección de anexos. Tabla 2: absorbancias disoluciones del colorante rojo Congo El valor de absorbancia 0,93 es el correspondiente a la solución Stock Tabla 1, este dato fue incluido para elevar el valor del R2, y se omitió el dado por el docente en el apartado de los datos de las absorbancias de la disoluciones (0,78) con el fin de obtener un valor de correlación de las variables más cercano a uno (gráfica 2). Rojo Congo Concentración Absorbancia 0,1 0,93 0,01 0,755 0,001 0,628 0,0001 0,593 0,00001 0,589 0,000001 0,578 Tabla 3: Absorbancias disoluciones del colorante Azul metileno. Al igual que el valor de absorbancia de stock del rongo Congo se empleo la aportada en la Tabla 1 que corresponde a 0,95. Azul metileno Concentración Absorbancia 0,1 0,95 0,01 0,586 0,001 0,485 0,0001 0,446 0,00001 0,443 0,000001 0,44 Tabla 4: absorbancias disoluciones del colorante Verde malaquita. Los valores de absorbancia corresponden a los proporcionados por el docente no se modifico la de la solución stock ya que el valor coincidía con el de la Tabla 1. Verde malaquita Concentración Absorbancia 0,1 0,025 0,01 0,012 0,001 0,003 0,0001 0,003 0,00001 0,002 0,000001 0,001 Luego se procedió a graficar por medio de una curva de calibración la concentración vs la absorbancia de las disoluciones de cada colorante absorbancia Rojo congo + etanol 1 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 y = 3,2098x + 0,6194 R² = 0,8537 0 0,02 0,04 0,06 0,08 0,1 0,12 mg/ml rojo congo Grafica 2: Curva calibración disoluciones de rojo Congo, relacionando las concentraciones de las seis disoluciones con el valor de las absorbancias arrojadas por el espectrofotómetro. De donde se obtiene la ecuación de la recta arrojando el valor de R2 (coeficiente de correlación) que indica la relación entre las dos variables analizadas, en este caso arroja un valor de 0,8537 indicando que estas variables están poco relacionadas entre si ya que el valor está muy por debajo de 1, además la grafica indica que hay un valor (abs= 0,755 y C= 0,01) que esta por fuera de la recta, este valor puede asociarse a un dato atípico y a un error en la medición. Azul de metileno+ etanol 1,2 y = 4,8931x + 0,4677 R² = 0,9655 Absorbancia 1 0,8 0,6 0,4 0,2 0 0 0,02 0,04 0,06 0,08 0,1 0,12 mg/ml Azul de metileno Grafica 3: Curva calibración disoluciones de Azul metileno, relacionando las concentraciones de las seis disoluciones con el valor de las absorbancias arrojadas por el espectrofotómetro. La ecuación de la recta en la grafica 3 indica que la relación entre las variables es de 0,9655 R2 este número esta muy cerca de 1 indicando una relación muy positiva entre las dos variables analizadas. Verde malaquita+ etanol 0,03 y = 0,2202x + 0,0036 R² = 0,888 Absorbancia 0,025 0,02 0,015 0,01 0,005 0 0 0,02 0,04 0,06 0,08 0,1 0,12 mg/ml verde malaquita Grafica 4: Curva calibración disoluciones de Verde malaquita, relacionando las concentraciones de las seis disoluciones con el valor de las absorbancias arrojadas por el espectrofotómetro. El coeficiente de correlación arroja un valor de 0,888 este valor no esta muy lejos de 1, pero hay un valor aislado de la recta (abs=0,012 y C=0,01) que da este margen de error en el R2. A partir de la ecuación dada por cada gráfica de curva de calibración se halló el valor de la concentración de tres soluciones problemas de los colorantes utilizados, teniendo en cuenta el valor de absorbancia de cada colorante (tabla 5). Tabla 5: absorbancia soluciones problema Datos de absorbancia proporcionados por el docente. Soluciones problema Colorantes Absorbancia Rojo Congo 0,512 Azul de Metileno 0,75 Verde Malaquita 0,358 La siguiente tabla relaciona las concentraciones obtenidas mediante la ecuación de regresión lineal y la obtenido por medio de la ecuación Lambert-Beer (anexos). Tabla 6: Relación de las concentraciones obtenidas a partir de dos modelos matemáticos de tres diferentes colorantes (rojo Congo, azul metileno y verde malaquita). concentraciones soluciones problemas Colorantes Y=mX+b A=εbc Rojo Congo -0,0334 0,0113 Azul metileno 0,0576 0,0115 Verde malaquita 1,6094 0,0122 Esta tabla permite relacionar los valores de concentración obtenidos por los dos modelos matemáticos, en donde los datos arrojados por la ecuación de regresión lineal presentan variaciones que van desde valores negativos C rojo Congo (-0,0334 mg/ml) a valores por arriba de 1 como la concentración verde malaquita 1,6094mg/ml, mientras que los valores obtenidos por la ecuación Lambert-Beer da resultados mas parejos entre si en las concentraciones de los tres colorantes, rojo congo (0.0113 mol/L), Azul metileno (0,0115mol/L) y Verde malaquita (0,0122 mol/L). ANÁLISIS DE RESULTADOS La espectrometría como sabemos es uno de los principales métodos analíticos que permite conocer las concentraciones de una solución. Este método se caracteriza principalmente por la precisión, sensibilidad y su amplio uso en cualquier aspecto científico.(Ultravioleta & Cercano, 2015) Como se puede evidenciar en los resultados a mayor concentración hay una mayor absorbancia haciendo evidente de que cada concentración y cada reactivo tenga una longitud de onda diferente, tal como se muestra en las tablas N° 2, 3 y 4 donde con la disminución de la concentración se evidencia una disminución en la en la absorbancia siendo estas dos directamente proporcionales, además otro aspecto y en contraste de las concentraciones son las medidas de absorbancia que tienen cada sustancias tal como se evidencia con el Verde malaquita, Azul metileno y Rojo Congo donde se muestra que en la concentración más alta la cual fue de 0,1M, la sustancia con mayor absorbancia fue el azul de metileno con un valor de 0,95 y con esa misma concentración la sustancia con menor absorbancia era verde malaquita con 0,25, dándonos así a entender que el azul de metileno posee una mayor cantidad de partículas que el verde malaquita en 0,1M. En cuanto a la solución del ejercicio planteado de hallar las concentraciones con estas podemos determinar que la de mejor ecuación para determinar cuál es la concentración es la de Lambert – Beer debido a que esta se determina gracias a su constante para cada uno de los reactivos siendo así que no se hagan evidentes ningún tipo de error sistemático.(Díaz et al., 2010) Mientras que dentro de la ecuación lineal se puede identificar ciertos errores sistemáticos cometidos a que durante la obtención de los datos pueden a ver alteraciones de cálculo y entre otros que pueden alterar el resultado de cada medida. (Amador, 2010). CONCLUSION Con las diferentes pruebas realizadas se estableció el espectro de absorción de cada uno de los reactivos, además de realizar la curva de calibración para que con esta se pueda determinar las concentraciones de cada reactivo. mientras que por otro lado determinamos que la ecuación de Lambert - Beer tenía una mayor efectividad en el momento de determinar las concentraciones de cada uno de los reactivos debido a que con esta no se tienen en cuenta errores sistemáticos además de que depende de una constante para cada reactivo. ANEXOS Preparación de las cinco disoluciones en serie a partir de las concentraciones stock de los tres colorantes. Soluciones stock (Rojo Congo, Azul de metileno y Verde malaquita) C= 0,1 M V= 5ml Disoluciones 1/10 (se realizó el mismo procedimiento para los tres colorantes con los mismos valores) C1=0,1M/10= 0,01M + 0,5 ml Sln stock + 4,5 ml etanol C2=0,01M/10= 0,001M + 0,5 ml Sln C1 + 4,5 ml etanol C3=0,001M/10= 0,0001M + 0,5 ml Sln C2 + 4,5 ml etanol C4=0,0001M/10= 0,00001M + 0,5 ml Sln C3 + 4,5 ml etanol C5=0,00001M/10= 0,000001M+ 0,5 ml Sln C4 + 4,5 ml etanol Para hallar la concentración de las soluciones problemas de los tres colorantes se emplearon dos modelos matemáticos la ecuación de regresión lineal y la ecuación de Lamber-Beer. Teniendo en cuenta que la ecuación de regresión lineal indica: Y=mx+b Donde se despeja x (concentración) teniendo así: X=Y-b/m Posteriormente se reemplazan los valores obtenidos en cada curva de calibración para los tres colorantes. Ecuación Rojo Congo (Gráfica 2) X= (0,512-0,6194) /3,2098 X= -0,0334 Ecuación Azul metileno (Gráfica 3) = (0,75-0,4671) /4,8931 X= 0,0576 Ecuación verde malaquita (Gráfica 4) = (0,358-0,0036) /0,2202 X= 1,6094 Por último, se emplea la ecuación de Lambert- Beer para comparar los valores de concentración obtenidos por medio de la ecuación de regresión lineal. A = ε b c = ecuación Lambert-Beer El valor de ε es dado de manera teórica, es relacionado al coeficiente de absorción molar de cada colorante empleado. Se despeja C (concentración) C=A/ε*L Rojo congo C=0,512/45,000 L (mol*cm) *1 cm C= 0,0113mol/L Azul metileno C=0,75/65,000L(mol*cm) *1cm C= 0,0115mol/L C=0,358/29,300L (mol*cm) *L C= 0,0122mol/L La relación de los valores de concentración de los dos modelos matemáticos se encuentra en la tabla 6. BIBLIOGRAFÍA Amador, J. (2010). Espectrometría óptica atómica. Temas de Ciencia y Tecnología, 14, 3–10. Castillo, L. (2010). Remoción del colorante trifenilmetánico verde básico 4 por cultivos mixtos microbianos usando agave tequilero (Agave tequilana weber) como bioportadorr. Instituto Politecnico Nacional. Díaz, N. A., Ruiz, J. A. B., Reyes, E. F., Cejudo, A. G., Novo, J. J., Peinado, J. P., Meléndezvaldés, F. T., & Fiñana, I. T. (2010). Espectrofometría: Espectros de absorción y cuantificación colorimétrica de biomoléculas. 1–8. D´ Alessio, A. , Guido, O. , & Bandín, N. (1980). Determinación Espectrofotométrica de Microcantidades de Boro en Agua (Informe CNEA 457). Merck, Kg. (2011). Rojo Congo (C.I. 22120) CAS 573-58-0 | 101340. Darmstadt, Germany,. https://www.merckmillipore.com/CO/es/product/Congo-red-C.I.-22120,MDA_CHEM-101340 Recta de regresión y correlaciones - hiru. (s/f). Hiru.eus. Recuperado 2021, de https://www.hiru.eus/es/matematicas/recta-de-regresion-y-correlaciones Ultravioleta, M., & Cercano, I. (2015). Introducción a la Espectroscopía de Absorción Molecular Ultravioleta, Visible e Infrarrojo Cercano. 1–10.