Ejercicios_espectrofotometria_2012 - U
Anuncio

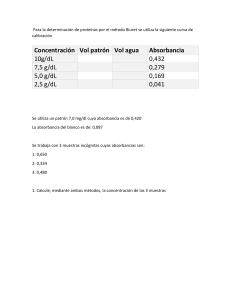
Ejercicios , Espectrofotometria 2012 1) El % de transmitancia de una solución medida a cierta longitud de onda en una celda de 1,00 cm es de 63,5% . Calcule el % de transmitancia de esta solución en celdas de trayectoria optica de A) 2,0 mm ; b) 2 ,0 cm y c) 5,00 cm . R: a) 91,3 %T ; b) 40,4 %T ; c) 10,3 %T 2) El compuesto orgánico 3-ciano-5- metilpirrolina ( C7H6N2 , PM :118,14) Presenta una banda de absorción UV en 272 nm en solucion de etanol. Una solucion que contiene 0,274 mg de este compuesto en 10 ml de etanol dio una absorbancia de 0,700 en una celda de 1,00 cm. Calcule: a) la absorbilidad , b) la absorbilidad molar del compuesto R: a) a = 25,6 L/g cm b) ε = 3018,5 L/mol cm 3) A partir de una solución patrón de 100 ppm ( 100 mg/L) de un compuesto orgánico que presenta una banda de absorción máxima a 270 nm se preparó una curva de calibracion : se obtuvieron los siguientes datos : Conc , ppm 1 1,5 2 3 4 A 0,1282 0,1940 0,2615 0,3995 0,5422 Si 2 ml de una solución desconocida de este compuesto son diluidos a 50 ml se obtiene una absorbancia de 0,425. Calcule la concentración de la muestra en mg/l. R: 79 ppm 4) Un método para la determinación cuantitativa de Pb++ en la sangre proporciona una Absorbancia de 0,712 en una muestra de 5,00 ml de sangre . Tras añadir a la muestra de sangre 5,0µL de un patron de Pb++ con 1,560 ppb se determina una absorbancia de 1,546 . Indique la concentración de Pb++ en la muestra de sangre original R: 1,343 ·10-3 ppb 5) Para determinar el contenido de Fe+3 en una muestra de agua natural se utilizó el método de las adiciones múltiples de estándar. Con una pipeta se transfirieron alícuotas de 10 ml de una muestra a matraces volumétricos de 50,0 ml . A cada matraz se le añadió un volumen de una solución estándar de Fe +3 de 11, 1 mg/l , según la tabla adjunta , y seguido por un exceso del ion tiocianato para formar el complejo Fe(SCN)+2. Después de diluir hasta la marca de aforo se midieron las absorbancias de las cinco soluciones en una celda de 1 cm a 480 nm: Las lecturas respectivas estan en la tabla . ¿Cual es la concentración de Fe+3 en la muestra de agua ? ml std. A 0 0.240 5 0.437 10 0.621 15 0.809 20 1.009 R: 7,0 mg/L 6) Los datos para los complejos de cobalto y niquel con 2,3 ditiol quinoxalina a los respectivos maximos de absorbancia son los siguientes. 510 nm 36400 5520 656 nm 1240 17500 ε Co ε Ni Una muestra de suelo de 0,425 g se disuelve y se diluye a 50,0 ml.Una alicuota de 25 ml es tratada para eliminar interferencias se ñade 2,3 ditiol quinoxalina y de afora a 50,0 ml : esta disolución a 510 nm tiene una absorbancia de 0,446 y a 656 nm una absorbancia de 0,326, ambas en una cubeta de 1,0 cm. Calcule las concentraciones de Co y Ni y los porcentajes de Co y Ni que hay en el suelo. R: [Ni] = 1,79· 10-5 M [Co] = 9,5· 10-6 M