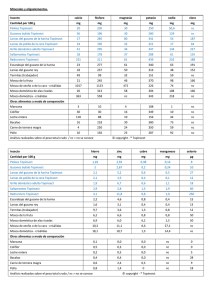
► ► ► TAMAÑO 2.5 cm Ciclo Biológico Daños en las plantas tiernas: • Se inicia generalmente a los 3 meses de edad de las plantas; las larvas emergen de las masas de huevos colocados en las hojas y penetran en el interior de los brotes tiernos cerca de la base. CorCao rzaóz ónn mmuue ret orto EN TALLOS TIERNOS DE CAÑA DE AZUCAR. • • Comen gran parte del tejido hasta destruir el punto de crecimiento, produciendo la muerte de la planta y dando lugar al conocido “corazón muerto”; esta mortalidad es generalmente de los tallos primarios, daño importante a pesar de que la planta puede compensar con el macollamiento; causando de todas maneras el retrasode la planta. Al iniciarse la temperatura en ocasión de la primavera, se comienza la siembra de caña y con ello el aumento de las poblaciones de la red, acentuándose los brotes dañados, especialmenteen el período Enero-Abril. DAÑOS EN PLANTAS DESARROLLADAS • Al formarse los tallos y sus entrenudos es frecuente observar los orificios circulares que aparecen en la corteza. Al daño primario le siguen otros como el ataque de hongos, frecuentemente Fusarium momiliforme que en definitiva son los responsables del deterioro de los tejidos de los entrenudos barrenados, al que denominamos “podredumbrecolorada”. ORIFICIO ENTRADA ORIFICIO SALIDA EL DAÑO SECUNDARIO DA 0RIGEN A LA EMFERMEDAD PODREDUMBRE COLORADA PRODUCIDA POR EL HONGO COLLETOTRICHUM FALCATUM CAÑA DE AZUCAR DAÑOS PRIMARIO DEL BARRENO HACIENDO GALERIAS EN EL TALLO. • La severidad del daño trae consigo una disminución del 1% de sacarosa rdeecxutrin ep raasb,lgeo,mbaasj,aetlca. dpifuicu er zltaanddeo llaosclajruigfiocasciyónaduemlo enstjaugolass imfápu en briecazass.: • • • Estudios realizados en ICIA entre los años 1972-1977 en el cultivar H328560, determinó una pérdida de azúcar de 0.025 Kg./TM de caña por cada 1% de entrenudos barrenados. También existen daños por la tumbada de tallos, lo que origina la aparición de “mamones” así como la destrucción de yemas que afecta la germinación normal de futuras plantaciones. Debe anotarse que los daños del barreno al interior de los entrenudos facilita y promueve la aparición del gorgojo rallado de la caña de azúcar “Metamasius hemipterus”. • Los factores que tienen marcada incidencia en los grados de infestación del barreno son: Nº de corte, edad, variedad, condiciones climática; siendo las cañas plantas más afectadas que las socas y conforme se aumenta el número de corte en la soca el porcentaje de intensidad disminuye. Control biológico: • • Esta técnica se inicia en el Perú en 1951 a base de parásitos Dípteros, bajo la dirección del cubano Scaramuza quien organizó el programa bajo la participación directa del edn ólo o etloam“ m og scoapceurbuaannao” SLaixúol pRhisacgoa; dpiraim traeero a,cluegn loa d inetrlaod“umco cisócna amazónica” Metagonistylum minensis. Los dos parásitos introducidos no se adaptaron a las condiciones del clima de los valles de la costa peruana y a su sourgpaenrvizivra enlacialuchya atbuararle, biporloógricaamcaoció ntnra en l eceidiaénd nodm teosel parásito nativo Paratheresia claripalpis Wulp, lográndose incrementar en el campo significativas poblaciones naturales REPRODUCCION = VIVIPARA = LARVAS . • • Este control prevalece hasta nuestros días reforzándose con la actividad parasitaria de la avispita Trichogramma exigum” La mosca Paratheresia realiza su parasitismo depositando sus larvas en las perforaciones de los tallos de la caña, estas penetran en las galerías y buscan a las larva del barreno, una vez ubicada la perfora entre los segmentos abdominales de la región ventral; al llegar al 3er estadío la larva del parásito abandona su huésped dejando solamente el tegumento vacío y pasados 1 a 2 días en pupa en la misma galería., • En algunos casos el parasitismo persiste hasta después del empupamiento del barreno, siendo frecuente observarse también 2 a 3 parásitos en una sola larva. • • • Las moscas hembras fertilizadas son disectadas bajo un estéreo microscopio, colocando a las hembras en una solución salina con “suero fisiológico” al 0.5%. El útero extraído cuidadosamente se rasga para dar salida a los maggots contenidos en su interior, luego con un pincel número 0 se procede a colocar sobre las larvas de barreno, convenientemente preparadas 1 o 2 larvas de la mosca. Las larvas parasitadas (inoculadas) se confinan individualmente en cajitas de aluminio en las que se añade una rodajita de tallo de maíz que le sirve de alimento. • La revisión del material parasitado se hace periódicamente hasta la obtención del pupario de la mosca, lo que suele ocurrir entre el 7mo u 8vo día de efectuada la parasitasión. • Los pupários así obtenidos deben ser cuidadosamente mantenidos en cajas especiales, siendo necesario una adecuada humedad y ventilación hasta que los pupários se coloquen en las cajas de emergencia, para el nacimiento de los adultos. • Cuando las moscas comienzan a emerger se hace la diferenciación de sexo y se les coloca en jaulas de cría o de liberación; a las moscas destinadas al caam repspoescq tiuveaspjareuvlaiasm haesnttaeehl laungasrideon sdeolned ealedovsa, libpeorasre ylesqlulevasoansucsam cceiosn coincidiendo con las áreas de mayor infestación del Diatraea. MOSCA NATIVA poniendo cresas sobre las hojas CRESA o MAGGOTS DE LA MOSCA NATIVA Cresa de mosca nativa en proceso de parasitacion de larvas LARVA PARASITADA LARVA DEL BARRENO • • Resulta evidente que este programa de laboratorio requiere de habilidad manual, que cuente con conocimientos básicos y realice las operaciones cuidadosamente del personal encargado debe ser bien seleccionado. Las larvas del barreno también tienen otros parásitos que según su importancia son: - Iphianlax rimac - Iphianlax abancay Hymenoptera: Braconidae Hymenoptera: Braconidae - Agathis stiymatenes Hymenoptera: Braconidae Liberación de parásitos • En el caso de la avispita Trichogramma exigum se utiliza 50 pulg2/Ha y se utiliza el mismo criterio, últimamente se están realizando trabajos para revisar otras opciones de liberación en cuanto a la dosis. • Generalmente se liberan 30 pares de moscas/hectárea, priorizando las cañas plantas y en las áreas donde existan mayores daños por la presencia de plantas hospederas o de susceptibilidad varietal, lo que debe ocurrir entre los 3-4 meses y de ser posible entre el 6º y 9º mes. • • • Esta técnica presupone obtener preferentemente larvas de Diatraea en suficiente cantidad, generalmente los estadíos 4-5 y 6 los que provienen de los corazones muertos. Como lo anterior no garantiza una cantidad adecuada y se tienen larvas en condiciones de ser inoculadas por las variaciones poblacionales propias al desarrollo del Diatraea(clima, variedady edad). Para la obtención de mariposas, las que se consiguen a partir de las “crisálidas”, las que se obtienen de la propia crianza masiva de larvas en el laboratorio. • Las crisálidas debidamente seleccionadas y limpias se acondicionan en una cama húmeda de bagacillo dentro de las cajas de oviposición hasta esperar la emergenciade adultos. • Para la obtención de los huevos, se recogen éstos de las cajas de oviposición, las mariposas hembras fecundadas depositan sus masas de huevo en la superficie del papel que recubre internamente la caja. • • • Se acumula este material en uno o más cajas de petri hasta que las larvitas inician su eclosión en 6 o 7 días. Para sembrar las larvitas en la dieta, se utilizan unos tubos de vidrio en cantidad suficiente, lo que debe hacerse con mucha asepsia para evitar la contaminación fungosa o bacteriana. El proceso de siembra se hace dentro de una cámara que ha sido previamente esterilizada con luz ultravioleta, estos tubos que reciben las larvitas se flamean y se cierran con un tapón de algodón también esterilizado. • • Los tubos contienen aproximadamente 25 cm2 de dieta, donde se siembran 25 larvas del estadío 1, acondicionándola en gavetas para su control y en espera de su desarrollo. Al cabo de aprox de 25 a 27 días de efectuada la siembra se procede a extraer las larvas de los tubos durante este tiempo ha sido consumida y no se ha presentado competencia ni por espacio ni por alimento. para la crianza de larvas de ADULTO TAMAÑO = 0.8 mm. • • • • Los huevecillos frescos se pesan, luego se pegan con goma liquida, diluida a razon de 1:1, en cartulinas de color blanco o negro de preferencia, cuadriculadas en pulgadas cuadradas. Las cartulinas conteniendo huevecillos frescos se introducen en frascos plasticos de 5 litros de capacidad, en donde son parasitados por la microavispa en la relacion de 1:5 pulgadas cuadradas; es decir 1 pulgada cuadrada de microavispas para 5 pulgadas cuadradas de huevecillos frescos. aDveislpoistahs uaepvaerctiilrlodse ploasra8sditiads.os dentro del frasco, emergen las De esta produccion la quinta parte; es decir un 20% se destina para la recria y el resto para la liberacion. • EVALUACIÓN ÍNDICE POBLACIONAL Índice de Población • Total estados vivos de la plaga x 100 Total de tallos PORCENTAJE DE INFESTACIÓN Porcentaje de Infestación Número de tallos dañados x Total de tallos de la muestra 100 PORCENTAJE INTENSIDAD DE INFESTACIÓN Porcentaje de Intensidad de Infestación Número de entrenudos barrenados Total de entrenudos muestreados x 100 PORCENTAJE DE LONGITUD DEL DAÑO Porcentaje de longitud de daño Longitud dañada x100 Total longitud muestra Muy baja Baja Moderada Mediana - 0 – 5% 6 – 10% 11 – 15% 16 – 20% A Mltuay Alta - – 30% 21 31 a más CONTROL CULTURAL : Sembrar semilla o estacas sanas, seleccionando campos como semilleros que tengan bajas infestaciones, a fin de evitar fallas en el brotamiento y no incurrir en costosos resiembros, pudiendo también afectar el brotamiento, macollamiento y retraso en el cultivo. El empleo de variedades tolerantes impone menos daños que en otros, así se considera en • • • elepnaoírs hlastHa3l7a-1fe9c3h3a, dHe3l 2i-n8fo m 5r6m 0,e PdeCGm 12ya2 7o4r5a, H50-7209 Y H52-4610. Eliminación de plantas hospederas silvestres y también en lo posible evitar la presencia de o aso epl amnataí zs yheol spoerdgeor.as en campos cercanos cotrm • Referido a la extracción y recojo de “corazones muertos”, producidos por el ataque del barreno en plantas tiernas, sobre todo en las épocas d caelim ficaaydoor. gradación de la plaga; esta labor debe realizarlo personal • Esta labor evita la reinfestación del campo en las generaciones subsiguientes, al eliminar pupas y larvas no parasitadas. • veoescadeParlartvhaesreasila,l absíorcaotm oroiolapraercauppeerarm pPropo argcaio cinóan doe p laroM ciiótinr dlea esta mosca de los puparios recogidos y de las larvas y crisálidas del barreno parasitado. • Abastecer de crisálidas para la obtención de mariposas destinadas p troasvaéss lidberelsasmadciehtoass aratriaficliaalecrsí,aasmí acsoiva mo dreallaizravrascadpetlurbaasrrdeeno m aarip con hembras vírgenes en trampas pegajosas en áreas experimentales. • • Disminuir las poblaciones de los hiperparásitos al extraer del campo los pulparios parasitados de la mosca. Evaluar la población del barreno y de su parásito (porcentaje general de parasitismo). No es recomendable realizar el recojo “ caoyroarzo d ese m denle5s0m%u. ert es” cuando el porcentaje de parasitismo • Feromona sexual secretada por las mariposas hembras vírgenes de Diatraea "borer" ejerce fuerte poder atrayente a los machos de la misma saccharalis • • • • • ecpiea.s hechas de envases plásticos descartables de gaseosa de 3.0 lt., con Tersapm dos aberturas rectangulares de 8 x 10 cm, en cuyo fondo contiene una mezcla de detergente y agua como medio de captura; en el interior de las trampas se suspendeuna hembravirgen confinadaen una pequeña jaula. Una sola hembra virgen, puede atraer en promedio 94 machos a la trampa, por noche de fuerte actividad de vuelo. Poder de atracción de las hembras vírgenes, es en promedio de 89 horas, siendo mas atractivo durante las primeras24 horas. Las trampas son colocadas cada 50 m. entre ellas. El resultado esta relacionadoa la capacidadde vuelo y el númerode mariposas. Tendencia de vuelo de los machos es contra el viento Importante en la atracción).