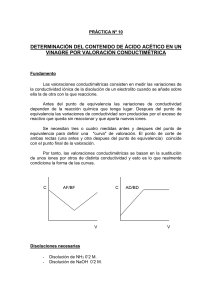
MEDIDA DE LA ACIDEZ DEL VINAGRE OBJETIVO Determinar el contenido en ácido acético de un vinagre comercial utilizando la técnica analítica de la valoración ácido-base. MATERIAL Balanza de precisión Bureta Pinza de bureta Vinagre comercial Pipeta de 10 Ml Fenolftaleína Hidróxido de sodio NaOH Pie soporte Cucharilla espátula Nuez doble Embudo pequeño Matraz erlenmeyer de 250 mL Vaso de precipitados de 100 mL FUNDAMENTO TEÓRICO El ácido acético CH3COOH es un ácido débil que reacciona con una base fuerte según la reacción de saponificación: CH3COOH + NaOH → CH3COONa + H2O En dicha reacción, el ácido se va neutralizando lentamente hasta quedar totalmente neutralizado por la sosa. El proceso debe hacerse lentamente a fin de detener la neutralización justo en el momento en que no queda nada de ácido y ligeramente poca cantidad de base. En este momento se da por concluida la valoración. Lo detectaremos con el cambio de color del indicador, que debe perdurar durante un minuto aproximadamente. Utilizaremos como indicador la fenolftaleína, que cambia de incoloro (medio ácido) a rosa fucsia (medio básico). Se emplea este indicador porque tras la neutralización queda una disolución de acetato de sodio cuyo pH es aproximadamente 9 (por la hidrólisis del anión), que entra dentro del rango de viraje de la fenolftaleína (8-10). Para el cálculo de la acidez del vinagre utiliza la siguiente ecuación: Acidez del vinagre = Vsosa (en litros) · 0’5 · 60 · 100 / 15 El resultado viene expresado en %. La acidez de un vinagre de uso comestible suele oscilar entre 3% y 6%. PROCEDIMIENTO Se prepara un litro de disolución de hidróxido de sodio NaOH 0'5N, pesando la cantidad necesaria, teniendo en cuenta su pureza. Se llena de esta disolución la bureta, procurando enrasar bien a cero. Vierte en el matraz erlenmeyer 15 mL de vinagre (a ser posible de color claro para poder observar el viraje) y añade unas cuatro gotas de fenolftaleína. Abre la llave de la bureta con cuidado dejando caer gota a gota la disolución de base y se procede a la valoración. Cuando se produzca el cambio de color a rosa fucsia, y éste sea permanente, justo en ese momento cerramos la llave de la bureta y damos por concluida la valoración. Debes procurar no pasarte porque en ese caso estarás calculando un valor erróneo. Anota el volumen gastado de base en la siguiente tabla. Repite el proceso tres veces para calcular el valor medio y reducir así errores. Experiencia nº Volumen NaOH Volumen medio Acidez (mL) NaOH (mL) vinagre del 1 2 3 CUESTIONES 1. ¿Se produce calor al disolver la sosa cáustica en agua? ¿Por qué? 2. ¿Aprecias mucha diferencia al valorar en los tres ensayos? ¿A qué crees que es debido? 3. ¿Qué significado tiene el resultado que has obtenido? 4. ¿Consideras alta la concentración de ácido acético en el vinagre? OBSERVACIONES Y CONCLUSIONES