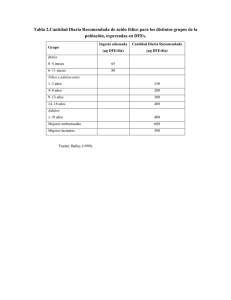
La fosfolipasa A2 del veneno de la abeja mejora las lesiones cutáneas Dermatitis Atópica en ratones inducidas por los ácaros del polvo doméstico Kyung-Hwa Jung 1 , Hyunjung Baek 1 , Manho Kang 1 , Namsik Kim 2 , Seung Young Lee 1 y Hyunsu Bae 1 , * 1 Departamento de Ciencia en Medicina de Corea, la Universidad de Kyung Hee, 26 Kyungheedae-ro, Dongdaemoon-gu, Seúl 02447, Corea 2 Departamento de Medicina Clínica de Corea, Graduate School, Kyung Hee Univeristy, 26 Kyungheedae-ro, Dongdaemoon-gu, Seúl 02447, Corea * Correspondencia: Tel .: + 82-2-961-9316; Fax: + 82-2-962-9316 Editores Académicos: Stuart M. Brierley e Irina Vetter Abstracto : La dermatitis atópica (DA) es una enfermedad inflamatoria de la piel bifásica que es provocado por los defectos de la epidermis de barrera, desregulación inmune, y el aumento de infecciones de la piel. Anteriormente, hemos demostrado que bvPLA2 evocado tolerancia inmune mediante la inducción de células T reguladoras (Treg), y por lo tanto alivia Th2 dominante asma alérgica en ratones.Aquí, nos gustaría para determinar si el tratamiento con bvPLA2 exacerba las inflamaciones alérgicas como AD-inducidas por el extracto de ácaro del polvo doméstico (DFE) en un modelo murino. espesor de la epidermis, infiltración de células inmunes, la inmunoglobulina de suero, y se midieron las citoquinas.hinchazón del oído, lesiones en la piel, y los niveles de IgE sérica total y Th1 / Th2 estaban elevados en los ratones AD DNCB inducida DFE /. La aplicación tópica de bvPLA2 provocó una supresión significativa del aumento de los síntomas de AD, incluyendo grosor de la oreja, la concentración de IgE sérica, citoquinas inflamatorias, y los cambios histológicos. Además, el tratamiento bvPLA2 inhibe la infiltración de mastocitos en el oído. Por otro lado, la reducción de células Treg abolió los efectos anti-atópicos de bvPLA2, lo que sugiere que los efectos de bvPLA2 dependen de la existencia de células T reguladoras. Tomados en conjunto, los resultados revelaron que la exposición tópica a bvPLA2 agrava la inflamación de la piel atópica, lo que sugiere que bvPLA2 podría ser un candidato para el tratamiento de la EA. Palabras clave: dermatitis atópica; bvPLA2; IgE; mastocitos; lesion de piel 1. Introducción La dermatitis atópica (AD) es una enfermedad de la piel inflamatoria crónica y recurrente común que resulta de la respuesta inmune dysregulated debido a la estimulación excesiva por antígenos externos [ 1 ]. La prevalencia de la EA se ha incrementado significativamente en los últimos años, y ahora afecta aproximadamente al 1% -3% de los adultos y hasta un 20% de los niños [ 2 ]. La patogénesis de la EA se ha atribuido a mecanismos alternativos que incluyen los contaminantes, las alergias, la constitución genética y la función inmunológica [ 3 , 4 , 5 ]. Las características clínicas de los pacientes con EA incluyen placas eritematosas de la piel, erupción, y IgE sérica elevada y T helper tipo de célula 2 (Th2) los niveles de citoquinas. AD pacientes también presentan hiperplasia epidérmica y la acumulación de células cebadas y citocinas Th2 [ 6, 7 ]. Muchos casos de AD son tratados con agentes anti-inflamatorios que modulan las respuestas Th1 y Th2 y la concentración de IgE. Los esteroides tópicos y otros agentes inmunosupresores se utilizan comúnmente para el tratamiento de la EA de moderada a grave. Nuevos enfoques terapéuticos implican componentes que son importantes para el mantenimiento de la barrera epidérmica, incluyendo la ceramida y otros componentes de enzimas de diferenciación epidérmica [ 8 ]. Sin embargo, la incidencia y el riesgo relativo de toxicidad de estos agentes no son insignificantes, especialmente en niños.Recientemente, varias fuentes, tales naturales como plantas, animales, microorganismos y hierbas han recibido atención como agentes terapéuticos alternativos en el tratamiento de la EA debido a sus dispositivos de seguridad probadas y potentes efectos inmunomoduladores. El veneno de abeja (BV) de Apis mellifera contiene una variedad de péptidos y proteínas, incluyendo la melitina, fosfolipasa A2 (PLA2), adolapin, apamina, y degranulación de los mastocitos (MCD) péptido [ 9 , 10 , 11 ]. BV es un fármaco anti-inflamatorio que se ha utilizado en el tratamiento del dolor, la artritis, la enfermedad de Parkinson, y esclerosis múltiple [ 12 , 13 , 14 ]. PLA2 es uno de los principales componentes de BV y juega un papel central en una amplia gama de respuestas celulares, tales como el metabolismo de fosfolípidos, la transducción de señales, y la regulación de las respuestas inflamatorias e inmunes [ 15 , 16 ]. Nuestro estudio reciente demostró que bvPLA2 hace que la tolerancia inmune aumentando la población de CD4 + Foxp3 + células T reguladoras (Treg) en la nefrotoxicidad inducida por cisplatino y modelos de asma alérgica [ 17 , 18 ]. Se encontró que los efectos protectores de bvPLA2 estar relacionado con la modulación de células T reguladoras. Por lo tanto, la hipótesis de que bvPLA2 podría ser un agente candidato anti-inflamatorio para el tratamiento de AD. Además, la producción de los marcadores séricos tales como el total de citoquinas de IgE y Th1 / Th2 se redujo significativamente en los ratones tratados con bvPLA2 en comparación con el grupo de control DFE / DNCB sensibilizadas. Además de la infiltración de mastocitos, hiperplasia epidérmica se reduce tras el tratamiento en ratones bvPLA2 AD. También se determinó el papel de células T reguladoras en la supresión mediada por bvPLA2 en lesiones de la piel. El efecto supresor de bvPLA2 fue abolida tras el agotamiento Treg utilizando PC61 anticuerpo monoclonal anti-CD25 (mAb). Finalmente, este estudio propone que bvPLA2 es un nuevo agente terapéutico potencial para el tratamiento de pacientes con EA. 2. resultados 2.1. Tratamiento bvPLA2 Alivia DFE / Lesiones cutáneas DNCB inducido Se investigaron los efectos de bvPLA2 en el alivio de los síntomas inducidos tipo-AD-DNCB / DFE. Los ratones fueron sometidos repetidamente a la irritación química con DNCB y el antígeno de reto con DFE en ambos lóbulos de las orejas durante cuatro semanas ( Figura 1 A). Como era de esperar, la administración tópica repetida de / DNCB (grupo AD) DFE aumentado gradualmente el espesor de la oreja en comparación con los ratones normales de control (grupo NC) por siete días. El tratamiento con bvPLA2 (16 y 80 ng / oreja) y DEXA produjeron menores parcialmente grosor de la oreja, en comparación con el grupo de AD. ( Figura 1 B). Aplicaciones tópicas repetidas del DFE / DNCB indujeron una hinchazón de la piel en los oídos de los ratones y se suscitó una mayor gravedad dermatitis como indica la gravedad de los síntomas, tales como eritema / hemorragia, edema, excoriaciones / erosión, y la sequedad / escala ( Figura 1 C ,RE). La administración de bvPLA2 mostró la supresión significativa de las lesiones de la piel similar a AD. Figura 1. Efectos del tratamiento sobre los síntomas bvPLA2-AD como DNCB inducida DFE /. ( A ) Diseño experimental del protocolo de estudio. Para estudiar el efecto de bvPLA2 en la dermatitis atópica, los ratones fueron tratados con DFE / DNCB durante cuatro semanas y bvPLA2 se inyectaron por tres semanas durante la sensibilización de antígeno; ( B ) El grosor de la oreja se midió usando un medidor de espesor de línea 24 h después de la aplicación / DNCB DFE; ( C ) Las imágenes de las lesiones de la piel del oído de los grupos de ratones tomadas en el último día del experimento (día 28); ( D ) Los niveles de gravedad de los síntomas de las lesiones de la piel del oído fueron indexados al microscopio con el marcador dermatitis, que se especifica como la suma de los puntos (0 = sin síntomas; 1 Los síntomas = leve, 2 = síntomas moderados, y 3 = grave síntomas) para los síntomas de eritema / hemorragia, edema, excoriación / erosión, y la sequedad / escalado.Carolina del Norte: grupo de control normal; AD: DFE / DNCB grupo aplicada; DEXA: DFE / DNCB aplicado y grupo tratados con dexametasona (0,1 mg / oído, 20 l) como control positivo; bvPLA2 (16 ng / oído): DFE / DNC aplicado y bvPLA2 (16 ng / oído) grupo tratado; bvPLA2 (80 ng / oído): DFE / DNC aplicado y bvPLA2 (80 ng / oído) grupo tratado. Los análisis estadísticos se realizaron con ANOVA de una vía seguido de pruebas de comparación múltiple de Newman-Keuls (*** p <0,001 vs. NC y ### p <0,001, ## p<0,01 vs. AD; n = 5). 2.2. Inhibe bvPLA2 / DNCB inducido por Th1 y Th2 producción de citoquinas y la IgE sérica Niveles DFE Para determinar los efectos de bvPLA2 sobre las respuestas / DFE DNCBinducida por AD como inflamatorias, que mide la expresión de Th1 (TNF-α, IL6 e IFN-γ) y citocinas Th2 (IL-4 e IL-13) en la proteína extraída de los tejidos del oído. El grupo AD mostró aumento de los niveles significativos de Th1 ( Figura 2 A-C) y Th2 ( Figura 2 D, E) citoquinas, mientras que los grupos expuestos bvPLA2 reducen significativamente los niveles de Th1 / 2 citoquinas en comparación con el grupo de AD. Además, el grupo DEXA reduce notablemente la expresión de citoquinas Th1 / 2 y dio como resultado un patrón de inhibición similar a la observada para el grupo bvPLA2 (80 ng / oreja). Figura 2. Efectos de bvPLA2 sobre la expresión de citoquinas y la IgE total en suero. Los niveles de ( A ) IL-4; ( B ) IL-13; ( C ) IFN-γ; ( D ) TNF-α; ( E ) IL-6 en el oído y ( F ) IgE total en el suero se cuantificaron por el ratón CBA (Th1, 2, y 17) y kit kit ELISA. Los análisis estadísticos se llevaron a cabo con un ANOVA de una vía seguido por pruebas de comparación múltiple de Newman-Keuls (*** p<0,001, ** p <0,01 y * p <0,05 vs. NC y ### p <0,001, ## p<0,01 y # p <0,05 vs. AD; n = 5). A continuación, se analizó el nivel de IgE total en suero. Hyper-producción de IgE en suero se sabe que es un rasgo característico importante de AD [ 19 ]. Como se muestra enla Figura 2 F, los grupos bvPLA2 mostraron una reducción significativa de la concentración sérica de IgE total en una forma dependiente de la dosis. Como se esperaba, el control positivo (grupo DEXA) mostró una supresión dramática del aumento de Th1 / 2 citoquinas así como la secreción de IgE total en suero. En conjunto, estos resultados sugieren fuertemente que bvPLA2 ejerció un efecto inhibidor significativo en Th1 / 2 la producción de citoquinas y la hiper-producción de IgE total en suero en lesiones de la piel-AD como en el modelo de ratones / DNCB inducida DFE. 2.3. Inhibe bvPLA2 DEF / DNCB inducido AD-Como histopatológico cambios DFE de desafío / DNCB causó cambios histopatológicos potentes que incluyen el engrosamiento de la epidermis, la fibrosis en la dermis, y la infiltración de células inflamatorias en la dermis [ 20 ]. Para analizar los efectos de los cambios histopatológicos en bvPLA2 / DFE DNCB inducida en los tejidos del oído, se evaluó el espesor epidermis, dermis, y el índice inflamatoria de las lesiones cutáneas ( Figura 3 A, C-E). El grupo AD aumentó significativamente la epidermis, dermis, y la infiltración de células inflamatorias en los tejidos del oído en comparación con el grupo NC. Curiosamente, los oídos de los grupos tratados con bvPLA2 exhibieron menos hiperplasia epidérmica y dérmica en comparación con el grupo de AD. Específicamente, la evaluación histológica usando H & E tinción reveló que la infiltración de linfocitos y la hiperplasia epidérmica ejercida por inducción AD fueron atenuadas por el tratamiento bvPLA2 de una manera dependiente de la dosis (16 y 80 ng / oreja). Estos efectos de la bvPLA2 no eran más significativamente diferentes que las del grupo DEXA. A continuación realizó tinción con azul de toluidina para investigar el efecto de bvPLA2 sobre la infiltración inducida por DNCB DFE / de los mastocitos y eosinófilos en lesiones de la piel del oído. Los mastocitos actúan como célula efectora importante en la hipersensibilidad a través de la activación a través del receptor de IgE en AD [ 21 ]. Como se muestra en la Figura 3 B, F, la acumulación de mastocitos se redujo significativamente en los grupos tratados con bvPLA2. Tomados en conjunto, estos datos indican que el tratamiento bvPLA2 presenta un efecto dependiente de la dosis en los cambios histopatológicos contra AD inducida por DNCB DFE /. Figura 3. Efectos de bvPLA2 sobre los cambios histológicos de las lesiones ADcomo DNCB / DFE-inducidos en la piel. ( A ) Las secciones del oído (4 m de espesor) se tiñeron con hematoxilina y eosina (H & E) y ( B ) azul de toluidina (TB) y tomada con × 200 y 400 × magnificación; ( C ) Los espesores de la epidermis y ( D dermis) se cuantificaron basan en las secciones teñidas con H & E utilizando el software Image Pro-Plus 5.1 como se describe en los Materiales y Métodos; ( E ) La evaluación de la gravedad de la oreja cambio histológico se cuantificó usando un sistema de puntuación de cinco puntos; ( F ) El número de mastocitos por cinco sitios seleccionados al azar se contaba con las secciones del oído con TB manchado. ( G ) La expresión de Foxp3 en el tejido de la oreja se determinó mediante PCR en tiempo real.Los análisis estadísticos se llevaron a cabo con un ANOVA de una vía seguido de Newman-Keuls prueba de comparaciones múltiples (*** p <0,001 y * p<0,05 vs. NC y ### p <0,001, ## p <0,01 y # p <0,05 vs. AD; n = 5). 2.4. bvPLA2 Contribuye a la inducción de células T reguladoras en DFE Lesiones cutáneas similar a AD / DNCB inducido Hemos informado anteriormente de que bvPLA2 puede inducir Foxp3 que expresan CD4 + células T reguladoras (Tregs) en el asma inducida por OVA y aguda modelo de lesión renal [ 17 ]. Estudio reciente ha sugerido que Tregs inhiben Th1 y Th2 respuestas de células específicas de alérgeno, jugando un papel en la respuesta inmune fisiológica a alergenos [ 22 ]. Para confirmar la implicación de bvPLA2 en la inducción de células T reguladoras a las lesiones de la piel, la expresión de Foxp3 en el tejido de la oreja se determinó mediante PCR en tiempo real. Como era de esperar, el tratamiento bvPLA2 mostró un aumento significativamente el nivel de ARNm de Foxp3 en las lesiones de AD como ( Figura 3 G). 2.5. Efectos de bvPLA2 en DFE Lesiones cutáneas similar a AD / DNCB-inducida a través de la inducción de células T reguladoras Para investigar si bvPLA2 tiene el potencial de mejorar las lesiones cutáneas AD-como a través de la inducción de células T reguladoras, que agotados Tregs utilizando un mAb anti-CD25 (clon: PC61) y determinados CD4 + CD25 + poblaciones en el bazo en el día 1 y 7. Tratamiento de anticuerpo PC61 eliminado completamente CD25 + células después de un día de la inyección y el agotamiento se mantuvo durante siete días ( Figura 4 a). Los resultados mostraron que la (isotipo IgG) grupo bvPLA2 redujo significativamente grosor de la oreja en la oreja inflamada ( Figura 4 B). Sin embargo, el grupo con reducción de Treg bvPLA2 (PC61) no mostró grosor de la oreja disminuyen, pero también se agravó comparación con el grupo bvPLA2 (IgG). Todas las citoquinas se upregulated en el grupo AD (IgG), y bvPLA2 suprimen la expresión de todas las citoquinas Th1 y Th2. Encontramos un patrón consistente de niveles más altos significativos de citocinas Th1 y Th2 por bvPLA2 en ratones-agotado Treg ( Figura 4 C-G). En conjunto, estos datos indican que aunque bvPLA2 puede suprimir el aumento de espesor del oído y de citocinas Th1 y Th2 en ratones la expresión de la lesión de la piel similar a AD, no se observaron estos efectos tras el agotamiento de las células T reguladoras. Figura 4. Efectos de bvPLA2 sobre lesiones de la piel similar a AD de ratones CD25 agotados. La ratones hembra BALB / C ratones recibió una vez con una dosis de 0,25 mg / kg de rata anti-ratón CD25 (PC61) o IgG total de rata en los días 3, 4, 11, 17, y 25. ( A ) CD4+ CD25 + poblaciones se midieron utilizando FACS en el día 1 y 7; ( B ) El grosor de la oreja se midió utilizando un medidor de espesor de línea 24 h después de la aplicación / DNCB DFE. La concentración de ( C ) IL-4; ( D ) IL-13; ( E ) IFN-γ; ( F) TNF-α; y ( G ) IL-6 se midió por el ratón CBA (Th1, 2, y 17) y kit kit ELSA. Carolina del Norte: grupo de control normal; AD: DFE / DNCB grupo aplicada;bvPLA2: DFE / DNC aplicado y bvPLA2 (80 ng / oído) grupo tratado. Agotado ratones no CD25;: IgG PC61: ratones anti-CD25-agotado. Los análisis estadísticos se realizaron con un ANOVA de una vía seguido de Newman-Keuls prueba de comparaciones múltiples (** p <0,01 y * p <0,05, ## p <0,01 y # p <0,05; no significativas = ns, n = 3 ). 2.6. bvPLA2 Suprime los cambios histopatológicos a través de la inducción de células T reguladoras También se investigó los cambios morfológicos de los tejidos del oído en respuesta a bvPLA2 y Treg agotamiento ( Figura 5 A). El grupo bvPLA2 (IgG) mostró una supresión significativa de los niveles elevados de la epidermis y la dermis de espesor y la infiltración de células inflamatorias en los tejidos del oído. Aunque bvPLA2 pueden suprimir las lesiones de la piel epidérmica en el modelo de ratones DFE / DNCB inducida, estos efectos no se observaron en el grupo empobrecido células Treg. Tomados en conjunto, estos datos demuestran que bvPLA2 tiene potencial para contrarrestar la lesión de la piel AD-como asociado respuestas inflamatorias a través de la inducción de células T reguladoras. Figura 5. Efectos de bvPLA2 sobre los cambios histológicos en lesiones de la piel similar a AD de ratones CD25 agotado. ( A ) Sección del oído Representante imágenes fueron teñidas con H & E para evaluar los cambios histológicos (x 200 aumentos); ( B ) los espesores de la epidermis; y ( C ) dermis se cuantificaron en base a las secciones H & E manchadas utilizando el software Image Pro-Plus 5.1 como se describe en los Materiales y Métodos; ( D ) La evaluación de la gravedad de la oreja cambio histológico se cuantificó usando un sistema de puntuación de cinco puntos. Los análisis estadísticos se realizaron con un ANOVA de una vía seguido de Newman-Keuls prueba de comparaciones múltiples (*** p <0,001 y * p <0,05 y ## p <0,01 y # p <0,05; no significativas = ns, n = 3). 3. Los debates La dermatitis atópica (AD) es una enfermedad de la piel inflamatoria crónica, que se caracteriza por prurito y lesiones cutáneas eccematosas. El aumento de la incidencia de AD en los niños está estrechamente relacionada con una historia potencial de eczema y se ha sugerido que un fondo genético es importante en la patogénesis de la AD [ 23 ]. Los activadores inmunológicos difieren entre individuos e incluyen varios alimentos, alérgenos en el aire, irritantes y contactantes, hormonas, el estrés, el clima y los microorganismos. AD está estrechamente relacionada con otras enfermedades atópicas, lo más frecuentemente como parte de la tríada atópica de la dermatitis infantil de la enfermedad alérgica, el asma y la rinitis alérgica [ 24 ]. En general, 50% -80% de los pacientes de AD a desarrollar asma y / o rinitis alérgica. En el presente estudio, hemos adoptado un modelo de ratón de AD-como lesiones en la piel inflamación a través de la aplicación epicutánea de ácaros del polvo doméstico, un alérgeno común asociado con AD humana. Hemos demostrado claramente que no se observaron síntomas típicos de AD después de la aplicación repetida de DFE / DNCB.Hinchazón de la oreja y no se detectaron cambios fibróticos, y la IgE total y los niveles de citoquinas Th1 / Th2 aumentado de manera espectacular. El análisis histopatológico reveló también la infiltración de mastocitos, que son células efectoras importantes y una fuente de la histamina en las lesiones de la piel. tratamiento bvPLA2 suprimió significativamente estos síntomas de AD, lo que sugiere que el efecto beneficioso de bvPLA2 en lesiones de la piel similar a AD. Lesiones cutáneas AD se caracterizan por la sobreexpresión de las citocinas Th2 las citoquinas Th22 IL-4 e IL-13 e IL-22. La sobreexpresión de citoquinas Th2 (IL-4, IL-5, y IL-13) conduce a una respuesta inmune que resulta en niveles de IgE en suero elevado y desarrollo de eosinófilos [ 25 ]. Otro grupo informó de que el desarrollo de la EA se asocia con la sobreexpresión de las citocinas Th2 y Th22, mientras que las respuestas inflamatorias crónicas están mediados por un IFN-γ y el componente Th1-12 productoras de IL y se caracterizan por el aumento del número de células de IgE que llevan en la epidermis y la dominación de los macrófagos en la infiltración de células mononucleares dérmicas [ 26 ]. En nuestro modelo de lesiones de la piel similar a AD, la expresión de citocinas Th1 y Th2, y el nivel sérico de IgE fueron marcadamente elevados. Además, bvPLA2 suprime tanto las respuestas Th1 y Th2 tanto la inflamación aguda y crónica de la piel provocadas por lesiones en la piel similar a AD. Las células Treg juegan un papel crítico en la supresión de las respuestas inmunes aberrantes contra antígenos propios [ 27 ]. Disminución del número de células T reguladoras en los sitios de inflamación está relacionada con la enfermedad inflamatoria, incluyendo AD. Bae et al., Informó que los ratones que tienen AD inducida por los ácaros del polvo mostraron una reducción en la expresión de Foxp3, tanto en el sitio inflamado y DLN [ 28 ]. La pérdida de células T reguladoras causada por deficiencia de Foxp3 provocó una respuesta inflamatoria multiorgánica incluyendo inflamación de la piel que se asemeja AD asociado con los niveles de IgE en suero elevada, eosinofilia, la producción de citoquinas Th1 y Th2 dysregulated, y otros síntomas autoinmunes [ 29 , 30]. El agotamiento de las células Treg durante la sensibilización epidérmica llevó a exacerbado significativamente lesiones de la piel, incluyendo el aumento de expresión de citocinas Th2 y los niveles de IgE en suero. Estos informes sugieren que la falta de células T reguladoras podría contribuir a recapitulatation de características inmunológicas importantes de la EA. En el estudio anterior, se informó de que el papel protector de bvPLA2 como una novela Foxp3 + Treg inductor de células en un modelo de ratón de la enfermedad de Parkinson [ 31 ]. Por otra parte, se determinó que la participación de las poblaciones Treg en los efectos protectores de bvPLA2 en DFE.DNCB inducida por lesiones en la piel similar a AD. El agotamiento de células T reguladoras utilizando PC61 anti-CD25 mAb dio como resultado una reducción significativa de espesor de la epidermis y Th1 / 2 citoquinas tales como IL-4, IL-13, IFN-γ, y IL-6 en los ratones tratados con AD bvPLA2. Así, el tratamiento mejora los bvPLA2 lesiones de la piel a través de la inducción de las células Treg, que tienen un papel importante en el control de la inflamaciónAD similares. No se conoce ninguna cura de pacientes con EA, pero las lesiones de la piel tratada con éxito por una variedad de agentes tópicos y / o sistémicos. Estos incluyen la prevención de respuestas Th2, aumento de las respuestas Th1 y disminución de la concentración de IgE. glucocorticosteroides tópicos son remedios importantes y eficaces para el tratamiento de enfermedades alérgicas de la piel. Sin embargo, es bien sabido que el uso prolongado de altas dosis de glucocorticoides causa una variedad de adversos efectos.En este estudio, hemos examinado los efectos de bvPLA2 sobre lesiones de la piel similar a AD utilizando el modelo de ratones Balb / c. El tratamiento con bvPLA2 suprimió significativamente el aumento de los niveles de suero de IgE y citoquinas Th1 y Th2. Los cambios histológicos y la infiltración de mastocitos se atenuaron por aplicación bvPLA2.Los resultados de este estudio revelaron que la exposición tópica a bvPLA2 agrava inflamación de la piel atópica. 4. Materiales y Métodos 4.1. animales los ratones Balb / c de 7-8 semanas de edad, hembras fueron adquiridos de Charles River Corea (Orient Bio, Seungnam, Corea). Los animales fueron alojados en condiciones libres de patógenos con aire acondicionado en un 12 h luz / oscuridad ciclo con acceso libre a comida y agua durante el período experimental (ad libitum). El estudio se realizó de conformidad con las Reglas de Cuidado de Animales y los principios rectores del experimento con animales y fueron aprobados por la Universidad de Kyung Hee Cuidado de Animales y el empleo Comisión (KHUASP (SE) -12 a 015, 15 de julio de 2012). 4.2. reactivos El veneno de abeja fosfolipasa A2 (bvPLA2, Apis mellifera ) y dexametasona (DEXA) fueron adquiridos de Sigma (Sigma-Aldrich, St. Louis, MO, EE.UU.). El ácaro del polvo doméstico estadounidense en forma de crudo liofilizados Dermatophagoides farinaeextracto (DFE) (Greer Laboratories, Lenoir, Carolina del Norte, EE.UU.) se utilizó como se utilizó un antígeno y 2,4dinitroclorobenceno (DNCB) (Sigma-Aldrich) como sensibilizador para inducir la EA en los ratones. bvPLA2 se disolvió en solución salina tamponada con fosfato (PBS) y DFE se disolvió en PBS que contiene 0,5% de Tween 20. DNCB se disolvió en acetona y aceite de oliva (AOO) en una proporción de 3: 1. AOO o AOO que contiene 0,5% de Tween 20 se utilizó como un vehículo. 4.3. Dermatitis Atópica Modelo La inducción de las lesiones de AD se realizó según un protocolo experimental descrito previamente [ 32 ]. Para inducir lesiones de AD, los ratones se dividieron en cinco grupos de la siguiente manera ( n = 5 por grupo). Carolina del Norte: grupo de control normal; AD: DFE / DNCB grupo aplicada; DEXA: DFE / DNCB aplicado y grupo tratados con dexametasona (0,1 mg / oído, 20 l) como control positivo; bvPLA2 (16 ng / oído): DFE / DNC aplicado y bvPLA2 (16 ng / oído) grupo tratado; bvPLA2 (80 ng / oído): DFE / DNC aplicado y bvPLA2 (80 ng / oído) grupo tratado. El pelo se eliminó con loción depilación y cinta quirúrgica (Nichiban, Tokio, Japón). Después de la eliminación del vello, 20 l de solución de DNCB 1% se aplicó a cada oído y después 20 l de 10 mg / ml DFE se aplicó para la sensibilización cuatro días más tarde. El tratamiento de la DFE o DNCB se repitió una vez a la semana durante cuatro semanas. Para el tratamiento bvPLA2, los ratones fueron tratados con bvPLA2 (16 y 80 ng / oído, aproximadamente equivalente a 0,2 y 1 picadura de abeja) aplicado con un cepillo de cuatro veces por semana durante tres semanas. Dexametasona (50 mg / oreja) se trató como control positivo. En el día 28, el grosor de la oreja se midió usando un medidor de espesor de línea (Kori Seiki MFG, Co., Tokio, Japón) y los ratones se evaluaron con una puntuación dermatitis por medio de una prueba ciega y se sacrificó. Las muestras de sangre se recogieron mediante punción orbital y los tejidos del oído se retiraron para el análisis adicional. Los experimentos se realizaron por duplicado. 4.4. El agotamiento de Treg Anti-ratón CD25 (clon: PC61) se produjo en la casa a partir de hibridomas obtenidos de la American Type Culture Collection (ATCC; Manassas, VA, EE.UU.). Hembra Balb / C ratones recibieron una dosis de 0,25 mg / kg de rata anti-ratón CD25 o control IgG de rata (Sigma-Aldrich) en los días 3, 4, 11, 17, y 25. La eficacia de la depleción de Treg se analizó en 28 días por FACSCalibur (BD Biosciences, San Diego, CA, EE.UU.) para la expresión de CD4 y CD25. 4.5. Evaluación de la Lesión de la Piel Los niveles de gravedad de las lesiones de la piel similar a AD-inducidas DBCB / DFE fueron clínicamente evaluados utilizando métodos previamente establecidos [ 33 , 34 ].Las lesiones de la piel en las orejas se puntuaron según los siguientes cuatro síntomas: eritema / hemorragia, edema, excoriación / erosión, y la sequedad / escalado. Puntuación Dermatitis se definió como la suma de las puntuaciones individuales, que se calificaron sigue: 0, sin síntomas; 1, síntomas leves; 2, síntomas moderados; y 3, síntomas graves. 4.6. La determinación de IgE en suero Los títulos Las muestras de sangre se recogieron por centrifugación a 2500 g durante 20 min. El suero se diluyó (1: 250) con 5% de suero bovino fetal (FBS) en PBS (diluyente de ensayo) y los niveles séricos de IgE se midieron utilizando un ratón IgE ELISA kit (BD Biosciences, San Diego, CA, EE.UU.) de acuerdo con las instrucciones del fabricante.Brevemente, una placa de microtitulación de 96 pocillos (Costar, NY, EE.UU.) se recubrieron durante la noche a 4 ° C con antiIgE de ratón mAb. Después del lavado con PBS que contenía 0,05% de Tween 20, las placas se bloquearon con 5% de FBS en PBS durante 1 h a TA. Los 100 l de muestras de suero diluidas se incubaron durante 2 h a TA.Secondary marcado con peroxidasa biotinilada anti-IgE de rata mAb se incubó en tampón de bloqueo durante 1 h. La reacción enzimática se inició por adición de solución de sustrato TMB (BD Biosciences) durante 30 min, y la reacción se detuvo mediante la adición de solución de parada 50 l a cada pocillo. La densidad óptica se midió a 450 nm con un lector de microplacas (SOFT max PRO, versión 3.1. Molecular Devices, Sunnyvale, CA, EE.UU.). El límite inferior de detección para el ELISA de IgE fue de 1,5 ng / ml. 4.7. Evaluación de citocinas Th1 y Th2 en los tejidos del oído mediante ELISA Los niveles de IL-4, TNF-α, IFN-γ, IL-6, y IL-13 en los tejidos del oído se determinaron utilizando un kit de ELISA (BD Biosciences y R & D, Minneapolis, MN, EE.UU.) de acuerdo con los protocolos del fabricante . Cada muestra de tejido de la oreja se preparó por homogeneización en la proteína del tejido reactivo de extracción (T-PER; Pierce Biotechnology Inc., Rockford, IL, EE.UU.) con 1 mg / ml de cóctel inhibidor de la proteasa (Roche Diagnostics, Mannheim, Alemania). placas de microtitulación de 96 pocillos se recubrieron durante la noche a 4 ° C con anti-ratón IL-4, TNF-alfa, IFN-gamma, IL-6 o IL-13 mAbs en tampón de recubrimiento. Las placas se lavaron dos veces con PBS que contenía 0,05% de Tween-20 y se bloquearon con 5% de FBS en PBS durante 1 h a TA. Después de dos lavados, las placas se incubaron durante 2 h a TA con los homogeneizados de tejido de la oreja. El marcado con peroxidasa secundario biotinilado anti-ratón de IL-4, TNF-α, IFN-gamma, IL-6 o IL-13 mAbs en diluyentes ensayo se incubaron durante 1 h. Finalmente, las placas se trataron con solución de sustrato TMB durante 30 min y la reacción se terminó mediante la adición de solución de parada. La densidad óptica se midió a 450 nm utilizando un lector de microplacas (SOFT max PRO).Las concentraciones de proteína total se determinaron usando un kit BCA (Pierce Biotechnology Inc.). Los resultados se normalizaron a la cantidad total de proteína de tejido de la oreja en cada muestra. 4.8. Análisis histológico Para los exámenes histopatológicos, el oído lesionado de la piel de cada ratón se retiró y se fija con 10% de formalina tamponada neutra durante 24 horas a 4 ° C. Los tejidos se deshidrataron, se incluyeron en parafina y se cortan en secciones de 4 micras de grosor utilizando un microtomo rotatorio. Las secciones fueron teñidas con hematoxilina y eosina (H & E; Sigma-Aldrich) para evaluar la hiperplasia epidérmica y la infiltración de las células inmunes en la dermis. azul de toluidina (TB) tinción se realizó para medir el grado de infiltración de mastocitos. Las imágenes de las secciones de tejido del oído fueron adquiridos utilizando un microscopio Olympus BX51 (Olympus, Tokio, Japón) y se cuantificaron utilizando Image Pro-Plus de software 5.1 (Media Inc. cibernética, Silver Spring, MD, EE.UU.). 4.9. Análisis estadístico El análisis estadístico de los datos se realizó usando Prism software 5 (GraphPad Software Inc., La Jolla, CA, EE.UU., versión 5.0). Los datos se presentan como la media ± SEM se determinaron las diferencias entre los grupos de estudio usando ANOVA de una vía seguido de Newman-Keuls pruebas de comparaciones múltiples. p <0,05 fue considerado estadísticamente significativo. Los experimentos con dos grupos se analizaron con dos colas unpaired t -pruebas. Expresiones de gratitud Este trabajo fue apoyado por la Fundación Nacional de Investigación de Corea (NRF) subvención financiado por el gobierno de Corea (Ministerio de Educación, Ciencia y Tecnología (MEST)) (Nº 2013-068954). Contribuciones de autor K.-HJ y MK llevaron a cabo los experimentos y se analizaron los datos; HB escribió el documento; NK realizado los experimentos de revisión; SYL contribuyó de reactivos y materiales; HB concebido y diseñado los experimentos. Conflicto de intereses Los autores declaran que no tienen intereses en competencia. referencias 1. Berke, R .; Singh, A .; Guralnick, M. Dermatitis atópica: una visión general. A.m.Fam. Physician 2012 , 86 , 35-42. [ Google Académico ] [ PubMed ] 2. La dermatitis Leung, DY atópica: nuevas perspectivas y oportunidades para la intervención terapéutica. J. Allergy Clin. Immunol. 2000 , 105 , 860-876. [ Google Académico ] [ CrossRef ] [ PubMed ] 3. Leung, DY; Boguniewicz, M .; Howell, MD; Nomura, I .; Hamid, QA Nuevos conocimientos sobre la dermatitis atópica. J. Clin. Investig. 2004 , 113 , 651657. [Google Académico ] [ CrossRef ] [ PubMed ] 4. Bonifacio, K .; Bernard, FX; García, M .; Gurney, AL; Lecron, JC; Morel, F. IL-22 inhibe la diferenciación epidérmica e induce la expresión de genes proinflamatorios y la migración de los queratinocitos humanos. J. Immunol. 2005 ,174 , 36953702. [ Google Académico ] [ CrossRef ] [ PubMed ] 5. Palmer, CN; Irvine, AD; Terron-Kwiatkowski, A .; Zhao, Y .; Liao, H .; Lee, SP;Goudie, DR; Sandilands, A .; Campbell, LE; Smith, FJ; et al. Las variantes comunes de pérdida de la función de la barrera epidérmica filagrina proteínas son un importante factor predisponente para la dermatitis atópica. Nat. Gineta. 2006 , 38 , 441446. [ Google Académico ] [ CrossRef ] [ PubMed ] 6. Akdis, CA; Akdis, M .; Bieber, T .; Bendslev-Jensen, C .; Boguniewicz, M .;Eigenmann, P .; Hamid, Q .; Kapp, A .; Leung, DY; Lipozencic, J .; et al.Diagnóstico y tratamiento de la dermatitis atópica en niños y adultos: Academia Europea de Alergología e Inmunología Clínica / Academia Americana de Alergia, Asma e 7. 8. 9. 10. 11. 12. 13. 14. Inmunología Consensus Report / PRACTALL. Alergia 2006 , 61 , 969-987. [Google Académico ] [ CrossRef ] [ PubMed ] Novak, N. Nuevos conocimientos sobre el mecanismo y tratamiento de las enfermedades alérgicas: La dermatitis atópica. Alergia 2009 , 64 , 265-275. [ Google Académico ] [ CrossRef ] [ PubMed ] Chamlin, SL; Kao, J .; Frieden, IJ; Sheu, MI; Fowler, AJ; Fluhr, JW; Williams, ML;Elias, lípidos reparación de la barrera PM-ceramida dominantes aliviar la dermatitis atópica infantil: Los cambios en la función de barrera proporcionan un indicador sensible de la actividad de la enfermedad. Mermelada. Acad. Dermatol.2002 , 47 , 198208. [ Google Académico ] [ CrossRef ] [ PubMed ] Habermann, E. abejas y avispas venenos. Ciencia 1972 , 177 , 314-322. [ Google Académico ] [ CrossRef ] [ PubMed ] Sobotka, AK; Franklin, RM; Adkinson, NF, Jr .; Valentine, M .; Baer, H .;Lichtenstein, LM La alergia a las picaduras de insectos. II. La fosfolipasa A: El principal alergeno en el veneno de abeja. J. Allergy Clin. Immunol. 1976 , 57 , 29-40.[ Google Académico ] [ CrossRef ] Raghuraman, H .; Chattopadhyay, A. melitina: Un péptido de membrana activa con diversas funciones. Biosci. Rep. 2007 , 27 , 189-223. [ Google Académico ] [CrossRef ] [ PubMed ] Doo, AR; Kim, ST; Kim, SN; Luna, W .; Yin, CS; Chae, Y .; Park, de Hong Kong;Lee, H .; Parque, los efectos neuroprotectores de HJ veneno de abeja acupuntura farmacéutica en aguda 1-metil-4-fenil-1,2,3,6-tetrahidropiridina inducida modelo de ratón de la enfermedad de Parkinson. Neurol. Res. 2010 , 32 (Supl. S1), 88-91. [Google Académico ] [ CrossRef ] [ PubMed ] Castro, HJ; Méndez-Lnocencio, JI; Omidvar, B .; Omidvar, J .; Santilli, J .; Nielsen, SA, Jr .; Pavot, AP; Richert, JR; Bellanti, JA Un estudio de fase I de la seguridad del extracto de veneno de abeja como un posible tratamiento para los pacientes con formas progresivas de esclerosis múltiple. Allergy Asthma Proc. 2005 , 26 , 470-476.[ Google Académico ] [ PubMed ] Chen, J .; Lariviere, WR El nociceptivo y efectos anti-nociceptivos de inyección de veneno de abeja y terapia: Un arma de doble filo. Prog. Neurobiol. 2010 , 92 , 151183. [ Google Académico ] [ CrossRef ] [ PubMed ] 15. Dennis, EA; Rhee, SG; Billah, MM; Hannun, YA papel de la fosfolipasa en la generación de segundos mensajeros lipídicos en la transducción de señales. FASEB J. 1991 , 5 , 2068-2077. [ Google Académico ] [ PubMed ] 16. Mukherjee, AB; Miele, L .; Pattabiraman, enzimas N. fosfolipasa A2: Regulación y papel fisiológico. Biochem. Pharmacol. 1994 , 48 , 1-10. [ Google Académico ] [CrossRef ] 17. Kim, H .; Lee, H .; Lee, G .; Jang, H .; Kim, SS; Yoon, H .; Kang, GH; Hwang, DS;Kim, SK; Chung, SA; et al. La fosfolipasa A2 inhibe la lesión renal aguda inducida por cisplatino mediante la modulación de las células T reguladoras por el receptor de manosa CD206. Kidney Int. 2015 , 88 , 550-559. [ Google Académico ] [ CrossRef] [ PubMed ] 18. Parque, S .; Baek, H .; Jung, KH; Lee, G .; Lee, H .; Kang, GH; Lee, G .; Bae, H. El veneno de abeja fosfolipasa A2 suprime la inflamación alérgica de las vías respiratorias en un modelo de asma inducida por ovoalbúmina a través de la inducción de células T reguladoras. Immun. Inflamm. Dis. 2015 , 3 , 386-397. [Google Académico ] [ CrossRef ] [ PubMed ] 19. Angeli, V .; Staumont, D .; Charbonnier, AS; Hammad, H .; Gosset, P .; Pichavant, M .; Lambrecht, BN; Capron, M .; Dombrowicz, D .; Trottein, F. La activación del receptor de prostanoides D 1 regula las respuestas alérgicas inmunes y de la piel.J. Immunol. 2004 , 172 , 3.822 hasta 3.829. [ Google Académico ] [ CrossRef ] [PubMed ] 20. Choi, EJ; Lee, S .; Hwang, JS; Im, SH; Jun, CD; Lee, SA; Kim, SH DA-9601 suprime 2,4-dinitroclorobenceno y atópicas extracto inducida por lesiones cutáneas tipo dermatitis del ácaro del polvo. Int. Immunopharmacol. 2011 , 11 , 1260-1264. [Google Académico ] [ CrossRef ] [ PubMed ] 21. Kawakami, T .; Ando, T .; Kimura, M .; Wilson, BS; Kawakami, Y. células cebadas en la dermatitis atópica. Curr. Opin. Immunol. 2009 , 21 , 666-678. [ Google Académico ] [ CrossRef ] [ PubMed ] 22. Braga, M .; Quecchia, C .; Cavallucci, E .; Di Giampaolo, L .; Schiavone, C .;Petrarca, C .; Di Gioacchino, células reguladoras T en M. alergia. Int. J. Immunopathol. Pharmacol. 2011 , 24 (Supl. S1), 55S-64S. [ Google Académico ] [PubMed ] 23. Bohme, M .; Wickman, M .; Lennart Nordvall, S .; Svartengren, M .; Wahlgren, historia familiar y CF riesgo de dermatitis atópica en niños hasta los 4 24. 25. 26. 27. 28. 29. 30. 31. años. Clin.Exp. Alergia 2003 , 33 , 1226-1231. [ Google Académico ] [ CrossRef ] [ PubMed ] Piedra, enfermedades atópicas KD de la infancia. Curr. Opin. Pediatr. 2002 , 14 , 634646. [ Google Académico ] [ CrossRef ] [ PubMed ] Blauvelt, A .; Hwang, ST; Udey, MC 11. alérgica y enfermedades inmunológicas de la piel. J. Allergy Clin. Immunol. 2003 , 111 (Suppl. S2), S560-S570. [ Google Académico ] [ CrossRef ] [ PubMed ] Gittler, JK; Shemer, A .; Suárez-Farinas, M .; Fuentes-Duculan, J .; Gulewicz, KJ;Wang, CQ; Mitsui, H .; Cardinale, I .; Fuerte de Guzmán, C .; Krueger, JG; et al.Activación progresiva de T (H) 2 / T (H) 22 citocinas y proteínas epidérmicas selectivos caracteriza dermatitis atópica aguda y crónica. J. Allergy Clin. Immunol.2012 , 130 , 1344-1354. [ Google Académico ] [ CrossRef ] [ PubMed ] Girolomoni, G .; Sebastiani, S .; Albanesi, C .; Cavani, A. subpoblaciones de células T en el desarrollo de la alergia atópica y de contacto. Curr. Opin. Immunol. 2001 , 13, 733-737. [ Google Académico ] [ CrossRef ] Bae, MJ; Lim, S .; Lee, DS; Ko, KR; Lee, W .; Kim, extractos solubles en agua de S. Actinidia arguta, PG102, atenúa la dermatitis atópica murino ácaros del polvo doméstico inducida por la inhibición de la vía mTOR con la generación de Treg. J. Ethnopharmacol. 2016 , 193 , 96-106. [ Google Académico ] [ CrossRef ] [ PubMed ] Lin, W .; Truong, N .; Grossman, WJ; Haribhai, D .; Williams, CB; Wang, J .;Martín, MG; Chatila, TA alérgica desregulación y hiperimmunoglobulinemia E en ratones mutantes Foxp3. J. Allergy Clin. Immunol. 2005 , 116 , 1106-1115. [ Google Académico ] [ CrossRef ] [ PubMed ] D'Hennezel, E .; Bin Dhuban, K .; Torgerson, T .; Piccirillo, CA Los inmunogenética de desregulación inmune, poliendocrinopatía, enteropatía, ligada al cromosoma X síndrome (IPEX). J. Med. Gineta. 2012 , 49 , 291-302. [ Google Académico ] [CrossRef ] [ PubMed ] Chung, ES; Lee, G .; Lee, C .; Ye, M .; Chung, SA; Kim, H .; Bae, SJ; Hwang, DS;Bae, H. abeja fosfolipasa A2 del veneno, un inductor de la célula Novel Foxp3 + T Reguladoras, protege las neuronas dopaminérgicas por modulación de las respuestas neuroinflamatorios en un modelo de ratón de la enfermedad de Parkinson. J. Immunol. 2015 , 195 , 4.853 a 4.860. [ Google Académico ] [ CrossRef ] [ PubMed ] 32. Choi, JK; Kim, SH Rutina suprime la dermatitis atópica y la dermatitis de contacto alérgica. Exp. Biol. Medicina. 2013 , 238 , 410-417. [ Google Académico ] [ CrossRef ] [ PubMed ] 33. Matsuda, H .; Watanabe, N .; Geba, GP; Sperl, J .; Tsudzuki, M .; Hiroi, J .;Matsumoto, M .; Ushio, H .; Saito, S .; Askenase, PW; et al. El desarrollo de la dermatitis atópica lesión de la piel similar a la IgE con hiperproducción en ratones NC / Nga. Int. Immunol. 1997 , 9 , 461-466. [ Google Académico ] [ CrossRef ] [PubMed ] 34. Kim, CE; Lee, SA; Kim, SK; Choi, MS; Lee, S .; Han, JB; An, HJ; Um, JY; Kim, HM;Lee, NY; et al. La corteza de Betula platyphylla var. japonica inhibe el desarrollo de lesiones cutáneas tipo dermatitis atópica en los ratones NC / Nga. J. Ethnopharmacol. 2008 , 116 , 270-278. [ Google Académico ] [ CrossRef ] [ PubMed ] © 2017 por los autores. Licenciatario MDPI, Basilea, Suiza. Este artículo es un artículo de acceso abierto distribuido bajo los términos y condiciones de la licencia Creative Commons Reconocimiento (CC BY) ( http://creativecommons.org/licenses/by/4.0/ ).