practica-3-equilibrio-liquido-vapor-presion-de-vapor-y-entalpia-de-vaporizacion-del-agua
Anuncio

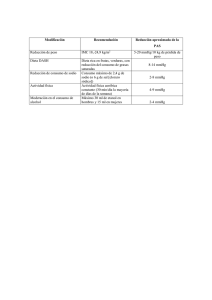
lOMoARcPSD|5822995 Práctica 3. Equilibrio LÍquido- Vapor PresiÓn DE Vapor Y EntalpÍa DE VaporizaciÓn DEL AGUA Fisicoquimica (Universidad Nacional Autónoma de México) StuDocu no está patrocinado ni avalado por ningún colegio o universidad. Descargado por jonathan perez ([email protected]) lOMoARcPSD|5822995 Universidad Nacional Autónoma de México Facultad de química Laboratorio de equilibrio y cinética 2018-2 Práctica 3. EQUILIBRIO LÍQUIDO-VAPOR PRESIÓN DE VAPOR Y ENTALPÍA DE VAPORIZACIÓN DEL AGUA Grupo: 09 Realización: 28/02/18 Profesora: Irma Susana Rojas Tome Integrantes: ● Alcaide Palapa Miriam ● Aparicio González Bibiana ● Montellano Rojas Andrea Gabriela ● Santana Anaya Atziri Nicole Descargado por jonathan perez ([email protected]) lOMoARcPSD|5822995 ➔ Problema Determinar la entalpía de vaporización del agua. H 2 O(L) → H 2 O(g) ⇒ △H m, vapor > 0 ➔ Objetivos generales Comprender e interpretar el significado de las variables termodinámicas involucradas en la ecuación de Clausius-Clapeyron, para aplicarlas en la determinación de la entalpía de vaporización de una sustancia. ➔ Objetivos específicos 1. Determinar valores de presión de vapor del agua a distintas temperaturas, para representar y describir la relación que se presenta entre ambas variables 2. Calcular la entalpía de vaporización del agua a partir de los datos experimentales y obtener la ecuación de Clausius-Clapeyron ➔ Hipótesis Si se incrementa la temperatura: ❖ El volumen experimental aumentará ❖ El volumen de aire aumentará ❖ El volumen de vapor aumentará ❖ La presión parcial del aire disminuirá ❖ La presión de vapor de agua aumentará ➔ Datos, cálculos y resultados TABLA 1. Datos experimentales y calculados para la determinación de la presión de vapor del agua en la Ciudad de México. Ciudad de México. T. inicial aire: 273,15 K V. inicial aire: 4 mL Presión atmosférica 586 mmHg Descargado por jonathan perez ([email protected]) lOMoARcPSD|5822995 Gráficas 1. Determinación de entalpía de vaporización. P vapor agua Vs Temperatura y P aire Vs temperatura Descargado por jonathan perez ([email protected]) lOMoARcPSD|5822995 Gráfica 2. Determinación de la entalpía de vaporización. Ln P vapor Vs T^-1 Gráfica 3. Gráfica de volumen experimental (agua) en función de la temperatura (K) y volumen de aire (mL) en función de la temperatura Descargado por jonathan perez ([email protected]) lOMoARcPSD|5822995 Descargado por jonathan perez ([email protected]) lOMoARcPSD|5822995 a. Determinar el volumen que ocupa el aire a cada una de las temperaturas de trabajo, aplicando la ley de Charles. Registrar los resultados en la tabla 1. Evento 2: Vaire V 2 = V 1 *T 2 T1 K) = (4 mL)(332.55 = 4.87 mL 273.15K Evento 3: Vaire V 2 = V 1 *T 2 T1 = (4 mL)(336.85 K) 273.15K = 4.93 mL Evento 4: Vaire V 2 = V 1 *T 2 T1 = (4 mL)(343.25 K) 273.15K = 5.03 mL Evento 5: Vaire V 2 = V 1 *T 2 T1 K) = 5.06 mL = (4 mL)(345.75 273.15K Evento 6: Vaire V 2 = V 1 *T 2 T1 K) = (4 mL)(346.85 = 5.08 mL 273.15K Evento 7: Vaire V 2 = V 1 *T 2 T1 = Evento 8: Vaire V 2 = V 1 *T 2 T1 K) = (4 mL)(352.75 = 5.17 mL 273.15K (4 mL)(348.15 K) 273.15K = 5.10 mL b. Determinar, por diferencia entre el volumen experimental y volumen del aire calculado en el inciso (a), el volumen que ocupa el vapor de agua dentro de la probeta, a cada una de las temperaturas registradas. Anotar los resultados en la tabla 1. V vapor = V agua l − V vapor Evento 1 V vapor = 4 − 4 = 0 mL Evento 2 V vapor = 8 − 4.87 = 3.13 mL Evento 3 V vapor = 9 − 4.93 = 4.07 mL Evento 4 V vapor = 10 − 5.03 = 4.97 mL Descargado por jonathan perez ([email protected]) lOMoARcPSD|5822995 c. Calcular la presión parcial del aire y la presión de vapor del agua, a partir de los valores de fracción mol de los componentes y de la presión total del sistema. Registrar los resultados en la tabla 1. ● Presión parcial del aire 1) Y AIRE = V aire V total = 4 mL 4 mL 2) Y AIRE = V aire V total = 4.87 mL 8 mL = 0.61 mL * 586 mmHg = 356.72 mmHg 3) Y AIRE = V aire V total = 4.93 mL 9 mL = 0.55 mL * 586 mmHg = 321.18 mmHg 4) Y AIRE = V aire V total = 5.03 mL 10 mL = 0.50 mL * 586 mmHg = 294.56 mmHg 5) Y AIRE = V aire V total = 5.06 mL 11 mL = 0.46 mL * 586 mmHg = 269.73 mmHg 6) Y AIRE = V aire V total = 5.08 mL 12 mL = 0.42 mL * 586 mmHg = 248.04 mmHg 7) Y AIRE = V aire V total = 5.10 mL 13 mL = 0.39 mL * 586 mmHg = 229.82 mmHg 8) Y AIRE = V aire V total = 5.17 mL 15 mL = 0.34 mL * 586 mmHg = 201.81 mmHg ● = 1 mL * 586 mmHg = 586 mmHg Presión parcial de vapor 1) Y V AP OR = V vapor V T otal = 0 mL 4 mL 2) Y V AP OR = V vapor V total = 3.13 mL 8 mL = 0.39 mL * 586 mmHg = 229.28 mmHg 3) Y V AP OR = V vapor V total = 4.07 mL 9 mL = 0.45 mL * 586 mmHg = 264.82 mmHg 4) Y V AP OR = V vapor V total = 4.97 mL 10 mL = 0.50 mL * 586 mmHg = 291.44 mmHg 5) Y V AP OR = V vapor V total = 5.94 mL 11 mL = 0.54 mL * 586 mmHg = 316.27 mmHg 6) Y V AP OR = V vapor V total = 6.92 mL 12 mL = 0.58 mL * 586 mmHg = 337.96 mmHg 7) Y V AP OR = V vapor V total = 7.90 mL 13 mL = 0.61 mL * 586 mmHg = 356.18 mmHg 8) Y V AP OR = V aire V total = = 0 mL * 586 mmHg = 0 mmHg 9.83 mL 15 mL = 0.66 mL * 586 mmHg = 384.19 mmHg d. Calcular el logaritmo natural de la presión de vapor y el inverso de la temperatura absoluta. Registrar los datos en la tabla 1. 1) I nP vapor = Ln(0 mmHg) = 0 mmHg 2) I nP vapor = Ln(229.28 mmHg) = 5.43 mmHg 3) I nP vapor = Ln(264.82 mmHg) = 5.58 mmHg 4) I nP vapor = Ln(291.44 mmHg) = 5.67 mmHg 5) I nP vapor = Ln(316.27 mmHg) = 5.76 mmHg 6) I nP vapor = Ln(337.96 mmHg) = 5.82 mmHg 7) I nP vapor = Ln(356.18 mmHg) = 5.88 mmHg 8) I nP vapor = Ln(384.19 mmHg) = 5.95 mmHg Descargado por jonathan perez ([email protected]) lOMoARcPSD|5822995 ➔ Análisis y discusión de resultados Podemos decir que cuando el experimento se empezó el único gas que se encontraba en la probeta era el aire conformado por diferentes gases ya que el agua aún no llegaba a su punto de ebullición provocando que no existiera vapor de agua los primeros instantes, por lo que se pudo calcular perfectamente cual era el volumen del aire contenido en la probeta. Posteriormente para medir el vapor de agua se aplicó la ley de Charles la cual nos dice que El vapor de agua= volumen experimental - volumen del aire. Para calcular la presión del vapor= volumen de vapor de agua/ volumen experimental x100 para así poder graficar las presiones de vapor contra las temperaturas. Al graficar las presiones de vapor y las temperaturas podemos observar cómo al aumentar la temperatura también se aumenta la presión resultando una relación directamente proporcional, ya que al aumentar la temperatura también se aumenta la energía cinética de las moléculas favoreciendo el cambio de estado. La relación entre el logaritmo de la presión de vapor y el inverso de la temperatura nos muestra una relación inversamente proporcional mientras el logaritmo de la presión aumenta, el inverso de la temperatura disminuye. . Mediante un análisis de regresión lineal pudimos conocer la pendiente para así obtener la entalpía de vaporización para el agua a las condiciones no estándares sino las experimentales como lo fue la presión atmosférica, este valor comparado con el valor teórico de la literatura de la entalpía de vaporización del agua es de 40.66 kJ/mol (Dean, 1972, p.1109) nos da un porcentaje de error de 38%, un valor aceptable tomando en cuenta que no tenemos las condiciones estándares con el que está reportado el de la literatura, este error también se pudo deber a errores de medición cometidos durante el desarrollo de la práctica o incluso errores de redondeo. Los resultados nos permitieron conocer un intervalo de temperatura para observar el cambio en la presión de vapor del agua, esto se pudo obtener midiendo la variación del Volumen total del sistema (Vtotal= Vaire + Vvapor)y su relación con la temperatura. Al observar nuestros resultados podemos decir que nuestras hipótesis estuvieron correctas ya que mediante las gráficas de los datos obtenidos podemos ver como el volumen experimental si aumento conforme se incrementó la temperatura, lo mismo pasó con el volumen del aire y e volumen del vapor ya que como se mencionó anteriormente se incrementa la energía cinética favoreciendo un cambio de fase. Nuestra Hipótesis sobre que la presión parcial del aire fue correcta debido a que esta disminuyó mientras se aumentó la temperatura, mientras que la presión de vapor de agua aumentó. Descargado por jonathan perez ([email protected]) lOMoARcPSD|5822995 ➔ Cuestionario Para llevar a cabo el análisis y la discusión de los resultados, se puede reflexionar sobre las preguntas siguientes, además de todos los puntos que los alumnos consideren importantes mencionar: 1. Indicar qué gases se encuentran confinados en la parte superior de la probeta a lo largo del experimento. Se encuentra la presión de vapor y el aire (N, O2, H2, C, He, etc) 2. Señalar cuál es el gas dentro de la probeta cuando la temperatura es de 0°C y explicar cuál es la utilidad de esa determinación. Se encuentra el aire ya que el vapor de agua está en una mínima cantidad o no hay, si es una mínima cantidad puede ser despreciable, por lo tanto se puede calcular el volumen de aire que existe dentro de la probeta. 3. Explicar qué tipo de relación existe entre la presión de vapor y la temperatura, de acuerdo al comportamiento que se observa en la gráfica 1. Es un comportamiento exponencial para la temperatura pues la temperatura y la presión de vapor son directamente proporcionales ya que conforme aumenta la temperatura también aumenta la presión de vapor pues es un cambio de líquido a gas. 4. Analizar qué tipo de relación se presenta entre el logaritmo natural de la presión de vapor del agua y el inverso de la temperatura absoluta (gráfica 2). Expresar la ecuación que describe el comportamiento de estos datos. En este caso es una relación inversamente proporcional a la anterior. Y=-2990.9x+14.432 5. Explicar qué información proporciona la pendiente de la ecuación establecida en el punto (4) e indicar sus unidades. In P = m= −△Hm, vapor R ( T1 ) + B −△Hm, vapor R Unidades = K 6. Calcular la entalpía de vaporización del agua a partir de la pendiente del gráfica 2. m= −△Hm, vapor R △H m, vapor = − m * R △H m, vapor = − (− 2990.9 K)(8.314 J/mol K) = 24866.3426 J/mol 7. Comparar el valor de la entalpía calculada a partir de los datos experimentales con el reportado en la literatura y calcular el por ciento de error. En caso de existir alguna diferencia, explicar a qué puede deberse. De acuerdo a la literatura el valor teórico de la entalpía de vaporización del agua es de 40.66 kJ/mol (Dean, 1972, p.1109) Descargado por jonathan perez ([email protected]) lOMoARcPSD|5822995 % error = (40.66-24.87/40.66)*100%= 38.83 J/mol de error 8. Explicar qué tipo de relación existe entre el volumen y la temperatura, de acuerdo al comportamiento que se observa en la gráfica 3. En las gráficas 3 se observa que la temperatura y el volumen son directamente proporcional, es decir, cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior). Lo que Charles descubrió que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor. (Okuda, M. 2016) Matemáticamente podemos expresarlo así: V/T=k (el cociente entre el volumen y la temperatura es constante) ➔ Conclusiones -La presión de vapor es directamente proporcional a la temperatura, debido a que entre mayor sea la temperatura se favorece el cambio de fase. -La ecuación de Clapeyron nos permite calcular la pendiente de una línea de equilibrio entre dos fases en este caso presión y temperatura de un sistema, esta expresión nos puede ayudar para predecir dónde se va a dar una transición de fase. -La presión parcial del aire disminuye, mientras que la presión de vapor de agua aumenta mientras aumenta la temperatura. ➔ Referencias consultadas ➢ John A. Dean. (1972). LANGE'S HANDBOOK OF CHEMISTRY. New York: McGRAW-HILL, INC. ➢ Okuda, M. (2016). Ley de Charles. 2018, de E+Educaplus Sitio web: http://www.educaplus.org/gases/ley_charles.html Descargado por jonathan perez ([email protected])