Serie 3. Equilibrio Líquido-Vapor 1. El benceno y el tolueno forman
Anuncio

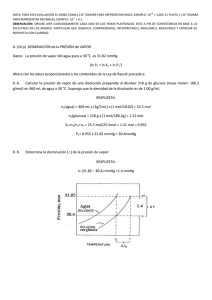
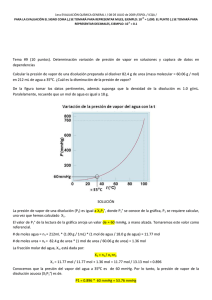
Serie 3. Equilibrio Líquido-Vapor 1. El benceno y el tolueno forman soluciones ideales. A 300 K, P0tolueno= 32.06 mmHg y P0benceno=103.01 mmHg a) Una mezcla líquida se compone de 3 moles de tolueno y 2 moles de benceno. Si la presión sobre la mezcla a 300K disminuye, ¿a qué presión se forma el vapor? b) ¿Cuál es la composición del primer vestigio de vapor formado? c) Si la presión disminuye aún más, ¿a qué presión desaparece el último vestigio de líquido? d) ¿Cuál es la composición del último vestigio de líquido? e) ¿Cuál será a presión, la composición del líquido y la composición del vapor cuando se ha evaporado 1 mol de la mezcla? 2. Dos líquidos, A y B, forman una solución ideal. A una temperatura específica, la presión de vapor de A puro es 200 mmHg, mientras que la de B puro es de 75 mmHg. Si el vapor de la mezcla consiste en 50% en mol de A, ¿cuál es el porcentaje de A en el líquido? 3. A -31.20C tenemos los datos siguientes: Compuesto Propano n-butano Presión de vapor, P0/mmHg 1200 200 a) Calcular la fracción mol de propano en la mezcla líquida que hierve a 31.20C y 760 mmHg b) Calcular la fracción mol de propano en el vapor en equilibrio con el líquido de a) 4. A – 470C la presión de vapor del bromuro de etilo es 10 mmHg, mientras que la del cloruro de etilo es de 40 mmHg. Supóngase que la mezcla es ideal. Si sólo está presente un vestigio de líquido en la fracción mol de cloruro de etilo en el vapor es 0.80 a) ¿Cuál es la presión total de la fracción mol de cloruro de etilo en el líquido? b) Si hay 5 moles de líquido y 3 moles de vapor presentes a la misma presión como en a), ¿Cuál es la composición global del sistema? 5. Una mezcla gaseosa de dos sustancias con una presión total de 0.8 atm está en equilibrio con una solución líquida ideal. La fracción mol de la sustancia A en la fase vapor es 0.5 y 0.2 en la fase líquida. ¿Cuáles son las presiones de vapor de los dos líquidos puros?