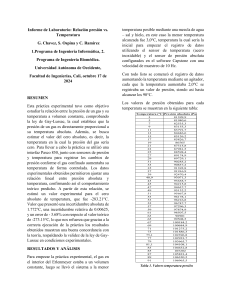
Ley de los gases ideales Ingeniería Mecatrónica Termodinamica Ingeniero Florencio Reyes Ortiz Alumno: Oscar de Jesús Hernández Flores ¿Que son los gases ideales? El gas ideal es aquel en que las moléculas o átomos no se atraen entre sí (sin interacción entre ellos, no existe atracción intermolecular), por lo que su comportamiento se puede explicar de una forma fija, y cumple una relación llamada Ley del gas ideal y la ley de charles Gay-Lussac. La presión ejercida por el gas se debe a los choques de las moléculas con las paredes del recipiente. Gas ideal: es el comportamiento que presentan aquellos gases cuyas moléculas no interactúan entre si y se mueven aleatoriamente. En condiciones normales y en condiciones estándar, la mayoría de los gases presentan comportamiento de gases ideales. Ley de los gases ideales La ley general de las Gases Ideales se expresa en la siguiente fórmula: PV=Nrt Dónde: P: presión en atmosferas (atm) 1atm = 760 mmHg. V: Volumen en litros 1l = dm3. n : número de moles. r = 0,082 atm l / K mol (es una constante, siempre la misma). T: temperatura en Kelvin (K). Para pasar de Grados Centígrados a Kelvin suma 273. Ejemplo: 25ºC= 25+273=298K Pero... si tenemos un mismo gas que cambia de presión, temperatura o volumen (pasa de un estado 1 a otro diferente 2 pero seguirá siendo el mismo gas) ¿Qué pasará....? Lo primero (P x V) / T = n x R; como las constantes n y R son las mismas en los dos estados (es el mismo gas), el término P x V / T será el mismo en los dos estados también. Por lo tanto podríamos deducir la siguiente ecuación: (P1 x V1) / T1 = (P2 x V2) / T2 Siendo el estado 1 el inicial del gas ideal y el estado 2 el final del mismo gas. De aquí deducimos las 3 leyes que cumplen todos los gases ideales de forma muy sencilla La ecuación del gas ideal se basa condensa la ley de Boyle, la de Gay-Lussac, la de Charles y la ley de Avogadro. Ley de los cambios triples Al combinar las leyes mencionadas se obtiene la ley combinada de los gases ideales o ley de los cambios triples, que establece que para una determinada cantidad de gas se cumple La ley de Charles y Gay Lussac se resume en: el volumen de una determinada cantidad de gas que se mantiene a presión constante, es directamente proporcional a su temperatura absoluta, que se expresa como V/P =CONSTANTE Para determinar los valores entre dos estados diferentes podemos emplear: Debemos tener presente que la temperatura se DEBE expresar en grados Kelvin, K. La ley de Boyle, que resume estas observaciones, establece que: el volumen de una determinada cantidad de gas, que se mantiene a temperatura constante, es inversamente proporcional a la presión que ejerce, lo que se resume en la siguiente expresión La ley de Avogadro establece que el volumen de un gas mantenido a temperatura y presión constantes, es directamente proporcional al número de moles del gas presentes Ley general del gas ideal Las leyes que hemos estudiado se cumplen cuando se trabaja a bajas presiones y temperaturas moderadas. Tenemos que: Cuando estas leyes se combinan en una sola ecuación, se obtiene la denominada ecuación general de los gases ideales: PV = nRT Donde la nueva constante de proporcionalidad se denomina R, constante universal de los gases ideales, que tiene el mismo valor para todas las sustancias gaseosas. El valor numérico de R dependerá de las unidades en las que se trabajen las otras propiedades, P, V, T y n. En consecuencia, debemos tener cuidado al elegir el valor de R que corresponda a los cálculos que estemos realizando, así tenemos: Densidad y masa molar de un gas idea La ecuación de los gases ideales permite determinar la densidad, d, y la masa molar, M, de un determinado gas ideal. Según las definiciones de densidad, d, el número de moles, n, y de la ecuación del gas ideal tenemos De donde obtenemos