Dra. Mary Maldonado de Katime
Morfología I
Medicina
UFM-Barinas
CARBOHIDRATOS
Familia de compuestos orgánicos que contienen carbono e hidrógeno. Son los compuestos
orgánicos más simples y pueden ser considerados como las sustancias principales de las que se
derivan todos los demás compuestos orgánicos. Los hidrocarburos se clasifican en dos grupos
principales, de cadena abierta y cíclica. En los compuestos de cadena abierta que contienen más
de un átomo de carbono, los átomos de carbono están unidos entre sí formando una cadena lineal
que puede tener una o más ramificaciones. En los compuestos cíclicos, los átomos de carbono
forman uno o más anillos cerrados. Los dos grupos principales se subdividen según su
comportamiento químico en saturados e insaturados.
ALCANOS
Los hidrocarburos saturados de cadena abierta forman un grupo homólogo denominado alcanos o
parafinas. La composición de todos los miembros del grupo responde a la fórmula CnH2n +2,
donde n es el número de átomos de carbono de la molécula. Los cuatro primeros miembros del
grupo son el metano, CH4, el etano, C2H6, el propano, C3H8 y el butano, C4H10. Todos los
miembros alcanos son inertes, es decir, no reaccionan fácilmente a temperaturas ordinarias con
reactivos como los ácidos, los álcalis o los oxidantes. Los primeros cuatro miembros del grupo son
gases a presión y temperatura ambiente; los miembros intermedios son líquidos, y los miembros
más pesados son semisólidos o sólidos. El petróleo contiene una gran variedad de hidrocarburos
saturados, y los productos del petróleo como la gasolina, el aceite combustible, los aceites
lubricantes y la parafina consisten principalmente en mezclas de estos hidrocarburos que varían
de los líquidos más ligeros a los sólidos.
ALQUENOS
El grupo de los alquenos u olefinas está formado por hidrocarburos de cadena abierta en los que
existe un doble enlace entre dos átomos de carbono. La fórmula general del grupo es CnH2n,
donde n es el número de átomos de carbono. Al igual que los alcanos, los miembros más bajos son
gases, los compuestos intermedios son líquidos y los más altos son sólidos. Los compuestos del
grupo de los alquenos son más reactivos químicamente que los compuestos saturados.
Reaccionan fácilmente con sustancias como los halógenos, adicionando átomos de halógeno a los
dobles enlaces. No se encuentran en los productos naturales, pero se obtienen en la destilación
destructiva de sustancias naturales complejas, como el carbón, y en grandes cantidades en las
refinerías de petróleo, especialmente en el proceso de craqueo. El primer miembro de la serie es
el eteno, C2H4. Los dienos contienen dos dobles enlaces entre las parejas de átomos de carbono
de la molécula. Están relacionados con los hidrocarburos complejos del caucho o hule natural y
son importantes en la fabricación de caucho y plásticos sintéticos. Son miembros importantes de
esta serie el butadieno, C4H6, y el isopreno, C5H8.
ALQUINOS
Los miembros del grupo de los alquinos contienen un triple enlace entre dos átomos de carbono
de la molécula. Son muy activos químicamente y no se presentan libres en la naturaleza. Forman
un grupo análogo al de los alquenos. El primero y más importante de los miembros del grupo es el
etino, C2H2. La fórmula general del grupo es CnHn donde n es el número de átomos de carbono.
HIDROCARBUROS CÍCLICOS
El más simple de los hidrocarburos cíclicos saturados o cicloalcanos es el ciclopropano, C3H6,
cuyas moléculas están formadas por tres átomos de carbono con dos átomos de hidrógeno unidos
a cada uno de ellos. El ciclopropano es un poco más reactivo que el correspondiente alcano de
cadena abierta, el propano, C3H8. Otros cicloalcanos forman parte del petróleo.
Varios hidrocarburos cíclicos insaturados, cuya fórmula general es C10H16, se encuentran en
algunos aceites naturales aromáticos y se destilan de los materiales vegetales. Esos hidrocarburos
se llaman terpenos e incluyen el pineno (en la trementina) y el limoneno (en los aceites de limón y
naranja).
El grupo más importante entre los hidrocarburos cíclicos insaturados es el de los aromáticos, que
se encuentran en el alquitrán de hulla. Aunque los hidrocarburos aromáticos presentan a veces
instauración, es decir, tienden a adicionar otras sustancias, sus principales reacciones producen la
sustitución de átomos de hidrógeno por otros tipos o grupos de átomos. Entre los hidrocarburos
aromáticos se encuentran el benceno, el tolueno, el antraceno y el naftaleno.
Éteres
Más específicamente éter etílico o etoxietano, compuesto líquido incoloro, de fórmula (C2H5)2O,
y con un punto de ebullición de 34,6 °C. Es extremamente volátil e inflamable, tiene un olor fuerte
y característico, y un sabor dulce y a quemado. El éter es casi insoluble en agua, pero se disuelve
en todas las proporciones en la mayoría de los disolventes líquidos orgánicos, como el alcohol y el
disulfuro de carbono. El éter es uno de los disolventes orgánicos más importantes y se usa con
frecuencia en el laboratorio como disolvente de grasas, aceites, resinas y alcaloides, entre otros
compuestos. La mezcla de vapor de éter y aire es muy explosiva; además, con el tiempo el éter
puede oxidarse parcialmente formando un peróxido explosivo. Por lo tanto, el éter debe
almacenarse y manejarse con mucho cuidado. Se usa principalmente como disolvente, como
materia prima para fabricar productos químicos y como anestésico.
Descubierto probablemente en el siglo XIII, el éter sigue preparándose mediante una de las
reacciones orgánicas más antiguas calentando etanol con ácido sulfúrico concentrado. Hay que
controlar cuidadosamente la temperatura para que oscile entre 130 y 150 °C, porque a
temperaturas mayores el éter reacciona produciendo gas eteno. El éter en bruto se purifica
agitándolo con agua de cal (para eliminar los contaminantes ácidos), después con cloruro de calcio
anhidro (para extraer el alcohol sin reaccionar y la mayoría del agua) y volviendo a destilar.
Aunque contiene pequeñas cantidades de agua, este éter es útil para la mayoría de las
aplicaciones, incluso para el uso quirúrgico. Si se vuelve a destilar en presencia de pentóxido de
fósforo o sodio metálico, el producto final, éter absoluto, no contiene ni agua ni alcohol.
Ésteres
En química orgánica, compuesto formado (junto con agua) por la reacción de un ácido y un
alcohol. Puesto que este proceso es análogo a la neutralización de un ácido por una base en la
formación de una sal, antiguamente los ésteres eran denominados sales etéreas. Este término es
incorrecto porque los ésteres, a diferencia de las sales, no se ionizan en disolución.
Estos compuestos se pueden obtener a partir de ácidos orgánicos y de ácidos inorgánicos. Por
ejemplo, un éster simple, el nitrato de etilo, se puede preparar a partir de etanol y ácido nítrico
(un ácido inorgánico), y el etanoato de etilo haciendo reaccionar etanol y ácido etanoico (un ácido
orgánico). Otro método de preparar ésteres es emplear no el ácido en sí, sino su cloruro. Por
ejemplo, el etanoato de etilo se puede obtener por la acción del alcohol sobre el cloruro del ácido
etanoico. Otro método importante de obtención consiste en hacer reaccionar las sales de plata de
los ácidos con un halogenuro de alquilo (normalmente de yodo). Por ejemplo, el etanoato de etilo
se puede preparar a partir de etanoato de plata y yoduro de etilo.
Los ésteres se descomponen por la acción del agua en sus correspondientes ácidos y alcoholes,
una reacción que es catalizada por la presencia de los ácidos. Por ejemplo, el etanoato de etilo se
descompone en ácido etanoico y etanol. La conversión de un ácido en un éster se denomina
esterificación. La reacción entre un éster y una base se conoce como saponificación .Cuando se
produce la descomposición de un éster por su reacción con agua, se dice que el éster ha sido
hidrolizado.
En general, los ésteres de los ácidos orgánicos son líquidos neutros, incoloros, con olor agradable e
insoluble en agua, aunque se disuelven con facilidad en disolventes orgánicos. Muchos ésteres
tienen un olor afrutado y se preparan sintéticamente en grandes cantidades para utilizarlos como
esencias frutales artificiales, como condimentos y como ingredientes de los perfumes Todas las
grasas y aceites naturales (exceptuando los aceites minerales) y la mayoría de las ceras son
mezclas de ésteres. Por ejemplo, los ésteres son los componentes principales de la grasa de res
(sebo), de la grasa de cerdo (manteca), de los aceites de pescado (incluyendo el aceite de hígado
de bacalao) y del aceite de linaza. Los ésteres de alcohol cetílico se encuentran en el espermaceti,
una cera que se obtiene del esperma de ballena, y los ésteres de alcohol miricílico en la cera de
abeja. La nitroglicerina, un explosivo importante, es el éster del ácido nítrico y la glicerina.
Los ésteres como el etanoato de isoamilo (aceite de banana), el etanoato de etilo y el etanoato de
ciclohexanol, son los principales disolventes en las preparaciones de lacas. Otros ésteres, como el
talato de dibutilo y el fosfato de tricresilo se usan como plastificadores en las lacas. El etanoato de
amilo se emplea como cebo odorífero en venenos para la langosta, y algunos de los metanoatos
son buenos fumigantes. Los ésteres tienen también importancia en síntesis orgánica.
Además, estos compuestos tienen aplicaciones médicas importantes. El nitrito de etilo es diurético
y antipirético. El nitrito de amilo se usa en el tratamiento del asma bronquial y de las convulsiones
epilépticas, y como antiespasmódico. La nitroglicerina y el nitrito de amilo producen la dilatación
de los vasos sanguíneos, disminuyendo por tanto la presión sanguínea. El chaulmugrato de etilo se
ha empleado en el tratamiento de la enfermedad de Hansen. El sulfato de dimetilo (utilizado con
frecuencia en síntesis orgánica como agente desnaturalizador) y el sulfato de dietilo son
extremamente peligrosos en forma de vapor, y deben ser manejados con cuidado.
Amidas
Cada uno de los compuestos orgánicos que se pueden considerar derivados de un ácido
carboxílico por sustitución del grupo —OH del ácido por un grupo —NH2, —NHR o —NRRð (siendo
R y Rð radicales orgánicos). Formalmente también se pueden considerar derivados del amoníaco,
de una amina primaria o de una amina secundaria por sustitución de un hidrógeno por un radical
ácido, dando lugar a una amida primaria, secundaria o terciaria, respectivamente.
Todas las amidas, excepto la primera de la serie, son sólidas a temperatura ambiente y sus puntos
de ebullición son elevados, más altos que los de los ácidos correspondientes. Presentan excelentes
propiedades disolventes y son bases muy débiles. Uno de los principales métodos de obtención de
estos compuestos consiste en hacer reaccionar el amoníaco (o aminas primarias o secundarias)
con ésteres.
Las amidas son comunes en la naturaleza, y una de las más conocidas es la urea, una diamida que
no contiene hidrocarburos. Las proteínas y los péptidos están formados por amidas. Un ejemplo
de poliamida de cadena larga es el nailon. Las amidas también se utilizan mucho en la industria
farmacéutica.
Aminas
Nombre que reciben los compuestos producidos a menudo en la descomposición de la materia
orgánica, que se forman por sustitución de uno o varios átomos de hidrógeno del amoníaco por
grupos orgánicos.
El número de grupos orgánicos unidos al átomo de nitrógeno determina que la molécula sea
clasificada como amina primaria (un grupo orgánico), secundaria (dos grupos) o terciaria (tres
grupos).
La mayoría de las aminas tienen un olor desagradable y son solubles en agua. Sus puntos de
ebullición son superiores a los hidrocarburos de análoga masa molecular e inferiores a los
correspondientes alcoholes.
Las aminas tienen carácter básico; son bases más fuertes que el agua y, en general, que el
amoníaco. El principal método de obtención de estos compuestos es la reacción entre el amoníaco
y un halogenuro de alquilo .Una de las aminas más importantes es la anilina, la amina aromática
más sencilla.
ALCOHOL
1. Alcohol, término aplicado a los miembros de un grupo de compuestos químicos del carbono
que contienen el grupo OH. Dicha denominación se utiliza comúnmente para designar un
compuesto específico: el alcohol etílico o etanol. Proviene de la palabra árabe al-kuhl, o kohl, un
polvo fino de antimonio que se utiliza para el maquillaje de ojos. En un principio, el término
alcohol se empleaba para referirse a cualquier tipo de polvo fino, aunque más tarde los
alquimistas de la Europa medieval lo utilizaron para las esencias obtenidas por destilación,
estableciendo así su acepción actual.
Los alcoholes tienen uno, dos o tres grupos hidróxido (-OH) enlazados a sus moléculas, por lo que
se clasifican en monohidroxílicos, dihidroxílicos y trihidroxílicos respectivamente. El metanol y el
etanol son alcoholes monohidroxílicos. Los alcoholes también se pueden clasificar en primarios,
secundarios y terciarios, dependiendo de que tengan uno, dos o tres átomos de carbono
enlazados con el átomo de carbono al que se encuentra unido el grupo hidróxido. Los alcoholes se
caracterizan por la gran variedad de reacciones en las que intervienen; una de las más importantes
es la reacción con los ácidos, en la que se forman sustancias llamadas ésteres, semejantes a las
sales inorgánicas. Los alcoholes son subproductos normales de la digestión y de los procesos
químicos en el interior de las células, y se encuentran en los tejidos y fluidos de animales y plantas.
2. METANOL
El alcohol de madera, alcohol metílico o metanol, de fórmula CH3OH, es el más simple de los
alcoholes. Antes se preparaba por destilación destructiva de la madera, pero hoy en día casi todo
el metanol producido es de origen sintético, elaborado a partir de hidrógeno y monóxido de
carbono. El metanol se utiliza para desnaturalizar alcohol etílico, como anticongelante, disolvente
para gomas y lacas, así como en la síntesis de compuestos orgánicos como el metanal
(formaldehído). Al ser ingerido en forma líquida o inhalada en vapor, el metanol puede resultar
peligroso. Tiene un punto de fusión de -97,8 °C y un punto de ebullición de 64,7 °C. Su densidad
relativa es de 0,7915 a 20 °C.
3. ETANOL
El alcohol de vino, alcohol etílico o etanol, de fórmula C2H5OH, es un líquido transparente e
incoloro, con sabor a quemado y un olor agradable característico. Es el alcohol que se encuentra
en bebidas como la cerveza, el vino y el brandy. Debido a su bajo punto de congelación, ha sido
empleado como fluido en termómetros para medir temperaturas inferiores al punto de
congelación del mercurio, -40 °C, y como anticongelante en radiadores de automóviles.
Normalmente el etanol se concentra por destilación de disoluciones diluidas. El de uso comercial
contiene un 95% en volumen de etanol y un 5% de agua. Ciertos agentes deshidratantes extraen el
agua residual y producen etanol absoluto. El etanol tiene un punto de fusión de -114,1 °C, un
punto de ebullición de 78,5 °C y una densidad relativa de 0,789 a 20 °C.
Desde la antigüedad, el etanol se ha obtenido por fermentación de azúcares. Todas las bebidas
con etanol y casi la mitad del etanol industrial aún se fabrican mediante este proceso. El almidón
de la patata (papa), del maíz y de otros cereales constituye una excelente materia prima. La
enzima de la levadura, la cimasa, transforma el azúcar simple en dióxido de carbono. La reacción
de la fermentación, representada por la ecuación
C6H12O6! 2C2 H5OH + 2CO2
Es realmente compleja, ya que los cultivos impuros de levaduras producen una amplia gama de
otras sustancias, como el aceite de fusel, la glicerina y diversos ácidos orgánicos. El líquido
fermentado, que contiene de un 7 a un 12% de etanol, se concentra hasta llegar a un 95%
mediante una serie de destilaciones. En la elaboración de ciertas bebidas como el whisky y el
brandy, algunas de sus impurezas son las encargadas de darle su característico sabor final. La
mayoría del etanol no destinado al consumo humano se prepara sintéticamente, tanto a partir del
etanal (acetaldehído) procedente del etino (acetileno), como del eteno del petróleo. También se
elabora en pequeñas cantidades a partir de la pulpa de madera.
La oxidación del etanol produce etanal que a su vez se oxida a ácido etanoico. Al deshidratarse, el
etanol forma dietiléter. El butadieno, utilizado en la fabricación de caucho sintético, y el
cloroetano, un anestésico local, son otros de los numerosos productos químicos que se obtienen
del etanol. Este alcohol es miscible (mezclable) con agua y con la mayor parte de los disolventes
orgánicos. Es un disolvente eficaz de un gran número de sustancias, y se utiliza en la elaboración
de perfumes, lacas, celuloides y explosivos. Las disoluciones alcohólicas de sustancias no volátiles
se denominan tinturas. Si la disolución es volátil recibe el nombre de espíritu.
4. ALCOHOLES SUPERIORES Los alcoholes superiores, de mayor masa molecular que el etanol,
tienen diversas aplicaciones tanto específicas como generales: el propanol se usa como alcohol
para frotar y el butanol como base para perfumes y fijadores. Otros constituyen importantes
condimentos y perfumes.
Cetonas
Cada uno de los compuestos orgánicos que contienen el grupo carbonilo (CO) y que responden a
la fórmula general R—CO—Rð, en la que R y Rð representan radicales orgánicos.
Al grupo carbonilo se debe la disolución de las cetonas en agua. Son compuestos relativamente
reactivos, y por eso resultan muy útiles para sintetizar otros compuestos; también son productos
intermedios importantes en el metabolismo de las células. Se obtienen a partir de los alcoholes
secundarios.
La cetona más simple, la propanona o acetona, CH3COCH3, es un producto del metabolismo de las
grasas, pero en condiciones normales se oxida rápidamente a agua y dióxido de carbono. Sin
embargo, en la diabetes mellitus la propanona se acumula en el cuerpo y puede ser detectada en
la orina. Otras cetonas son el alcanfor, muchos de los esteroides, y algunas fragancias y azúcares.
Ácidos Grasos
Nombre común de un grupo de ácidos orgánicos, con un único grupo carboxilo (ðCOOH), entre los
que se encuentran los ácidos saturados (hidrogenados) de cadena lineal producidos por la
hidrólisis de las grasas. El grupo incluye asimismo todos los demás ácidos saturados de cadena
lineal e incluso ácidos con cadena ramificada o estructura cíclica. Los ácidos grasos pueden ser
también no saturados o insaturados, es decir, pueden presentar dobles enlaces. El ácido
metanoico (fórmico), HCOOH, y el ácido etanoico (acético), CH3COOH, son los ácidos grasos más
simples. Ambos tienen sabor amargo, irritan la piel y tienen un olor penetrante. Otros ácidos
grasos saturados con estructura más complicada son el butanoico, el hexanoico y el octanoico,
todos con un olor desagradable. Los ácidos esteárico y palmítico son materiales grasientos que
tienen poco olor. Ejemplos de ácidos grasos insaturados son el ácido oleico y el linoleico, ambos
líquidos oleosos, incoloros o amarillentos. Una fuente cada vez más importante de ácidos grasos
es el tallol, un subproducto obtenido en la fabricación de la pasta de papel con madera de pino.
Los ácidos grasos se utilizan para fabricar detergentes biodegradables, lubricantes y espesantes
para pinturas. El ácido esteárico se emplea para combinar caucho o hule con otras sustancias,
como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del
caucho; también se usa en la polimerización de estireno y butadieno para hacer caucho artificial.
Entre los nuevos usos de los ácidos grasos se encuentran la flotación de menas y la fabricación de
desinfectantes, secadores de barniz y estabilizadores de calor para las resinas de vinilo. Los ácidos
grasos se utilizan también en productos plásticos, como los recubrimientos para madera y metal, y
en los automóviles, desde el alojamiento del filtro de aire hasta la tapicería.
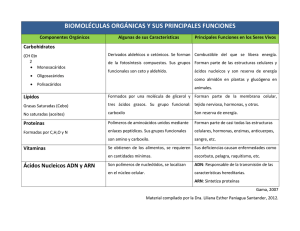
Ácidos Nucleicos
Moléculas muy complejas que producen las células vivas y los virus. Reciben este nombre porque
fueron aisladas por primera vez del núcleo de células vivas. Sin embargo, ciertos ácidos nucleicos
no se encuentran en el núcleo de la célula, sino en el citoplasma celular. Los ácidos nucleicos
tienen al menos dos funciones: transmitir las características hereditarias de una generación a la
siguiente y dirigir la síntesis de proteínas específicas. El modo en que los ácidos nucleicos realizan
estas funciones es el objetivo de algunas de las más prometedoras e intensas investigaciones
actuales. Los ácidos nucleicos son las sustancias fundamentales de los seres vivos, y se cree que
aparecieron hace unos 3.000 millones de años, cuando surgieron en la Tierra las formas de vida
más elementales. Los investigadores han aceptado que el origen del código genético que portan
estas moléculas es muy cercano en el tiempo al origen de la vida en la Tierra .Los bioquímicos han
conseguido descifrarlo, es decir, determinar la forma en que la secuencia de los ácidos nucleicos
dicta la estructura de las proteínas.
Las dos clases de ácidos nucleicos son el ácido desoxirribonucleico (ADN) y el ácido ribonucleico
(ARN). Tanto la molécula de ARN como la molécula de ADN tienen una estructura de forma
helicoidal. Su peso molecular es del orden de millones. A las cadenas se les unen una gran
cantidad de moléculas más pequeñas (grupos laterales) de cuatro tipos diferentes. La secuencia de
estas moléculas a lo largo de la cadena determina el código de cada ácido nucleico particular. A su
vez, este código indica a la célula cómo reproducir un duplicado de sí misma o las proteínas que
necesita para su supervivencia.
Todas las células vivas codifican el material genético en forma de ADN. Las células bacterianas
pueden tener una sola cadena de ADN, pero esta cadena contiene toda la información necesaria
para que la célula produzca unos descendientes iguales a ella. En las células de los mamíferos las
cadenas de ADN están agrupadas formando cromosomas. En resumen, la estructura de una
molécula de ADN, o de una combinación de moléculas de ADN, determina la forma y la función de
la descendencia. Algunos virus, llamados retrovirus, sólo contienen ARN en lugar de ADN, pero los
virus no suelen considerarse verdaderos organismos vivos.
La investigación pionera que reveló la estructura general del ADN fue llevada a cabo por los
biofísicos británicos Francis Crick, Maurice Wilkins y Rosalind Franklin, y por el bioquímico
estadounidense James Watson. Utilizando una fotografía de una difracción de rayos X de la
molécula de ADN obtenida por Wilkins en 1951, Watson y Crick elaboraron un modelo de la
molécula de ADN, que fue completado en 1953. La estructura del ARN fue descrita por el científico
español Severo Ochoa y por el bioquímico estadounidense Arthur Kornberg. Ambos sintetizaron
ADN a partir de distintas sustancias. Este ADN tenía una estructura similar a la del ADN natural,
pero no era biológicamente activo. Sin embargo, en 1967 junto con un equipo de investigadores
de la Universidad de Stanford (EEUU) consiguieron sintetizar ADN biológicamente activo a partir
de reactivos muy sencillos.
Ciertos tipos de ARN tienen una función diferente de la del ADN. Toman parte en la síntesis de las
proteínas que una célula produce. Esto es muy interesante para los virólogos, puesto que muchos
virus se reproducen obligando a las células huésped a sintetizar más virus. El virus inyecta su
propio ARN en el interior de la célula huésped, y ésta obedece el código del ARN invasor en lugar
de obedecer al suyo propio. De este modo, la célula produce proteínas que son, de hecho, víricas
en lugar de las proteínas necesarias para el funcionamiento celular. La célula huésped es destruida
y los virus recién formados son libres para inyectar su ARN en otras células huésped.
Se ha determinado la estructura y la función en la síntesis de proteínas de dos tipos de ARN. El
químico indio nacionalizado estadounidense Har Gobind Khorana ha realizado importantes
investigaciones sobre la interpretación del código genético y su papel en la síntesis de proteínas.
En 1970 realizó la primera síntesis completa de un gen y repitió su logro en 1973. Desde entonces
se ha sintetizado un tipo de ARN y se ha demostrado que en algunos casos el ARN puede funcionar
como un verdadero catalizador.
Aldehído
Son compuestos orgánicos caracterizados por poseer el grupo funcional -CHO (formilo). Un grupo
formilo es el que se obtiene separando un átomo de hidrógeno del formaldehído.
Nomenclatura de Aldehídos y Cetonas - Reglas IUPAC
Regla 1. Los aldehídos se nombran reemplazando la terminación -ano del alcano correspondiente
por -al. No es necesario especificar la posición del grupo aldehído, puesto que ocupa el extremo de
la cadena (localizador 1).
Cuando la cadena contiene dos funciones aldehído se emplea el sufijo -dial.
Regla 2. El grupo -CHO se denomina -carbaldehído. Este tipo de nomenclatura es muy útil cuando
el grupo aldehído va unido a un ciclo. La numeración del ciclo se realiza dando localizador 1 al
carbono del ciclo que contiene el grupo aldehído.
Regla 3. Cuando en la molécula existe un grupo prioritario al aldehído, este pasa a ser un
sustituyente que se nombra como oxo- o formil-.
{nota}Tanto -carbaldehído como formil- son nomenclaturas que incluyen el carbono del grupo
carbonilo. -carbaldehído se emplea cuando el aldehído es grupo funcional, mientras que formil- se
usa cuando actúa de sustituyente.{/nota}
Regla 4. Algunos nombres comunes de aldehídos aceptados por la IUPAC son:
Regla 5. Las cetonas se nombran sustituyendo la terminación -ano del alcano con igual longitud de
cadena por -ona. Se toma como cadena principal la de mayor longitud que contiene el grupo
carbonilo y se numera para que éste tome el localizador más bajo.
Regla 6. Existe un segundo tipo de nomenclatura para las cetonas, que consiste en nombrar las
cadenas como sustituyentes, ordenándolas alfabéticamente y terminando el nombre con la palabra
cetona.
Regla 7. Cuando la cetona no es el grupo funcional de la molécula pasa a llamarse oxo-.
La mayoría de los aldehídos son solubles en agua y presentan puntos de ebullición elevados. El
grupo carbonilo les proporciona una gran reactividad desde el punto de vista químico; dan ácidos
carboxílicos con mucha facilidad. Los aldehídos se obtienen a partir de los alcoholes primarios,
controlando el proceso para evitar que el aldehído pase a ácido.
Estos compuestos están presentes en muchas frutas, siendo responsables de su olor y sabor
característicos, y tienen mucha importancia en la fabricación de plásticos, tintes, aditivos y otros
compuestos químicos. Los dos primeros de la serie son el metanal y el etanal.
REFERENCIAS
PETERSON, W.R. Formulación y Nomenclatura Química Orgánica (6ta edición). Barcelona-España:
Eunibar-editorial universitaria de Barcelona. pp. 98-1
↑ Fieser, Louis F.; Fieser, Mary (1981). Química orgánica fundamental. Reverte. ISBN
9788429171617. Consultado el 18 de noviembre de 2017.