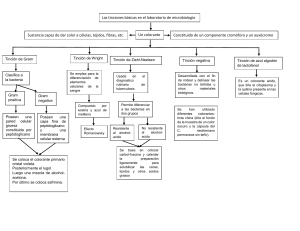
TÉCNICAS EN PATOLOGÍA AUXILIAR: LEIDY SUSY CASTELLON SANCHEZ LABORATORIO CLÍNICO – U.M.S.A 12- TINCION O COLORACION UNIVERSAL La tinción del corte permite estudiar y conocer las características físicas y químicas de los tejidos y las relaciones entre las células que la constituyen. La diferencia de tinción puede explicarse, por las variaciones de estructuras de la composición celular y de los tejidos y tinción más ordinaria y de rutina utilizada en histopatología es la hematoxilina y eosina. Los colorantes son los elementos principales de las tinciones generales. La molécula de un colorante tiene normalmente dos componentes importantes: uno que aporta el color, denominado cromógeno, y otro que posibilita la unión a elementos del tejido denominado auxocromo El auxocromo puede ser un grupo inonizable, un grupo que reacciona covalentemente con iones metálicos (mordientes) o puede reaccionar covalentemente con el sustrato, en este caso el tejido. Los colorantes son normalmente hidrosolubles, aunque hay colorantes que carecen de grupos ionizables y sirven para teñir sustancias grasas, como gotas de lípidos. TIPOS DE COLORANTES Básicos: son sales en las que la base, normalmente una amina, aporta el color, mientras que la parte ácida es incolora. Es decir, con colorantes catiónicos. Tienen apetencia por sustancias ácidas del tejido como el ADN o ciertos componentes de la matriz extracelular como los glicosaminoglicanos. La unión es por atracción eléctrica. Así, ponen de manifiesto el núcleo y el ARN, sobre todo el ARNr presente en los ribosomas por ser muy abundante, así como ciertas matrices extracelulares ricas en componentes ácidos. Ejemplos de colorantes básicos son la tionina, safranina, azul de toluidina, el azul de metileno o la hematoxilina. Ácidos: son sales con el anión coloreado y la base incolora. Son derivados de grupos sulfónicos, carboxilos o hidroxilos fenólicos. Tienen apetencia por sustancias básicas, sobre todo estructuras proteicas localizadas en el citoplasma celular y también por el colágeno de la matriz extracelular. La unión es por atracción eléctrica. Ejemplos de colorantes ácidos son la fucsina ácida, verde rápido, naranja G o la eosina. Porque donde esté vuestro tesoro, allí estará también vuestro corazón Mateo 6:21 1 TÉCNICAS EN PATOLOGÍA AUXILIAR: LEIDY SUSY CASTELLON SANCHEZ LABORATORIO CLÍNICO – U.M.S.A Colorantes mordientes: son aquellos que se usan en combinación con sales metálicas, que actúan como mordiente. Estas sales se pueden emplear junto con el colorante, antes o después. En algunos casos el colorante mordiente puede ser también aniónico o, menos frecuentemente, catiónico. Normalmente se emplean para teñir los núcleos. Por ejemplo, la hematoxilina férrica de Heidenhain Neutros: poseen una porción ácida y otra básica, ambas con capacidad para aportar color. Por tanto un mismo colorante puede teñir tanto las partes básicas como las ácidas de los tejidos. Por ejemplo, el eosinato de azul de metileno. Indiferentes o hidrofóbicos: realmente no se unen a elementos de los tejidos por afinidad química sino porque se disuelven en ellos. Por ejemplo, el colorante sudán se disuelve en los lípidos y por tanto teñirá a las gotas de lípidos, especialmente en los adipocitos. Tinción especifica. Esta tinción es la base de la histoquímica es la identificación de ciertas estructuras o substancias químicas. Estas reacciones son especificas a las substancias correspondientes a la células y los tejidos ej. : rojo de aceite para tinción grasa método con la hematoxilina de Weigert específica para la detección de fibras elásticas el método de Best para la detección de glucógeno el método de PAS es específico para mucopolisacaridos. TINCIÓN UNIVERSAL Es la que se utiliza para todo tipo de tejidos y para todo examen de rutina en un laboratorio patológico. La hematoxilina es un colorante natural que se extrae del corazón o duramen del árbol llamado hematoxylon campechiaum. Este árbol se encontró por primera vez en la región de Campeche cuyos habitantes conocían muy bien sus propiedades tintoriales cuando los árboles crecen durante 10 años estos se cortan y se quita la corteza y la madera de capas externas y el corazón se corta alrededor de un metro a los que se llama palos de campeche se los corta en trozos para la extracción del colorante obtenido así se los utiliza no solamente en microscopía sino también en la industria textil. Durante muchos años fue utilizado en la industria textil hasta que Ball Deber le dio el uso en histopatologia en el año 1862. El extracto natural que se obtiene de la madera se denomina hematoxilon siendo esta una sustancia no activa primeramente debe ser oxidado o dar lugar a la sustancia llamada hemateina. Porque donde esté vuestro tesoro, allí estará también vuestro corazón Mateo 6:21 2 TÉCNICAS EN PATOLOGÍA AUXILIAR: LEIDY SUSY CASTELLON SANCHEZ LABORATORIO CLÍNICO – U.M.S.A Método de coloración con la hematoxilina. Se siguen dos modalidades La tinción progresiva consiste en obtener una coloración adecuada controlando el tiempo de la sección en el colorante, de modo que a más tiempo más coloración. La tinción regresiva consiste en la eliminación lenta de colorante de una tinción que ha sido teñida en exceso. Esta eliminación se consigue normalmente con soluciones alcohólicas y al proceso se le denomina desteñido. La concentración de la solución y tiempo de diferenciación nos aporta la coloración adecuada. CLASES DE HEMATOXILINA: HEMATOXILINA DE MAYER Disolvente hematoxilina 1g Mordiente alumbre de potasio 1000g Subs oxidante yodato de sodio 0,2g Preservador hidrato cloral 5.0g Ácido cítrico 1g Preparación. Se diluye primeramente el alumbre de K en 800cc de agua destilada con la ayuda del calor en otro preferiblemente en un mortero disolvemos la hematoxilina con agua destilada se juntan estas dos preparaciones hasta que hierba la solución una vez que ha hervido se lleva a un recipiente de agua fría. Una vez enfriado se coloca el hidrato cloral, el ácido cítrico el yodato de sodio se mezcla bien todos los componentes y se procede a filtrar con papel grueso se guarda en frascos herméticos de color ámbar no es necesario que este en refrigeración se lo debe guardar en lugar oscuro. La hematoxilina de Mayer es el colorante específico que acompaña a la reacción PAS. Porque donde esté vuestro tesoro, allí estará también vuestro corazón Mateo 6:21 3 TÉCNICAS EN PATOLOGÍA AUXILIAR: LEIDY SUSY CASTELLON SANCHEZ LABORATORIO CLÍNICO – U.M.S.A HEMATOXILINA DE CARAZZI Hematoxilina 0,5 a 2g Agua destilada 400mL Yodato de sodio 0,1g Alumbre de K y Al 25g Alcohol absoluto 10mL Glicerina 100mL Preparación Solución a disolver al alumbre de potasio y aluminio en agua destilada en un Erlen Meyer y llevar al calor. Solución b disolver la hematoxilina o polvo de hematoxilina en el alcohol absoluto. Juntas las dos soluciones a y b previamente enfriar para que actúen el oxidaste yodato de sodio y finalmente echar la glicerina para su conservación. HEMATOXILINA DE HARRIS Hematoxilina 1g Agua destilada 200cc Alumbre de K y Al 20g Alcohol absoluto 10cc Amarillo oxido 0.5g Rojo de Hg Preparación Solución a mezclar el alumbre de potasio y aluminio con agua destilada y calentar. Solución b Disolver la Hematoxilina con el alcohol. Mezclar las 2 soluciones a y b llevar a ebullición, enfriar y agregar poco a poco el óxido rojo de Hg sino se cuenta con el óxido rojo de Hg se puede usar también el óxido amarillo de Hg Porque donde esté vuestro tesoro, allí estará también vuestro corazón Mateo 6:21 4 TÉCNICAS EN PATOLOGÍA AUXILIAR: LEIDY SUSY CASTELLON SANCHEZ LABORATORIO CLÍNICO – U.M.S.A EOSINA Preparación de la eosina alcohólica. Esta compuesta por: Solución stock o madre: Colorante de eosina yellow (amarillo) 1-5 g Agua destilada 20 ml Alcohol absoluto 80 ml Se puede usar de 1-5 g para solución stock, dependiendo la acción de la eosina. Solución trabajo: Solución stock 25 ml Alcohol (absoluto) 80% 75 ml La solución stock, se la preserva añadiendo unas gotas de cristales de timol, o algunas gotas de formol al 10%. Como colorante, citoplasmatico también se puede utilizar a la safranina, que es de constitución alcohólica. La eosina llamada también colorante de contraste o secundaria, es aquella que se va a fijar directamente al citoplasma de las células. BATERIA DE TINCION.- Es un conjunto de frascos o cubetas que contengan sustancias que nos ayuden con la tinción y entre esta batería podemos encontrar el Xilol y Alcoholes. Procedimiento de tinción. Una vez obtenido el corte, esta se lleva a la fase de coloración o tinción en el primer lugar por el método de tinción universal formada por: Porque donde esté vuestro tesoro, allí estará también vuestro corazón Mateo 6:21 5 1er COLORANTE HIDRATACION DESPARAFINADO PROCEDIMIENTO PARA LA TINCION XILOL TIEMPO TÉCNICAS EN PATOLOGÍA AUXILIAR: LEIDY SUSY CASTELLON SANCHEZ 20 mi n OBJETIVOS RESULTADOS Elimina de manera progresiva la parafina existente al realizar la inclusión. Tiene la capacidad para disolver el poliestileno de la parafina (después de la diafinizacion). Fortalecer al tejido de tal manera que se encuentre activa para la inmersión en el colorante hídrico. Rehidratar la muestra de tejido de manera decreciente de tal manera que se encuentre activa al momento de captar los colorantes. El componente activo de la hemateina que contiene cargas negativas lograra la atracción necesaria para la oxidación. XILOL 20 mi n ALCOHOL ABSOLUTO 100% 2 mi n ALCOHOL CORRIENTE 90% 2 mi n ALCOHOL CORRIENTE 80% 2 mi n HEMATOXILINA Tiñe a todas las estructuras que 5-7 contienen acido de mi color morado (como n el ácido desoxirribonucleico del núcleo). DIFERENCIADO R AGUA CORRIENTE DIFERENCIADO R ALCALINO LABORATORIO CLÍNICO – U.M.S.A Quita el exceso de colorante 30 se g Mordiente que suministra cargas (+), que actúan Fijar el colorante como puentes químicos nuclear, dando color a para unirse a las cargas (la hematoxilina ) de la hemateina graba el color en las células. Porque donde esté vuestro tesoro, allí estará también vuestro corazón Mateo 6:21 6 2do COLORANTE TÉCNICAS EN PATOLOGÍA AUXILIAR: LEIDY SUSY CASTELLON SANCHEZ DIFERENCIADO R ACIDO 30 se g EOSINA Colorear componentes y orgánulos 1-3 citoplasmáticos mi colágeno y fibras n musculares y todo componente acidofilo o eosinofilo. ACLARADOR DESHIDRATACION ALCOHOL 2 CORRIENTE 80 mi % n ALCOHOL CORRIENTE 90 2 % mi ALCOHOL n ABSOLUTO 100% XILOL XILOL 5 mi n LABORATORIO CLÍNICO – U.M.S.A Estabiliza al colorante Incrementa la precisión y al mismo tiempo de la tinción nuclear. previene la oxidación. Compuesto acido basado en su polaridad negativa para adherirse a células de carga positiva. Deshidrata y evita la contaminación con Retira todas las hongos. moléculas de agua al punto de secado, con el fin de mantener y las Deshidratar la preservar muestra del tejido de características tintoriales del tejido después de la manera creciente. coloración. Aclarante Aclara el tejido terminado para la observación en el microscopio manteniendo su contraste. Porque donde esté vuestro tesoro, allí estará también vuestro corazón Mateo 6:21 7 TÉCNICAS EN PATOLOGÍA AUXILIAR: LEIDY SUSY CASTELLON SANCHEZ LABORATORIO CLÍNICO – U.M.S.A RESULTADOS: • Núcleos: • Citoplasma: Rosado • Glóbulos Naranja o rojo Porque donde esté vuestro tesoro, allí estará también vuestro corazón Mateo 6:21 Morado Rojos: 8 TÉCNICAS EN PATOLOGÍA AUXILIAR: LEIDY SUSY CASTELLON SANCHEZ LABORATORIO CLÍNICO – U.M.S.A Porque donde esté vuestro tesoro, allí estará también vuestro corazón Mateo 6:21 9