MICROSCOPÍA ÓPTICA. INTRODUCCION
Anuncio

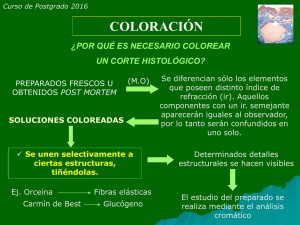
MICROSCOPÍA ÓPTICA. INTRODUCCION Microscopio es una palabra derivada del griego cuyo significado literal es visión de lo pequeño; como bien lo indica su nombre, nos permite visualizar elementos que a simple vista no son visibles, o difícil de ver en detalle. La utilización de lentes para observar elementos aumentados se conocía desde tiempos de Arquímedes, pero la óptica como disciplina se vino a desarrollar durante el siglo XIII con el monje franciscano Roger Bacon. La invención del microscopio compuesto (combinación de varias lentes) permitió el desarrollo de la microscopía y de avances en materia como la botánica y la biología celular; su invención se atribuye a diversos personajes históricos como Hans y Zacharias Janssen, Galileo Galilei, Cornelius Drebbel, Robert Hooke y Anton van Leeuwenhoek, siendo Hooke, en el año 1655, quien describe las primeras células (celdas) en cortes de corcho, y van Leeuwenhoek, en el año 1674, quien descubre a protozoos y posteriormente bacterias, a los que llamó animalículos. Actualmente el microscopio es un instrumento de uso cotidiano en laboratorios de diagnóstico y de investigación, en diversas áreas como la bacteriología, patología, micología y, como en nuestro caso, en la histología. Por esto es necesario conocer sus componentes y principios de funcionamiento. Sistema de iluminación: fuente de luz, filtros y diafragma. Sistema mecánico: base, brazo, platina, tornillos, revolver, tubo y cabezal. Sistema óptico: condensador, objetivos, prismas y oculares. Conceptos importantes en microscopía • Escala de reproducción: es la relación lineal que existe entre el tamaño del objeto y su imagen. Por ejemplo, 4:1, 10:1, 40:1. • Aumento: es la proporción entre el tamaño de la imagen observada al microscopio y el tamaño real del objeto. Aumento total se calcula multiplicando aumento de ocular por el del objetivo. • Distancia frontal: distancia entre el objeto observado y la lente del objetivo utilizado, cuando se encuentra bien enfocada la muestra. Es inversamente proporcional al aumento. • Profundidad de campo o de foco, o poder de penetración: espesor del preparado que se observa con nitidez, o profundidad de planos que están en foco en un momento dado. Con aumentos más grandes se observa sólo pequeños espesores con nitidez, mientras que por arriba y debajo de estos la imagen se desvanece; por lo tanto también es inversa al aumento. 1 • Campo observado: porción del preparado incluida en la imagen. Su tamaño también es inverso al aumento utilizado y va determinado por el área de campo visual de cada objetivo. • Poder de resolución (PR): capacidad de los lentes de mostrar separados con nitidez dos puntos. Si el PR es mayor quiere decir que la distancia que separa estos dos puntos es menor. Por lo tanto da una imagen más detallada. • Límite de resolución: distancia mínima que debe existir para que dos puntos del objeto se visualicen por separado. • Apertura numérica: medida de la capacidad del microscopio de agrupar las refracciones de la luz producidas por los finos detalles del objeto. Es propia de cada objetivo. Actividades • De acuerdo a los conocimientos que usted posee sobre los microscopios ópticos, señale las estructuras que lo conforman y la función de cada una de estas partes. • ¿Qué partes del microscopio permiten una adecuada iluminación de la muestra? • ¿Hacia donde debe dirigirse la luz de la lámpara? ¿Por qué? • ¿Qué se puede colocar en el portafiltros y con que finalidad? • ¿Cómo varía la iluminación al abrir y cerrar el diafragma? • ¿Qué características posee la imagen final del microscopio compuesto? • ¿Cómo se mueve la imagen al desplazar el portaobjetos? • ¿Por qué se debe centrar en el campo de observación el objeto que se desea estudiar con aumentos mayores? • Complete el cuadro N°1 con los datos que se le piden. • Averigûe los tipos de microscopios electrónicos que existen y las características de ellos. • Complete el cuadro N°2. Cuadro N°1 Objetivo Aumento objetivo Aumento ocular Aumento total DCV Cuadro N°2 MO MEB MET Fuente de energía Uso de vacío Lentes usadas Células vivas/muertas Portaobjetos usados Imagen (BN/color) Aumento total Límite de resolución • Nombre las partes del microscopio óptico. ___________________________________________________________________ Más información en: http://www.qb.fcen.uba.ar/microinmuno/SeminarioMicroscopia.htm 2 TÉCNICAS DE PREPARACIÓN HISTOLÓGICAS. Se denomina técnica histológica a todo aquel conjunto de procedimientos aplicados a un material biológico con la finalidad de conferirle las condiciones óptimas para observar, examinar y analizar sus componentes morfológicos a través del microscopio óptico o electrónico. Se pueden distinguir dos tipos de procedimientos: • Inmediatos o vitales: en los que la muestra a observar se encuentra en el mismo líquido de su hábitat (linfa, suero sanguíneo, agua de estanque, etc), o bien, en algún medio que lo reemplace (solución salina balanceada). Así, es posible observar las células aún vivas, como protozoos, células descamadas o disociadas, estructuras delgadas o translúcidas, sin necesidad de tinciones (observación al estado fresco); hay casos en que la observación de alguna estructura celular específica se facilita con colorantes inocuos para las células, sin modificar su estructura o función (coloración vital).algunos ejemplos de estos colorantes son: tinta china, carmín de litio, azul tripan, verde de Jano, rojo neutro, azul de metileno o naranja de acridina. • Mediatos o postvitales: permiten observar células de seres vivos que han detenido sus procesos vitales y es necesario conservar su estructura. Para esto es necesario seguir varios pasos: • Toma de muestra: biopsia (muestra de tejido u órgano de un ser vivo) o necropsia (obtener muestras a partir de un individuo muerto). • Fijación: su fin es dar termino a la vida de las células impidiendo cualquier modificación postmortem (procesos autolíticos), manteniendo así la forma de los tejidos sin cambios notables en ellos. Para esto es necesario aplicar fijadores que se clasifican en dos grupos: OXIDANTES (ácido ósmico, ácido crómico, ácido acético, entre otros) y REDUCTORES (formaldehído, glutaraldehído, alcohol metílico, entre otros). Un fijador debe ser fácil de conseguir y manipular, no debe disolver componentes celulares, debe dar cierta dureza a los tejidos sin llegar al punto de hacerlos quebradizos y debe ser de bajo costo económico. • Inclusión: corresponde a la formación de un bloque de parafina con la muestra en su interior. Para esto es necesario que la muestra se deshidrate en baños sucesivos de alcohol etílico de distinta concentración (en forma ascendente); luego se aplica algún líquido diafanizador como el xilol (aclaración) y finalmente se forma el bloque de parafina sólida con la muestra en el interior, formando un bloque que posteriormente se secciona para obtener las muestras. • Obtención del corte: a través del micrótomo, instrumentos mecánicos que permiten obtener cortes de un grosor uniforme a partir del bloque de parafina con la muestra incluida. Los cortes van siendo colocados en el portaobjetos facilitando esto con una gota de agua que recibe el corte. • Coloración o tinción: permite que una estructura celular o tisular adquiera una coloración específica. Se considera teñido cuando al ser lavada la estructura con el disolvente del colorante, esta no se decolora. Colorante es aquella sustancia capaz de transferir su color a otro cuerpo. Los colorantes pueden ser clasificados en: • Naturales: se extraen de animales como la chinita (carmín) o de vegetales (hematoxilina). • Artificiales: derivados de la anilina. Los anteriores pueden ser ácidos, básicos, neutros o indiferentes. Son ácidos o básicos dependiendo si la sal posee la parte ácida o básica con color, respectivamente. Las sustancias que atraen los colorantes ácidos se denominan acidófilas (eosina), mientras que las que atraen a los básicos se denominan basófilos (hematoxilina). Los neutros en cambio proporcionan color tanto por su parte ácida como por la básica (azul de metileno, giemsa). Los indiferentes no forman sales, por lo que no poseen capacidad de disociación electrolítica; son insolubles en agua pero solubles en solventes orgánicos como el alcohol, y también grasas o 3 lípidos, por ello son utilizados para detectar presencia de estos elementos en las células y tejidos (Sudán III). Además, de acuerdo a como se tiñen las muestras se reconocen varios tipos de coloraciones. • Directa: tinción de una estructura al contacto con el colorante (azul de metileno=>núcleos) • Indirecta: requiere sustancias intermediarias que faciliten adhesión del colorante (laca o mordiente). Hematoxilina requiere mordiente por ejemplo. • Progresiva: de acuerdo a paso del tiempo se regula la intensidad de la coloración, deteniendo el proceso cuando alcance el nivel deseado. • Regresiva: se sobrecolorea corte y aplicando un diferenciador se extrae parte del colorante hasta lograr la intensidad deseada de tinción. • Simple: se utiliza un solo colorante para teñir una estructura en específico (tionina=>núcleos). • Compuesta: varios colorantes se aplican sobre el corte para contrastar estructuras. Simultánea o sucesiva (hematoxilina−eosina, por ejemplo). • Ortocromática: estructura adquiere el mismo color del colorante (la mayoría de los colorantes). • Metacromática: colorean algunas estructuras del mismo color y otras de color distinto (azul de toluidina). • Pancromática: producida por los colorantes neutros. Tiñen a través de sus partes ácidas y básicas, pero a la vez tiñen otras estructuras de otro color (Giemsa). • Montaje: consiste en agregar alguna sustancia adherente (resina natural como el bálsamo de Canadá, o resina sintética) diluida en xilol sobre el corte colocado en el portaobjetos ya teñido; las resinas deben tener un índice de refracción similar al del vidrio. Finalmente se coloca el cubreobjeto, cuidando que no queden burbujas; se debe dejar que el xilol se evapore y la resina se solidifique a una temperatura de unos 45º a 50ºC durante 24 a 48 horas. Actividades • ¿Cuál es el propósito de la fijación? • ¿Cuál es el propósito de la inclusión? • ¿Es necesario siempre deshidratar la muestra para observación en microscopio óptico? • ¿En qué consiste el aclarado de las muestras? • Averigüe que tinciones se utilizan para teñir: citoplasma, núcleos, mucopolisacáridos, lípidos, sangre, bacterias. • Averigüe que elementos se utilizan para el contraste en la microscopia electrónica. • Explique la utilidad de técnicas como la inmunocitoquímica y radioautografía en el estudio de las células y/o tejidos. 4