Cuestionario: Tinciones Simples, Diferenciales y Especiales
Anuncio

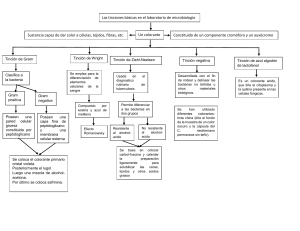
PRÁCTICA N° 3: TINCIONES SIMPLES, DIFERENCIALES Y ESPECIALES CUESTIONARIO 1. En su estado natural ¿qué color y aspecto tienen las bacterias? Las bacterias, levaduras y protozoarios, en su estado natural, carecen de color, teniendo un aspecto semitransparente, por lo que resulta muy difícil su observación en las preparaciones acuosas sobre láminas portaobjetos, sometidas a la intensa iluminación que se requiere en los exámenes microscópicos de campo brillante, siendo necesario colorearlas por diferentes métodos de tinción que factibilicen su observación y distinguir las características morfológicas y estructurales que sirvan de datos para su identificación genérica. 2. ¿Qué entiende usted por colorantes? Los colorantes son sustancias de origen químico o biológico, generalmente tintes, pigmentos, reactivos u otros compuestos, empleados en la coloración de tejidos microorganismos para exámenes microscópicos. 3. ¿Cuáles son las ventajas de la toxicidad que ocasionan los colorantes a los microorganismos? Los colorantes son sustancias tóxicas, por lo tanto el proceso de la tinción generalmente resulta letal para los microorganismos, provocando su inmovilización, lo cual puede significar una ventaja o desventaja para el investigador. En las ventajas tenemos: Al ocasionar la muerte de los microorganismos sometidos al proceso de tinción se reducen las posibilidades de contaminación para el manipulador. Algunos colorantes solo tienen afecto letal para determinadas especies o géneros bacterianos, siendo utilizados como constituyentes de medios de cultivo selectivo para impedir el desarrollo de microorganismos indeseables y favorecer el desarrollo de las especies que nos interesa estudiar. Algunos tipos de colorantes son empleados no para teñir, sino como indicadores de pH, formando parte de la composición de los medios de cultivo para indicar los cambios de basicidad o acidez que se vayan produciendo en el medio como consecuencia de su actividad metabólica. Otros se emplean como desinfectantes microbianos. 4. ¿En qué consiste el método de coloración simple? En la tinción simple se utiliza un solo colorante con el que se tiñe rápidamente el microorganismo, utilizándose fundamentalmente para observar su morfología y tamaño. 5. Investigue cuales son las moléculas responsables de la tinción simple realizada. De ejemplos de otros colorantes que se podrían utilizarse. Muchos colorantes utilizados con frecuencia son moléculas cargadas positivamente (cationes) y penetran al interior de las células y se combinan con intensidad con los constituyentes celulares cargados negativamente, tales como los ácidos nucleicos. Ejemplos de colorantes catiónicos son el azul de metileno, el cristal violeta y la safranina, fucsina básica, verde malaquita. Colorantes que tienen el grupo cromófero cargado negativamente (aniones) y se combinan con los constituyentes celulares cargados positivamente, tales como muchas proteínas y estructuras citoplasmáticas de células eucariotas. Estos colorantes no penetran el interior de las células de modo que no tiñen las células bacterianas, por lo tanto, pueden usarse para impartir al fondo un color de contraste (coloración negativa). Ejemplos de colorantes aniónicos son nigrosina, eosina, fucsina ácida, rojo de congo, rosa de bengala. 6. ¿Cuáles son las ventajas o ilimitaciones de la tinción simple? Las tinciones tienen la finalidad de aumentar el contraste para que puedas observar estructuras celulares en el microscopio. La ventaja principal es que nos permite observar estructuras que en su forma natural carecen de coloración suficiente para ser distinguidas por microscopio. Otra ventaja es que nos permite distinguir entre diferentes tipos celulares, ya que distintas células responden de manera diferente a las tinciones, además de que, mediante el uso de las llamadas técnicas histoquímicas, podemos teñir un determinado tipo celular y hacer que sólo estas células se tiñan, mientras que las otras no, así podemos seguir células que tengan una enzima determinada o donde tenga una reacción particular que no ocurra en otras, siempre que se usen colorantes adecuados. Por otro lado, la principal desventaja es que, debido al tratamiento al que debe someterse un tejido vivo para su tinción, las células acaban muriendo, con lo cual, no es posible observar esas células activas en su estado natural, sino muertas. 7. Con los resultados de una tinción simple se puede saber si la muestra teñida es un cultivo puro 8. ¿Cuáles son las principales precauciones de manejo del microscopio y porque se debe de utilizar el aceite de inmersión al hacer el estudio microscopio de bacterias? El aceite de inmersión tiene aproximadamente el mismo índice de refracción que el vidrio y con el se elimina casi completamente los rayos de la luz y aumenta en gran cantidad la eficacia del uso del microscopio. Al ofrecer un índice de refracción similar al del vidrio, el objeto aparece como "incluido en el vidrio del objetivo" eliminando el efecto reflector del vidrio exterior del. Eso permite lograr mucho mayores aumentos con menor distorsión esférica, menor aberración cromática y mayor luminosidad o "abertura de pupila" 9. ¿En qué consiste el método de coloración diferencial? Utilizan dos colorantes. Las tinciones diferenciales permiten diferenciar microorganismos con características superficiales distintas, por lo que requieren más de un colorante. Se basan en el hecho de que distintos tipos de células tienen distinta composición química, y por lo tanto reaccionan de forma diferente frente a una tinción, lo que permite clasificar los microorganismos en diferentes grupos, según su capacidad de tinción. 10. Responder a las siguientes preguntas: a. Describa brevemente el procedimiento o los pasos para la Tinción Gram (coloque los tiempos para cada paso) 1. Se prepara el frotis, se seca y se fija al calor del mechero. 2. Se cubre con cristal violeta durante un minuto. 3. Lavar suavemente con agua corriente para eliminar el exceso de colorante. 4. Añadir lugol por un minuto. 5. Lavar con agua corriente el exceso de lugol. 6. Se gotea alcohol-acetona de forma continua hasta que la preparación deje de perder color 7. Lavar enseguida con agua abundante. 8. Se cubre la preparación con safranina por un minuto (Safranina es colorante de contraste) 9. Se lava con agua y se seca al aire. b. Explica en forma completa la teoría que explica la tinción Gram. Explicar desde el punto de vista de su pared celular. Un microorganismo Gram positivo debe presentar una pared celular sana. El mismo microorganismo, si sufre daño de la pared por una u otra causa, se vuelve Gram negativo. Esto indica la importancia de la pared para la retención o el escape del colorante. Una posible teoría del mecanismo de tinción es la siguiente: El colorante básico entra al microorganismo, donde forma con el yodo una laca insoluble en agua. El alcohol o la acetona empleados para aclarar, deshidratan las paredes de los microorganismos Gram positivos, tratados con mordiente, y forma una barrera que la laca no puede atravesar. En las células Gram negativas, los lípidos de la pared (más abundantes que en las células Gram positivas) se disuelven por este tratamiento, lo que permite el escape del complejo de cristal violeta con yodo. c. ¿Cuál es la función del lugol? El lugol actúa como mordiente aumentando la afinidad del colorante por la bacteria. d. ¿Cómo reaccionan las bacterias cuando se adiciona el alcohol acetona? La función del alcohol-acetona es la quitar el colorante de las bacterias, así si la bacteria conserva el tinte, es Gram positiva y si el tinte no se mantiene es Gram negativa. e. ¿Qué función tiene la Safranina? Sirve para hacer una tinción de contraste que pone de manifiesto las bacterias Gram negativas. f. ¿Cómo se clasifican las bacterias después de haber sido teñidas? Bacterias Gram-positivas: Presentarán una coloración violeta Bacterias Gram-negativas: Presentarán una coloración roja o rosa. 11. Responder a las siguientes preguntas: a. Describa brevemente el procedimiento o pasos para la Tinción Ziehl Neelsen (coloque los tiempos para cada paso) 1. Realizar la extensión de la muestra y fijar al calor moderado del mechero. 2. Cubrir el extendido con fucsina fenicada de Ziehl y flamear por debajo del portaobjeto hasta el desprendimiento de vapores blancos (evitar que se produzca la ebullición por exceso de calor). Dejar enfriar 5 minutos. Repetir este proceso por 3 veces consecutivas. Finalmente dejar enfriar 5 minutos. 3. Lavar abundantemente con agua corriente. 4. Cubrir con el decolorante alcohol-ácido durante 10-20 segundos. . Realizar sucesivos lavados hasta que no se desprenda más colorante (aproximadamente 2 minutos; pero en el caso de preparados más gruesos, puede requerirse mayor tiempo). 5. Lavar con agua corriente 6. Teñir con el colorante de contraste azul de metileno durante 30 segundos. 7. Lavar con agua corriente durante 30 segundos. 8. Secar el extendido 9. Cubrir el extendido con una gota de aceite de inmersión y observar al microscopio óptico, con aumento 100X. b. Explica en forma completa la teoría que explica de Ziehl Neelsen Las paredes celulares de ciertas bacterias contienen ácidos grasos (ácidos micólicos) de cadena larga (50 a 90 átomos de carbono) que les confieren la propiedad de resistir la decoloración con alcoholácido, después de la tinción con colorantes básicos. Por esto se denominan ácido-alcohol resistente. Las micobacterias como Mycobacterium tuberculosis y M. marinum se caracterizan por sus propiedades de ácido-alcohol resistencia. La coloración clásica de Ziehl-Neelsen requiere calentamiento para que el colorante atraviese la pared bacteriana que contiene ceras. Al suspender el calentamiento y enfriar con agua, provoca una nueva solidificación de los ácidos grasos de modo que el colorante ya no puede salir de las bacterias. Por otro lado, el calentamiento aumenta la energía cinética de las moléculas del colorante lo cual también facilita su entrada a las bacterias. Las bacterias que resisten la decoloración son de color rojo y las que no, se ven de color azul ya que se utiliza azul de metileno como tinción de contraste. c. ¿Porque se debe calentar la fucsina en la tinción? La fucsina fenicada penetre y tiña la pared celular de la bacteria. No deje que hierva o se seque el colorante. d. ¿Cuál es el colorante de contraste en esta tinción? Azul de metileno. 12. ¿Cuáles son las fuentes de error más frecuentes en la preparación del frotis? 13. Indique que etapas debe de seguir para preparar una extensión o frotis de las siguientes muestras: yogurt, saliva, una colonia bacteriana resuspendida en agua, sedimento de un rio. 14. ¿Qué finalidad tiene fijar las muestras cuando se realiza un frotis bacteriano? 15. Señale las ventajas y desventajas de la tinción simple respecto del examen en fresco. 16. Explique el fundamento de la tinción de esporas con el Metodo de Wirtz-Conklin Las endosporas poseen unas cubiertas exclusivas que las hacen resistentes a los factores ambientales adversos como temperaturas extremas, radiaciones, etc. La tinción de esporas requiere de dos colorantes: a. Verde malaquita: Capaz de teñir las esporas en caliente. b. Safranina: Colorante de contraste que tiñe las formas vegetativas Tras la primera tinción las endosporas no pierden el colorante en el lavado con agua, mientras que las formas vegetativas si lo hacen. Las formas vegetativas quedaran teñidas con el segundo colorante. 17. Como se apreciarían tanto la célula vegetativa como la endospora si únicamente las visualizamos tras una tinción de Gram. Probablemente se apreciarían del color primario que es el cristal violeta. Esto debido a que el colorante primario tiñe por igual a todas las bacterias. 18. A que puede deberse que no se vea endospora en todas las células de una preparación de bacterias formadoras de endospora como Bacillus sp. El proceso de formación de endosporas por una bacteria es un proceso lento. Probablemente si la endospora no es visible es que todavía no se ha formado completamente, ya que las endosporas suelen aparecer libres o en algunas ocasiones en el interior de algunas bacterias deformadas. 19. ¿Con qué objetivo son tratadas con ácido tánico las bacterias, antes de aplicar una coloración de flagelos? El ácido Tánico es el mordiente, es decir, es el agente que va a incrementar el grosor de los flagelos para que estos sean visibles ante el microscopio. 20. ¿Qué requisitos han de tenerse en cuenta para realizar una coloración de flagelos? 21. Describa el procedimiento para la coloración de cápsula. Especifique los tiempos. a. Se coloca una pequeña gota de tinta china en el extremo del portaobjetos, junto a esta se colocara una gota del cultivo de la bacteria(en caso de ser solido suspender con agua destilada) b. Distribuir la mezcla a lo ancho del portaobjetos, colocando otro portaobjetos en angulo 45° sobre la muestra. c. Desplazar poco a poco el segundo portaobjetos a lo largo del primero para hacer una capa fina de la mezcla. d. Dejar secar al aire 22. Explique el fundamento de la tinción de Cápsula. Cuál es la función de la tinta china o nigrosina? La capsula o glicocalix es una estructura externa ala celula que confiere protección a las bacterias contra la desecación y la fagocitosos. En este tipo de tinción las células se dejan sin teñir, sin embargo se colorea el medio que las rodea, en este caso la capsula. La tinta china o nigrosina permite observar en el microscopio estructuras especiales como las capsulas, que aparecen como una zona clara que rodea a la celula bacteriana en un fondo obscuro.