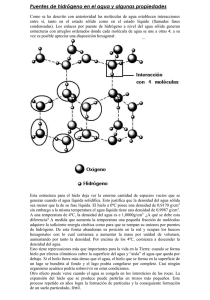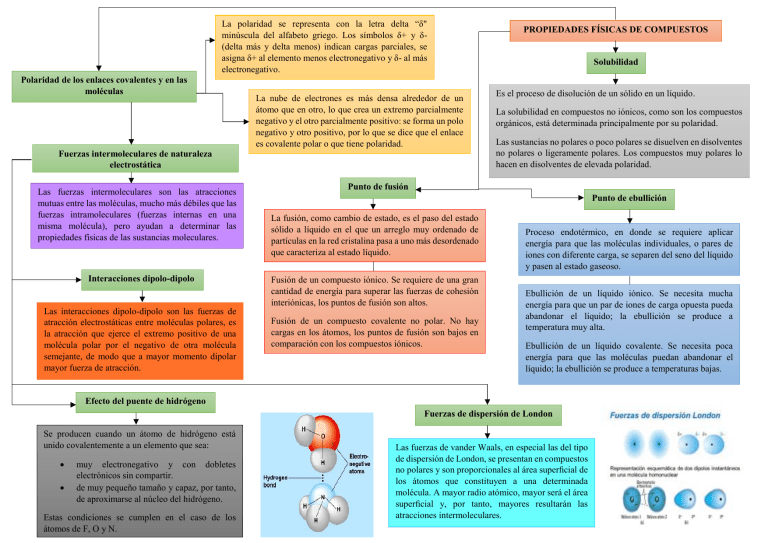
La polaridad se representa con la letra delta “δ" minúscula del alfabeto griego. Los símbolos δ+ y δ(delta más y delta menos) indican cargas parciales, se asigna δ+ al elemento menos electronegativo y δ- al más electronegativo. Polaridad de los enlaces covalentes y en las moléculas La nube de electrones es más densa alrededor de un átomo que en otro, lo que crea un extremo parcialmente negativo y el otro parcialmente positivo: se forma un polo negativo y otro positivo, por lo que se dice que el enlace es covalente polar o que tiene polaridad. Fuerzas intermoleculares de naturaleza electrostática Las fuerzas intermoleculares son las atracciones mutuas entre las moléculas, mucho más débiles que las fuerzas intramoleculares (fuerzas internas en una misma molécula), pero ayudan a determinar las propiedades físicas de las sustancias moleculares. Interacciones dipolo-dipolo Las interacciones dipolo-dipolo son las fuerzas de atracción electrostáticas entre moléculas polares, es la atracción que ejerce el extremo positivo de una molécula polar por el negativo de otra molécula semejante, de modo que a mayor momento dipolar mayor fuerza de atracción. PROPIEDADES FÍSICAS DE COMPUESTOS Solubilidad Es el proceso de disolución de un sólido en un líquido. La solubilidad en compuestos no iónicos, como son los compuestos orgánicos, está determinada principalmente por su polaridad. Las sustancias no polares o poco polares se disuelven en disolventes no polares o ligeramente polares. Los compuestos muy polares lo hacen en disolventes de elevada polaridad. Punto de fusión Punto de ebullición La fusión, como cambio de estado, es el paso del estado sólido a líquido en el que un arreglo muy ordenado de partículas en la red cristalina pasa a uno más desordenado que caracteriza al estado líquido. Fusión de un compuesto iónico. Se requiere de una gran cantidad de energía para superar las fuerzas de cohesión interiónicas, los puntos de fusión son altos. Fusión de un compuesto covalente no polar. No hay cargas en los átomos, los puntos de fusión son bajos en comparación con los compuestos iónicos. Proceso endotérmico, en donde se requiere aplicar energía para que las moléculas individuales, o pares de iones con diferente carga, se separen del seno del líquido y pasen al estado gaseoso. Ebullición de un líquido iónico. Se necesita mucha energía para que un par de iones de carga opuesta pueda abandonar el líquido; la ebullición se produce a temperatura muy alta. Ebullición de un líquido covalente. Se necesita poca energía para que las moléculas puedan abandonar el líquido; la ebullición se produce a temperaturas bajas. Efecto del puente de hidrógeno Fuerzas de dispersión de London Se producen cuando un átomo de hidrógeno está unido covalentemente a un elemento que sea: muy electronegativo y con dobletes electrónicos sin compartir. de muy pequeño tamaño y capaz, por tanto, de aproximarse al núcleo del hidrógeno. Estas condiciones se cumplen en el caso de los átomos de F, O y N. Las fuerzas de vander Waals, en especial las del tipo de dispersión de London, se presentan en compuestos no polares y son proporcionales al área superficial de los átomos que constituyen a una determinada molécula. A mayor radio atómico, mayor será el área superficial y, por tanto, mayores resultarán las atracciones intermoleculares.