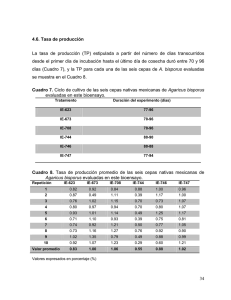
See discussions, stats, and author profiles for this publication at: https://www.researchgate.net/publication/256527519 Cultivo, mercadotecnia e inocuidad alaimenticia de Agaricus bisporus Book · January 2007 CITATION READS 1 11,022 3 authors, including: José Ernesto Sánchez Daniel J Royse El Colegio de la Frontera Sur Pennsylvania State University 58 PUBLICATIONS 596 CITATIONS 252 PUBLICATIONS 3,264 CITATIONS SEE PROFILE SEE PROFILE Some of the authors of this publication are also working on these related projects: Industrial Enzymes View project Para ver nuestros proyectos en curso, por favor visite http://www2.tap-ecosur.edu.mx/hongos/ View project All content following this page was uploaded by José Ernesto Sánchez on 21 May 2014. The user has requested enhancement of the downloaded file. Cultivo, mercadotecnia e inocuidad alimenticia de Agaricus bisporus José E. Sánchez * Daniel J. Royse * Hermilo Leal Lara CULTIVO, MERCADOTECNIA E INOCUIDAD ALIMENTICIA DE AGARICUS BISPORUS José E. Sánchez Vázquez Daniel J. Royse Hermilo Leal Lara Editores El Colegio de la Frontera Sur 2007 1a. edición 2007 D.R. El Colegio de la Frontera Sur Carretera Antiguo Aeropuerto Km 2.5, Apartado Postal 36, 30700 Tapachula, Chiapas, México. Tel.(52) 962 628 9800, 962 628 9811, 962 628 9812, 962 628 9813 Fax (52) 962 628 9806 La presentación y disposición en conjunto del libro Cultivo, mercadotecnia e inocuidad alimenticia de Agaricus bisporus Son propiedad de ECOSUR. Ninguna parte de esta obra puede ser reproducida o transmitida, mediante ningún sistema o método, electrónico o mecánico (incluyendo el fotocopiado, la grabación o cualquier sistema de recuperación y almacenamiento de información), sin consentimiento por escrito de esta institución. Primera edición Hecho en México ISBN 978-970-9712-55-1 Los artículos incluidos no necesariamente reflejan el criterio de los editores, ni de ECOSUR; siendo responsabilidad exclusiva de los autores. Impreso en: Departamento de Difusión y Comunicación, ECOSUR, Unidad Tapachula Responsable: Adalberto Aquino Vázquez <[email protected]> Noviembre de 2007. INDICE PRESENTACIÓN Capitulo I II III IV V VI VII VIII IX X XI XII XIII XIV Pag. CONSUMO Y PRODUCCIÓN DE AGARICUS BISPORUS EN EL MUNDO Daniel J. Royse 7 EL GENERO AGARICUS Philippe Callac 19 PRODUCCIÓN DE SEMILLA Y CONSERVACIÓN DE CEPAS DE AGARICUS BISPORUS Gerardo Mata y Jean Michel Savoie DESARROLLO DE SISTEMAS DE PROCESAMIENTO DE COMPOSTA PARA EL CHAMPIÑÓN AGARICUS BISPORUS Ray Samp SUSTRATOS NO COMPOSTEADOS PARA LA PRODUCCION DE AGARICUS BISPORUS Daniel J. Royse USO DE HONGOS TERMÓFILOS PARA LA PREPARACIÓN DE SUSTRATOS José E. Sánchez CULTIVO Y PRODUCCIÓN DEL CHAMPIÑÓN: UN ENFOQUE TECNOLÓGICO Agustín García Parada 37 49 57 65 75 MANEJO INTEGRADO DE PLAGAS DEL CHAMPIÑÓN Danny Lee Rinker 81 INOCUIDAD ALIMENTICIA DEL CHAMPIÑÓN Luke F. LaBorde 101 ASPECTOS SALUDABLES AL CONSUMIR HONGOS Jan I. Lelley 113 CONTROL DEL AMBIENTE EN LOS CUARTOS DE CRECIMIENTO DE CHAMPIÑONES Ken M. Lomax 121 USOS DEL SUSTRATO DEGRADADO DE LOS HONGOS Danny Lee Rinker 135 ORGANIZACION Y MERCADO: LA CLAVE PARA EL ÉXITO Ramón Jarquín Gálvez y Raúl Cuevas González 151 EVOLUCIÓN DE LA INDUSTRIA DEL CHAMPIÑÓN AGARICUS BISPORUS EN LATINOAMÉRICA Oscar Lahmann 161 COLABORADORES Callac, Philippe INRA-MYCSA UPR 1264, Mycologie et Sécurité des Aliments B.P.81 33883 VILLENAVE D'ORNON Cedex, Francia. <[email protected]> Cuevas González, Raúl Carretera Antiguo Aeropuerto Km. 2.5 Tapachula, Chiapas, México <[email protected]> García Parada, Agustín Grupo Monteblanco, Bosque de Ciruelos 304, piso 9, México D.F., C.P. 11700. <[email protected]> Jarquín Gálvez, Ramón Carretera Antiguo Aeropuerto Km. 2.5 Tapachula, Chiapas, México <[email protected]> LaBorde, Luke F. The Pennsylvania State University. Department of Food Science University Park, Pennsylvania USA 16802-2504 Lahmann, Oscar Lahmann Enterprises, 150 Bonaventure Drive, Hamilton , Ontario Canada L9C 4P9 <[email protected]> Lelley, Jan I. GAMU Ltd Institut for Mushroom Research Krefeld, Alemania <[email protected]> Lomax, Ken M. Bioresources Engineering Department. University of Delaware Newark, Delaware, USA 19716 Mata, Gerardo Unidad de Micología, Instituto de Ecología, A.C., Apartado Postal 63, Xalapa 91000, Veracruz, México <[email protected]> Rinker, Danny L. Mushrooms, University of Guelph, Department of Plant Agriculture, 4890 Victoria Avenue, P.O. Box 7000, Vineland, ON L0R 2E0 Canada, <[email protected]> Royse, Daniel J. 316 Buckhout Lab, Department of Plant Pathology, The Pennsylvania State University, University Park, PA 16802, U.S. <[email protected]> Samp, Ray 113 Colleen Court, San Marcos, Texas 78667 USA <[email protected]> Sánchez, José E. El Colegio de la Frontera Sur. Apartado postal 36. Tapachula, Chiapas 30700 México. <[email protected]> Savoie, Jean Michel MyCSA, Institut National de la Recherche Agronomique, BP 81, Villenave d’Ornon 33883, cedex, Francia <[email protected]> PRESENTACIÓN Los avances en el conocimiento de los hongos, particularmente los comestibles, y el desarrollo de tecnología para el cultivo de diversas especies de estos organismos han sido muy importantes en los últimos años. Así, las aplicaciones micotecnológícas actuales –relevantes y comparables en su conjunto al descubrimiento y desarrollo de la agricultura, hace a unos 10,000 años, con la diferencia de que ésta cultiva organismos del reino de las plantas- hacen pensar en un futuro muy promisorio, en el cual los hongos podrán aportar nuevas fuentes de alimentos, de medicamentos y de productos diversos. En la actualidad, el cultivo de hongos comestibles se visualiza como una alternativa de desarrollo económico y de desarrollo rural que, con seguridad, irá tomando más fuerza en el porvenir debido al crecimiento de la población, a la necesidad de diversificar la alimentación, a las características cualitativas de los mismos hongos –que se recomiendan solos-, a la necesidad de ser más eficientes en el aprovechamiento de la energía y la biomasa, etc. Aún cuando existe una tendencia general a la diversificación de las especies y variedades cultivadas de hongos comestibles, el champiñón Agaricus bisporus es el hongo comestible más ampliamente cultivado en Hispanoamérica y en todo el mundo. No solo mantiene su producción desde hace muchos años, sino, inclusive la ha incrementado en algunas variedades que han reaparecido recientemente en el mercado, como son los casos de los hongos Portobello y Crimini. Esta situación ha propiciado que el interés por cultivar esta especie se mantenga y que cada vez surjan mayores exigencias hacia los cultivadores en cuanto a conocimientos y actualización de técnicas y métodos que les permitan hacer rentable sus cultivos y mantenerse competitivos. Desafortunadamente, en idioma español existe muy poca literatura sobre aspectos básicos y de cultivo de este hongo. Esta situación limita o hace difícil la obtención de conocimiento y la actualización de aquellas personas interesadas en mejorar sus sistemas de producción. Ante este problema, El Colegio de la Frontera Sur, la Universidad Nacional Autónoma de México y la Universidad Estatal de Pennsylvania unieron esfuerzos para realizar un curso internacional que aportara información sobre los últimos adelantos y conceptos relevantes en el cultivo de este hongo. Así, al realizar este curso, durante los días 6 y 7 de diciembre 2007, se reunieron especialistas de reconocido prestigio de Europa, Estados Unidos y México, para hacer una revisión del estado del arte y una actualización de información básica y aplicada. El presente libro contiene los documentos completos, a manera de capítulos, de los trabajos presentados por cada especialista. Es de asegurar que este libro será de gran interés y utilidad para cultivadores, investigadores, profesionales y estudiantes relacionados con el cultivo del champiñón. Quisiéramos agradecer a todos los patrocinadores, participantes y asistentes el apoyo brindado para la organización y la realización del evento, sin el cual no hubiera sido posible elaborar este libro. Hacemos también público nuestro reconocimiento al MC René Andrade Gallegos, MC Rebeca Ramírez, QFB Lilia Moreno y Gerardo Hernández por el apoyo brindado para la realización del evento y la elaboración del libro mismo. También hacemos extensivo nuestro agradecimiento más sincero a Adalberto Aquino por el apoyo otorgado en el formateo, paginación, revisión e impresión del documento. Finalmente agradecemos al personal de los departamentos de Difusión, Informática y Biblioteca de Ecosur por la puesta en línea de la versión electrónica del libro. Los editores Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus I. CONSUMO Y PRODUCCIÓN DE AGARICUS BISPORUS EN EL MUNDO Daniel J. Royse 316 Buckhout Lab, Department of Plant Pathology, The Pennsylvania State University, University Park, PA 16802, U.S. <[email protected]> RESUMEN La tecnología para el cultivo de Agaricus bisporus, un hongo relativamente reciente en la lista de hongos comestibles cultivados, ha evolucionado considerablemente en los últimos 350 años, especialmente desde la segunda Guerra mundial. En Estados Unidos, el cultivo de este hongo empezó en el sureste de Pennsylvania, más de 100 años después de que los cultivadores de melón en la región de Paris, Francia, desarrollaran el primer método. Ahora, la producción comercial de A. bisporus comprende cerca de 40% de la producción mundial de hongos comestibles y su cultivo se desarrolla en una docena de países. Aproximadamente 55% de la producción mundial se enlata o seca y 45% se vende fresca. En Europa el consumo es de cerca de 3 kg per cápita, mientras que en Estados Unidos es de 1.8 kg por persona por año. Agaricus bisporus es producido sobre mezclas de materias primas composteadas formadas por varias combinaciones de heno, rastrojo, cáscara de semilla de algodón, olote, pasto, estiércol de caballo y de pollo, corteza, harina de semilla de algodón y de soya, desechos de destilería y yeso. Estos materiales son mezclados y humedecidos al iniciar el proceso de composteo. Desde principios de los 1950’s, este proceso se ha dividido en dos distintas fases: La fase I, conducida generalmente a la intemperie sobre un patio o un bunker aireado y la fase II, llevada a cabo en túneles, en estantes o en charolas. En años recientes, las variedades oscuras se han vuelto muy populares porque los consumidores han aceptado los hongos Crimini (cerrados) y Portobello (abiertos) por su más intenso sabor y aroma. La producción orgánica se encuentra en su infancia y los consumidores demandan cada vez más esta modalidad. El desecho de la composta o CGH, obtenido después de la producción de hongos, puede ser un problema en algunas áreas, aunque en general se está convirtiendo en un producto hortícola de alto valor, en especial para mejorar el suelo y suprimir hongos del género Sphaerobolus. Palabras clave: champiñón, Portobello, tecnología de producción, cultivo en dos fases. INTRODUCCIÓN En la actualidad hay aproximadamente 2,000 variedades de hongos comestibles en el mercado mundial (Anónimo 2007). La mayoría de estas variedades son colectadas silvestres, las variedades cultivadas son alrededor de 50. Agaricus bisporus, el champiñón, comprende cerca del 40% de la producción y consumo mundial de hongos comestibles. China es el mayor proveedor (Chang 2005) seguido de Estados Unidos, Holanda, España, Francia y Polonia. Algunos hongos han sido cultivados por cientos de años, mientras que A. bisporus tiene un ingreso relativamente reciente a la lista de hongos cultivados: fue domesticado hace 350 años. El método para cultivar A. bisporus fue desarrollado en la región de París, Francia, donde los cultivadores de melón descubrieron cómo podía propagarse este hongo e iniciaron su cultivo hacia 1650 (Royse y Schisler 1980). Alrededor de 1700, Tournefort, un botánico francés, describió el primer método de cultivo de A. bisporus (Vedder 1978). Él concluía que los champiñones se originaban “de los caballos” y creía que las esporas estaban presentes en su estado natural en el estiércol de estos animales. Él describió un método de cultivo que consistía en colocar porciones de estiércol de caballo cubiertas con moho en una cama de estiércol y cubriéndolo con una capa de suelo. 7 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus En la década de 1780, Chambry, un jardinero francés, notó que A. bisporus podía crecer sin luz y que las cuevas proveían condiciones favorables para la producción del hongo. Como resultado de ese descubrimiento, el cultivo del champiñón empezó a desarrollarse dentro de numerosas minas que habían sido excavadas para extraer yeso y material de construcción. Las minas ofrecían varias ventajas, como temperatura y humedad constante, comparada con las condiciones al aire libre en la superficie. Desde Francia, el cultivo del champiñón se dispersó hacia otras partes del mundo. Hacia 1825, ya se producía en cuevas en Holanda (Van Griensven 1988). En 1865 empezó en Estados Unidos, introducido de Inglaterra. En los inicios de 1900, el cultivo del champiñón empezó a recibir atención por parte de especialistas y micólogos (Sinden 1971). Los avances en la tecnología de producción incrementaron más rápidamente desde la segunda guerra mundial y especialmente desde 1960 (Fig.1). Los primeros módulos para investigar la producción del champiñón fueron establecidas por estaciones gubernamentales experimentales en Estados Unidos, así como en muchos otros países en Europa, Japón, Sud Corea, Taiwán y China. La investigación también inició en algunas plantas de cultivo individuales, grandes, y por parte de varios productores de inóculo o semilla (Royse y Schisler 1980). Actualmente, mientras que algunos cultivadores continúan produciendo los hongos en minas o cuevas, la mayor parte de la producción se da sobre el suelo en naves con ambiente controlado. En muchos casos, las condiciones ambientales como humedad relativa, niveles de bióxido de carbono, temperatura y ventilación son controlados por computadora en cada parte del proceso. Esto ha permitido a los cultivadores proveer al hongo de condiciones óptimas durante todas las etapas del ciclo de producción y producir hongos casi independientemente de las condiciones climáticas. 3500 3000 2500 2000 1500 1000 500 0 1930 1950 1970 1990 2010 Año Figura 1. Producción mundial de Agaricus bisporus (equivalente fresco) desde 1935 8 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus DEMANDA DE MÁS HONGOS COMESTIBLES La demanda de hongos comestibles se ha incrementado drásticamente durante los últimos años a medida que los consumidores modernos han incrementado la búsqueda de beneficios proporcionados con alimentos saludables (Anónimo 2007). Un grande y reciente desarrollo de la industria de los hongos viene de la Universidad Estatal de Pennsylvania. En efecto, Dubost et al. (2006) mostraron que A. bisporus es uno de las fuentes más ricas de ergotionina. Este antioxidante está presente en el champiñón en un nivel 12 veces mayor que en el germen de trigo, considerado en alguna ocasión como su fuente natural más alta. El cocimiento no destruye la ergotionina, por lo que los consumidores pueden disfrutar de los beneficios de este hongo sin pérdida de su potencia durante la preparación (Dubost et al. 2007). En la actualidad, 55% de la producción mundial de A. bisporus es procesada, principalmente para conservar el producto para consumo futuro. Aproximadamente 50% de la producción es enlatada, mientras que el 5% es secada. El restante 45% es consumido en fresco y este segmento del mercado está creciendo más rápido que el mercado procesado. En algunos países, incluyendo Estados Unidos, el consumo fresco alcanza más del 75% del mercado (USDA 2006). En términos de consumo per cápita, los europeos están en la punta o muy cerca, ya que ellos consumen alrededor de 3 kg de hongos por año. En Europa A. bisporus comprende cerca del 90% de las ventas de hongos comestibles, con solamente 1% de las ventas producidas de manera orgánica (Fletcher 2001). En los Estados Unidos, el consumo se ha incrementado continuamente durante las últimas décadas. El consumo per cápita ha incrementado de 0.31 kg en 1965 a 1.82 kg por año en 2006 (Lucier y Jerardo 2005, USDA 2006). Al igual que en Europa, aproximadamente 1% de las ventas de A. bisporus son producidas orgánicamente (USDA 2006). Los factores que influyen en el uso de los hongos han sido examinados en varios estudios en Estados Unidos (Patterson 2003, Lucier et al. 2003) y México (Mayett et al. 2006). En Estados Unidos, los hogares que compran hongos generalmente tienen un ingreso más alto y una mayor educación (Patterson 2003). Además, los hogares compuestos por familias tienen mayor probabilidad de comprar hongos que los hogares compuestos por individuos que viven solos o con personas no relacionadas. Los hogares comandados por mujeres son más susceptibles de comprar hongos y la probabilidad de compra de hongos se incrementa con la edad de la cabeza de familia (Patterson 2003). El consumo per cápita es más alto entre las edades de 20-39 años y el más bajo entre niños por debajo de 12 años. Aproximadamente la mitad del mercado fresco de hongos es comprado al menudeo y consumido en casa, mientras que tres cuartas partes del procesado es consumido en casa (Lucier et al. 2003). Las compras de hongos en México son hechas mayormente por mujeres (80.5%) independientemente del nivel social, mientras que los hombres compran una porción menor (19.5%). Desde la niñez, la mayoría de los mexicanos consumidores han preferido los hongos frescos (75.5%) comparados con los enlatados (21.3%) o los silvestres (3.2%) (Mayett et al. 2006). Los hongos frescos son preferiblemente comprados en mercados públicos (67.2%), supermercados (14.7%), tianguis (8.6%), tiendas verdes (2.7) y otras localidades (6.8). La mayoría de los consumidores mexicanos no están bien informados sobre los beneficios nutritivos y saludables de los hongos, por lo que ellos no son propensos a comprar hongos en comparación con otros alimentos considerados como saludables (Mayett et al. 2006). 9 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus PRODUCCIÓN Agaricus bisporus es producido comercialmente sobre materias primas composteadas con diferentes combinaciones de heno, rastrojo, cáscara de semilla de algodón, olote, pasto, estiércol de pollo y de caballo, corteza de árbol, harina de semillas de algodón y de soya, desechos de destilación de etanol y yeso. Estos materiales son mezclados y humedecidos al empezar el proceso (Fig. 2). Desde los 1950’s el proceso de composteo se ha dividido en dos fases distintas. La Fase I generalmente se desarrolla a la intemperie sobre el suelo o en un bunker aireado, mientras que la Fase II de composteo se desarrolla en interiores (“Indoor”) en túneles, en anaqueles o en charolas. Una descripción del proceso de composteo comienza con una discusión de la Fase I: Fase I de composteo – Inicio de la composta La Fase I de composteo es el paso en donde las materias primas son mezcladas, humedecidas y apiladas o colocadas en un bunker aireado. En unas cuantas horas, la pila empieza a calentar debido a la actividad de los microorganismos que crecen en ella. Este proceso tarda siete días según las condiciones de los materiales en el inicio. Aquellos materiales que están parcialmente mojados o parcialmente degradados pueden requerir menos tiempo en esta fase. Las pilas pueden ser volteadas dos o tres veces para mezclar el agua y redistribuir las materias primas para desarrollar una composta más homogénea y húmeda. Se agrega tanta agua como sea posible en esta etapa para proveer a los microorganismos con la humedad adecuada y eventualmente proveer al champiñón con el óptimo de humedad para su fase de crecimiento. Figura 2. Materias primas para la composta antes del mezclado (izquierda), humedecido y apilado (derecha) (México). Fase II de composteo – Terminación de la composta Los propósitos de la Fase II son pasteurizar la composta, reducir la cantidad de amonio presente y desarrollar una composta selectiva para el champiñón. La pasteurización es necesaria para eliminar hongos indeseables, insectos y nemátodos que pueden causar enfermedades, daño o alteraciones durante el desarrollo del champiñón. La Fase II puede durar 6-8 días según la habilidad de la población de microorganismos para convertir el amonio en proteína microbiana. Esta proteína puede ser utilizada por el hongo como alimento. Puesto que el amonio es tóxico para el champiñón en niveles superiores al 0.1%, es necesario reducir su cantidad en la composta por debajo de este nivel. La mayoría de la gente puede detectar amonio en el ambiente con el olfato, en niveles inferiores al 0.1%, por lo que es una muy buena regla el reducir el nivel de amonio a niveles debajo del umbral humano de detección. La producción de composta selectiva para el crecimiento de A. 10 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus bisporus, pero no para otro hongo, es crítica para alcanzar el éxito del cultivo comercial del champiñón. La Fase II es un proceso controlado que puede ser realizado a granel, en túneles, o en anaqueles o charolas (Fig. 3). La tendencia en años recientes es conducir la Fase II en túneles especialmente diseñados para este propósito. La ventaja de los túneles incluye el manejo en volumen de la composta, con menos mano de obra y condiciones ambientales más uniformes, que resultan en una composta más uniforme. Como desventaja, la construcción de túneles puede requerir mayor inversión. A B C D Figura 3. Llenado de las naves. Fase I de composteo del champiñón, en EUA (A) o en túneles de Fase II, en México (B) y en China (C,D). Semilla, siembra e incubación La semilla consiste en un grano esterilizado u otro material apropiado que es colonizado por el micelio del hongo y usado para sembrar la “composta”. La semilla es producida generalmente con un cultivo puro de micelio de una cepa de la variedad que ha sido desarrollada y seleccionada por sus características productivas. Estas cualidades deben incluir la productividad, el color del píleo (sombrero) resistencia a enfermedades, textura, etc. Dos tipos de cepas de hongo que son usados comercialmente incluyen híbridos blancos y oscuros (cafés). El híbrido blanco fue desarrollado en los años 1980’s por Gerda Fritsche, en Holanda, al cruzar una cepa suave blanca con una “off white” (con escamas). Estas cepas han llegado a dominar la industria en el mundo y ahora son ofrecidas por todas las compañías de semilla. La producción de semilla es una tarea técnica que requiere mantenimiento de las cepas, prueba de inóculo e inoculación aséptica de grano estéril para producir un producto de alta calidad. Por lo 11 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus tanto, la mayoría de los productores confían en compañías de producción de semilla que se han especializado en este tipo de negocio para asegurar su propia calidad. La mayoría de compañías que producen semilla ofrecen instrucciones y asistencia técnica a los cultivadores que compran su semilla. A B C D E F Figura 4. Examen de la semilla (A), siembra a mano en bolsas de plástico (B) o con máquina (C), transporte en carreta de la composta inoculada hacia la nave de cultivo (D, China), paquetes de composta Fase II sembrada saliendo de la máquina compactadora (E) y pila de paquetes listos para envío al cultivador (F, España). Una vez que el tipo apropiado de semilla ha sido seleccionado, el cultivador debe sembrarlo, es decir, mezclarlo con la composta o sustrato. Según el país y el cultivador, la siembra puede ser hecha a mano o con máquina (Fig. 4). Algunas máquinas sembradoras hidráulicas han sido 12 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus desarrolladas para este propósito, para usarlas en las camas de cultivo. Después de la siembra sigue la incubación. Cuando los cultivadores usan túneles para incubar el sustrato a granel, inoculan la composta al momento de llenar los túneles (Royse y Beelman 2007, Chang 2006). En estos casos, a esta etapa de incubación se le denomina Fase III. Los paquetes de composta (Fase II o Fase III) así obtenidos pueden ser enviados a los cultivadores para ser colocados en camas para incubarlos o bien ya para aplicar la tierra de cobertura (Samp 2006, Fig. 4). Sin considerar la forma en que la semilla es inoculada en la composta, es importante el control de la temperatura, la humedad y la concentración de CO2 durante la incubación para alcanzar una producción máxima de hongos. Suplementación de la composta con nutrientes en la siembra y al aplicar la tierra de cobertura Los trabajos de Schisler y Sinden (1962) y Sinden y Schisler (1962) demostraron que al agregar algunos suplementos ricos en proteínas en la siembra durante la aplicación de la tierra de cobertura de estimulaba la producción y que se obtenían mayores rendimientos cuando los suplementos eran agregados al aplicar la tierra de cobertura en vez de aplicarlos en la siembra. Esta diferencia era debida a la habilidad del hongo a utilizar mejor los suplementos en esta etapa. La adición de suplementos en la siembra causaba excesivo calentamiento y estimulaba el desarrollo de hongos competidores que interferían con la producción. Carroll y Schisler (1976) desarrollaron los nutrientes de disponibilidad retrasada para ser agregados al momento de la siembra. La condición de disponibilidad retrasada de los suplementos fue lograda al encapsular micro gotas de aceite vegetal con una cubierta de proteína que fue desnaturalizada con formaldehído. Este tratamiento superó las limitaciones de agregar nutrientes no composteadas en la siembra e incrementó la producción en 60% y aún más. El suministro de los nutrientes de disponibilidad retrasada era observable por la estimulación de la producción más allá de las primeras cosechas. Actualmente se encuentran en el mercado marcas comerciales de nutrientes de disponibilidad retrasada vendidos por muchas compañías productoras de semilla y de suplementos y prácticamente todos los cultivadores en Norteamérica y Europa suplementan sus cultivos con estos nutrientes. Hay un número considerable de suplementos disponibles con un variado contenido de proteína y de grasa (Wach y Wheeler 1998). Estos suplementos pueden ser usados para producir el efecto deseado (incrementar la producción y el beneficio) al conjugar las condiciones de uso con el beneficio potencial; por ejemplo: un suplemento con alto contenido de proteína y bajo en grasa puede tener el beneficio potencial más grande de rendimiento pero puede ser el último en perdonar una calidad pobre en la composta, una inadecuada capacidad de manejo del aire, del equipo de mezclado eficiente o del nivel de experiencia del cultivador. Por otra parte, un suplemento con bajo contenido en proteína y bajo contenido de grasa puede ser más conveniente para ambientes de cultivos con menor capacidad de manejo del aire y cultivadores menos experimentados. La mayoría de los proveedores de suplementos proporcionan las instrucciones de uso de sus productos. Tierra de cobertura La tierra de cobertura es una mezcla de varios ingredientes aplicados a la composta ya colonizada para estimular la formación de primordios y proveer el agua para la maduración de los carpóforos. La tierra de cobertura puede consistir de turba neutra, suelo, fibra de coco, periódico, composta usada de hongo y otros materiales convenientes (Fig. 5). La turba se ha vuelto muy popular entre los cultivadores en los últimos años por su capacidad superior de retención de agua y porque no requiere pasteurización antes de usarse. Además, se agrega cal agrícola para incrementar el pH alrededor de la neutralidad y suministrar calcio para el desarrollo de los hongos. Hasta el 46% del 13 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus agua que necesitan los hongos para su desarrollo puede provenir de la capa de tierra de cobertura (Karlberer 1991). En años recientes la tendencia de muchas plantas de cultivo es aplicar la tierra de cobertura con una humedad muy cercana a la capacidad de retención de agua. Esto reduce el número de riegos que se requieren después de haber aplicado la tierra de cobertura sobre la composta. Inóculo de cobertura (IC) El inóculo de cobertura es la mezcla de turba, vermiculita y salvado de trigo que ha sido esterilizada, enfriada e inoculada con micelio. Una vez que el micelio ha colonizado, el IC es usado para inocular la capa de tierra de cobertura que se aplicará a la superficie de la composta para que el crecimiento del micelio sea más rápido y uniforme. El micelio del IC comenzará a crecer en la tierra de cobertura que le rodea y después conectará con el micelio de la composta. Esta conexión con el micelio de la composta es vital, si no, el IC morirá. El uso de IC mejora la limpieza de los hongos e incrementa el número de cortes por cultivo o el número de cultivos por año. El IC puede también ser usado para cubrir la superficie de la composta para que una conexión temprana pueda hacerse entre el IC en la tierra de cobertura y el micelio de la composta. Spear (1998) describió la técnica ‘sandwich” en la cual se cubre la superficie de la composta con IC (250 g IC/m2 de superficie de composta) inmediatamente después de sembrar. La cobertura es aplicada en el día 6 después de la siembra en lugar de los tradicionales 14 días. Al usar IC para cubrir la superficie, es posible obtener producciones una semana más temprano. La aplicación de IC en la superficie es una medida adicional que permite a los cultivadores ajustar sus tiempos de producción a los picos de demanda en períodos festivos y otras ocasiones. Figura 5. Paquetes de composta inoculada en incubación en anaqueles (A, España). Paquetes de composta colonizada con tierra de cobertura en anaqueles (B, España). Producción y cosecha La producción de hongos ocurre en oleadas llamadas cortes o cosechas, en las cuales el pico de cosecha se presenta aproximadamente cada siete días. La mayoría de los cultivadores realiza 2-4 cortes y termina el ciclo porque la producción declina rápidamente después del segundo corte. El riego es considerado muchas veces más como un arte que como una ciencia. En general, la mayor cantidad de agua posible es agregada al suelo de cobertura sin que drene hacia la composta que le soporta. Durante la incubación posterior a la aplicación de la tierra de cobertura, el riego debe ser aplicado tan pronto como sea posible, evitando sellar los poros de la superficie del suelo 14 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus de cobertura. Si se aplica mucha agua en una sola ocasión, los espacios con aire en la cobertura pueden ser llenados y sellar el movimiento de aire. En general, aproximadamente 500 ml de agua/m2 de superficie de producción pueden ser aplicados en una sola ocasión. Para controlar la temperatura tanto del aire como de la composta durante el proceso, se usa aire fresco del exterior. Este aire reduce el nivel de bióxido de carbono producido por el micelio en crecimiento y la maduración de los hongos y, puesto que más crecimiento ocurre durante los dos primeros cortes, más aire es requerido durante este período. El manejo adecuado del aire interior en la nave de producción es esencial para una producción óptima. Para hacer circular el aire que ha sido acondicionado en temperatura y humedad se usan ventiladores. El calentamiento y enfriamiento puede ser originado con serpentines de agua caliente o fría mientras que la humedad puede ser agregada al aire por una neblina fría o vapor, o por simple mojado de las paredes y pisos. A B C D Figura 6. Hongos Portobello madurando en camas (A, EUA), cosechadores examinando la madurez de los hongos en charolas (B, EUA), cosecha de hongos sobre las charolas en movimiento en una línea de producción (C, España) y de camas estacionarias (D, México). Los hongos son cosechados en un ciclo de 7-9 días, dependiendo de la temperatura, la humedad, el cultivar, y el estado en el cual son cosechados. Cuando se cosecha, un inhibidor del desarrollo de los hongos es removido y la siguiente oleada empieza a madurar inmediatamente en las camas. En Norteamérica los consumidores generalmente prefieren hongos cerrados (sin el velo roto) blancos u oscuros (Crimini). Sin embargo, en los últimos años los hongos oscuros abiertos (Portobello, Fig. 6A). Se han vuelto muy populares entre los consumidores. Los hongos son cosechados de las camas o charolas en los cuartos donde se encuentran creciendo. En algunas plantas, sin embargo, las charolas pueden ser desplazadas hacia una línea de cosecha donde los cosechadores toman los hongos a medida que se mueven lentamente a lo largo de ellos. (Fig. 6C). 15 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Sustrato gastado de los hongos (SGH) Al fin del proceso, los cuartos de cultivo son cerrados y pasteurizados con vapor para matar las plagas que pudieran estar presentes en la composta o en la estructuras de la nave de cultivo. Esto minimiza la probabilidad de infestar el siguiente cultivo cuando se llenan las camas nuevamente. El SGH (Fig. 7) es el material que queda una vez que el cultivo termina. Desechar el SGH puede ser un problema para los cultivadores, especialmente en comunidades donde muchos cultivadores producen grandes cantidades de SGH. Hay muchos usos para este valioso producto, incluyendo la incorporación del SGH como “mulch” en el suelo, la aplicación en plantaciones en producción, el uso como suelo en invernaderos o la reutilización como suelo de cobertura. Es especialmente útil para suprimir los hongos del género Sphaerobolus presentes en el mulch (Davis et al. 2005). Estos hongos producen masas de esporas pegajosas del tamaño de la cabeza de un alfiler que son descargadas con fuerza hacia superficies iluminadas como las paredes de una casa o de los vehículos cercanos. Una vez que esta masa se seca, es prácticamente imposible removerla sin dejar manchas sobre la superficie. El uso de 20-40% de SGH en el mulch puede suprimir efectivamente estos hongos. Figura 7. Sustrato gastado de los hongos (SGH) al momento de transferirla a un camión (izquierda, EUA) y un camión lleno con SGH saliendo de una planta de cultivo (derecha, EUA). REFERENCIAS Anónimo (2007) A mushrooming industry. Food production daily. Europe. http://foodproductiondaily.com/news/ng.asp?id=69917-mushrooms-shiitake (Accessed April 4, 2007). Carroll DA, Schisler LC (1976) Delayed release nutrient supplement for mushroom culture. Appl. Environ. Microbiol. 31:499-503. Chang ST (2005) Witnessing the development of the mushroom industry in China. In: Tan Q, Zhang J, Chen M, Cao H, Buswell JA (eds) Proceedings of the 5th International Conference on Mushroom Biology and Mushroom Products 8-12 April 2005, Shanghai, China, Acta Edulis Fungi 12 (supplement). 3-19. Chang ST (2006) The world mushroom industry: trends and technological development. Int. J. Med. Mush. 8:297-314. Davis DD, Kuhns LJ, Harpster TL (2005) Use of mushroom compost to suppress artillery fungi. J. Environ. Hort. 23 (4), 212-215. Dubost NJ, Beelman RB, Peterson D, Royse DJ (2006) Identification and quantification of ergothioneine in cultivated mushrooms by liquid chromatography-mass spectroscopy. Int. J. Med. Mush. 8:215-222. Dubost NJ, Beelman RB, Royse DJ (2007) Influence of selected cultural factors and postharvest storage on ergothioneine content of common button mushrooms (Agaricus bisporus). Int. J. Med. Mush. 9: (in press). 16 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Fletcher J (2001) 15th International Congress on the Science and Cultivation of Edible Fungi, Maastricht, The Netherlands: 15 – 19 May, 2000. BSPP News Spring 2001 – Online Edition, http://www.bspp.org.uk/bsppnews/bsppnews38/bsppnews38-13.htm (Accessed April 4, 2007). Fritsche G (1981) Some remarks on the breeding, maintenance of strains and spawn of Agaricus bisporus and A. bitorquis. Mush. Sci. 11:367-385. Kalberer PP (1991) Water relations of the mushroom culture (Agaricus bisporus): Influence on the crop yield and on the dry matter content of the fruit bodies Mush. Sci. 13:269-274. Lucier G, Jerardo A (2005) USDA. Vegetables and melons outlook. VGS-310. Pp 21-22. http://www.ers.usda.gov/publications/vgs/aug05/vgs310.pdf (Accessed April 4, 2007). Lucier G, Allshouse J, Lin BH (2003) USDA. Factors affecting U.S. mushroom consumption. VGS 295-01. 11 pp. Mayett Y, Martinez Carrera D, Sanchez M, Macias A, Mora S, Estrada-Torres A (2006) Consumption of edible mushrooms in developing countries: The case of Mexico. J Int. Fd & Agribus. Mar. 18:151-176. Patterson PM (2003) Mushroom buyers: A segmentation analysis. Report prepared for the Mushroom Council. http://www.mushroomcouncil.org/docs/MushroomBuyerSegmentationAnalysis.pdf (Accessed April 27, 2007). Royse DJ, Schisler LC (1980) Mushrooms: their consumption, production and culture development. Interdiscip. Sci. Rev. 5:324-332. Royse DJ, Beelman RB (2007) Six steps to mushroom farming. College of Agricultural Sciences, The Pennsylvania State University, University Park, PA. Samp R (2006) Recent developments & future possibilities in the Agaricus spp. (button) mushroom industry – Part 1. Mushroom News 54(3):12-23. Schisler LC, Sinden JW (1962) Nutrient supplementation of mushroom compost at spawning. Mush. Sci. 5:150-164. Sinden JW (1971) Ecological control of pathogens and weed molds in mushroom culture. Ann. Rev. Phytopathol. 9:411-432. Sinden JW, Schisler LC (1962) Nutrient supplementation of mushroom compost at casing. Mush. Sci. 5:267280. Spear M (1998) Sandwich technique. Mush. News 46(7):24-29. United States Department of Agriculture (USDA) (2006) Mushrooms. National Agricultural Statistics Service, Agricultural Statistics Board. Washington, D.C. Van Griensven LJLD (1988) The Cultivation of Mushrooms. Mushroom Experimental Station, Horst, the Netherlands, 515 pp. Vedder PJC (1978) Modern Mushroom Growing. Hauser Champignonkulturen AG, Gossau-Zurich. Wach MP, Wheeler DW (1998) Mushroom supplements: what they are & why we use them. Mush. News 46(7):10-16. 17 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus II. EL GENERO AGARICUS Philippe Callac INRA-MYCSA UPR 1264, Mycologie et Sécurité des Aliments B.P.81 33883 VILLENAVE D'ORNON Cedex, Francia. <[email protected]> RESUMEN El género Agaricus se compone de especies muy populares recolectadas o cultivadas cuyo interés no es solamente alimenticio. La biodiversidad dentro del género es poco conocida, tanto a nivel interespecífico como intraespecífico. Después de situar al género dentro de la clasificación del reino fungi, se describen las principales secciones que lo componen. Algunas nociones de filogenia son recordadas y los resultados recientes sobre la clasificación de especies según su historia son mencionados. Los análisis filogenéticos o de genética de poblaciones son útiles para apreciar la pertinencia de caracteres empleados en taxonomía tradicional. Por ejemplo, el olor es un criterio pertinente a nivel de las secciones mientras que el color del sombrero no lo es, aún a nivel de especies. Después de recordar algunas nociones de especie biológica y sobre los diversos tipos de ciclos de reproducción, el concepto de especie en el género Agaricus es abordado a través de ejemplos que ilustran la diversidad de situaciones que los biólogos, los mejoradores o los ecólogos pueden encontrar. El acento es puesto en la importancia de la variabilidad intraespecífica. Palabras clave: Agaricus, biodiversidad, concepto de especie, ciclo de reproducción, filogenia, hongos comestibles INTERÉS DE LA BIODIVERSIDAD DEL GÉNERO AGARICUS Recolección, domesticación, cultivo y mejoramiento de las especies comestibles. Los hongos del género Agaricus son comúnmente recolectados en la naturaleza y frecuentemente consumidos sin que la especie sea rigurosamente determinada. El resultado es que, entre estos hongos, por ejemplo, en Francia, se encuentran las principales especies responsables de envenenamiento. Afortunadamente ninguna especie del género es mortal por simple ingestión. Solo se trata de problemas gastrointestinales menores que no conllevan a una hospitalización prolongada. Las especies tóxicas conocidas pertenecen todas a la sección Xanthodermatei y poseen características comunes que son indicadas más adelante. Por lo tanto, es importante circunscribir las especies y conocer su parentesco. Finalmente, existen numerosas especies raras en las cuales la comestibilidad permanece desconocida. Una decena de especies es cultivable, entre las cuales, A. bisporus es la más cultivada en el mundo. Bajo reserva de descubrimientos posteriores, porque muchas especies no han sido objeto de pruebas de fructificación, parece que las especies cultivables pertenecen a ciertas secciones del género (principalmente las secciones Duploannulati y Arvenses). La aptitud para el cultivo está en relación con la ecología de la especie, sus interacciones con los microorganismos y su potencial enzimático para la degradación de sustratos. Todas esas características, han sido adquiridas a lo largo de la evolución y no es sorprendente que algunas especies filogenéticamente cercanas puedan ser cultivables, pero no es una regla absoluta. Para las especies cultivadas, la diversidad intraespecífica representa la base genética disponible para la creación varietal. Diferentes criterios, como las posibilidades de cruzamientos, de fructificación haploide, de regeneración de protoplastos o de transformación con Agrobacterium tumefaciens, varían según los individuos, aún entre poblaciones. Las estrategias de selección son definidas en función de esos criterios biológicos, de la base genética disponible, y claro está, de los objetivos fijados. Los objetivos de selección pueden ser 19 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus culturales (rendimiento, resistencia a patógenos, adaptación a un ambiente, a un sustrato, o a un tipo de cosecha, o de conservación después de la cosecha), o referirse a la forma, el color, la firmeza, la composición química en los diversos elementos que intervienen en el sabor, el olor, el valor nutritivo o el riesgo de toxicidad. Existe diversidad en las poblaciones naturales para todos esos criterios, aún cuando no aparecen directamente en la naturaleza. Propiedades medicinales y bioproductos. El consumo de ciertas especies de Agaricus es recomendado desde el punto de vista terapéutico, incluso preventivo. No hay duda de que existe un potencial importante y que la investigación de moléculas biológicamente activas debe continuarse en todas las especies comestibles o no. Conviene mantenerse prudente porque los efectos de las biomoléculas y los productos derivados del micelio o de los esporóforos son todavía mal conocidos. Por ejemplo, el interés antibiótico del ión 4-hydroxybenzenediazonio presente en A.xanthodermus (Dornberger et al.1986) ha sido frecuentemente citado; pero Toth et al. (1989) mostraron que este ión es potencialmente cancerígeno. Las especies de Agaricus son también utilizadas para la producción de moléculas de interés más general, como por ejemplo, la tirosinasa producida a partir de A. bisporus. El propósito no es hacer aquí una revisión de bioproductos, pero de insistir sobre el interés de la biodiversidad. Existen cepas de especies raras en colección que podrían poseer actividades y moléculas potencialmente útiles. La circunscripción de especies es por lo tanto esencial para poder probar racionalmente su potencial. En caso de descubrimiento de una especie con propiedades interesantes, los datos filogenéticos son útiles para buscar esta propiedad en las especies emparentadas. Así mismo, los datos sobre la distribución de una especie y sobre las divergencias entre sus poblaciones son útiles para analizar la variabilidad de esta propiedad o del contenido de un compuesto en el seno de la especie. En contraposición, esta biodiversidad sería poco útil para proyectos basados sobre la transformación genética y que tuvieran como objetivo producir moléculas a partir de genes externos al género. Ecología y comprensión de los procesos evolutivos. Los hongos del género Agaricus son saprófitos generalmente humícolas. Muchas especies son frecuentes en medios abiertos graminícolas, mientras que otros prefieren los bosques. Algunos tienen hábitos particulares, por ejemplo, A. menieri que crece solo en las dunas. En la sección Duploannulati, todas las especies pueden ser encontradas bajo los cipreses u otros Cupressaceae. Ciertas especies son oportunistas y crecen sobre los desechos vegetales, otras se instalan por largo tiempo en bosques o en el pasto. En breve, existen numerosos comportamientos diferentes, es por lo tanto, difícil en el estado de conocimiento actual, precisar la importancia del papel ecológico de las especies. Por lo mismo, es difícil evaluar la eventual expansión o reducción de sus áreas de distribución salvo para algunas especies comunes o que han sido particularmente estudiadas, como A. bisporus de la cual nosotros conocemos poblaciones naturales desde hace 15 años. Solo algunas especies parecen proliferar o rarificarse al mismo tiempo que su biotipo predilecto o en función de aportes nitrogenados. Sin embargo, por precaución, deberá considerarse que todas las especies raras están en peligro, es decir, la mayoría de las especies del género. El comprender mejor la aptitud de estas especies para degradar la materia orgánica es uno de los próximos retos asociados al proyecto de secuenciación de A. bisporus, que iniciará en 2008. La filogenia de las especies, asociada a la comparación de sus metabolitos secundarios (en particular aquellos que tienen efectos tóxicos o que están involucrados en el olor) aportarán una idea más precisa de su evolución que la simple comparación de caracteres morfológicos, dentro de los cuales no se sabe todavía cuáles son ancestrales. Finalmente, es de hacer notar que además de su potencial de degradación de biomasa, Agaricus spp son también agentes potenciales de bioremediación como por ejemplo A. urinascens (syn. A. macrosporus; García et al. 2005) y que para esos dos potenciales la variabilidad entre y 20 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus dentro de las especies queda por estudiar. La conservación de la biodiversidad del género no consiste simplemente en conservar el máximo de especies sino mas bien conservar las poblaciones, que sean de la misma especie o no, y más particularmente, aquellas que tuvieran un interés alimenticio o medicinal o que tuvieran un papel efectivo o potencial mayor para la degradación de sustratos naturales o no. EL GÉNERO AGARICUS EN LA CLASIFICACIÓN En la antigüedad, Agaricum designaba un hongo arborícola y fosforescente (Plinio) que no podría ser otro que Omphalotus olearius y/o una especie del género Armillaria. En Francia, el uso de la palabra agaric para designar diversos hongos está confirmado desde 1256 (Aldebrant de Sienne). Dentro del sistema binario, fue el botánico francés Tournefort (1694) el primero en utilizar el nombre genérico Agaricus, aunque refiriéndose a hongos de la madera. Posteriormente, el botánico sueco Carl von Linnée (1735) el primero en utilizar el nombre genérico Agaricus, principalmente para hongos terrícolas con láminas y pié. El género fue rebautizado Pratella (en latin « que crece en los prados ») por Gray, y después Psalliota (del griego psallion, anillo) por Kummer. Actualmente el término Agaricus es de nuevo utilizado. El sistema de clasificación en vigor en nuestros días está basado en el de Linnée (1735) que creía que las especies eran fijas desde la creación. Esto puede parecer sorprendente porque desde esta época la sistemática ha tomado en cuenta la teoría de la evolución (Darwin 1859). En efecto, su objetivo no es nada más clasificar las especies agrupándolas según sus similitudes, sino también según un sistema natural que refleja el proceso de la evolución, es decir, según su origen, su historia y su parentesco. Los taxones son entidades de clasificación jerarquizada. Por ejemplo, la variedad « Agaricus bisporus var. burnettii » pertenece a la especie « Agaricus bisporus » que pertenece a la sección « Agaricus sect. Duploannulati » que pertenece al género « Agaricus ». Es también posible definir subespecies, subsecciones y subgéneros. No es necesario aquí considerar toda la clasificación del reino Fungi; pero para comprender lo siguiente falta precisar que el género Agaricus pertenece a la familia de los Agaricaceae (Vellinga 2004) en el clado de los Euagarics o Agaricales (Matheny et al. 2006) en el phylum de los Basidiomycota. Los Basidiomycota están caracterizados por sus células reproductivas que producen meiosporas hacia el exterior, llamadas basidiosporas (Fig. 1). En el basidio, la cariogamia, la meiosis y la esporogénesis se desarrollan sucesivamente. En los Agaricaceae, las especies comestibles reconocidas que no pertenecen al género Agaricus son poco numerosas y son principalmente las siguientes: Langermania gigantea, Macrolepiota procera y Leucoagaricus leucothites. Esta última especie es menos conocida pero cultivable con un rendimiento elevado (Brian et al. 1981); la producción no ha sido estimulada porque su difusión podría acarrear una confusión en los consumidores, que son también colectores, con las amanitas blancas mortales. Por otra parte, Lycoperdon marginatum y L. mixtecorum son utilizados como alucinógenos por los Mixtecos del sur de Oaxaca, México. Finalmente, es de hacer notar que existen especies mortales como Lepiota brunneoincarnata (síndrome faloidiano). 21 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Figura 1. Los diferentes ciclos de reproducción. El color del núcleo (blanco o negro) representa el alelo de incompatibilidad sexual portado por su nucleo. En el esquema del pseudohomotalismo, la distribución de los productos de la meiosis dentro de las esporas no es aleatorio porque los dos núcleos que migran dentro de cada espora portan dos alelos de incompatibilidad diferentes (en A. bisporus). Dentro del esquema del homotalismo el basidio puede también ser bispórico. No existe una especie únicamente pseudohomotalica, sino especies anfitálicas cuyos esporóforos producen a la vez basidios bispóricos y basidios tetraspóricos. Las dos divisiones meióticas son generalmente seguidas de una división mitótica. 22 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Reconocer un hongo perteneciente al género Agaricus es relativamente fácil. La gran mayoría de las especies de este género presentan un conjunto único de características: Al inicio de su desarrollo, el esporóforo joven está encerrado en una envoltura llamada velo general, que se rompe rápidamente al mismo tiempo que el esporóforo aumenta de tamaño. Otro velo, denominado parcial, liga el margen del pileo al estípite y se rompe al mismo tiempo que el sombrero se abre como un paraguas. En la madurez, el esporóforo está constituido de un estípite montado por un sombrero bajo el cual las láminas están dispuestas radialmente. Estas láminas tapizan el himenio constituido de células estériles (cistidios) y de basidios productores de esporas color café que en masa le confieren un color café oscuro o café chocolate. Al romperse, los velos dejan restos que decoran el sombrero y el estípite; en particular este último presenta uno o varios anillos que pueden descender desde lo alto del pié (anillo descendente) o al contrario, ascender desde la base del pié (anillo ascendente). Gracias al análisis filogenético, algunas especies raras denominadas secotioides, que abren el sombrero solo parcialmente en la madurez, han sido incluidas dentro del género Agaricus. Así, Gyrophragmium dunalii ha sido rebautizada Agaricus aridicola (Geml et al. 2004; Fig. 2-c). De la misma manera, pero en un rango taxonómico superior, los géneros enteramente constituidos de especies gasteroides (esporóforos en forma de bola), como Lycoperdon han sido agregados a la familia Agaricaceae. Distinguir las especies del género Agaricus es bastante difícil, porque los caracteres distintivos morfológicos, organolépticos, bioquímicos o ecológicos son poco numerosos y susceptibles de variar no solamente dentro de una especie, sino también en función del ambiente; por esta razón se necesitan en teoría numerosas muestras para describir rigurosamente una especie dentro de su diversidad, lo que no es posible por las numerosas especies raras del género Agaricus. Delimitar las especies y dotarse de medios fiables para reconocerlas es una etapa necesaria para el estudio de la biodiversidad dentro de este género. LAS PRINCIPALES SECCIONES DEL GÉNERO AGARICUS Las grandes secciones tradicionalmente reconocidas en regiones templadas de Europa (cf. Cappelli 1984; Courtecuisse y Duhem 1994, Nauta 2001) y de América del Norte (cf. Kerrigan 1986) son las siguientes: La sección del champiñón de París. Ha tenido diferentes nombres como Agaricus sect. Hortenses o actualmente Agaricus sect. Duploannulati. En general, el contexto se torna rosado al corte, el olor es agradable (champiñón de París, o vecino) y cuando se jala sobre el anillo se arranca un fragmento hacia la base del pié (anillo ínfero). En el caso de algunas especies como el champiñón de París, el anillo es algodonoso y generalmente se separa a la tracción (anillo intermedio); A. cupressicola es una excepción puesto que la tracción ejercida arranca un pedazo hacia lo alto (anillo súpero). A excepción de esta última especie, en la cual la comestibilidad no es conocida, todas las especies de esta sección son comestibles. La reacción de Schäffer es negativa (ausencia de reacción coloreada sobre el sombrero o el pié después de la acción conjugada de anilina y del ácido nítrico). Su habitat natural es variable pero todas pueden ser encontradas bajo cipreses. Todas las especies que nosotros hemos estudiado se encuentran tanto en América del Norte como en Europa, salvo A. cupressicola que solo es conocida en Europa y que crece casi exclusivamente sobre las cupressaceas. Todas las especies son cultivables salvo A. cappellianus pero solo dos de ellas son explotadas comercialmente: A. bisporus el champiñón de París cuyo cultivo está confirmado en Francia desde la mitad del siglo XVII, y A. bitorquis, el champiñón de las banquetas. Las otras especies cultivables son A. subfloccosus (Fig. 2d; Noble et al. 1995; Callac 1994), A. devoniensis (Fig. 2a; Callac et al. 2005b) y A. cupressicola (Fig. 2f). 23 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Figura 2. Algunas especies de Agaricus silvestres o cultivados. a. Agaricus devoniensis CA 58 fructificación en cultivo. Aislamiento por cultivo de tejido de un especimen colectado en Plouharnel, Francia, bajo Cupressus macrocarpa. b. Agaricus subrufescens CA 438A. fructificación en cultivo. Aislamiento en cultivo monospórico de un especimen encontrado en España por Pedro Arrillaga (cf. Arrillaga y Parra 2006). c. Agaricus aridicola (= Gyrophragmium dunalii) CA 101 (=GYR). Especimenes secotioides encontrados en la isla de Oléron, Francia, en la duna, por J. Guinberteau. Una secuencia de GYR fue utilizada por Geml et al (2004) quienes renombraron esta especie. d. Agaricus. subfloccosus CA 70 (= Sf 5) Fructificación en cultivo. Aislamiento por cultivo de tejidos de un especimen colectado en Dinard, Francia, que crecía en compañía de A. bisporus bajo C. macrocarpa (cf. Challen et al. 2003). e. Agaricus bisporus var. eurotetrasporus Bs 423. Fructificación en cultivo. Aislamiento por cultivo de tejido de un especimen colectado en Olonne-sur-mer, Francia, bajo C. macrocarpa, esporóforo haploide, basidios en gran mayoría tetraespóricos. (cf. Callac et al. 2003). f. Agaricus cupressicola CA 72 (= Cp 1) Fructificación en cultivo. Aislamiento por cultivo de tejidos de un especimen colectado en Olonne-sur-mer, Francia, bajo C. macrocarpa (cf. Challen et al. 2003). Todas las cepas CA están depositadas en la Colección del Germoplasma del género Agaricus de Burdeos (CGAB).Todas las fotos son del autor o de Jacques Guinberteau. Todos los especimenes fotografiados fueron cultivados en el INRA de Burdeos, con excepción de la Figura 2c. 24 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Una sección vecina (Agaricus sect. Chitonioides) está en curso de reconstrucción filogenética y solo contiene especies raras, con excepción de A. bernardii cuyo olor poco atractivo -a humedaddesaparece con la cocción; esta especie es también cultivable. La sección de los Agaricus tóxicos (Agaricus sect. Xanthodermatei) Tiene al menos 21 especies de las cuales siete no han sido nominadas o han sido nominadas muy recientemente como A. tollocanensis encontrada en la región de Toluca, México (Callac y Mata 2005). Todas estas especies están caracterizadas por su olor más o menos fuerte a fenol, algunas veces más particularmente en la base del pié después de una herida. Este olor está asociado a su toxicidad debida a compuestos fenólicos responsables de problemas gastrointestinales sin mayor gravedad. Con las especies de esta sección, cuando se jala sobre el anillo se arranca un pedazo hacia la parte alta del pié (anillo súpero). Finalmente, la mayor parte de especies tienen un contexto que se amarillenta cuando se rasca el pié, algunas especies de la sección sin embargo cambian a rosado. La reacción de Schäffer es negativa. Al contrario de la sección precedente, y exceptuando A. iodosmus y la especie comun A. xanthodermus, las especies de esta sección solo se encuentran en un solo continente (América o Europa). El interés de cultivar estas especies no comestibles es limitado y no ha sido intentado sistemáticamente. Se observa sin embargo que A. pseudopratensis fructifica en cultivo. La sección del rosado de los prados (Agaricus sect. Agaricus) Las especies de esta sección tienen un anillo súpero y un contexto que se torna rosado al corte. La reacción de Schäffer es negativa. Las especies de esta sección son difíciles de distinguir. El rosado de los prados es muy popular y frecuentemente considerado por error, como un champiñón de París silvestre, cuando se trata de A. campestris que crece en los prados. A pesar de su atractivo, las especies de esta sección no han podido jamás ser cultivadas hasta la fructificación, por razones aún desconocidas. La sección de los Agaricus muy enrojecidos (Agaricus sect. Sanguinolenti) En esta sección el anillo es generalmente súpero y el contexto enrojece fuertemente pero existen excepciones. La reacción de Schäeffer es negativa. Se dificulta aislar cultivos micelianos y, cuando esto es posible, el micelio oscurece y crece tan lentamente que no se considera hacerlo fructificar. Aún si se llegan a cultivar estas especies comestibles, como el champiñón de los bosques A. silvaticus, serían difícilmente comercializables por su enrojecimiento seguido de un ennegrecimiento. La sección de los Agaricus con olor a almendra o anís (Agaricus sect. Arvenses y frecuentemente integrado Agaricus sect. Minores). Además de su olor característico, las especies de esta sección están caracterizadas por un anillo súpero, frecuentemente amplio y decorado sobre su fase inferior, por el amarillamiento de la carne y por la reacción de Schäffer positiva. La caracterización y la circunscripción de las especies es particularmente difícil como lo muestran los trabajos de Calvo Bado et al. (2000). Numerosas especies son probablemente cultivadas, como por ejemplo la especie secoioide A. aridicola pero dos solamente son cultivadas comercialmente: A. arvensis y A. subrufescens (Fig. 2b). Es de hacer notar que esta última especie, que ha sido cultivada desde fines del siglo XIX en América del Norte (Kerrigan 2005), ha sido « redescubierta » y cultivada en los años 80 en Brasil y en Francia (Brian et al. 1981) pero bajo los nombres respectivos erróneos de A. blazei y A. purpurascens (= A. porphyrhizon), que son en realidad especies diferentes. Además, el nombre A. brasiliensis propuesto 25 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus por Wasser et al. (2002) es ilegítimo porque ha sido ya utilizado por Fries (1830). Es sin embargo a partir de cepas provenientes de Brasil que se ha desarrollado notoriamente en Asia, un particular interés por esta especie o sus derivados, que presentan, entre otras, propiedades antitumorales y antigenotóxicas ciertas; pero también en algunos casos, propiedades opuestas (Bellini et al. 2006, Nagaoka et al. 2006, Firenzuoli et al. 2007). Curiosamente, mientras que las dos especies A. subrufescens y A. bisporus son filogenéticamente lejanas, presentan similitudes como su repartición amfiatlántica, su crecimiento oportunista sobre desechos vegetales, su ciclo de reproducción anfitálica y su posibilidad de cultivo sobre sustratos similares, pero en condiciones diferentes porque A. subrufescens prefiere temperaturas más elevadas. Una sección más alejada, Agaricus sect. Spissicaules, contiene especies poco conocidas y no es presentada aquí en detalle. Nótese que esta última sección difiere de la sección Arvenses por su olor complejo y la reacción de Schäffer que solo es positiva en la base del pié. EL APORTE DE LA FILOGENIA MOLECULAR Algunos principios. La filogenia es la historia de la descendencia de los organismos vivos. Se debe conservar la idea de que una relación filogenética entre dos entidades naturales se mantiene siempre hipotética aún si parece sólidamente establecida. Esta disciplina basada sobre la teoría de la evolución ha recuperado un interés cierto con la aparición de nuevos métodos de análisis y el uso de nuevos tipos de caracteres moleculares más numerosos que los caracteres tradicionales e insensibles al ambiente. Los métodos actuales se basan sobre la comparación de secuencias de ADN. Cada individuo posee su propia información genética y las moléculas de ADN que le soportan están presentes idénticamente en cada una de sus células. Simplificando, el ADN es una molécula muy larga constituida por dos cadenas (o secuencias complementarias). Una secuencia es un encadenamiento de cuatro tipos de bases (A,T,C,G) cuyo orden determina la información genética transmitida idénticamente de generación en generación, a menos que se produzca una mutación. Las mutaciones son el origen de variaciones encontradas en las secuencias de ADN. Una mutación puntual modifica un par de bases en un lugar dado (o locus) de ADN; este locus es entonces variable (polimorfo), las diferentes formas que él puede tomar se llaman formas alélicas o alelos. Así, por ejemplo, después de una transición C-T en la quinta posición de una secuencia cuyo largo es de 11 bp (pares de bases), se encontraran individuos que portan el alelo C (secuencia ctgacCggta) y otros el alelo T (secuencia ctgacTggtat). Al alinear las dos secuencias una sobre la otra, se detecta muy fácilmente el locus polimorfo y sus dos alelos. Según que la mutación sea muy antigua o relativamente reciente, una de las formas alelas puede caracterizar un grupo de especies, una especie o simplemente individuos dentro de una especie. Ciertos casos son particularmente interesantes: --- Cuando una forma alélica caracteriza un grupo de especies y esta apareció solo una vez después de una sucesión de eventos mutacionales, entonces todas estas especies tienen un ancestro común y constituyen una entidad monofilética; el caracter nuevo heredado de este ancestro común es considerado sinapomórfico. Más generalmente, un grupo monofilético está constituido por todas las especies que derivan de un ancestro común y una sinapomorfia es un carácter derivado (no ancestral) que es compartido por al menos dos taxones. Las sinapomorfias son pertinentes desde el punto de vista filogenético y taxonómico, ya que permiten establecer parentesco. ---Cuando una forma alelélica caracteriza un grupo de especies, pero la mutación que la ha generado se produjo varias veces independientemente, las especies que la poseen constituyen un grupo polifilético. Este fenómeno (homoplasia) muestra bien que un parecido entre dos especies puede ser engañoso en cuanto al parentesco. Más generalmente, un carácter que tiene varios 26 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus origenes es homoplásico y representa una fuente de errores de interpretación. ---Cuando una forma alélica se encuentra en todos los individuos de una especie, y solamente en ellos, el polimorfismo se vuelve útil para caracterizar y circunscribir la especie. ---Si varios caracteres moleculares, morfológicos u otros son compartidos por el mismo grupo de especies, entonces es muy probable que ellas constituyan un grupo monofilético. Por lo tanto es importante utilizar numerosos caracteres moleculares (loci polimórficos) y tomar en cuenta todos los otros tipos de caracteres. Elección de las secuencias y de los métodos. Con excepción de raras especies secotioides que quedarían todavía en otros géneros, el género Agaricus es monofilético. Desde hace algunos años se inició la reconstrucción filogenética de este género. Esto consiste en circunscribir los diferentes taxones en entidades monofiléticas; en otros términos, consiste en modificar la clasificación con la integración de datos filogenéticos. La elección de la región secuenciada de ADN es muy importante y depende del rango taxonómico estudiado. Debe ser suficientemente variable para encontrar las diferencias entre los taxones y no muy variable porque un gran número de mutaciones aumenta el riesgo de homoplasia y no facilita el alineamiento de las secuencias. Para establecer la filogenia de especies (del género Agaricus) y para delimitarlas, las regiones no codificantes « internal transcribed spacers » llamadas ITS1 e ITS2 y consideradas como neutras (ausencia de selección) se revelan particularmente adecuadas. En efecto, para casi todas las especies estudiadas hasta ahora, se han puesto en evidencia polimorfismos específicos. Por el contrario, las secuencias de esas regiones son menos adecuadas para establecer la filogenia de secciones, para las cuales puede ser necesario comparar secuencias de otras regiones de ADN. Después de haber secuenciado y alineado las secuencias de una región de alrededor de 700 bp que incluye los ITS1 e ITS2, los loci polimorfos son tomados en cuenta para los análisis filogenéticos. Estos análisis están basados en diferentes principios y el resultado es representado en forma de un árbol o dendograma que muestra las relaciones entre los taxones. Existen numerosos métodos que no serán detallados aquí, pero es necesario saber que los métodos basados en la distancia entre los taxones no produce realmente árboles filogenéticos a menos de enraizarlos (orientar el sentido de la evolución) con uno o varios taxones extragrupo y de tener razones para considerar que la homoplasia no es significativa. Por el contrario, existen métodos cladísticos basados en el principio de parsimonia (homoplasia minimizada) que toman en cuenta los acontecimientos mutacionales separadamente y producen árboles filogenéticos. Finalmente, existe una serie de métodos probabilísticos. Reconstrucción filogenética. Hasta ahora, dos equipos han publicado árboles filogenéticos que cubren las principales secciones del género Agaricus (Mitchell y Bresinsky 1999, Geml et al. 2004). Estos árboles sostienen en cierta medida las grandes secciones generalmente aceptadas dentro del género. Por el contrario, su parentesco no está bien definido y es imposible circunscribir numerosas especies representadas por un solo espécimen. Otros equipos han preferido estudiar solo secciones del género, pero de manera detallada discutiendo cada especie desde el punto de vista taxonómico. Sobresalen las siguientes grandes líneas para las secciones estudiadas hasta ahora Duploannulati (Challen et al. 2003; Didukh et al. 2005) y Xanthodermati: (Kerrigan et al. 2006) los análisis han confirmado la existencia de nuevas especies de las cuales varias han sido nombradas, en otros casos, las especies han sido sinonimizadas. Algunas especies han sido excluidas o al contrario incluidas dentro de las secciones reconstruidas. Después de esas modificaciones las dos secciones Xanthodermatei y Duploannulati son ambas monofiléticas y contra toda previsión, vecinas. De este hecho, los dos sub 27 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus géneros que separaban el conjunto de secciones en dos grandes grupos (Flavescentes y Rubescentes) según el cambio de color del contexto (resp. amarillamiento y enrojecimiento) no tienen más significado desde el punto de vista filogenético puesto que el carácter de amarillamiento se encuentra en secciones que no están emparentadas (Xanthodermatei y Arvenses). Por el contrario, sería probablemente poco juicioso reagrupar las secciones en función de su respuesta a la reacción de Schäffer. Por otra parte, el hecho que A. cupressicola se encuentre dentro de la sección Duploannulati cuando tiene un anillo descendente, complica también la distinción entre la sección Duploannulati y la sección Sanguinolenti dentro de la cual esta especie estaba ubicada anteriormente. La característica más discriminante para caracterizar la sección Xanthodermatei deviene el olor a fenol (asociado a su toxicidad). Finalmente, se han encontrado polimorfismos característicos para todas las especies estudiadas. Pertinencia taxonómica de los caracteres. La filogenia del género está todavía muy poco avanzada para tratar de determinar a qué se parecía el ancestro de todos los Agaricus o aún, cuáles son los caracteres más antiguos. Sin embargo, la filogenia permite precisar la pertinencia taxonómica de los caracteres. Parece por ejemplo, que ciertos caracteres bioquímicos y correlativamente organolépticos se han diversificado muy temprano y se han mantenido a lo largo de la historia del género. Ciertos, como la reacción de Schäffer y el olor del esporoforo, son sinapomorfias de interés taxonómico mayor a nivel de las secciones. Por el contrario, el cambio de color del contexto, tradicionalmente considerado como un criterio esencial, no puede seguir siendo considerado como tal. Siempre a nivel de las secciones, pero entre los criterios macroscópicos, la estructura del velo y en particular del anillo es ciertamente el carácter más pertinente, pero su apreciación (súpero, intermedio o ínfero) es delicada y requiere un poco de experiencia. Otros caracteres numerosos solo son pertinentes a nivel de especie. Se debe desconfiar de los caracteres que son ya sea sensibles al ambiente como el aspecto del revestimiento del píleo o el tamaño del esporóforo, ya sea conocidos por ser variables en algunas especies, como la presencia de cistidios, el tamaño de las esporas, el cambio de color del contexto, o ya sea por ser variables en numerosas especies como el color del pileo. Sin embargo, es necesario hacer notar que cada uno de esos caracteres puede, en ciertos casos precisos, ser pertinente. Así, por ejemplo, algunas especies son siempre blancas y/o siempre pequeñas. No es el caso del champiñón de París, que en la naturaleza es café o crema con, sin embargo un porcentaje de especimenes blancos que varía según la población silvestre considerada, de menos de 1% en Francia a un 12% máximo en Grecia (Callac et al. 2000). Estos individuos blancos portan dos alelos recesivos « blancos » en el locus del color PPC1 (Callac et al. 1998b). En Holanda, los híbridos que Gerda Fritsche (1983) seleccionó después de haber cruzado dos cultivares blancos llamados « white » y « off white » han sido el origen de la mayoría de cultivares blancos actuales en el mundo. En cuanto al Portobello « inventado » en Estados Unidos, se trata simplemente de un antiguo cultivar tradicional café europeo cuyo comportamiento cultural dirigido a obtener calibres grandes, asociados a una buena mercadotecnia (apelaciones : Portobello, Portobella, exotic mushroom, etc), ha podido hacer creer que se trata de otra especie diferente del champiñón de París. En Francia, este cultivar cultivado desde hace decenios y llamado « gros blond » tendría pocas oportunidades de tener éxito comercial bajo su aspecto « Portobello » por dos razones : i) tradicionalmente la barbacoa es mucho menos utilizada que en Estados Unidos y los champiñones de París son vendidos cerrados, en garantía de frescura ; ii) Cuando A. bisporus es comercializado, el nombre « champiñón de París» debe ser indicado. A causa de la misma reglamentación, cuando A. bitorquis es comercializado, « Champiñón de París» no puede ser indicado sobre la etiqueta; esto todavía no es el caso de ciertos países europeos. Así, hay personas en Estados Unidos que consumen A. bisporus creyendo que es otra especie (Portobello), y otros en España que creen consumir A. bisporus, cuando se puede tratar de otra especie (A. bitorquis). Un bello ejemplo que muestra que no se debe confiar en el color. 28 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus NOCIONES DE INDIVIDUO, DE POBLACIÓN Y DE ESPECIE Actualmente, cuando algunos consideran que los genes mismos son el centro del proceso de evolución (Dawkins 1976) y que otros consideran que el motor se sitúa al nivel de las comunidades de organismos y de sus interacciones, nosotros nos colocaremos aquí más tradicionalmente al nivel de la especie, pero ¿qué conjunto de individuos constituye una especie y en primer lugar, ¿qué es un individuo? Teóricamente, un individuo es una célula aislada o masa de células en crecimiento salidas de una célula inicial por división mitótica. En la práctica, nosotros recolectamos esporóforos y no sabemos si ellos pertenecen a un mismo individuo, es decir, si ellos provienen del mismo micelio subterráneo. Por esta razón, los esporóforos colectados en la naturaleza son considerados en un primer tiempo como individuos diferentes. Solo un análisis filogenético ulterior puede permitir mostrar que dos esporóforos colectados en un mismo sitio y el mismo año pertenecen al mismo individuo. Mientras que en la población local los individuos difieren unos de otros por su información genética, dos esporóforos de un mismo individuo son en teoría, genéticamente idénticos. Sus moléculas de ADN son por lo tanto idénticas. En la práctica, es suficiente verificar esta identidad en algunos loci polimorfos de ADN. Sin embargo, habrá sido necesario detectar anteriormente esos loci polimorfos. Es decir, mostrar que existen alelos diferentes entre los individuos de la población local. La elección de técnicas utilizadas es muy importante. En efecto, con excepción del caso de homotalismo, los esporóforos colectados poseen como los humanos, una doble información genética heredada de cada uno de sus dos padres; ellos portan en consecuencia dos alelos en cada locus, que pueden ser parecidos (homoalelismo) o diferentes (heteroalelismo). Es necesario disponer de un mismo método capaz de detectar los dos alelos y no solamente uno de ellos (llamado dominante). En otros términos, una buena técnica es aquella que permite utilizar esos loci polimorfos como marcadores codominantes. Por ejemplo, si se utilizan cuatro loci (M1 a M4) para cada uno de los cuales existen dos alelos (1 y 2) presentes cada uno con una frecuencia de 50% en la población, la probabilidad de encontrar un individuo con una combinación de alelos dada (= al genotipo), como por ejemplo [M1-1/1, M2-1/2, M3-1/2, M4-2/2] es igual a 1/4 x 1/2 x 1/2 x 1/4 = 3.1 %, es probable entonces que dos esporóforos colectados a una corta distancia uno de otro y poseyendo el mismo genotipo provengan del mismo micelio y pertenezcan por lo tanto al mismo individuo (clonación vegetativa). Para ciertas especies que son perennes (anillo de brujas como A. arvensis), el individuo se extiende en el tiempo y en el espacio pero otros individuos pueden limitar su extensión. En todos los casos, no se debe confiar en las apariencias. Nosotros hemos analizado sitios de A. bisporus en Francia donde casi todos los individuos colectados a más de un metro de distancia unos de otros tenían genotipos diferentes. A la inversa, en un sitio de Portugal donde había varias centenas de esporóforos, nosotros analizamos cinco al azar y todos tenían el mismo genotipo, lo que demostró ya sea que pertenecían al mismo individuo o que la población era muy homogénea; En los dos casos, probablemente un solo individuo había colonizado ese sitio. Es probable que en este sitio la nube de inóculo (esporas o fragmento de micelio) era muy pobre. En efecto, cuando un micelio se instala emite compuestos volátiles que estimulan la germinación de esporas y facilitan así la instalación de otros micelios. Se puede notar además que en el laboratorio se puede aún estimular la germinación de esporas de una especie con el micelio de otra especie. Esto podría explicar que no es raro encontrar varias especies de Agaricus casi mezclados en el mismo sitio. Por lo tanto, hay que permanecer prudente sobre la interpretación de las colectas hechas en un mismo sitio: pueden pertenecer a individuos diferentes de una especie, inclusive a especies diferentes. Entre el individuo y la especie se insinúa otra noción que es la de población. Una población es definida arbitrariamente sobre la base del conocimiento geográfico, ecológico y/o biológico como un conjunto de individuos considerados relativamente homogéneos, desde el punto de vista genético, ya sea porque descienden todos directamente del mismo individuo inicial (población clonal), ya sea porque intercambian continuamente sus alelos. En este último caso, la población 29 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus teóricamente más homogénea sería una población en equilibrio conocido como panmictico y definido como un conjunto infinito de individuos que se cruzan libremente y sin preferencias entre ellos generando así una nueva población globalmente parecida a la precedente. En la realidad las poblaciones son finitas y evolucionan lentamente bajo el efecto de la deriva genética, las mutaciones, las migraciones, las selecciones y, algunas veces, drásticamente cuando se dan cambios rápidos del ambiente. Por diferentes razones geográficas y /o biológicas, la población global se estructura en varias poblaciones que van a divergir con el tiempo; a largo plazo nuevas especies pueden emerger. La definición más utilizada y la menos controvertida de especie biológica es la de Mayr (1963) que circunscribe las especies a "groups of actually or potentially interbreeding natural populations which are reproductively isolated from other such groups". Esta definición biológica de especie es ampliamente admitida pero pone numerosos problemas: técnicamente, sería no solamente fastidioso mostrar que todos los individuos presumidos de una misma especie son interfertiles, sino aún en muchas especies de Agaricus no se pueden realizar pruebas de interfertilidad. Alternativamente, se podría mostrar que dos presuntas especies no intercambian alelos al comparar las frecuencias alélicas dentro de las dos poblaciones pero eso también sería fastidioso. En la práctica es lo que se hace al caracterizar las especies por polimorfismos encontrados en las secuencias de ADN; Sin embargo, este método es mas o menos pertinente según el número de polimorfismos, el tamaño de las muestras y su repartición. Otro método indirecto, dicho fenético, basado sobre la hipótesis de que los individuos de una especie se parecen más entre ellos que a individuos de especies diferentes, funciona si se escogen criterios pertinentes. En ausencia de pruebas de interfertilidad y de análisis de poblaciones, es difícil saber si dos entidades vecinas según criterios morfológicos y/o moleculares son especies biológicas o poblaciones divergentes de una misma especie. En todo caso, la elección de criterios pertinentes, el aumento del número de criterios y del tamaño de la muestra de cada presunta especie refuerza la conclusión. En los análisis filogenéticos destinados no solamente a establecer la filogenia de las especies, sino también a circunscribirlas (método cladistico) es preferible representar a cada especie con varios individuos de orígenes lejanos y, cuando es posible, disponer de individuos de especies presuntamente vecinas provenientes de una misma región. Existen por lo tanto, diferentes métodos para circunscribir una especie. Evidentemente, lo ideal es de llegar a la misma conclusión por dos métodos diferentes, es lo que se trata de hacer al asociar los métodos biológicos, fenológicos y cladísticos. IMPORTANCIA DEL MODO DE REPRODUCCIÓN Las especies de Agaricus se reproducen vegetativamente por fragmentación del micelio o sexualmente a través de las basidiosporas, en los cuales los núcleos son producto de la meiosis. Generalmente, los micelios homocarioticos o heterocaróticos no tienen fíbulas y las células que les constituyen son multinucleadas. En A. bitorquis, sin embargo, los heterocariones son binucleados (Hou y Elliott 1979). Existen tres tipos de ciclos de reproducción sexual en el género, como en los basidiomicetos, en general. El ciclo heterotálico, el ciclo pseudohomotálico y el ciclo homotálico (Fig. 1). Solo el ciclo heterotálico permite a dos individuos cruzarse. Se debe precisar que la figura 1 muestra el cruzamiento por plasmogamia entre dos homocariones surgidos de esporas de un mismo esporóforo (autofecundación), pero pueden también provenir de dos esporóforos diferentes (interfecundación) siempre que sean sexualmente compatibles. En todas las especies de Agaricus estudiadas, el sistema de incompatibilidad sexual es unifactorial y multialélico: Para que dos homocariones de una misma especie se crucen, basta que porten alelos de incompatibilidad diferentes en su locus de incompatibilidad sexual. El heterocarion resultante de la plasmogamia es fértil. En el género Agaricus, el ciclo de reproducción no ha sido estudiado más que en algunos taxones: 30 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Heterotalismo. A. bitorquis, A. capellianus (= A. vaporarius), A. arvensis, y A. devoniensis (Anderson et al. 1984, Martínez Carrera et al. 1995, Calvo-Bado et al. 2000, Callac et al. 2005b) son heterotálicos en una primera aproximación. Sin embargo, excepto A. cappellianus de la cual solo tres especimenes de la misma región han sido probadas, una parte de los individuos son capaces de cruzarse experimentalmente. Esto sugiere que hay varias entidades agrupadas bajo esos nombres de especies y/o otros ciclos de reproducción. Anfitalismo. Tres taxones son anfitálicos es decir, a la vez heterotálicos y pseudohomotálicos. El ciclo es anfitálico y con predominancia del ciclo heterotálico en A. bisporus var. burnettii (Kerrigan et al. 1994). El ciclo es anfitálico con predominancia del pseudohomotalismo en A. subrufescens y A. bisporus var. bisporus. En A. bisporus var. bisporus un esporóforo produce una mayoría de esporas heterocarióticas y un pequeño porcentaje de esporas homocarioticas. Esos porcentajes están correlacionados con los porcentajes de diferentes tipos de basidios (bi-, tri-, y tetrasporicos) que están determinados por un locus mayor (locus BSN, Basidial Spore Number; Imbernon et al. 1996) pero también influenciados por las condiciones ambientales (Kerrigan y Ross 1987). Estos porcentajes están invertidos en A. bisporus var. burnettii en donde las esporas son mayoritariamente homocarióticas. Estas dos variedades son perfectamente interfértiles en el laboratorio, pero ellas no se cruzan, en principio, en la naturaleza porque la variedad burnettii está geográficamente aislada en el desierto californiano de Sonora. Homotalismo. A. bisporus var. eurotetrasporus y las entidades que constituyen el complejo de especies A. subfloccosus som homotálicas (Callac et al. 1998a, 2003; Kerrigan et al. 1999). El micelio y el esporóforo son haploides, la cariogamia y la meiosis tienen lugar en el basidio a partir de núcleos teóricamente idénticos (Kamzolkina et al. 2006). Ciclo desconocido. Finalmente, en A. campestris, A. sylvicola, y A. placomyces no ha sido observada ninguna reacción durante las confrontaciones entre cultivos monospóricos (Anderson et al. 1984). El ciclo permanece por lo tanto indeterminado. Fenómeno de Buller. El ciclo heterotálico, que es el más distribuido en los homobasidiomicetos, no sería probablemente tan común en el género Agaricus. Es de hacer notar que otra vía de interfecundación por cruzamiento entre homocarion y heterocarion, o fenómeno Buller, podría jugar un papel importante. Excepto en A. bitorquis, la migración de núcleos no parece ser un fenómeno común en Agaricus spp. La confrontación entre homocarión y heterocarión no acarrea entonces una heterocariotización del conjunto del homocarión, sin embargo genera un nuevo heterocarión en el cual el núcleo del homocarión está asociado a uno de los dos núcleos del heterocarión. Este fenómeno, generalmente obtenido in vitro ha sido puesto en evidencia recientemente en A. bisporus por co-cultivo de esporas y de micelio (Callac et al. 2006). Estos resultados abren la vía de métodos de cruzamiento directamente sobre composta de cultivo. 31 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Los modos de reproducción tienen un impacto sobre la estructura y la dinámica de las poblaciones. Ellos representan un carácter suave que varía entre especies vecinas, dentro de una especie y aún del individuo que puede disponer de varios modos de reproducción a la vez. Es un carácter adaptativo que puede fácilmente cambiar en función del ambiente, pero también del genotipo, en la medida que es controlado por pocos genes. Así, en A. bisporus var. bisporus, la predominancia del pseudohomotalismo está correlacionado a la fuerte proporción de basidios bispóricos resultante de la presencia de dos alelos recesivos en el locus mayor BSN. De una manera general, los ciclos de reproducción de Agaricus spp son poco conocidos. El papel de las esporas no está todavía bien comprendido y el papel del micelio dicho « vegetativo » es probablemente subestimado porque potencialmente puede participar en la diseminación, la interfecundación y aún la recombinación conocida como « somática » (Xu et al. 1996). EL CONCEPTO DE ESPECIE EN AGARICUS La interfertilidad. La interfertilidad entre dos entidades está definida como la aptitud de los individuos de una de ellas a cruzarse con los de la otra para dar individuos estables y fértiles. Existen numerosos casos donde este criterio simplemente no es utilizable para determinar si dos entidades son dos especies diferentes según el concepto biológico de especie. Múltiples factores espacio-temporales, demográficos, ambientales bióticos o abióticos, biológicos, genéticos o genómicos pueden facilitar o limitar la interfecundación. Es difícil situar hasta dónde el hombre puede intervenir en una prueba de interfertilidad para superar una barrera a la reproducción. Cuando no es suficiente acercar individuos pertenecientes a dos entidades geográficamente alejadas para que se crucen y es necesario por ejemplo, hacer híbridos forzados sobre medio mínimo entre mutante auxótrofos o aún fusión de protoplastos, se vuelve difícil considerar que dos individuos que se cruzan en tales condiciones son de la misma especie, incluso si el híbrido obtenido es fértil. Se habla entonces de complejo de especies que comparten aún numerosos alelos y entre los cuales la interfecundación es solo potencial o excepcional. Más generalmente, un complejo de especies reagrupa entidades difíciles de distinguir. Una barrera a la reproducción puede establecerse cuando las dos entidades resultantes son morfológicamente parecidas o casi, tales especies son llamadas gemelas. Especiación alopátrica y simpátrica. Cuando los análisis muestran que no hay más o casi, flujo de genes entre dos poblaciones fuertemente estructuradas pero que hay todavía interfertilidad, al menos experimentalmente, entre los individuos de esas poblaciones, se puede considerar que ellas representan dos entidades potencialmente en vías de especiación, o bien ya entradas en el proceso de especiación, si la interfertilidad es parcial. Cuando el aislamiento es geográfico el proceso de especiación es alopátrico. Es potencialmente el caso, por ejemplo de A. bisporus var. burnettii que constituye una población aislada en el desierto de Sonora, sin embargo, aunque se noten diferencias fisiológicas (ciclo de fructificación rápida), genéticas (poblaciones divergentes ; Xu et al. 1998) morfológicas (esporas más pequeñas, alto porcentaje de basidios tetraspóricos) y correlativamente biológicos (ciclo heterotálico predominante) esta variedad permanece perfectamente interfértil con la var. bisporus. Por el contrario, con A. bisporus var. eurotetrasporus (Fig. 2e) un probable proceso de especiación simpátrica está en curso. Esta variedad es tetraspórica y homotálica; en otros términos, las fructificaciones son haploides, los individuos no se cruzan entre ellos y forma una línea casi clonal en la cual dos individuos han sido encontrados en Francia y en Grecia. Aunque esta variedad pueda cruzarse con la var. bisporus que cohabita en los mismos sitios, parece que el flujo de genes es casi 32 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus inexistente puesto que un alelo de esta línea no ha sido encontrado entre 300 cepas de poblaciones francesas o griegas, excepto dentro de un híbrido intervarietal ya conocido (resultados no publicados). Puede ser que un proceso equivalente haya estado al origen de A. subfloccosus, una especie homotalica, hermana de A. bisporus, y que se encuentra en los mismos habitats. Martínez Carrera et al. (1995) consideraron A. bitorquis como un complejo dentro del cual un proceso de especiación simpátrica estaría en curso: una barrera a la reproducción asociada a una selección disruptiva aislaría progresivamente una sub población tropical de individuos que presentan una aptitud a fructificar a temperaturas particularmente elevadas. La situación es compleja porque tres entidades fueron puestas en evidencia, de las cuales dos son interestériles entre ellas pero interfértiles con la tercera. El caso del homotalismo. La ausencia o débil contribución de la reproducción sexual con relación a la asexual vuelve inapropiado el concepto de especie biológica. Es el caso de especies homotálicas o consideradas como tales. Por ejemplo, A. subfloccosus es considerada como un complejo de especies constituidas por dos entidades homotálicas difíciles de distinguir morfológicamente; ellas difieren sin embargo por su hábitat y son muy distintas filogenéticamente. Sin embargo, genéticamente cada una de esas entidades no es completamente homogénea y está de hecho constituida de microlíneas diferentes. Por esta razón estas dos entidades podrían ser consideradas como dos especies según la definición de especie filogenética de Cracraft (1983): "smallest diagnosable cluster of individual organisms within which there is a parental pattern of ancestry and descent". Evolución reticulada. En varias especies de Agaricus se encuentran individuos cuyas secuencias de ADN comportan múltiples loci heteroalélicos. En A. subrufescens Kerrigan (2005) sugiere que este heteroalelismo resulta de un cruzamiento entre individuos de poblaciones aisladas mucho tiempo. En A. cupressicola nosotros encontramos en Italia, Grecia y Francia individuos que poseen una o la otra de dos secuencias de ITS1+2 que difieren de tres loci. Pero además, encontramos en Portugal un espécimen « híbrido » heteroalélico en esos tres loci (resultado no publicado). Queda por aclarar en qué medida esos heteroalelismos reflejan un proceso de evolución reticulada. La comunidad de organismos. En ausencia de datos sobre las relaciones entre las especies de Agaricus y otros organismos, no es posible decir cómo la evolución de este género se inscribe en términos de coevolución en el seno de comunidades de organismos. Una pista interesante es la de los metabolitos secundarios que están implicados en el olor y la toxicidad de las especies, que representan caracteres sinapomórficos de primer orden para la caracterización de las secciones, y que se presume tienen un rol defensivo (Callac et al. 2005a). CONCLUSIÓN Una pregunta que no ha sido abordada voluntariamente es: ¿cuántas especies pertenecen al género Agaricus? En la medida en que solo para la sección Xanthodermatei un tercera parte de las especies analizadas por Kerrigan et al. (2006) son nuevas, y se trata de especies de regiones donde la flora micológica es la más conocida (América del Norte y Europa), no parece posible hacer una estimación razonable antes de que los análisis filogenéticos estén más avanzados. Hay también especies que tienen áreas limitadas a un solo continente y otras, como A. bitorquis, que se 33 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus encuentran desde Noruega hasta Senegal. Es probable que el concepto de especie se debe reconsiderar para A. arvensis, A. devoniensis y probablemente varios otros complejos de especies. Finalmente, no es necesariamente juicioso enfocarse al número de especies. La biodiversidad del género no se puede concebir sin la diversidad intraespecífica de una parte, y la diversidad de interacciones con los otros organismos en los medios naturales, por otra. No resta más que la reconstrucción filogenética del género, así como los estudios de poblaciones y de genómica en A. bisporus, tomado como modelo para un mejor conocimiento del género. AGRADECIMIENTOS Se agradece a ECOS-Nord y ANUIES (programa franco-mexicano M06A01) y el BRG (programa 2007-2008 n°51) por su contribución financiera al estudio de la biodiversidad en el género Agaricus. REFERENCIAS Aldebrant de Sienne (1226) Régime du Corps, Landouzy-Pépin, according to QUEM. t. 1 1959. Anderson JB, Petsche DM, Herr FB, Horgen PA (1984) Breeding relationships among several species of Agaricus. Can. J. Bot. 62:1984. Arrillaga P, Parra LA (2006) El Genero Agaricus L. en Espana. XI. Agaricus subrufescens, prima cita para España Bol. Soc Micol Madrid 30:201-207. Bellini MF, Angeli JPF, Matuo R, Terezan AP, Ribeiro LR, Mantovani MS (2006) Antigenotoxicity of Agaricus blazei mushroom organic and aqueous extracts in chromosomal aberration and cytokinesis block micronucleus assays in CHO-k1 and HTC cells. Toxicology in Vitro 20:355-360. Brian C, Pirobe L, Guinberteau J (1981) Amelioration de differentes especes de champignons comestibles. Mush Sci 11(2):715–723. Callac P (1994) Prospections pour la recherche d’Agaricus bisporus en France: contexte historique et scientifique, premiers résultats. Bull. Soc. Mycol. France 110: 145-165. Callac P, Mata G. (2005) Agaricus tollocanensis, une nouvelle espèce de la section Xanthodermatei trouvée au Mexique. Doc. Mycol. 132: 31-35. « 2004 »]. Callac P, Hocquart S, Imbernon M, Desmerger C, Olivier JM (1998a) Bsn-t allele from French field strains of Agaricus bisporus. Appl. Env. Microbiol. 64: 2105-2110 Callac P, Moquet F, Imbernon M, Ramos Guedes-Lafargue M, Mamoun M, Olivier JM (1998b) Evidence for PPC1, a determinant of the pilei-pellis color of Agaricus bisporus fruitbodies. Fungal Genetics and Biology 23: 181-188. Callac P, Imbernon M, Guinberteau J, Pirobe L, Granit S, Olivier JM, Theochari I (2000) Discovery of a wild Mediterranean population of Agaricus bisporus, and its usefulness for breeding work. Mush Sc 15 (1): 245252. Callac P, Jacobe de Haut I, Imbernon M, Guinberteau J, Theochari I (2003) A novel homothallic variety of Agaricus bisporus comprises rare tetrasporic isolates from Europe, Mycologia 95: 222-231. Callac P, Guinberteau J, Rapior S. (2005a) New hypotheses from integration of morphological traits, biochemical data and molecular phylogeny in Agaricus spp. Proceedings of the fifth international conference on mushroom biology and mushroom products. 8-12 April 2005, Shanghai, China. Acta Edulis fungi 12 (Supplement):37-44. Callac P, Spataro C, Lataillade E, Blasi P, Guinberteau J (2005b) Agaricus devoniensis complex comprises a group of heterothallic isolates constituting a basis for breeding. Abstract p. 273 in: Genetics and Cellular Biology of Basidiomycetes VI. Pisabarro AG, Ramirez L (Eds). Universidad Pública de Navarra. Pamplona España. 312 p. Callac P, Spataro C, Caille A, Imbernon M (2006) Evidence for outcrossing via Buller phenomenon in substrate simultaneously inoculated with spores and mycelium of Agaricus bisporus Appl. Env. Microbiol. 72:2366-2372. Calvo Bado L, Noble R, Challen M, Dobrovin-Pennington A, Elliott T (2000) Sexuality and genetic identity in the Agaricus section Arvenses. Appl. Environ. Microbiol. 66:728-734. 34 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Cappelli A. 1984 Agaricus. Saronno, Italia: Libreria Editrice Biella Giovanna. 560 p. Challen MP, Kerrigan RW et Callac P (2003) A phylogenetic reconstruction and emendation of Agaricus section Duploannulatae, Mycologia 95: 61-71. Courtecuisse R, Duhem B (1994) Guide des champignons de France et d’Europe. Paris: Delachaux et Niestlé. 476p. Cracraft J (1983) Species concepts and speciation analysis. In: Johnston R (ed) Current Ornithology. Plenum, New York, pp 159-187 Darwin CMA (1859) The origin of species by means of natural selection, or the preservation of favoured races in the struggle for life. Fellow of the Royal, Geological, Linnæan, etc. societies; Author of Journal of researches during H. M. S. Beagle's Voyage round the world. London: John Murray, Albemarle Street, (cf. http://www.literature.org/authors/darwin-charles/the-origin-of-species/) Dawkins R (1976) The Selfish gene. New ed 1989. Oxford university press. 352pp Didukh M, Vilgalys R, Wasser SP, Isikhuemhen OS, Nevo E (2005) Notes on Agaricus section Duploannulati using molecular and morphological data. Mycol. Res. 109:729–740 Dornberger K, Ihn W, Schade W, Tresselt D, Zureck A, Radice L (1986) Antibiotics from Basidomycetes. Evidence for the occurrence of the 4-hydroxybenzenediazonium ion in the extracts of Agaricus xanthodermus genevier (Agaricales). Tetrahedron Lett 27(5):559-60. Firenzuoli F, Gori L, Lombardo G (2007) The Medicinal Mushroom Agaricus blazei Murrill: Review of Literature and Pharmaco-Toxicological Problems. eCAM Advance Access published March 27, 2007 doi:10.1093/ecam/nem007. Fries E (1830) Eclogae fungorum. Praecipue ex Herbariis Germanorum de Scriptorum. Linnaea 5: 509. Fritsche G (1983) Breeding Agaricus bisporus at the Mushroom Experimental Station, Horst. Mushroom Journal 122:49-53. García MA, Alonso J, Melgar MJ (2005) Agaricus macrosporus as a potential bioremediation agent for substrates contaminated with heavy metals. Journal of Chemical Technology and Biotechnology 80:325330. Geml J, Geiser DM, Royse DJ (2004) Molecular evolution of Agaricus species based on ITS and LSU rDNA sequences. Mycol. Progress 3:157-176. Hou HH, Elliott TJ (1979) Comparative cytology in the genus Agaricus. Mush Sci. 10:51–62. Imbernon M, Callac P, Gasqui P, Kerrigan RW, Velcko Jr AJ (1996) BSN, the primary determinant of basidial spore number and reproductive mode in Agaricus bisporus, maps to chromosome I. Mycologia 88: 749-761 Kamzolkina O, Volkova V, Kozlova M, Pancheva E, Dyakov Yu., Callac P (2006) Karyological evidence for meiosis in the three different types of life cycles existing in Agaricus bisporus. Mycologia 98:763-770. Kerrigan RW (1986) The Agaricales (Gilled Fungi) of California. 9. Agaricaceae. Arcata, California: Mad River Press. 62 p. Kerrigan RW (2005) Agaricus subrufescens, a cultivated edible and medicinal mushroom and its synonyms Mycologia 97:12-24. Kerrigan RW, Ross K (1987) Basidiospore number variation in Agaricus Pp. 155-162 In: Cultivating edible fungi. Eds, P J West, D J Royse, R B Beelman. Elsevie Science Publisher, B. V., Amsterdam, The Netherlands. Kerrigan RW, Imbernon M, Callac P, Billette C, Olivier JM (1994) The heterothallic life cycle of Agaricus bisporus var. burnettii, and the inheritance of its tetrasporic trait. Exp. Mycol. 18: 193-210. Kerrigan RW, Callac P, Xu J, Noble R (1999) Population and phylogenetic structure within the Agaricus subfloccosus complex. Mycological Research 103: 1515-1523. Kerrigan RW, Callac P, Guinberteau J, Challen M, Parra LA (2006) Agaricus section Xanthodermatei: a phylogenetic reconstruction with commentary on taxa. Mycologia 97:1292-1315 {« 2005 »]. Linné C (1737) Genera plantarum Linné C (1735) Systema naturae Martínez Carrera D, Smith JF, Challen MP, Elliott TJ, Thurston CF (1995) Evolutionary trends in the Agaricus bitorquis complex and their relevance for breeding. Mush Sci 14:29–36. Matheny PB, Curtis JM, Hofstetter V, Aime MC, Moncalvo JM, Ge ZW, Slot JC, Ammirati JF, Baroni TJ, Bougher NL, Hughes KW, Lodge DJ, Kerrigan RW, Seidl MT, Aanen DK, DeNitis M, Daniele GM, Desjardin DE, Kropp BR, Norvell LL, Parker A, Vellinga EC, Vilgalys R, Hibbett DS (2006) Major clades of Agaricales: a multilocus phylogenetic overview. Mycologia. 98:982-95. Mayr E (1963) Animal species and evolution. Cambridge, MA: Harvard Univ. Press. 35 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Mitchell AD, Bresinsky A (1999) Phylogenetic relationships of Agaricus species based on ITS-2 and 28S ribosomal DNA sequences. Mycologia 91:811–819. Nagaoka MH, Nagaoka H, Kondo K, Akiyama H. Maitani H (2006) Measurement of a Genotoxic Hydrazine, Agaritine, and Its Derivatives by HPLC with Fluorescence Derivatization in the Agaricus Mushroom and Its Products. Chem. Pharm. Bull. 54: 922-924 Nauta MM (2001) Agaricus L. In: Noordeloos ME, Kuyper TW, Vellinga EC, (eds) Flora Agaricina Neerlandica 5. Lisse: A.A. Balkema Publishers. 169p. Noble R, Grogan HM, Elliott TJ (1995) Variation in morphology, growth, and fructication of isolates in the Agaricus subfloccosus complex. Mycological Research 99:1453-1461. Pline, Nat., 25, 103 in TLL, 1268, 48 Cf. http://www.cnrtl.fr/etymologie/agaric. 10 de agosto de 2007. Toth B, Patil K, Taylor J, Stessman C, Gannett P (1989) Cancer induction in mice by 4hydroxybenzenediazoniumsulfate of the Agaricus xanthodermus mushroom. In vivo 3:301-306. Tournefort JP, de. (1694) Eléments de botanique. 3 volumes. Imprimerie royale. Paris. Vellinga EC (2004) Genera in the family Agaricaceae: evidence from nrITS and nrLSU sequences. Mycol. Res. 108:354–377. Wasser SP, Didukh MY, de Amazonas MAL, Nevo E, Stamets P, da Eira AF (2002) Is a widely cultivated culinary-medicinal Royal Sun Agaricus (the Himematsutake Mushroom) indeed Agaricus blazei Murrill? Int. J. Med. Mush. 4:267–290. Xu J, Horgen PA, Anderson JB (1996) Somatic recombination in the cultivated mushroom Agaricus bisporus. Mycol. Res. 100:188-192. Xu J, Kerrigan RW, Sonnenberg A, Callac P, Horgen PA, Anderson JB (1998) Mitochondrial DNA variation in natural populations of the mushroom Agaricus bisporus. Molecular Ecology 7: 19-33. 36 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus III. PRODUCCIÓN DE SEMILLA Y CONSERVACIÓN DE CEPAS DE AGARICUS BISPORUS Gerardo Mata y Jean Michel Savoie Unidad de Micología, Instituto de Ecología, A.C., Apartado Postal 63, Xalapa 91000, Veracruz, México MyCSA, Institut National de la Recherche Agronomique, BP 81, Villenave d’Ornon 33883, cedex, Francia <[email protected]> <[email protected]> RESUMEN La producción de semilla o inóculo es una de las etapas más importantes en el proceso de cultivo del champiñón. Se describe un método sencillo para la producción de inóculo primario y secundario y se presenta la fórmula base del mismo. Se describen brevemente los métodos más comúnmente utilizados para la conservación de cepas con énfasis en la crioconservación, lo que permite mantener las características morfológicas y de producción de las cepas por largos períodos de tiempo. Palabras clave: champiñón, hongos comestibles, producción de inóculo, mantenimiento de cepas, congelación de cepas. INTRODUCCIÓN Para realizar la siembra de hongos comestibles se utiliza un inóculo conocido comercialmente como “semilla”, “micelio”, “blanco”, “spawn”, etc. El término se refiere al desarrollo masivo y exponencial del micelio del hongo que se va a cultivar sobre un sustrato compuesto, generalmente de semillas de gramíneas o materiales lignocelulósicos. Los granos utilizados no son únicamente un vehículo para la dispersión del micelio, sino que constituyen el principal elemento nutritivo para que el hongo se desarrolle en esta etapa. Para la producción del inóculo de champiñón generalmente se utilizan granos de centeno, sin embargo, otro tipo de granos como trigo, mijo o sorgo también pueden ser utilizados. La utilización de granos pequeños como el mijo y el sorgo puede ser muy útil ya que proporciona un mayor número de puntos de inoculación y permite por tanto utilizar tasas de inoculación bajas. La preparación del inóculo se realiza por personal especializado en grandes compañías productoras que cuentan con laboratorios bien equipados para asegurar la calidad del inóculo que ofrecen. Dichas compañías tienen a la venta diversas cepas de champiñón, en particular algunos híbridos que son muy competitivos en condiciones óptimas de cultivo pero que presentan una variabilidad genética baja (ver el capítulo II de P. Callac en este libro). Sin embargo, algunos pequeños productores preparan su propio inóculo lo que les permite reducir sus costos de producción. Esta opción es particularmente interesante sobre todo en las regiones poco accesibles y para las cuales el transporte del inóculo bajo condiciones de refrigeración es muy caro. De manera general y con el fin de obtener un mayor rendimiento en la preparación del inóculo, este proceso se lleva a cabo en dos etapas: 1) inóculo primario, también conocido como “master”, el cual será utilizado esencialmente para la reproducción masiva del mismo inóculo. 2) inóculo secundario, obtenido a partir del inóculo primario. La mayor parte de los productores utilizan inóculo secundario para los cultivos comerciales del champiñón. Aunque en un inicio el inóculo se preparaba en frascos de vidrio, actualmente casi la totalidad del inóculo comercial se prepara en bolsas de plástico de alta densidad (lo que permite su esterilización), principalmente de polipropileno, con filtros especiales 37 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus que permiten la respiración del micelio del hongo e impiden la penetración de microorganismos nocivos. Si bien la preparación de inóculo para el cultivo del champiñón no es esencialmente difícil, sí se requiere de una inversión inicial considerable para establecer un laboratorio que cuente con los medios indispensables. Además, en este proceso es necesario contar con personal capacitado que pueda llevar a cabo las labores particulares de la producción de inóculo. Debido a que buena parte del éxito del cultivo del champiñón radica en la utilización de un inóculo de calidad, para algunos productores a mediana escala la obtención del inóculo se convierte en un “cuello de botella” que en ocasiones es difícil salvar. LA PREPARACIÓN DEL INÓCULO Cuidados generales La producción de inóculo en semillas de gramíneas se realizó por primera vez por Sinden en 1932 y el método fue perfeccionado por Stoller en 1962 (Stamets y Chilton 1983). La selección de las semillas es una parte muy importante de este proceso y es necesario tomar en cuenta varios aspectos: 1) Disponibilidad, se prefiere utilizar semillas de fácil acceso que no tengan que ser transportadas desde sitios lejanos; 2) Precio, utilizar semillas de precio bajo o accesible; 3) Estado físico de los granos, escoger semillas que no estén quebradas y que se encuentren libres de parásitos; 4) Semillas sin sustancias químicas, con especial atención en que las semillas no hayan sido tratadas con fungicidas o plaguicidas. Como se mencionó anteriormente, el sistema general para la preparación del inóculo se basa en la producción de un inóculo llamado “primario”, obtenido directamente del micelio de una cepa cultivada en medio artificial, y a partir del cual se obtendrá el micelio “secundario” que se utilizará para el cultivo comercial. Aunque no existe un método “único” para la preparación del inóculo del champiñón, las etapas que cualquier método debe considerar son: hidratación del grano, esterilización del mismo y finalmente inoculación con el hongo. En cada una de estas etapas se deben extremar las precauciones para obtener un inóculo de calidad. La hidratación de las semillas debe ser de alrededor de 50%, lo cual se puede lograr por un período de remojo de entre 12 y 24 horas o por un precocido del grano durante alrededor de 30 minutos. Esto depende en gran medida de la calidad y tipo de semilla que se esté utilizando. El exceso de humedad puede producir que las semillas se revienten durante la esterilización, lo que con frecuencia genera problemas de contaminación por bacterias o mohos. Después de la esterilización, las semillas se deben inocular de preferencia en condiciones asépticas utilizando una cámara de flujo laminar. El inóculo primario Para asegurar una buena preparación del inóculo primario, el proceso debe completarse en tres días (Figura 1), tomando las precauciones necesarias en cada etapa. Primer día Lavar las semillas con agua corriente para eliminar el polvo y restos de materiales ajenos. Poner agua a hervir en un recipiente con tapa, agregar la semilla cuando el agua esté caliente y realizar un precocido durante 30 minutos. Las proporciones de agua y semilla recomendadas se muestran en la Tabla 1. Dejar reposar las semillas en el agua caliente durante 10 minutos, después drenar el exceso de agua con la ayuda de un tamiz centrifugado. Una vez escurrido el exceso de agua agregar yeso y mezclar hasta uniformizar. Colocar la semilla en bolsas de plástico y esterilizarlas a 121°C durante 1 hora (Figura 2). Después dejarlas enfriar en una mesa hasta el día siguiente. 38 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Segundo día Transcurridas 24 horas, realizar una segunda esterilización a 121 °C durante una hora. Después dejar enfriar las semillas en una zona aséptica o dentro de una cámara de flujo laminar. Tercer día Inocular las muestras con micelio de champiñón cultivado en cajas de Petri. Esta parte del proceso debe ser realizada en una cámara de flujo laminar para evitar la contaminación del grano. Se puede colocar un fragmento de medio de cultivo con inóculo de 1 cm2 por cada 250 g de semilla esterilizada (Figura 3). En caso de colocar más de un fragmento de medio de cultivo, se sugiere distribuirlos de manera homogénea para facilitar el crecimiento del micelio en la semilla. Después incubar las muestras a 25 °C en oscuridad durante 2 – 3 semanas. Tabla 1. Proporción de compuestos para elaborar el inóculo o semilla de champiñón Grano (kg) Agua (l) Yeso * (g) 1 0.65 2.63 Proporción de ingredientes 1.5 2.5 0.974 1.625 3.945 6,057 3.8 2.5 10 * También se puede agregar una mezcla en proporción 1:1 de yeso y cal 1er día Limpieza e hidratación de la semilla Agregar yeso y/o suplementos 2° día 3er día Colocación en bolsas y esterilización de la semilla Preparación de medio de cultivo 2ª esterilización Aislamiento o resiembra de cepas Colocación de un fragmento de micelio en semillas esterilizadas Incubación a 25 °C en oscuridad Inóculo primario Repetición de los Procesos del 1ero, 2° y 3er día en 3 días Propagación del inóculo primario Inóculo secundario Limpieza, hidratación y esterilización de la semilla Incubación a 25 °C en oscuridad Figura 1. Proceso general de elaboración del inóculo primario y secundario del champiñón. Se enfatiza la etapa de actividades realizadas durante tres días para la preparación de la semilla. 39 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Figuras 2 – 3: Preparación del inóculo primario de champiñón. 2a: Lavado de la semilla. 2b: Escurrido después del precocido. 2c: Centrifugación para eliminar exceso de humedad. 2d: Adición de yeso. 2e: Colocación en bolsas. 2f: Esterilización en autoclave. 3a: Inoculación del grano estéril con micelio cultivado en caja de Petri. 3b: Incubación de inóculo primario en muestra de 250 g. 3c: Producción comercial de inóculo primario. 40 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Además de los granos se pueden utilizar otros soportes para preparar el inóculo primario del champiñón. Estos soportes pueden estar constituidos de elementos nutritivos adaptados al champiñón y presentarse en forma de particulas o de geles más o menos viscosos. El inóculo secundario Una vez obtenido el inóculo primario, éste puede utilizarse en lugar del micelio cultivado en cajas de Petri para inocular nuevas muestras de semilla estéril y procesada con el método anterior de tres días y obtener el llamado inóculo secundario (Figura 4). Cada muestra de inóculo primario, digamos de 1 kg, puede generar 10 muestras de inóculo secundario de 1 kg. Sin embargo, utilizando proporciones de inoculación baja, con una muestra de inóculo primario se pueden obtener hasta 40 muestras de inóculo secundario (Stamets, 1993). Se recomienda colocar el inóculo primario sobre la nueva semilla estéril y agitar con cuidado para permitir una distribución homogénea de los granos con micelio. La incubación se realiza de la misma manera que el inóculo primario. Se recomienda refrigerar el inóculo secundario de champiñón a 5 °C durante 10 días antes de utilizarlo. El inóculo mejorado La adición de suplementos en el inóculo es una práctica frecuente que tiene como objetivo preadaptar nutritivamente el micelio del hongo al sustrato final de cultivo así como estimular la capacidad de las cepas para resistir la presencia de organismos antagonistas (Mata et al. 1998). La preadaptación del micelio del hongo en el inóculo, permite una considerable reducción de la contaminación en el substrato sobre todo durante las primeras etapas de desarrollo, particularmente de los mohos del género Trichoderma que son considerados entre los antagonistas más difíciles de controlar (Mata et al. 1998, Savoie et al. 2000, Savoie y Mata 2003). Cuando el micelio de T. aggressivum se confronta in vitro con micelio de shiitake Lentinula edodes o de setas Pleurotus ostreatus se observa con frecuencia la formación de una línea oscura de micelio formado por hifas engrosadas que producen altas cantidades de enzimas del tipo de las fenolixidasas (lacasa principalmente), lo cual permite detener el crecimiento del moho. Este fenómeno también se observa cuando el micelio de dichos hongos comestibles es cultivado en un medio adicionado de enzimas líticas obtenidas de T. harzianum. Algunas cepas de L. edodes y de P. ostreatus son capaces de crecer adecuadamente en presencia de los metabolitos producidos por estos mohos gracias a su capacidad para formar la línea oscura (Savoie y Mata 2003). Este sencillo principio de preadaptación del micelio, ha permitido desarrollar algunas formulaciones de inóculo para dichas especies con las que se ha logrado reducir el impacto de la presencia de mohos antagonistas del género Trichoderma. Si bien las cepas de champiñón no se comportan de la misma forma que las de shiitake o de setas, la adición de suplementos como la turba y la utilización de semilla de sorgo para preparar el inóculo, permiten obtener un inicio de crecimiento micelial acelerado después de la siembra en el compost. Este inicio de crecimiento micelial, conocido entre los cultivadores comerciales como “estrellado”, favorece un establecimiento rápido del hongo en el compost. A pesar de los buenos resultados obtenidos con la utilización del inóculo mejorado no se ha observado un aumento claro en el rendimiento o productividad de las cepas, pero si una disminución en el tiempo de incubación y por lo tanto, una reducción en el ciclo completo de cultivo (datos no mostrados). Los problemas más frecuentes La mayoría de los problemas que se presentan durante la preparación del inóculo están asociados a un mal manejo de las semillas. Generalmente el productor de inóculo enfrenta problemas para obtener una hidratación correcta de los granos. Una hidratación deficiente limitará el crecimiento micelial durante la incubación, mientras que un exceso de humedad favorecerá la aparición de 41 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus bacterias y mohos de diferentes especies. Es muy importante que las semillas utilizadas no estén quebradas o fracturadas ya que esto puede ocasionar la liberación de almidón durante la esterilización, aumentando el riesgo de contaminación y sobre todo produciendo grumos de semillas en los cuales se dificulta la oxigenación y el crecimiento del micelio. También es importante asegurarse de que las semillas no han sido tratadas previamente con fungicidas o algún otro producto químico que pudiera inhibir el crecimiento del micelio. Es fácil distinguir la presencia de mohos y bacteria ya que se forman áreas sin crecimiento del micelio del champiñón o, en el caso de los mohos, con la presencia de micelios de diferentes tonalidades. Las muestras contaminadas por bacterias desprenden un olor a “fermentado” que es muy fácil distinguir. Cuando se detectan muestras contaminadas, estas deberán eliminarse de inmediato para evitar la posible propagación de la infección. Figuras 4 - 5. 4: Preparación de inóculo secundario a partir de inóculo primario. 5a: Bolsa de plástico con un filtro. 5b: Bolsa de plástico con filtro completo. 5c: Muestra comercial de inóculo de champiñón. 5d: Incubación de bolsas con inóculo de champiñón a nivel comercial. 42 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus El tamaño de la muestra, el tipo de bolsa y el sistema utilizado para cerrar las bolsas también son factores que deben controlarse. El inóculo comercial se vende en bolsas que pueden alcanzar entre 5 y 10 Kg. Se debe considerar que cuanto más inóculo contenga una bolsa, mayor deberá ser el tamaño del filtro para permitir una adecuada respiración al micelio. Algunas bolsas tienen uno o dos filtros pequeños, mientras que otras tienen el filtro del mismo tamaño de la bolsa o en cintas a lo largo o ancho de la misma (Figura 5). Las bolsas inoculadas deben ser colocadas en estantes, preferentemente metálicos ya que son fáciles de limpiar, en condiciones óptimas de incubación (oscuridad y 25 °C), teniendo precaución de que exista un espacio pequeño de separación entre cada bolsa para evitar el posible calentamiento que se genera cuando las bolsas están en contacto. Otro problema frecuentemente encontrado es la pérdida de la calidad de las cepas a lo largo de las resiembras de las mismas. Este fenómeno es complejo y no puede predecirse con facilidad, por lo tanto, es necesario implementar un sistema para mantener las cepas (ver más abajo) y controlar la calidad del inóculo con el fin de evitar la multiplicación a gran escala de una cepa que no se encuentre en buen estado. Dicho sistema debe incluir un control de la fabricación de lotes de inóculo primario y secundario asociados a la realización de pruebas de cultivo a pequeña escala antes de utilizar un lote de inóculo para el cultivo comercial. LA CONSERVACIÓN DE LAS CEPAS La conservación de las características de las cepas de hongos comestibles durante largos períodos de tiempo es el principal objetivo de las colecciones de hongos o ceparios. El método tradicional de resiembras continuas en medios de cultivo, es un sistema efectivo para la conservación a corto plazo. Sin embargo, dicho sistema incrementa el riesgo de contaminación accidental o de cambios en las características morfológicas y fisiológicas de los organismos (Chvostová et al. 1995). La conservación de cepas en nitrógeno líquido es la alternativa más recomendable para los hongos que no esporulan en el micelio, ya que disminuye los riesgos de contaminación o envejecimiento y permite un manejo más adecuado en colecciones con gran número de cepas. Sin embargo, es necesario conocer a fondo el proceso para realizar la congelación de los micelios y poder obtener una recuperación adecuada de los mismos. La viabilidad de las muestras congeladas depende básicamente de los siguientes factores: 1) la especie de hongo, 2) la edad y condiciones de crecimiento de los micelios, 3) la presencia y tipo de crioprotector, 4) la velocidad de penetración del crioprotector, 5) la velocidad y método de congelación, 6) la temperatura y tiempo de descongelación (Chvostová et al. 1995, Mata et al. 1994, Mata y Pérez-Merlo 2003). Para evitar daños en las células debidos a la congelación, ya que la temperatura del nitrógeno líquido es de -196 °C, se utilizan soluciones protectoras (crioprotector) que evitan la formación de grandes cristales en el interior de las células congeladas. El uso de dichas soluciones crioprotectoras es generalmente considerado como indispensable en el proceso de conservación de las cepas (Mata et al. 2000). Comúnmente se utilizan fragmentos de agar con micelio, los cuales una vez inmersos en la solución crioprotectora son congelados gradualmente a partir de la temperatura ambiente hasta – 40 °C, generalmente a una tasa de 1 a 10°C/min (Smith 1993, 1998). La congelación inmediata de este tipo de muestras ocasiona daños irreversibles en las células, con la consecuente pérdida total de la viabilidad (Roquebert y Bury 1993). Sin embargo, el uso de inóculo de hongos comestibles, producido en semillas de gramíneas, ha mostrado ser un método sencillo y efectivo para la congelación (Hwang y San Antonio 1972, San Antonio y Hwang 1982), además ha permitido recuperar el 100 % de las muestras sin someterles a un proceso de precongelación y los micelios recuperados mantienen sin variación su capacidad de producción de cuerpos fructíferos (Mata y Pérez-Merlo 2003, Mata y Rodríguez Estrada 2005). 43 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Aislamiento de una cepa Es muy importante utilizar como cepa inicial un cultivo in vivo proporcionado por una colección oficial o aislar una cepa a partir de un hongo claramente identificado por un especialista como Agaricus bisporus, con el fin de evitar riesgos y problemas con los hongos que se cultivarán. Los tejidos de los champiñones, formados esencialmente por hifas (filamentos blanquecinos) que en conjunto son conocidas como micelio, no son altamente específicos lo que permite obtener fácilmente clones de los mismos en cultivos in vitro. Para obtener una cepa es muy importante seleccionar un champiñón con características deseadas en cuanto al tamaño color y forma. Se debe tomar precaución también de que el champiñón sea un organismo joven, turgente, libre de contaminantes. En el caso de utilizar un hongo colectado en el campo, se debe poner especial atención a que no esté parasitado por larvas de moscas u otros organismos. El aislamiento de la cepa debe ser realizado en una cámara de flujo laminar para asegurar un ambiente de esterilidad. Antes de iniciar, el champiñón que se utilizará puede ser lavado con una solución de hipoclorito de sodio al 10 %. Se corta el hongo a la mitad cuidadosamente con una navaja esterilizada en alcohol con el fin de exponer el tejido interno del hongo. Con una pinza metálica o una aguja de disección, igualmente esterilizadas en alcohol, se toma un fragmento del tejido del hongo, preferentemente del píleo o sombrero (tomar precaución de que dicho fragmento se encuentre alejado de las láminas del hongo y de la parte superior del mismo) y se coloca en una caja de Petri con medio de cultivo especial (ver sección siguiente) (Figura 6). En cada caja de Petri se pueden colocar hasta 5 fragmentos del tejido del hongo. Las cajas de Petri deben ser incubadas en condiciones óptimas hasta que se observe el crecimiento de hifas del champiñón a partir de los fragmentos de tejido. Las cajas de Petri deben seer revisadas diariamente para observar el crecimiento del hongo pero sobre todo para asegurarse que no aparezca ningún contaminante en el medio de cultivo. Cuando ha crecido suficiente, se toma un fragmento de medio de cultivo con micelio y se transfiere a otra caja de Petri con medio de cultivo (Guzmán et al. 1993). Es muy importante registrar los datos de la cepa obtenida como fecha, sitio de colecta, colector, persona que obtuvo la cepa y método de aislamiento. Todos estos datos son fundamentales para una colección de cepas. Métodos de conservación a corto plazo Son aquellos en los que las cepas no pueden tenerse mucho tiempo sin transferir, es decir, se tienen que resembrar constantemente aumentando con ello el riesgo de contaminación o mutaciones en cada transferencia. La mayoría de las cepas de A. bisporus se desarrollan de manera adecuada en el medio de cultivo conocido comercialmente como agar con extracto de malta (AEM). Sin embargo, el medio AEM puede ser adicionado de un extracto de compost para estimular el crecimiento del micelio. Este medio se prepara hirviendo 20 g de compost en un litro de agua durante 20 min. Después se filtra la infusión obtenida y el volumen se completa a un litro, después se adiciona con el de medio de cultivo AEM. Los medios de cultivo se deben esterilizar antes de usarse a 121 °C durante 15 minutos. El manejo de estos medios requiere de condiciones de asepsia total ya que con facilidad se pueden contaminar con mohos y bacterias. 44 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Figuras 6 – 9. 6a: Aislamiento de una cepa de champiñón a partir de un hongo cultivado comercialmente. 6b: Fragmentos de tejido de champiñón en medio de cultivo. 7a: Medio de cultivo inclinado en tubos de ensaye. 7b: Frasquitos con medio de cultivo, micelio y aceite mineral. 8a: Inóculo preparado en caja de Petri. 8b: Inóculo de champiñón sumergido en la solución crioprotectora. 9: Contenedor de nitrógeno líquido utilizado para la congelación de cepas de hongos. 45 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Dentro de los métodos de conservación a corto plazo podemos mencionar la resiembra periódica del micelio en medios de cultivo y la inmersión en aceite mineral. Resembrando periódicamente las cepas en cajas de Petri y manteniéndolas en refrigeración a 5°C, se pueden conservar sin problemas hasta 6 meses, antes de practicar una nueva resiembra. La inmersión en aceite mineral consiste en cubrir el micelio del champiñón con aceite mineral (densidad 0.8) estéril con el fin de reducir la demanda de oxígeno y por lo tanto, retrasar el envejecimiento. Generalmente en este método el micelio se desarrolla en tubos de ensaye o pequeños frascos con medio de cultivo inclinado para facilitar el crecimiento del hongo (Figura 7). Cuando el medio ha sido colonizado completamente por el micelio, se agrega el aceite mineral que se ha esterilizado previamente en una autoclave a 121 °C durante 15 minutos. Las cepas deben ser conservadas en refrigeración y pueden ser almacenadas cerca de un año. Métodos a largo plazo Con la utilización del nitrógeno líquido las cepas pueden conservarse durante largos períodos de tiempo sin causar variaciones a su estructura genética. Sin embargo, este método requiere de personal capacitado y con experiencia en el manejo de cepas ya que la congelación y descongelación de las mismas son etapas que deben realizarse con mucho cuidado para evitar daños que resulten irreversibles en las células. Para congelar las cepas de champiñón se recomienda utilizar inóculo primario preparado con el método de los tres días en semillas de sorgo. Para facilitar el manejo de las muestras que se van a congelar, se sugiere colocar las semillas de sorgo después de la 2ª esterilización en cajas de Petri en donde serán inoculadas, en condiciones asépticas, con un disco (± 0.5 cm de diámetro) de agar con micelio. Las muestras se deben incubar en condiciones óptimas (25 °C en oscuridad) durante 2 a 3 semanas, hasta obtener un inóculo de buena calidad con semillas completamente invadidas por el micelio. La congelación a temperaturas ultrabajas requiere de la utilización de materiales especiales. En este caso se deben emplear viales de policarbonato (Nalgene) con capacidad de 2 ml, a los cuales se les agrega 1.5 ml de una solución de glicerol al 10% (v/v), la cual funciona como solución crioprotectora. Los viales con la solución crioprotectora se esterilizan en una autoclave a 121 °C durante 15 minutos. Una vez fríos, se colocan en cada vial de 15 a 20 semillas de inóculo de champiñón, las cuales deberán permanecer sumergidas en la solución crioprotectora durante una hora (Figura 8). Transcurrido este tiempo los viales se colocan en cajas de policarbonato y se transfieren directamente al contenedor con nitrógeno líquido (-196°C) (Figura 9). Este método reduce al máximo el metabolismo del hongo y evita el envejecimiento y las modificaciones genéticas del mismo. Las cepas congeladas se pueden mantener por largos períodos de tiempo. La descongelación de las muestras es un proceso delicado que se debe realizar con mucho cuidado. Las muestras se deben descongelar sumergiendo los viales en agua a 30°C durante 10 min (Mata et al. 2000, Mata y Rodríguez Estrada 2005). Una vez descongelados se deben limpiar durante 1 min en una solución de alcohol (70% v/v), de preferencia en condiciones de asepsia o en una cámara de flujo laminar. Posteriormente las semillas se retiran de los viales y se colocan en cajas de Petri con AEM para la recuperación del micelio y el crecimiento del mismo. Los micelios recuperados se pueden utilizar para producir nuevamente inóculo primario. El sistema de congelación en nitrógeno líquido permite mantener las cepas por períodos de cerca de 10 años. La utilización de inóculo para la congelación del micelio del champiñón es un método que facilita el proceso de congelación y descongelación de las muestras. Si se toman las precauciones necesarias, la congelación de las cepas en nitrógeno líquido no debe afectar la capacidad productiva de las cepas (Hwang y San Antonio 1972, Jodon et al. 1982, Kneebone et al. 1974, San Antonio y Hwang 1982, Suman y Jandiak 1991, Mata y Rodríguez Estrada 2005). 46 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus CONCLUSIÓN En este capítulo se brindan los elementos necesarios para producir inóculo de champiñón así como para la conservación de cepas. Sin embargo, es necesario recordar que ambas actividades son delicadas y requieren de infraestructura, que generalmente tiene un costo elevado, y de personal altamente calificado, por lo que se recomienda inicialmente adquirir el inóculo con alguna casa comercial que garantice la calidad del mismo. Si se desea cultivar alguna cepa en especial, que no se encuentre entre los catálogos de las principales casas comerciales, se podría solicitar la fabricación especial de inóculo con la cepa deseada en alguna casa comercial o en alguna universidad o instituto de investigación. La organización actual de las grandes empresas cultivadoras de champiñón ha generado la división de las labores en todo el sector. De esta forma encontramos empresas especializadas en la producción de inóculo, en la preparación de compost, en la producción de hongos y en la comercialización de los mismos. De esta manera prácticamente todo el mercado mundial del inóculo del champiñón está controlado por unas cuantas casas comerciales. Por otra parte el material genético del champiñón (cepas) con el que se prepara el inóculo tiene una variación muy limitada. La investigación deberá facilitar la obtención de nuevos híbridos con mayor capacidad de resistencia a los organismos patógenos, con alta productividad, con calidad visual y organoléptica y con facilidad de adaptación a diferentes tipos de clima. Si se aumenta la diversidad genética de las cepas de champiñón utilizadas para la producción comercial, se podrían obtener cepas con capacidades de adaptación específicas a diferentes condiciones de cultivo, lo que permitiría abatir costos de producción. La elaboración de un inóculo de alta calidad seguirá siendo la base de la creciente industria del champiñón. AGRADECIMIENTOS Los autores agradecen a la Dra. Dulce Salmones del Instituto de Ecología, la revisión crítica del manuscrito y a la Sra. Christiane Coldefy del INRA de Bordeaux, el apoyo en la revisión de las diferentes etapas de la producción del inóculo. Este trabajo forma parte del proyecto “Análisis de la biodiversidad de los hongos mexicanos del género Agaricus y valorización por la obtención de variedades de Agaricus bisporus y de otras especies cultivables en estas regiones” financiado por ECOS –CONACYT y dirigido por los autores. REFERENCIAS Chvostová V, Nerud F, Homolka L (1995) Viability of wood-inhabiting basidiomycetes following cryogenic preservation. Folia Microbiologica 40: 193-197. Guzmán G, Mata G, Salmones D, Soto C, Guzmán-Dávalos L (1993) El cultivo de los hongos comestibles. Con especial atención a especies tropicales y subtropicales en esquilmos y residuos agro-industriales. IPN, Mexico, D.F., 245 pp. Hwang SW, San Antonio JP (1972) Stability of spawn stocks of the cultivated mushroom after 26 months liquid nitrogen refrigeration (-160 ºC to -196 ºC). Mushroom Science 8: 35-42. Jodon MH, Royse DJ, Jong SC (1982) Productivity of Agaricus brunnescens stock cultures following 5-,7-, and 10-year storage periods in liquid nitrogen. Cryobiology 19: 602-606. Kneebone LR, Hwang SW, Shultz PG, Patton TG Jr (1974) Comparative production performance of stock cultures of eight strains of Agaricus bisporus preserved by liquid nitrogen freezing and by repeated vegetative transfer. Mushroom Science 9: 229-235. Mata G, Pérez-Merlo R (2003) Spawn viability in edible mushrooms alter freezing in liquid nitrogen without a cryoprotectant. Cryobiology 47: 14-20. Mata G, Rodríguez Estrada AE (2005) Viability in spawn stocks of the white button mushroom, Agaricus bisporus, after freezing in liquid nitrogen without a cryoprotectant. Journal of Agricultural Technology 1: 153-162. 47 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Mata G, Pérez R, Salmones D, Guzmán G (1994) Behavior of some strains of the genus Pleurotus under freezing conditions in liquid nitrogen. Revista de Microbiología 25: 197-200. Mata G, Salmones D, Ortega PM (2000) Viability and Mushroom production of Lentinula edodes and L. boryana strains (Fungi: Basidiomycetes) after cryogenic storage of spawn stocks. World Journal of Microbiology and Biotechnology 16: 283-287. Mata G, Savoie JM, Delpech P, Olivier JM (1998) Reductions in the incidence of Trichoderma spp. using substrate supplementation with peat and an alternative spawn during cultivation of Lentinula edodes on pasteurized wheat straw. Agronomie18: 515-520. Roquebert MF, Bury E (1993) Effect of freezing and thawing on cell membranes of Lentinus edodes, the shiitake mushroom. World Journal of Microbiology and Biotechnology 9: 641-647. San Antonio JP, Hwang SW (1982) Liquid nitrogen preservation of Agaricus bisporus (Lange) Sing. spawn stocks. Mushroom Journal 120: 410-419. Savoie JM, Mata G (2003) Trichoderma harzianum metabolites pre-adapt mushrooms to Trichoderma aggressivum antagonism. Mycologia 95: 191-199. Savoie JM, Delpech P, Billette C, Mata G (2000) Inoculum adaptation changes the outcome of the competition between Lentinula edodes and Trichoderma spp. during shiitake cultivation on pasteurized wheat straw. Mushroom Science 15: 667-674. Smith D (1993) Culture collection, In: Chang ST, Buswell JA, Miles PG (Eds.) Genetics and Breeding of Edible Mushrooms, Gordon and Breach Science Publishers, Amsterdam, pp. 15-33. Smith D (1998) The use of cryopreservation in the ex-situ conservation of Fungi. Cryo-Letters 19: 79-90. Stamets P (1993) Growing gourmet & medicinal mushrooms. Ten speed press, Berkeley, 552 pp. Stamets P, Chilton JS (1983) The mushroom cultivator. A practical guide to growing mushrooms at home. Agarikon Press, Olimpia, 415 pp. Suman BC, Jandaik CL (1991) Preservation of culture of Agaricus bisporus (Lange)Sing. in liquid nitrogen and its effect on yield and characters of fruiting bodies. Indian Journal of Mycology and Plant Pathology 21: 34-37. 48 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus IV. DESARROLLO DE SISTEMAS DE PROCESAMIENTO DE COMPOSTA PARA EL CHAMPIÑÓN AGARICUS BISPORUS Ray Samp 113 Colleen Court, San Marcos, Texas 78667 USA <[email protected]> RESUMEN Durante los últimos 25 años ha habido grandes cambios en la preparación y el procesamiento del sustrato para el champiñón. Con respecto a la preparación del sustrato, los ciclos de composteo se han reducido para conservar más materia seca para la producción del hongo. Adicionalmente, ha habido movimientos en la búsqueda de materias primas alternativas para la producción de compostas. Algo de ese movimiento ha sido en respuesta al temor a la gripe aviar, mientras que también se ha observado interés en fuentes de carbono diferentes del rastrojo de trigo. Con respecto a la preparación del sustrato, ha habido cambios significativos en la forma en que la composta es manejada en todas las fases del proceso de composteo. La esencia de esos cambios ha sido sobre la línea predecible de eficiencia operativa y energética. Esto es, un procesamiento del sustrato a granel en lugar de numerosos contenedores individuales. La fase II de pasteurización fue la primera en entrar al sistema de manejo a granel, después la fase III de incubación y finalmente, la fase I del proceso de producción de composta. En este documento se revisan los principios, el diseño y la aplicación de la preparación y el procesamiento de sustrato de champiñón a granel. Palabras clave: búnkers, fase I, fase II, fase III, cultivo del champiñón, protección ambiental, optimización de sustratos, aireación FASE I DE COMPOSTEO – PREPARACION DEL SUSTRATO La fase I de composteo es el proceso mediante el cual cantidades específicas de rastrojo, estiércol de pollo y yeso son composteados para producir un medio selectivo para el cultivo de champiñón. El proceso tradicional se llevaba a cabo en acumulaciones grandes, ineficientes y no aireadas de sustrato a granel que, una semana más tarde, daban lugar a muchas pilas individuales, como describieron Yoder y Sinden en 1953. Estos amontonamientos y las pilas eran periódicamente volteados y la duración del proceso variaba entre 2.5 y 4 semanas. Este sistema de composteo fue universalmente usado hasta que la industria fue literalmente forzada al desarrollo de sistemas de composteo a granel de fase I más eficientes. El estímulo para cambiar dicho sistema fue administrado por el Ministerio Holandés de Protección Ambiental, hacia fines de los 1980’s, cuando ordenó que la industria redujera el olor y la emisión de amonio de sus enormes operaciones de composteo. La industria recibió un período de gracia para implementar cambios que alcanzaran los estándares de emisiones o debían cesar sus operaciones de composteo. En esencia, la industria tuvo que desarrollar alternativas y hacerlo rápido. Bajo esta situación, varios investigadores e industriales holandeses trabajaron juntos para desarrollar tecnologías que significarían reducir el proceso de composteo y disminuir las emisiones a la atmósfera. Los ingenieros holandeses tomaron principios y sistemas ya establecidos en la industria champiñonera italiana y los aplicaron para satisfacer el mandato. Aunque los resultados tomaron ligeramente más tiempo que el permitido por el gobierno, fue así como empezó la implementación de los sistemas, en los inicios de los 1990’s. Los conceptos y resultados no fueron nada menos que revolucionarios. El concepto básico fue producir composta a granel en contenedores grandes cerrados (6X40 m de largo). La clave era que el piso estaba cubierto de tubos 49 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus y agujeros a través de los cuales el aire era forzado para pasar entre la composta. Esto es, se introdujeron líneas de aireación en el piso de concreto para que el oxígeno pudiera ser suministrado en la masa encerrada, según se necesitara. Anteriormente, la oxigenación de las pilas de composta era solamente por convección. La aireación, un tanto al azar, de las relativamente pequeñas pilas utilizadas en el método tradicional, era mayormente una función de densidad, de niveles de humedad y de calidad de las materias primas. Por esta razón, el área de trabajo de una pila era normalmente menor al 50% y raramente mayor que el 60% de la masa. El nuevo procedimiento de proveer aireación a la gran masa de composta casi eliminaba el olor producido por condiciones anaerobias en la composta. Adicionalmente, aceleraba y mejoraba el proceso de composteo porque el área de trabajo aumentaba a 80-90% de la masa. El incremento en la eficiencia de composteo redujo la duración del ciclo de composteo y las subsecuentes emisiones, mientras que mejoró la producción de champiñón. Más allá de estas mejoras, los diseñadores incorporaron sistemas que colectarían el aire emanado de las pilas de composta encerradas para procesamiento posterior. Las emisiones fueron pasadas a través de limpiadores de aire y biofiltros para reducir los olores y otros contaminantes amoniacales que eran responsables de la lluvia ácida y de otros problemas ambientales. Los contenedores cerrados de fase I de composteo con capacidad de procesamiento de aire de desecho se dieron a conocer como túneles de fase I. Aunque el resto del mundo no estaba obligado a seguir el liderazgo de la industria holandesa, los resultados fueron tan universalmente benéficos que el principio básico fue rápidamente usado en otros países, con varias modificaciones. El concepto de piso aireado fue usado en una variedad de formas para mejorar y producir composta fase I más eficientemente. Puesto que los estándares ambientales son raramente tan estrictos como en Holanda, los sistemas de fase I a granel realizados en otros países generalmente no capturaban el aire de escape para limpiarlo o biofiltrarlo. En lugar de eso, se implementaron generalmente contenedores con paredes sin techo, con sistemas de aireación en el piso. Estos contenedores fueron conocidos como bunkers. Al principio había varios diseños de bunkers, basados en varias teorías. Los bunkers eran ya sea de alta presión de aire (más de 2,000 pascales) o de baja presión (menos de 1,000 Pa) para proveer aireación a la masa de composta. También podían ser de doble pared con la creencia de que las paredes frías eran necesarias para promover la microflora, o de una sola pared. Los búnkers fueron construidos con paredes convexas y afiladas en la punta para promover la compactación o con paredes verticales. Se hizo mucha experimentación con el tamaño de las válvulas de aireación, la proximidad de las líneas de aireación, el espacio entre válvulas dentro de las líneas, el tamaño de los hoyos de las válvulas, el largo y el ancho de los búnkers, los sistemas de suministro de aire y el drenado de las líneas de aireación. Adicionalmente, factores como la cantidad de aire, la programación del tiempo de aireación, los rangos óptimos de temperatura de la composta, los métodos de vaciado y de llenado fueron motivo de debate y experimentación. Ahora, en 2007, el bunker estándar es de alta presión (>4,000 Pa), con paredes verticales comunes, pero hay todavía mucha variación de sistema a sistema, según el tamaño, naturaleza y presupuesto de la operación en cuestión. En lo referente a la operación de un sistema de búnker, en principio, el sistema funciona de la siguiente manera: se toma un período de tiempo para llevar a cabo la eliminación inicial de cera y la adecuada absorción de agua por el rastrojo o por el material a base de rastrojo proveniente de camas estabuladas con una microflora aerobia. Esto se llama el premojado o fase 0 y puede ocurrir en un suelo aireado o no. Una vez que esto se cumple, la composta es colocada en el piso aireado de un bunker de manera homogénea y consistente. Cuando se llena el búnker, se introduce aire a través 50 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus del piso a intervalos programados para alcanzar un contenido de oxígeno en la composta de 6-12%. Por ejemplo esos intervalos pueden ser de 15 minutos de aire (ventilador encendido) y 15 minutos de ventilación apagada. A medida que la composta se calienta, la demanda de oxígeno disminuye y los intervalos son alterados para mantener 6-12% de oxígeno. Por ejemplo, a 65°C el ventilador puede ser cambiado a 10 min de encendido y 20 min apagado. A medida que la temperatura de la composta continúa aumentando, la demanda de oxígeno decrece más y el tiempo de ventilación es cambiado nuevamente, aunque la presión a la cual el aire es suministrado es generalmente retenida. Por ejemplo, cuando la composta alcanza 75°C el intervalo de ventilación puede ser cambiado a 7 min encendido y 25 min apagado. Este ciclo puede ser mantenido por el resto de tiempo en el bunker, que puede ser entre 2 y 7 días. La mayoría de las operaciones sacarán la composta del bunker y lo colocarán en otro por un período similar al primero. En cada transferencia la composta se recalienta hasta que alcanza su máxima temperatura alrededor de 83°C. En cuanto al proceso en sí, el tiempo total de composteo puede ser tan corto como siete días, desde la mezcla de materia prima nitrogenada con la paja de establo hasta 18 días con el uso de rastrojo de alta calidad. Generalmente el tiempo total de composteo desde la mezcla de todos las materias primas hasta el llenado de fase II es de dos semanas. El mezclado de las materias primas es crítico para el proceso y debe ser logrado con estándares muy altos, porque no hay más mezclados en el curso del ciclo de composteo. Adicionalmente, el llenado de búnkers debe ser consistente para asegurar una aireación homogénea de la composta. Las áreas que son densas o flojas pueden favorecer una mala aireación y por ahí afectar la conversión de la composta. Finalmente, después de que se completa el proceso fase I, algunas plantas han demostrado la necesidad de reinocular la composta con la microflora de fase II para lograr una fase II eficiente. Esto puede ser realizado por vía natural al permitir que la composta “descanse” fuera por 12-24 horas después del período final de búnker. Alternativamente, algunas plantas inoculan con composta fase II recién concluida para asegurar una fase II exitosa. PROCESO DE COMPOSTEO FASE II El proceso fase II involucra la pasteurización y la conversión biológica del medio nutritivo para el champiñón que concluyó la fase I. Durante la pasteurización, el aire y la temperatura de la composta se mantiene entre 55-60°C para matar organismos competidores y causantes de enfermedades y plagas. El proceso de conversión involucra el mantenimiento de las temperaturas optimas para el aire y la composta para promover el crecimiento de bacterias y hongos termofílicos y para utilizar todos los carbohidratos y los compuestos nitrogenados dejados después de la fase I. Tradicionalmente, el proceso se da en cajas de madera portátiles (charolas) o en camas fijas, lo que es mayormente el caso en Estados Unidos y en otras áreas. Los túneles fase II, que fueron desarrollados a finales de los 1970’s y principios de los 1980’s en Italia y Holanda presentaban una alternativa mas eficiente desde el punto de vista del cultivo y de la operación. En las charolas o camas tradicionales de fase II, el aire es movido alrededor de numerosas charolas o camas con el fin de airear la composta y controlar la temperatura. El número de camas en un cuarto de fase II puede ser de 12-28, mientras que el número de charolas puede ser superior a 100. En un túnel, toda la composta es colocada en un simple recipiente largo, que puede tener 20-150 m2 de superficie de piso aireado. El aire es enviado a un manejador de aire que lo distribuye a través de la composta bajo relativamente alta presión (1500-2000 Pa). Esto provee del control exacto de temperatura y aireación homogénea para la composta. Las operaciones en túnel son preferidas para sistemas de composteo fase II, desde que fueron desarrollados. 51 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus En un proceso típico con túnel fase II la composta es llenada a una profundidad de 0.8-1.3 t de fase I por m2 de superficie de parrilla (piso) con una maquina llenadora. Esta máquina distribuye la composta sobre una red, la cual es usada al final del proceso para sacar la composta del túnel. Alternativamente, la composta puede ser llenada directamente sobre la parrilla para ser vaciada con una pala mecánica en la siembra. Una fase II en túnel típico dura seis días, pero puede variar entre 5 y 7. La temperatura es controlada por computadora, la cual monitorea las temperaturas de la composta y del aire de entrada, la velocidad del ventilador y el suministro de aire fresco. La velocidad del ventilador y el suministro de aire fresco son regulados para proveer la temperatura deseada a la composta en cualquier momento del proceso. El contenido de amonio y la actividad de la composta es monitoreada a lo largo del proceso y una vez que el amonio ha sido clarificado y la actividad disminuye, la composta es enfriada para siembra. La composta es entonces jalada con la red, desde el túnel con un jalador (winch) o descargada con pala mecánica, como se mencionó. Ha habido algunos cambios en el diseño de túneles fase II durante los últimos años. En general, los túneles modernos son más largos por lo que se requieren en menor número en las empresas. Anteriormente, los túneles de capacidad para 100-150 t de composta fase I eran considerados grandes; sin embargo, ahora es posible encontrar túneles de 200-250 t. El incremento en la capacidad ha sido logrado con el incremento de la superficie de piso aireado y también de los sistemas de distribución de aire. La composta puede ser llenada hasta 1.5 t/m2 en túneles que pueden suministrar aire a 2000 Pa y más. Esto ha requerido esfuerzos de reingeniería de los ventiladores, los ductos, los sistemas de suministro de aire y los vaciadores tipo winch. La construcción interna de las paredes ha cambiado a través de los años desde madera hasta acero inoxidable, pasando por el aluminio, el concreto y de vuelta al acero inoxidable. Aunque el diseño de túneles grandes haya crecido, no todos los túneles son construidos a tal grado de sofisticación o tamaño. Las plantas más pequeñas emplean túneles más pequeños que pueden ser descargados sin palas mecánicas. El concepto de estos túneles cambió a causa de las laboriosas tareas de limpieza del manejador de aire después de cada proceso fase II. Debido a la naturaleza abierta de la parrilla del piso, cae mucha composta a través del manejador de aire requiriendo una limpieza semanal. Los túneles nuevos son construidos con pisos valvulados, más bajo el principio de un piso para bunker. Un túnel con piso valvulado tiene líneas de aireación y válvulas mucho más juntas para una aireación más uniforme en relaciones más altas de aire/composta que un bunker. Cuando están vacías, las líneas de aireación no requieren de la limpieza extensa que requiere la parrilla del piso de un túnel. Aunque este diseño solamente tiene unos cuantos años, ha sido recibido con gran entusiasmo. TÚNELES FASE III La tendencia hacia el procesamiento de la composta a granel condujo a una fase III o incubación a granel. Esta tecnología empezó en los 1980’s y ha sido más lenta en ganar la aceptación general que la fase I o II, por varias situaciones de plagas y enfermedades. Aunque la fase III a granel es más fácil de controlar por computadora y es más eficiente con relación a mano de obra y energía, ha habido varias fallas serias ampliamente reconocidas. Puesto que una masa más grande de composta puede ser mantenida en un túnel fase III (hasta 150 t) cualquier falla puede tener implicaciones económicas muy significativas en una planta de cultivo. Por lo tanto, hasta ahora muchos cultivadores no desean tomar el riesgo. El diseño y el principio de operación de un túnel a granel fase III es muy parecido al túnel fase II. Los dos son llenados a granel, se suministra aire a través del piso, la temperatura es controlada por computadora de la misma manera y los dos son generalmente descargados con un jalador winch. Las mayores diferencias son el ajuste en el control de la temperatura y la disponibilidad de 52 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus enfriamiento. Las temperaturas son mantenidas aproximadamente a 26°C durante 13-18 días y se requiere de enfriamiento cuando el micelio se calienta. Se reconoce generalmente que una fase III larga es mejor que una corta. Cuando la colonización termina la composta puede ser depositada en anaqueles, camas, charolas, bloques, o bolsas para aplicar la cobertura, formar primordios y continuar el resto del ciclo productivo. Además de la eficiencia ganada por las operaciones a granel, se reduce el ciclo de cultivo a 5-6 semanas, por lo que un mayor número de ciclos puede pasar por las instalaciones de la planta en el año. Los problemas de la fase III surgieron ya sea de una composta fase I pobremente preparada o por contaminación. En lo que se refiere al primer caso, si ocurre una fermentación secundaria es difícil de controlar algunas áreas particulares de alta temperatura. En ciertos momentos la masa puede ponerse muy caliente, y pueden ocurrir las mayores pérdidas posibles. La solución obvia es producir buena composta, lo que ha sido el caso. Situaciones de contaminación llevaron a problemas más extensos y más significativos: puesto que la composta está totalmente pasteurizada al momento de la siembra, al llenado del túnel fase III es imperativo que no se permita la presencia de ninguna plaga o enfermedad en la composta “virgen”. Debido a defectos de diseño y/o manejo deficiente ha habido varias situaciones donde la contaminación en la siembra ha llevado a problemas serios. Las contaminaciones por hongos de los géneros Trichoderma, Penicillium y Aspergillus han sido la causa de desastres aislados, pero las enfermedades virales han puesto a varias plantas sobre sus rodillas. Esto ocurrió principalmente en plantas que producen fase III y cultivan champiñones en el mismo sitio, pero no siempre. La cronología de la infección de un virus empieza cuando algunas esporas de champiñón infectadas contaminan la composta fase II en la siembra. Aún pequeñas cantidades de contaminante pueden ser muy peligrosas por el sistema a granel que se usa y porque cualquier cantidad de composta infectada puede dispersar el virus a toda la composta a través del micelio. Por lo tanto, cuando el túnel es vaciado la contaminación se dispersa a toda la composta en el túnel y en el área de trabajo. Contrariamente, la fase III, realizada de otra forma, subdivide la composta de tal manera que cualquier infección probablemente no se dispersará tanto. El peor aspecto de una contaminación viral en un túnel fase III a granel es que después del vaciado, el micelio infectado puede ser encontrado por todas partes del área productiva. Es extremadamente difícil matar el 100% del micelio contaminado, por lo que cuando el túnel es llenado con el siguiente lote, ocurre una nueva contaminación. Por lo tanto, cuando el sustrato es sacado, el nivel de contaminación incrementa nuevamente y puede contaminar subsecuentes lotes fase II y así sucesivamente. Las soluciones al problema han sido el aislamiento de las plantas de producción fase II/III de las instalaciones de producción de champiñones, el rediseño de los complejos fase II/III y túneles y el establecimiento de programas fanáticos de higiene. Las mayores modificaciones de diseño fueron la separación de las áreas de vaciado fase II y fase III, el uso de filtros y condiciones de sobrepresurización de las áreas fase II. En esta forma, el aire de fase III no entra en contacto con la composta de fase II. El diseño y los procedimientos de ajustes han sido exitosos puesto que los mayores cambios a la fase III fueron mínimos desde el inicio del presente siglo, pero los cultivadores se mantienen cautos ante esta tecnología. La evolución de los sistemas de procesamiento de composta ha seguido sobre las líneas de mejoramiento de la eficiencia e impacto ambiental. En el futuro, se hará uso de más sistemas de manejo a granel no solo por su eficiencia, sino también por su confiabilidad y su facilidad de uso. Finalmente, la productividad total mejorará por estos factores, pero también cuando los ciclos de cultivo más cortos asociados con los sistemas a granel sean aplicados a las plantas existentes. Para entonces, mayor cantidad de composta por año podrá ocurrir. 53 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus En las figuras 1-7 se presentan diferentes ejemplos de instalaciones dedicadas al procesamiento de la composta (Fases I-III). Figura 1. Túnel fase II con equipo móvil de llenado Figura 2. Búnker fase I Figura 3. Búnker fase I con piso aireado 54 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Figura 4. Llenado de un túnel fase II Figura 5. Sistema de transferencia de composta en una instalación moderna Fase II/III Figura 6. Parrilla de concreto en el piso fase II/III 55 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Figura 7. Túnel fase II/III REFERENCIAS Samp R (2002) Recent developments and future posibilities in the Agaricus spp (button) mushroom industry. In: Sanchez JE, Huerta G, Montiel E (eds) Proceedings of the 4th Internacional Conference on Mushroom Biology and Mushroom Products. Universidad Autónoma del Estado de México. 15-30. Yoder JB, Sinden JW (1953) Synthetic mushroom compost in America. Mush. Sc. 2, 1-5 56 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus V. SUSTRATOS NO COMPOSTEADOS PARA LA PRODUCCION DE AGARICUS BISPORUS Daniel J. Royse 316 Buckhout Lab, Department of Plant Pathology, The Pennsylvania State University, University Park, PA 16802, U.S. <[email protected]> RESUMEN El desarrollo de sustratos no composteadas (SNC) para la producción de Agaricus bisporus está en su infancia, si se compara con los esfuerzos dirigidos hacia el mejoramiento de la calidad y la productividad de la composta tradicional. En la actualidad se producen cantidades no comerciales de A. bisporus sobre SNC; sin embargo, desarrollos recientes pueden ayudar a hacer ésta una posibilidad para el futuro. La producción de champiñones sobre SNC puede permitir mejorar la calidad, la vida de anaquel y la calidad medicinal del producto. En algunos experimentos, los rendimientos obtenidos con SNC han excedido por mucho los alcanzados con composta de fase II. Palabras clave: métodos alternativos, cultivo de champiñón, sustratos estériles. INTRODUCCION La producción comercial de A. bisporus depende de varias materias primas composteadas que consisten en la combinación de heno, rastrojo, pasto, olote, cáscara de semilla de algodón, estiércol de pollo y de caballo, corteza, harina de soya y de semilla de algodón, desechos de la destilación de etanol y yeso. El proceso de composteo consiste de dos fases, en la cual cada fase dura, más o menos, una semana: La fase I es llevada a cabo a la intemperie sobre un patio o búnker aireado o bien en pisos aireados de concreto, mientras que la fase II es conducida en el interior de túneles, en charolas o anaqueles. Durante el proceso de composteo se generan compuestos mal olientes que pueden resultar en quejas de las comunidades vecinas. Los cultivadores han adoptado varias medidas para reducir los olores producidos en las plantas de cultivo de champiñones, entre las que se incluye la práctica de aireación forzada en la fase I de la composta contenida en búnkers o túneles (Op den Camp et al. 1991, Noble et al. 2001, Duns y Rinker 2004). Varios tipos de sustancias volátiles, que incluyen compuestos reducidos de azúfre, ácidos grasos volátiles y aminas, quetonas y compuestos fenólicos han sido asociados con el proceso de composteo. La aireación forzada de la composta fase I ha reducido empíricamente la emisión de compuestos de azúfre en un promedio de 40%, comparado con una pila tradicional de composta, pero esta reducción es muy variable debido a las diferencias que se dan cada semana en las prácticas de cada planta de cultivo (Duns y Rinker 2004). Además, los compuestos reducidos de azúfre tienen un umbral muy bajo de tal manera que los humanos pueden detectar estos compuestos en concentraciones muy bajas. Debido a esto, la emisiones de olores son una fuente constante de quejas y las apelaciones para implementar normas gubernamentales continúan. Es posible producir A. bisporus sobre sustratos no composteadas (SNC) estériles. Varios investigadores han realizado trabajos interesantes a este respecto (Till 1962, Lemke 1965, Huhnke y Sengbusch 1969, San Antonio 1971, Mee 1978, Sánchez y Royse 2001, Sánchez et al. 2002, García et al. 2005, Bechara et al. 2005a,b, 2006a,b,c, Mamiro 2006, Mamiro et al. 2007) que demuestran que los rendimientos de hongos pueden igualar o exceder aquellos obtenidos con la composta fase II. Hasta la fecha, sin embargo, la producción de A. bisporus sobre SNC no ha sido practicada 57 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus comercialmente. Se desconoce la economía de la producción y el método más económico y productivo está aún en evolución. Algunos factores como los ingredientes del sustrato, el tipo y oportunidad de la suplementación y la calidad del hongo requieren ser optimizados para alcanzar prospecciones de carácter comercial en la producción de A. bisporus mediante esta forma. El propósito de este capítulo es revisar el desarrollo hasta la fecha de la producción del champiñón sobre SNC. METODOS DE PRODUCCION DE CHAMPIÑON SOBRE SNC Los primeros experimentos para la producción de A. bisporus sobre SNC fueron iniciados en los primeros años de la década de los 1960’s (Tabla 1). Till (1962) demostró que el rendimiento de A. bisporus sobre una mezcla estéril no composteada de rastrojo de trigo molida, harina de semilla de algodón, turba y carbonato de calcio igualaba o sobrepasaba el obtenido con composta fase II. El sustrato era esterilizado, inoculado asépticamente y mantenido axénicamente hasta que el hongo había colonizado totalmente el sustrato. El sustrato colonizado era entonces cubierto con tierra de cobertura no estéril y los hongos eran cosechados a medida que maduraban. Después, Lemke (1965) siguió la caracterización del sustrato mediante un análisis de la humedad, el pH antes y después de la esterilización y el contenido de nitrógeno. Ella también agregó harina de semilla de algodón a la tierra de cobertura y señaló la tendencia del sustrato a sobrecalentarse cuando la harina era agregada. Los intentos por escalar el método de Till guiaron a Huhnke y Sengbusch al uso de tambos de lámina de 200 l para esterilizar el sustrato con aireación forzada (1968). Ellos también adicionaron un proceso de fermentación después de la esterilización para suprimir el desarrollo de microorganismos competitivos. Este paso adicional permitió sembrar e incubar el sustrato en condiciones no asépticas San Antonio fue el primero en producir hongos A. bisporus directamente de “semilla” o “blanco de hongo” en grano (San Antonio 1971). Su procedimiento involucraba aplicar una capa de tierra de cobertura a la semilla, preparada previamente con grano de cereal. Él desarrolló originalmente esta técnica como una herramienta para estudiar la esterilidad de cultivos derivados de una basidiospora y como un método para estudiar la fisiología, la genética y las enfermedades de A. bisporus. San Antonio (1971) usó recipientes de vidrio de los usados para enlatar alimentos caseros de 8-oz (240 ml), de boca ancha, con 20 g de grano de centeno, 0.4 g de CaCO3 y 20 ml de agua destilada. El grano estéril fue sembrado con 10-20 granos de inóculo e incubado (24° C) por dos semanas con agitación de los granos en los días 4 y 6 para distribuir el micelio del hongo en todo el sustrato, constituido por los granos. En el día 14 el grano colonizado fue cubierto con suelo arcilloso, pasteurizado recientemente (4 h 60°C) y con una humedad a capacidad de saturación como cobertura. El suelo era regado ocasionalmente para mantenerlo a capacidad de campo y los hongos fueron obtenidos 17 días después de aplicar la cobertura. El autor señalaba que habían varias desventajas serias que tendrían que ser superadas antes de que los hongos pudieran ser obtenidos en grandes cantidades a partir de semilla de grano. El sugería que el método de Till parecía más viable para producir hongos con material no composteado. Mee (1978) describió un método para producir hongos sobre SNC que comprendía la combinación de estiércol “frío” (descrito como estiércol de buey, vaca o borrego), ácidos húmicos naturales (como turba) y un material inorgánico para mejorar la permeabilidad (yeso). La base de este método es que los estiércoles fríos no generan calor como los “calientes” como los de caballo y de pollo. Los estiércoles fríos fueron usados en forma seca y pudieron o no ser previamente esterilizados. Mee (1978) propuso que las mezclas podían ser pasteurizadas a 85-100°C por 0.5-4.5 h y encontró 58 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus que durante este paso poco o ningún compuesto nitrogenado se perdía. Esto resultó en la ausencia de olor a amonio o amonio libre, que es tóxico para el crecimiento del hongo. Tabla 1. Historia y resumen de métodos de producción de Agaricus bisporus sobre sustratos no composteados (SNC). Año 1962 1965 1968 1971 1978 1999 2001 2002 2005 2005 2006 2007 Descripción del Método Mezcla de rastrojo de trigo molido y otros aditivos humedecidos, llenado de recipientes, esterilización, enfriamiento y siembra aséptica Caracterización del método de Till mediante mediciones de humedad, pH y contenido de N2 antes y después de esterilizar. Adición de harina de semilla de algodón al sustrato colonizado al aplicar la tierra de cobertura y primera indicación del sobrecalentamiento por adición de nutrientes enriquecidos Uso de tambos de lámina de 200 litros con aireación forzada para esterilizar el sustrato, preparado por el método de Till. Después de la esterilización, el sustrato fue sujeto a un proceso de fermentación que suprimió el desarrollo de organismos competidores. La siembra y la incubación fueron posibles en condiciones no asépticas Sustrato constituido por semilla de hongo en grano cubierta con tierra de cobertura no estéril Obtención de hongos de “buena calidad” sobre una mezcla pasteurizada de estiércol “frío”, turba y yeso Producción hidropónica de hongos sobre roca volcánica y perlita. Se encontró que el mejor medio líquido para promover el crecimiento micelial estaba compuesto de sacarosa, fosfato de amonio, nitrato de potasio y otros minerales esenciales Producción de hongos oscuros Portobello y Crimini sobre sustrato adaptado de formulas utilizadas para cultivar shiitake. Los materiales incluían aserrín de encino, mijo, centeno, turba, alfalfa molida, salvado de trigo y carbonato de calcio Incremento del rango de materias primas como pulpa de café y pasto que podían ser utilizados con SNC Adición de vermicomposta al sustrato (0-12%) y a la tierra de cobertura (0-100%). Los niveles de turba 4% y vermicomposta 4% en el sustrato fueron encontrados mejores. Se alcanzaron valores de EB de 96% Uso de una mezcla de semilla de hongo en grano de cereal y nutrientes de disponibilidad retrasada para la producción de champiñones. Uso de perlita saturada en agua como soporte para los granos para incrementar la disponibilidad de agua y el subsecuente rendimiento en hongos. Evaluación de un ciclo cerrado, un ciclo abierto y un sistema hidropónico no circulado para cultivar champiñones. Obtuvieron los mejores resultados en el sistema no circulado con solución 30 g/l de dextrina como medio Suplementación del SNC de Sánchez y Royse con Micromax® en la siembra y con nutrientes de disponibilidad retrasada al aplicar la tierra de cobertura para mejorar los rendimientos 59 Autor(es) Till O Lemke G Huhnke W, Sengbusch RV San Antonio JP Mee H Aksu S, Gunay A Sanchez JE, Royse DJ Sanchez JE, Royse DJ, Hernandez G García BS, Royse DJ, Sánchez JE Bechara M, Heinemann P, Walker PN, Romaine CP Bechara M, Heinemann P, Walker PN, Romaine CP Mamiro DP, Royse DJ, Beelman RB Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Durante un período de cerca de 20 años, muy poco o ningún trabajo fue reportado sobre el crecimiento y producción de A. bisporus en SNC. A principios de la presente década, Sánchez y Royse (2001) adaptaron formulaciones de sustrato empleadas para cultivar shiitake (Lentinula edodes) en la producción de una variedad oscura de A. bisporus (Fig. 1). Ellos produjeron Portobello sobre un sustrato pasteurizado (110°C durante 15 min), la mezcla básica de SNC consistía en mijo (29%), aserrín de encino (28%), salvado de trigo (9%), centeno (8%), turba (8%), harina de alfalfa (4%), harina de soya (4%), y CaCO3 (10%). La eficiencia biológica obtenida (EB) variaba de un valor inferior de 30.1% (cuando el rastrojo de trigo fue sustituido por aserrín) a 77.1% para la mezcla básica. Los intentos para mejorar la mezcla básica sustituyendo desechos de cervecería, rastrojo de trigo u olote por centeno o aserrín no tuvieron éxito. Ellos usaron bolsas especiales con filtros de alta porosidad para optimizar el crecimiento micelial durante la incubación y observaron que entre más grande era la cantidad de sustrato en la bolsa, más grande era la producción; sin embargo, la EB no se incrementaba de la misma manera. También observaron que con las bolsas estándares utilizadas para cultivar shiitake, el micelio no crecía muy bien en la parte inferior, en el caso de bolsas grandes (6 kg, 25 cm de profundidad, con el filtro microporo cerca de la parte superior). Sin embargo, bolsas hechas especialmente para este propósito (de alta porosidad) proveían suficiente intercambio de gas y crecimiento uniforme desde arriba hasta abajo de la bolsa. Así mismo, se vio que el contenido óptimo de humedad del SNC varió de 50 a 53%, considerablemente menos que el nivel deseado para composta de fase II (alrededor de 72%). Figura 1. Portobellos en fase de maduración (izquierda) sobre un sustrato no composteado compuesto por mijo (29%), aserrín de encino (28%), salvado de trigo (9%), centeno (8%), turba (8%), harina de alfalfa (4%), harina de soya (4%), y CaCO3 (10%) de Sánchez y Royse (2001). Portobellos maduros listos para ser cosechados (derecha). Tratando de mejorar los resultados obtenidos con este tipo de SNC, Sánchez et al. (2002) lograron incrementar el rango de materias primas utilizadas, como pulpa de café y pasto, y García et al. (2005) utilizaron vermicomposta como parte del sustrato (0-12%) y de la tierra de cobertura (0100%). Los niveles de turba 4% y vermicomposta 4% en el sustrato fueron encontrados mejores. Ellos reportaron valores de EB de 96%. Bechara et al. (2005a,b) evaluaron diferentes tasas (20%, 15%, 10%, 5%, 1% y 0%) de los suplementos nutritivos S41 y S44 aplicados a la semilla de grano como sustrato. Ellos también examinaron el efecto de tratar el suplemento con metil tiofanato, un fungicida usado para suprimir el desarrollo del hongo verde durante el cultivo de hongos comestibles. Finalmente, ellos agregaron una sub capa de perlita al sustrato como material para retener humedad. 60 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus El rendimiento de hongos más alto (10.2 kg/m2) fue obtenido con el sustrato suplementado con 15% de nutriente de hongo S41 mientras que la eficiencia biológica más alta (130%) se obtuvo con un sustrato suplementado con 5% de S41. El tratamiento de la semilla con el fungicida metil tiofanato (0.188g Topsin®/150 g semilla/9.3 g CaCO3) redujo significativamente el rendimiento sobre semilla no tratada. El efecto inhibitorio, no observado en escenarios comerciales en donde la semilla es agregada a la composta a una tasa de alrededor de 1.5% semilla/peso de composta seca, pudo ser debido al efecto concentrado del fungicida sobre la semilla, que en este caso formaba la mayor parte del sustrato. Por esta razón no se presentó el efecto de dilución del fungicida que normalmente se da cuando la semilla es solo utilizada para inocular el sustrato. Los autores sugirieron que se necesitaba más experimentación para examinar el efecto de concentraciones más bajas de fungicida y diferentes materiales esponjantes que pudieran controlar el hongo verde sin los efectos inhibitorios en el champiñón. La semilla de grano típicamente tiene un contenido de humedad de 52-58%. Por otra parte, la composta usada para producir hongos tiene una humedad óptima de 68-72%. Por lo tanto, sería de esperarse que un incremento en la humedad del grano a niveles cercanos al de la composta incrementarían los rendimientos. Bechara et al. (2005a,b) usaron una capa de perlita como retenedor de humedad. La perlita, material poroso de origen volcánico puede retener agua en proporciones que van de tres a cuatro veces su propio peso (Hall et al. 1988). Así, ellos colocaron perlita húmeda (590 g agua/2000 ml perlita) en recipientes y la esterilizaron a 121°C durante 60 min. Después colocaron semilla de grano suplementada con 10% de S41 sobre la perlita húmeda. El rendimiento de hongos incrementó de 7.5 kg/m2 sin sub capa de perlita a 13 kg/m2 con dicha capa (EB de 97% y 166%, respectivamente). Por lo tanto, una capa de 2 cm de semilla de grano suplementada y colocada sobre una cama de perlita húmeda produce cerca de la mitad del rendimiento comercial promedio (alrededor de 28 kg/m2) obtenido en una composta de 20 cm de profundidad en Estados Unidos. La literatura sobre producción de hongos con sistemas hidropónicos está limitada a dos reportes (Aksu y Gunay 1999, Bechara et al. 2006c). Aksu y Gunay (1999) reportaron la producción de hongos sobre un sustrato inerte hecho de roca volcánica y perlita (como reportado por Bechara et al. 2006). Un medio líquido compuesto de sacarosa, fosfato de amonio, nitrato de potasio y otros minerales esenciales fueron usados para irrigar una cama de perlita (colocada sobre la roca volcánica) que fue colonizada por el micelio del hongo. El exceso de líquido de la solución fue dejado drenar por gravedad hacia el tanque de alimentación. Una vez que la perlita estuvo totalmente colonizada por el micelio, fue cubierta con una capa no estéril de tierra de cobertura, después de lo cual se cosecharon los hongos. Los rendimientos alcanzaron 17 kg/m2 con este sistema, comparados con los 28 kg/m2 observados en la producción comercial. Bechara (2006c) examinó tres sistemas hidropónicos para la producción de A. bisporus sobre SNC. Él evaluó un ciclo cerrado, un ciclo abierto y un sistema no circulado acoplados a soluciones basadas en sacarosa y dextrina para la producción de hongos. El sistema no circulado con dextrina (30 g/l), caseína (1.76 g/l), tiamina (50 mg/l) y tetraciclina (400 µg/l) produjeron los rendimientos más altos (2.96 kg/m2). El sistema no circulado consistió en una mezcla de perlita húmeda + 30% de turba (v/v) que fue esterilizada antes de inocularla con 200 g de semilla. Este fue el sistema más prometedor y fue comparable a la producción de composta en términos de días desde la aparición de primordios hasta la producción de carpóforos (10 días para el hidropónico vs. 14 para la composta) y de duración de la cosecha (34 días para el hidropónico vs. 30 con la composta). Mamiro (2006), Mamiro et al. (2007) y Mamiro y Royse (2007) examinaron el efecto de la composición del sustrato, tipo de semilla y la adición de suplementos orgánicos e inorgánicos al momento de la siembra y de aplicar la tierra de cobertura en SNC y las posibles interacciones sobre 61 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus el rendimiento, tamaño de los hongos y contenido de sólidos de A. bisporus. Ellos usaron el sustrato básico de Sánchez y Royse (2001) y un inóculo de cobertura (IC) o SNC como semilla para producir una variedad oscura. El primer cultivo (C-1) consistió de cuatro tratamientos, como sigue: 1) 50/50 mezcla de SNC (SNC) y composta gastada de hongo (CGH), 2) SNC, 3) CGH, y 4) composta fase II. Todos los tratamientos fueron suplementados en la siembra con 0.0%, 0.6% ó 0.74% (b.s.) de Micromax®. Micromax® contiene una mezcla de nueve micronutrientes que incluyen (porciento en base seca): Ca (12%), Mg (3%), S (12%), B (0.1%), Cu (1%), Fe (17%), Mn (2.5%), Mo (0.05%), Zn (1%) e ingredientes inertes (57.35%) que se sabe que estimulan el rendimiento de A. bisporus producido con composta fase II (Weil 2003, Weil et al. 2004, 2006). Sobre SNC, los rendimientos generalmente incrementaron cuando incrementó el nivel de Micromax®. Los rendimientos incrementaron de 8.7 kg/m2 sobre SNC sin Micromax® hasta 14 kg/m2 con 0.74% Micromax®. El contenido de sólidos también incrementó en los hongos cosechados del SNC suplementado con Micromax®. En un segundo cultivo con Micromax® (C-2), el rendimiento de hongos también aumentó cuando se aumentó el nivel de Micromax® en el SNC hasta 0.9%. Sin embargo, a un nivel de 1.2% el rendimiento disminuyó y fue significativamente más bajo que al nivel 0.9%. Los sólidos en los carpóforos fueron más altos con 0.74% Micromax®. La producción de hongos sobre SNC como lo proponen Mamiro et al. (2007) requiere una combinación de contenedores. La incubación fue realizada axénicamente en bolsas de plástico, mientras que la producción se llevó a cabo en recipientes de plástico. Este proceso requiere de la fragmentación del sustrato colonizado. Se sabe que la fragmentación mejora la calidad y la vida de anaquel y puede incrementar el nivel de antioxidantes (Dubost 2006, Dubost et al. 2006). Los antioxidantes son conocidos por reducir el daño oxidativo a las células humanas y animales (DiSilvestro 2001, Halliwell 2001). Dubost (2006) encontró que los niveles de ergotionina, un antioxidante presente en relativamente altos niveles en A. bisporus, incrementaba en hongos producidos sobre composta fase II fragmentada al aplicar la tierra de cobertura. En plantas con camas, la composta totalmente colonizada no es fragmentada antes de aplicar la tierra de cobertura; sin embargo, cuando la incubación se hace a granel en túneles (composta fase III), la fragmentación es necesaria para remover y transportar la composta colonizada a las charolas, camas o paquetes. La producción de hongos comienza 1 o 2 días antes sobre composta fragmentada comparado con composta colonizada no perturbada (Sinden y Schisler 1962). Por lo tanto, la fragmentación de la composta puede ofrecer una producción más precoz y puede mejorar la calidad, la vida de anaquel y la calidad saludable de los hongos. CONCLUSIONES El desarrollo de SNC para la producción de hongos está en su infancia, si se compara con la cantidad de esfuerzo dirigido hacia mejorar la productividad de la composta. Se requiere más trabajo sustancial para mejorar la factibilidad económica de producir hongos sobre SNC. Sin embargo, el potencial de mejorar la eficiencia y la calidad del producto y de disminuir el impacto ambiental pueden empujar el uso de SNC hacia una aplicación comercial en un futuro no muy lejano. REFERENCIAS Aksu S, Gunay A (1999) Studies on mushroom production in aquaculture with volcanic turf and perlite. Turkish J. Agric. Forest 23:297-302 (in Turkish). Bechara MA, Heinemann P, Walker PN, Romaine CP (2005a) Agaricus bisporus grain spawn substrate with S41 and S44 nutrient supplements. ASAE Paper No. 057008. St. Joseph, Mich.: ASAE. 62 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Bechara MA, Heinemann P, Walker PN, Romaine CP (2005b) Cultivation of Agaricus bisporus on a mixture of cereal grain spawn and delayed-release nutrient supplement. Mush. News 53(8):6-10. Bechara MA, Heinemann P, Walker PN, Romaine CP, Wilkinson VL (2006a) Evaluating non-composted grain substrates for the production of Agaricus bisporus and Agaricus blazei mushrooms. ASABE Paper No. 067089. St. Joseph, Mich.: ASABE. Bechara MA, Heinemann P, Walker PN, Romaine CP (2006b) Non-composted grain-based substrates for mushroom production (Agaricus bisporus). Transactions of the ASABE 49(3):819-824. Bechara MA, Heinemann P, Walker PN, Romaine CP (2006c) Agaricus bisporus mushroom cultivation in hydroponic systems. Transactions of the ASABE 49(3):825-832. DiSilvestro RA (2001) Flavonoids as antioxidants. Pp 127-128. In: Wildman, R.E.C. (ed.). Handbook of Nutraceuticals and Functional Foods. CRC Press, Boca Raton, Florida. Dubost NJ (2006) Evaluation of ergothioneine and other antioxidants in cultivated mushrooms and factors affecting ergothioneine in Agaricus bisporus. PhD Thesis. The Pennsylvania State University, University Park, PA. Dubost NJ, Beelman RB, Peterson D, Royse DJ (2006) Identification and quantification of ergothioneine in cultivated mushrooms by liquid chromatography-mass spectroscopy. International J. Medicinal Mushrooms 8:215-222. Duns G, Rinker DL (2004) Investigation of mushroom substrate odors by chemical and olfactory methods. Mush. Sci. 16:193-202. García BS, Royse DJ, Sánchez JE (2005) Vermicompost in substrate and casing formulas for the production of brown Agaricus bisporus. In: Tan Q, Zhang J, Chen M, Cao H, Buswell JA, (eds), Proceedings of the 5th International Conference on Mushroom Biology and Mushroom Products, Shanghai. 243-248. Hall DA, Hitchon GM, Szmidt RAK (1988) Perlite culture a new development in hydroponics. In: Proceedings 7th International Congress on Soilless Culture 5:177-183. Halliwell B (2001) Free radical reactions in human disease. Pp 7-8, In: Fuchs, J. & Packer, L. (eds.). Environmental Stressors in Health and Disease. Marcel Dekker, Inc., 270 Madison Avenue, New York. Huhnke W, Sengbusch RV (1968) Champignonanbau auf nicht kompostiertem Nahrsubstrat. Mush. Sci. 7:405-419 Lemke G (1965) Kontrollmassnahmen bim champignonkultur verfahren nach Till. Mush. Sci. 6:393-402. Mamiro DP (2006) Non-composted and spent mushroom substrates for production of Agaricus bisporus. PhD Thesis, The Pennsylvania State University, University Park, PA. Mamiro D, Royse DJ, Beelman RB (2007) Yield, size, and mushroom solids content of Agaricus bisporus produced on non-composted substrate and spent mushroom compost. World J. Microbiol. Biotechnol. (in press). Mamiro D, Royse DJ (2007) The influence of spawn carrier, strain and substrate on yield, size and mushroom solids content of Agaricus bisporus produced on non-composted and spent mushroom compost. Bioresource Tech. (in press). Mee HM (1978) Mushroom composting. U. S. Patent No. 4,127,964. Noble R, Hobbs PJ, Dobrovin-Pennington A, Misselbrook TH, Mead A (2001) Olfactory response to mushroom composting emissions as a function of chemical concentration. J. Environ. Qual. 30:760-767. Op den Camp HJM, Pol A, van der Drift C, Vogels GD, van Griensven LJD (1991) Odorous sulfur compounds emitted during conventional outdoor- and during indoor- composting. Mush. Sci. 13(1):147153. San Antonio JP (1971) A laboratory method to obtain fruit from cased grain spawn of the cultivated mushroom, Agaricus bisporus. Mycologia 63:16-21. Sanchez JE, Royse DJ (2001) Adapting substrate formulas used for shiitake for production of brown Agaricus bisporus. Bioresource Technology 77:65-69. Sanchez JE, Royse DJ, Hernandez G (2002) Development of non-composted substrate for production of Agaricus bisporus. In: Sánchez, J.E., Huerta, G., & Montiel, E., (eds.), Proceedings of the 4th International Conference on Mushroom Biology and Mushroom Products, February 20-23, Cuernavaca, Mexico. 265-270. Sinden JW, Schisler LC (1962) Nutrient supplementation of mushroom compost at casing. Mushroom Science 5:267-280. Till O (1962) Champignonkultur auf sterilisiertem naehrsubstrat und die wiederverwendung von abgetragenem compost. Mush. Sci. 5:127-133. 63 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Weil DA (2003) The effect of micronutrients added to compost on yield and quality of fresh mushrooms. M.S. Thesis, The Pennsylvania State University, University Park, PA. Weil DA, Beelman RB, Beyer DM (2004) Effect of adding a micronutrient-rich supplement to compost on yield and quality of Agaricus bisporus. Mush. Sci. 16:365-371. Weil DA, Beelman RB, Beyer DM (2006) Manganese and other micronutrient additions to improve yield of Agaricus bisporus. Bioresorce Tech. 97:1012-1017. 64 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus VI. USO DE HONGOS TERMÓFILOS PARA LA PREPARACIÓN DE SUSTRATOS José E. Sánchez El Colegio de la Frontera Sur Apartado postal 36. Tapachula, Chiapas 30700 México. <[email protected]> RESUMEN Los hongos termófilos son habitantes naturales de la composta del champiñón. Algunos de estos organismos muestran efectos positivos sobre el crecimiento y la producción de A. bisporus, sin embargo hasta la fecha no ha habido una aplicación directa de esta situación. En la búsqueda de nuevas técnicas de cultivo, alternativas al método tradicional en dos fases y al empleo de sustratos no composteados, se ha retomado el estudio de los hongos termófilos, en especial S. thermophilum, conocido desde hace casi 50 años. Los avances parecen promisorios, aunque se requiere más investigación para mejorar los rendimientos obtenidos y disminuir la incidencia de enfermedades. Palabras clave: hongos comestibles, tecnología fúngica, cultivo de hongos, sustratos alternativos, champiñón, sustratos no composteados, Scytalidium thermophilum. INTRODUCCION La producción comercial de Agaricus bisporus se hace normalmente sobre un sustrato preparado por composteo. Este método ha sido adoptado prácticamente en todo el mundo porque tiene varias ventajas, como son: selectividad en cuanto al crecimiento del champiñón sobre posibles competidores, rendimientos económicamente aceptables y calidad de los hongos, además de que es un método que puede emplearse comercialmente a gran escala. Sin embargo tiene varios inconvenientes como: altos requerimientos de tiempo, espacio, mano de obra e inversión, emisión de olores indeseables y CO2 a la atmósfera, merma entre el 20-30% de materia seca y producción de efluentes con alta carga orgánica. Los detalles del método se han visto y discutido en los capítulos previos de este libro, por lo que aquí solo se recuerda que para la preparación de este sustrato se usan mezclas de rastrojo de trigo con estiércol de caballo o de pollo, heno, olote y otros suplementos. Estos materiales son procesados en una primera fase de composteo aerobio a cielo abierto o en bunkers (Ver capítulos 1 y 4), que puede durar de 5 a15 días, según el tipo de procesado de los materiales y de las condiciones ambientales. La fase II es un proceso que se lleva a cabo en el interior de instalaciones acondicionadas especialmente y dura de 5 a 7 días a 45–60ºC. En esta fase, la composta es pasteurizada y el amonio que se produce durante la primera fase es reducido a niveles que no son tóxicos para el champiñón (Laborde et al. 1993). Debido a que los cultivadores requieren de una preparación más rápida sin los inconvenientes antes mencionados (Op den Camp et al. 1991, Duns et al. 2004), se han desarrollado alternativas con sustratos no composteados (Till 1962, San Antonio 1971, Mee 1978, Sánchez y Royse 2001, Sánchez et al. 2002, García et al. 2005, Bechara et al. 2005 y 2006), que fueron revisadas en el capítulo anterior. Con estas alternativas ha sido posible obtener eficiencias biológicas entre 90– 200% en tres cosechas, las cuales son buenas y aún mejores que las obtenidas por el método tradicional en dos fases. Sin embargo, la mayor limitante de estos métodos alternativos es el uso de ingredientes de alto costo (granos), de altas temperaturas de pasteurización-esterilización del sustrato y el costo del cambio tecnológico. Debido a esta situación, estos métodos no compiten comercialmente con el método tradicional. En la búsqueda por mejorar el método en dos fases, las investigaciones efectuadas hasta ahora han demostrado que la fase I no es un pre-requisito para la fase II y que el hongo que coloniza las compostas, Scytalidium thermophilum (St), es importante en 65 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus la estimulación del crecimiento, desarrollo y producción de A. bisporus (Ab) (Wiegant 1992, Straatsma et al. 1991). Por esta razón, diversos trabajos de investigación se han enfocado a estudiar la aplicación de hongos termofílicos, principalmente St para acortar el ciclo de producción de la composta, mantener un mejor control del proceso de composteo y obtener un sustrato más homogéneo. Sin embargo, la mayoría de estos estudios han concluido que la inoculación de la composta al inicio de la fase II con St no es necesaria porque existe en el proceso suficiente inóculo de este organismo. Por otra parte, los ensayos realizados para eliminar la fase I de composteo a través de inoculación directa de composta con St han demostrado no ser económicamente viables; además, la fase I del composteo es necesaria para suavizar el rastrojo y los demás materiales utilizados. De hecho, la densidad aparente de las materias primas mejora después de la fase I de composteo, lo que redunda en que un mayor peso seco de sustrato puede introducirse por m3 en los túneles y cuartos donde se produce Ab (Straatsma et al. 1995, Gerrits et al. 1995). Estas conclusiones, obtenidas hace más de diez años, detuvieron el estudio de la aplicación de hongos termófilos en procesos alternativos de cultivo de champiñón; sin embargo, en la actualidad estos esfuerzos se han retomado porque los hongos termófilos parecen ser una alternativa con gran potencial. A continuación se hace un resumen de los avances logrados. LOS HONGOS TERMÓFILOS Puede decirse, de manera general, que los hongos no poseen una alta capacidad para crecer a temperaturas elevadas, como sí es el caso de algunos archae, bacterias y actinomicetos, que son encontrados en habitats con temperaturas superiores a 70°C y aún extremas. Sin embargo, al igual que todos los organismos, para efectos de estudio y de identificación, los hongos pueden ser clasificados en psicrófilos, mesófilos, y termófilos en razón de los rangos de temperatura en los cuales se pueden desarrollar particularmente. Según Cooney y Emerson (1964), tomando una definición arbitraria con los mismos fines, los hongos termófilos son aquellos hongos que tienen un temperatura mínima de crecimiento igual o superior a 20ºC y una optima de crecimiento de 50ºC o superior. Estos mismos autores indican que otro criterio también empleado para definir estos hongos considera como termófilos a aquellos hongos con una temperatura óptima de crecimiento superior a 40ºC. Pope et al. (1963) señalaron la diferencia entre aquellos hongos que tienen una temperatura óptima de crecimiento igual o superior a 40ºC de aquellos que pueden soportar temperaturas altas en alguna fase de dormancia o inactividad. Este sería el caso de las esporas de ciertos hongos que crecen sobre un rango amplio de temperaturas (algunas especies de Rhizopus y de Aspergillus, por ejemplo) y por lo tanto son considerados más bien termotolerantes que termofílicos. Los hongos termófilos actualmente han adquirido mucho interés en razón de su capacidad, no solo para crecer a temperaturas relativamente altas, sino porque algunos son capaces de degradar polímeros difíciles como la celulosa y el almidón. Esto abre el interés por el metabolismo de estos organismos y en particular de sus enzimas. Los ácidos grasos y en particular los lípidos polares de los hongos termofílicos, entre ellos Humicola grisea var thermoidea, parecen estar más saturados que los lípidos de especies mesofílicas similares. La estabilidad de la membrana a altas temperaturas es sin lugar a dudas debida al grado de saturación de sus ácidos grasos. Esta estabilidad puede también ser en parte, debida a otros compuestos como proteínas, esteroles, lípidos polares y su interacción (Mumma et al. 1971). Los hongos termófilos son fuente potencial de enzimas con interés científico y/o comercial. Las propiedades de sus enzimas muestran diferencias no solo entre especies, sino entre cepas. Sus enzimas extracelulares tienen temperaturas óptimas de actividad que están cerca o arriba del óptimo de crecimiento del organismo y, en general, son más termoestables que las enzimas de hongos 66 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus mesofílicos. Algunas enzimas extracelulares de hongos termófilos son producidas comercialmente, y algunas otras parecen interesantes para tal fin. Los genes de algunos hongos termofílicos que codifican lipasas, proteasas, xylanasas y celulasas han sido clonados y sobreexpresados en hongos heterólogos y se han obtenido proteínas puras, cristalinas para elucidar los mecanismos de termoestabilidad y de la catálisis. En contraste, la estabilidad térmica de algunas enzimas intracelulares que han sido purificadas es comparable y en algunos casos, menor que la observada en hongos mesofílicos. Aunque hacen falta datos rigurosos, parece ser que los eucariotes termófilos involucran varios mecanismos de estabilización enzimática o de optimización de su actividad, con diferentes mecanismos que operan para diferentes enzimas (Maheshwari et al. 2000) Habitat natural de los hongos termófilos Aunque pudiera pensarse que, debido a una mayor temperatura y condiciones favorables de desarrollo, los trópicos fueran los sitios de mayor prevalencia de los hongos termófilos, la verdad es que estos organismos se encuentran en todas partes del mundo, especialmente en aquellos lugares en donde hay materiales orgánicos en proceso de autocalentamiento y en lugares en donde las temperaturas les son propicias. Los hongos termófilos han sido encontrado en: heno, compostas, turba almacenada, suelo, estiércol de animales de sangre caliente, nidos de pájaros o de animales en hibernación y aún en ambientes acuáticos, de donde el micelio o las esporas han podido ser aisladas (Eggins y Malik 1969, Ellis 1980). Uno de los principales habitats en donde viven los hongos termófilos son las compostas, en la medida en que ellas reúnen características particulares en cuanto a temperatura, pH, disponibilidad de oxígeno, sustrato, que permitan a estos organismos desarrollarse paralelamente con otros organismos, también termófilos, y calentar la masa en proceso. Estas condiciones naturalmente se ven afectadas por el volumen, granulometría del sustrato y otros factores físicoquímicos. La composta para el champiñón La composta donde tradicionalmente se cultiva el champiñón ha sido reportada en una gran cantidad de estudios como un habitat propicio para el desarrollo de hongos termófilos. Después de cortar o moler el sustrato, humedecerlo y apilarlo, empieza una notable actividad microbiana que hace que la temperatura de la masa en proceso suba por efecto del metabolismo microbiano sobre los azúcares, principalmente. Como la temperatura sube, los organismos mesofílicos mueren y son reemplazados por poblaciones termofílicas. Las bacterias como Proteus, Micrococcus y Aerobacter utilizan nitrógeno orgánico e inorgánico y son acompañadas por consumidores de carbohidratos, bacterias de géneros como Bacillus, Flavobacterium, Pseudomonas y Serratia que degradan la grasa, los almidones, la celulosa y la cera de la cutícula de la paja. Estos organismos además degradan partes de la lignina en la paja. En algún momento Streptomyces thermovulgaricus y S. rectus generan calor adicional y los actinomicetes nitrificantes elevan la concentración de amonio a niveles tóxicos para otros miembros de la microflora de la composta (Harvey 1982). Toda esta secuencia suele presentarse durante la fase I del composteo tradicional para la elaboración del sustrato para producir champiñón. Al subir la temperatura de la composta por encima de 50-55°C, los hongos termófilos se inactivan y aún mueren; sin embargo al descender la temperatura, son reinoculados a partir de las paredes y maquinaria utilizada para el manejo y almacenamiento de estos materiales, haciendo que vuelvan a desarrollarse. La obtención de una composta de calidad se realiza durante la fase II, como resultado del control de la sucesión ecológica de microorganismos termofílicos, los cuales selectivamente utilizan los desechos de los compuestos nitrogenados inestables y los carbohidratos disponibles en la composta. La sucesión microecológica durante la fase II, consiste en la propagación de actinomicetes y hongos 67 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus termofílicos. Dos actinomicetos, Thermoactinomyces y Thermomonospora, que se encuentran comúnmente en esta fase, consumen amonio como fuente de nitrógeno para la síntesis de sus células. Un grupo de hongos no celulolíticos ayudan a los actinomicetes en la conversión de amonio; estos incluyen a Humicola launginosa, H. stellata, Mucor y Thermoascus. El porcentaje de conversión de amonio es más rápido y el proceso más eficiente en las primeras 60 horas de la fase II (Harvey 1982). Cuando la temperatura baja a menos de 53ºC se presentan un gran número de poblaciones fúngicas mesofilicas, donde predominan Humicola grisea, Scytalidium thermophilum, Humicola insolens, Torula sp y Myriococcum sp, los cuales asimilan carbono del sustrato debido a su actividad celulasa (Harvey 1982, Schisler 1982). Estos hongos tienen la habilidad de degradar la celulosa cristalina (pura) y preceden a un grupo secundario que tienen menor capacidad de degradar el complejo formado por la celulosa. Este incluye a Malbranchea, Stilbella thermophila y Talaromyces. Finalmente el proceso de composteo concluye con el agotamiento de los nutrientes dentro del sustrato, la composta se enfría a menos de 45ºC, los hongos termofílicos disminuyen su actividad o bien mueren y dejan como residuos sus membranas celulares, las cuales están compuestas por polisacáridos, ácidos grasos como ácido linoleico y proteínas que constituyen una rica reserva para A. bisporus. Estos compuestos son desdoblados por acción enzimática del micelio del champiñón y absorbidos como fuente de energía y crecimiento. INTERRELACIÓN AGARICUS BISPORUS HONGOS TERMÓFILOS En el proceso de cultivo del champiñón, los efectos que se atribuyen a la acción de los hongos termofilicos se refieren a: 1) la disminución de la concentración de amonio, que permite neutralizar el medio para el crecimiento micelial de éste; 2) a la inmovilización de nutrientes para otros microorganismos competidores para una disponibilidad de éstos por el micelio de Ab, 3) a un efecto de estimulación-crecimiento en el champiñón (Wiegant 1992, Wiegant et al. 1992) y 4) la producción de metabolitos que pueden inhibir el crecimiento de organimos competidores (Lyons et al. 1999) En un estudio de dinámica poblacional, Straastma et al. (1989) determinó que la densidad de S. thermophilum estimula fuertemente la tasa de extensión lineal del micelio del hongo y se correlaciona de manera positiva con la producción de A. bisporus. De manera general, S. thermophilum provee de una composta selectiva, que protege el crecimiento micelial de Ab contra la acción de efectos negativos de bacterias, además es probable que S. thermophilum posea un disparador que estimula el crecimiento de Ab por un mecanismo todavía no definido, en donde algunas sustancias volátiles pudieran estar incluidas. Straastma et al. (1994a) identificó nueve especies de hongos termófilos que promueven el crecimiento micelial de A. bisporus: Chaetomiun thermophilum, Chaetomiun sp., Malbrachea sulfurea, Myriococcum thermophilum, Scytalidium thermophilum, Stilbella thermophila Thielavia terrestres y dos basidiomicetes. Menciona que la densidad de S. thermophilum ha sido correlacionada positivamente con la producción de hongos y que estimula fuertemente el crecimiento micelial, ya que A. bisporus puede alcanzar una velocidad de crecimiento en promedio de 7 mmd-1. Algunas especies de hongos termofílicos no promueven el crecimiento de A. bisporus, entre éstos, Thermomyces lanuginosus, Aspergillus fumigatus y Zigomycetes, todos comunes en fases tempranas del composteo. También, se han aislado actinomicetes y bacterias (Bacillus licheniformis) que tienen efectos adversos en el crecimiento de A. bisporus, pero este efecto fue contrarrestado por S. thermophilum (Straastma et al. 1991). Op den Camp et al. (1990), mencionaron que la presencia de St es importante para la colonización del sustrato por Ab y que la precolonización por este hongo termofílico podría permitir la obtención de un medio selectivo. 68 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Estos autores describieron la interacción entre estos dos hongos como competitiva, en donde Ab es clasificado como un competidor combativo de St. ENSAYOS CON HONGOS TERMÓFILOS En el año de 1963, Pope et al. reportaron el uso de hongos termofílicos para la preparación de compostas para el cultivo del champiñón. Ellos probaron varias especies de Penicillium, Anixia, Chaetomium, Mucor, Monotospora, Humicola, Torula, Rhizopus, Aspergillus, Thermoascus, Malbranchia, Thermoidium, Cephalosporium, Arthrobotrys, Graphium, y Dactylomyces, en un sustrato formado por 50% heno y 50% olote de maíz, suplementado con 0.1% de yeso y 1% de harina de sangre. A partir de sus resultados, ellos consideraron que en los casos en que habían utilizado especies de Penicillium y Anixia el sustrato era más favorable para el crecimiento de Agaricus. Cuando probaron compostas colonizadas con Torula y Humicola obtuvieron rendimientos entre 3.4 y 8.78 kg/m2 (0.7 y 1.8 lb/pie2) con hongos de buen tamaño (20-30 g de peso), sin embargo observaron que la contaminación por bacterias era casi inminente en cada caso. Ellos concluyeron que para hacer posible esta alternativa, que parecía buena por las ventajas con respecto del tiempo de preparación y la calidad de los hongos, debería de resolverse problemas como 1) la eliminación de la contaminación por bacterias y otros hongos, 2) la estabilización del contenido de agua de la composta y 3) el uso de combinaciones compatibles de hongos termófilos. Sin embargo, no hubo en los años siguientes, estudios que optimizaran esta técnica. Uso de Scytalidium thermophilum como alternativa de producción. Dada la importancia que se ha dado a St, a continuación se hace una breve reseña de sus características generales: Según Straastma y Samson (1993), S. thermophilum (Cooney &Emerson) Austick (= Humicola grisea Traaen var. Thermoidea Cooney & Emerson, = Torula thermophila Cooney & Emerson, = Humicola insolens Cooney & Emerson), pertenece a la clase Hyphomycetes, orden Moniliales, familia Demathiaceae. Sus colonias crecen rápidamente y alcanzan un diámetro de 9 cm en cinco días a 40ºC. Presenta micelio de color verde oscuro, especialmente en los márgenes e hifas hialinas de 4-6 µm de ancho, con paredes lisas. Los conidios son elipsoidales o globosos, con paredes lisas y gruesas, pigmentadas de color oscuro, con 8 –12 µm de diámetro. Sánchez et al. (2007) indican que crece bien a pH neutros y medianamente alcalinos y que tolera concentraciones variables según la fuente, de calcio en el sustrato sólido, y que pueden ser superiores al 15%. Su temperatura óptima de crecimiento es 45ºC, y aún crece a 25º y 50ºC. Según Wiegant 1992, St crece hasta los 55ºC, las hifas mueren a 58ºC y las esporas a 68ºC y es común encontrarlo en las pajas y estiércoles de caballo. Nuestros estudios han demostrado que crece bien sobre el medio agar papa dextrosa y levadura, mejor que sobre agar glucosa levadura o agar extracto de malta glucosa. Así, crece bien también sobre sustratos celulósicos y amiláceos y uno de los sustratos donde crece muy bien es el pasto pangola. Otros sustratos recomendables son el rastrojo de trigo y el olote, así como los granos cocidos de mijo, sorgo, avena o arroz, entre otros, pero no el de trigo. Straastma y Samson (1993) mencionaron que S. thermophilum es una de las especies dominantes en compostas para producción de hongos. Bajo ciertas condiciones pueden convertir diversos sustratos en materiales que pueden ser utilizados por A. bisporus. Se ha señalado la importancia del uso de hongos termofílicos, como S. thermophilum en la estimulación de la velocidad de crecimiento micelial y producción de Agaricus spp., la disminución de la concentración de amonio y la inmovilización de nutrientes (Straastma et al 1989, Straastama et al. 1991, Wiegant et al. 1992, Sánchez et al. 2007). La inoculación durante la segunda fase del proceso de composteo puede considerarse como una 69 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus manera de acortar el tiempo de preparación del sustrato para el cultivo de A. bisporus; la inoculación puede realizarse de dos maneras: antes o después de la fase de pasteurización; en el caso de la primera las esporas actúan solo como inoculo y en la segunda tanto el micelio como esporas actúan como inoculo (Wiegant, 1992) AVANCES Ensayos de producción Sánchez et al. (2007) determinaron que es posible cultivar Ab sobre pasto pangola precolonizado por St. Ellos pasteurizaron el pasto durante 8 horas a 60ºC (ó 1h a 90ºC) y después hicieron crecer el hongo mitospórico sobre el pasto por cuatro días a 45ºC. Al cabo de este tiempo sembraron Ab y lo cultivaron en las condiciones normales de humedad y temperatura. Al evaluar la producción notaron que el pasto precolonizado por St produjo más del doble de carpóforos que el sustrato sin precolonizar por St. Adicionalmente notaron que cuando agregaron 2% de cal al pasto pudieron alcanzar una eficiencia biológica de 48%. Este resultado, aunque bajo desde el punto de vista comercial, es notable si se toma en cuenta que se obtuvo sobre un sustrato crudo (sin procesar por 15 días en la fase I de composteo) y sin adición de suplementos. Estos resultados indicaron la posibilidad de desarrollar un sustrato alternativo no estéril para cultivar el champiñón. En continuación a estos estudios, Coello Castillo (2006), siguiendo las recomendaciones de Schisler y Sinden (1966) de suplementar al momento de aplicar la tierra de cobertura, determinó que la adición de 6% de soya granulada mejora la producción (Figura 1). Ella también probó la adición de garbanzo y frijol negro, obteniendo EB entre 50-79%. Así mismo indicó que la suplementación mejora la producción y reduce el ciclo de cultivo, ya que con los sustratos suplementados obtuvo la primera cosecha 40-42 días después de la siembra de Ab, mientras que con el control sin suplemento la obtuvieron a los 50. Así mismo, en este estudio se encontró que a pequeña escala, después de la pasteurización, es posible mantener la temperatura adecuada para la incubación de St, (alrededor de 45ºC) si se compostea en cajones de madera en capas de sustrato de alrededor de 40 cm, para propiciar que el autocalentamiento de las pilas no exceda los niveles adecuados para St. Así mismo encontró que al intervenir la micobiota nativa en las pilas y mantener el composteo por solo 2-3 días, la eficiencia biológica mejora, con relación a la obtenida en condiciones controladas, utilizando únicamente St, probablemente por la intervención de la biota benéfica natural. Esta situación abre la posibilidad de cultivar Ab en áreas rurales, en condiciones rústicas, siempre y cuando la temperatura y la humedad del lugar sean adecuadas. Finalmente, los últimos resultados, aún pendientes de publicación (Sánchez y Royse, en preparación) demuestran que es posible incrementar más la producción de carpóforos si se utiliza una mezcla de olote + rastrojo de trigo adicionada de mijo precocido y suplementada al momento de aplicar la tierra de cobertura (6% de suplemento comercial), o bien si el rastrojo de trigo se suplementa tanto a la siembra como a la aplicación de la tierra de cobertura con 6% de suplemento comercial rico en proteína. En este caso, es posible obtener EB superiores a 80%. 70 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus a b d c Figura 1.a) Colonia de Agaricus bisporus creciendo sobre pasto pangola previamente colonizado por Scytalidium thermophilum, b) Hongos Portobello cultivados sobre pasto pangola suplementado al aplicar la cobertura con 6% de soya granulada (Coello Castillo 2006), c) Mezcla de olote, rastrojo de trigo y mijo precocido cubierta por el micelio de A. bisporus después de haber sido colonizada por S. thermophilum d) Fructificaciones de A. bisporus sobre el mismo sustrato en c), suplementado al aplicar la cobertura con 6% de suplemento comercial (Sánchez y Royse en preparación) Enfermedades y plagas Durante el desarrollo de los estudios aquí mencionados se han visto con frecuencia diversos problemas derivados de organismos no deseados. Así, aunque los hongos verdes del género Trichoderma, han estado presentes eventualmente, podría decirse que no han sido los contaminantes más communes, ya que también se ha visto notablemente la presencia de Penicillium sp y de otros hongos de los géneros Rhizopus y Cryptococcus. Por otra parte, se ha observado también la presencia de nemátodos, ácaros y myxomycetes. Estos problemas se han presentado principalmente cuando el crecimiento de St no es uniforme, derivado de una deficiente incubación después de la siembra del termófilo. Esto hace pensar que el desarrollo de una técnica diferente puede también propiciar la aparición de otros organismos que son seleccionados por el medio formado. Esta es un área que debe ser estudiada con mayor detalle. Ab Cal 2% Agua 70% Semilla 2% Suplemento St 0.5% Pasto o rastrojo molido 60°C 8 h ó 90ºC 1h Pasto o rastrojo + 2% cal 45°C 72 h, humedad y O2 Pasto o rastrojo + 2% cal Incubación Cobertura IC Suplemento Sustrato colonizado Incubación 34 días Figura 2. Esquema de preparación del sustrato y cultivo de Agaricus bisporus con precolonización de Scytalidum thermophilum. El proceso dura 34 días desde la preparación de la materia prima hasta el término de la colonización del suelo de cobertura, justo antes de la fructificación. 71 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Otros termófilos Aparte de los casos ya mencionados, no existen en la literatura reportes sobre la utilización de otros hongos termófilos para el cultivo del champiñón. En nuestro caso, hemos iniciado algunos estudios con dos cepas de Myriococcum thermophilium (Papulaspora thermophila Fergus), donadas por el Dr. G. Straatsma. En su opinión, este hongo podría tener algún provecho, en consideración a su velocidad de crecimiento a 45°C y su capacidad para estimular el crecimiento de Ab. Los estudios en laboratorio han confirmado que este hongo (que no produce esporas), tiene la capacidad de estimular el crecimiento de Ab, y no crece a temperatura ambiente, como sí crece St. Esto pudiera ser un indicio de una manera diferente de aprovecharlo en caso de utilizarlo como pre-inóculo para Ab. Estudios futuros con este y otros organismos permitirán plantear nuevas alternativas de aprovechamiento de la relación Ab-termófilos, con lo cual podría pensarse no solamente en hongos, ya que entre los actinomicetos pudieran existir algunas especies de interés. PERSPECTIVAS Los logros alcanzados hasta ahora han demostrado que es posible cultivar A. bisporus (variedades blancas y oscuras) en un sustrato precultivado con termófilos con rendimientos comparables al método de dos fases, sin embargo, especial cuidado debe ponerse para evitar la presencia de contaminantes. Las eficiencias obtenidas (alrededor de 80%) no son sin embargo suficientemente altas para convencer a los cultivadores de un cambio de tecnología. Más esfuerzos de investigación son necesarios para mejorar esta alternativa. El proceso de cultivo propuesto se esquematiza en la figura 2: Los materiales molidos (con pH 8 y 70% de humedad) son mezclados y pasteurizados (60°C por 8 h) para formar el sustrato que será sembrado con St. Posteriormente este sustrato se incuba a 45°C, 48-72 h, al cabo de lo cual se siembra A. bisporus. Finalmente se siguen las condiciones ya establecidas para el cultivo de este hongo bajo condiciones normales. De esta manera, se logra la eliminación de la fase I de composteo, lo cual puede representar una disminución de 7-10 días con respecto del proceso tradicional de dos fases. El efecto ocasionado por la fase I del composteo de comprimir, o hacer más denso el sustrato (que ha sido considerado como una desventaja para el caso de algunos sustratos utilizados por métodos sin composteo), puede ser paliado al realizar mezclas de materias primas adecuadas (granos, condensados protéicos, etc) y la molienda de los otros ingredientes como el pasto o el rastrojo. Así mismo, más estudios son necesarios para incrementar el rendimiento usando ingredientes de bajo costo o de fácil disponibilidad y sin gasto de energía para cocer el grano utilizado actualmente. Se ha visto que los riesgos de enfermedades y plagas son altos, lo cual obliga a incorporar fuertemente la evaluación del riesgo de organismos indeseables paralelamente con los estudios de optimización de la tecnología. Por otra parte, es claro que se necesita más investigación básica sobre hongos termófilos y su relación con A. bisporus. El conocimiento de estos aspectos básicos puede dar pauta para poder solventar los problemas actuales de inconsistencia de resultados, así como, seguramente, identificar y estudiar microorganismos alternativos a St. AGRADECIMIENTOS Se agradece al MC. René Andrade Gallegos, a la QFB Lilia Moreno y al Sr. Gerardo Hernández el apoyo otorgado durante la realización de los diferentes trabajos que condujeron a la elaboración de este capítulo. 72 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus REFERENCIAS Bechara MA, Heinemann P, Walker PN, Romaine CP (2005) Cultivation of Agaricus bisporus on a mixture of cereal grain spawn and delayed-release nutrient supplement. Mush. News 53(8):6-10. Bechara MA, Heinemann P, Walker PN, Romaine CP (2006) Non-composted grain-based substrates for mushroom production (Agaricus bisporus). Transactions of the ASABE 49(3):819-824. Beyer, DM (2005) Best management practices of mushroom substrate preparation. Mush. News 53 (11), 30– 34. Coello Castillo MM (2006) Uso de Scytalidium thermophilum para el cultivo semi-comercial de Agaricus spp. Tesis de maestría. Instituto Politécnico Nacional. Unidad Oaxaca. 68p Cooney DG, Emerson R (1964) Thermophilic fungi. An account of their biology, activities and classification. WH Freeman and Co. San Francisco y Londres. Duns GJ, Rinker DL, King L, Ripley BD, Alm G (2004) Comparasions of odor emissions from mushroom substrate prepared by traditional windrow and forced aereation composting methods using organoleptic and analytical chemical methods of odor assessment. Mush. News 52(8):6-24. Eggins HOW, Malik KA (1969) The occurrence of thermophilic cellulolytic fungi in a pasture land soil. Antonie van Leeuwenhoek 35:178-184. Ellis DH (1980) Thermophilic fungi isolated from a heated aquatic habitat. Mycologia 72 (5):1030-1033 Garcia BS, Royse DJ, Sanchez JE (2005) Vermicompost in substrate and casing formulas for the production of brown Agaricus bisporus. In: Tan Q, Zhang J, Chen M, C., Cao H, Buswell JA (eds) Proceedings of the fifth International Conference on Mushroom Biology and Mushroom Products. (Supplement)12: 243248. Gerrits JPG, Amsing JGM, Straatsma G, Van Griensven LJDL (1995) Phase I process in tunnels for the production of Agaricus bisporus compost with special referente to the importante of water. Mush. Sci. 14:203-211. Harvey C (1982) Some biological indicators of compost quality. In: Penn State Handbook for Commercial Mushroom Growers Special publication. College of Agricultural Sciences, Pennsylvania State University, 129. pp 11-18. Laborde J, Lanzi G, Francescutti B, Giordani E (1993) Indoor composting: general principes and large scale development in Italy. In: Chang K et al. (eds). Proceed. 1st Int. Conf. On Musroom Biology and Mushroom Products. The Chinese university Press. Hong Kong 93-113. Lyons GA, Sharma HSS, Blakeman JP (1999) The importante of Scytalidium thermophilum in substrate specificity for the production of Agaricus bisporus. In: Proceed. Third Internacional Conference on Muchroom Biology and Mushroom Products. CD. Sydney Maheshwari R, Bharadwaj G, Bhat MK (2000) Thermophilic fungi: their physiology and enzymes. Microbiol Mol Biol Rev 64(3):461-88. Mee HM (1978) Mushroom composting. US Patent 4 127 964. Mumma RO, Sekura RD, Fergus CL (1971) Thermophilic fungi: III. The lipids of Humicola grisea var.thermoidea. Lipids 6(8):589-594. Op den Camp HJM, Derkx PJl, Van der Drift C, Vogels GD, Van Griensven LJLD (1991) Odorous sulfur compounds emitted during conventional outdoor and during indoor composting. Mush. Sci. 13(1):147153. Op den Camp HJM, Stumin CK, Straatsma G, Derikx PJL, Van Griensven LJLD (1990) Hyphal and micelial interaction between Agaricus bisporus and Scytalidium thermophilum on agar media. Microb. Ecol. 19: 303-309. Pope S, Knaust S, Knaust K (1963) Production of compost by thermophilic fungi. Mush. Sci. 5, 123-126. San Antonio JP (1971) A laboratory method to obtain fruit from cased grain spawn of the cultivated mushroom, Agaricus bisporus. Mycologia 63:16-21. Sánchez JE, Mejía L, Royse DJ (2007) Colonization of pangola grass with Scytalidium thermophilum for production of Agaricus bisporus. Bioresource Technology. On line first. doi:10.1016/j.biortech.2006.11.067 Sanchez JE, Royse DJ, Hernandez G (2002) Development of non-composted substrate for production of Agaricus bisporus. In: Sánchez, J.E., Huerta, G., & Montiel, E., (eds.), Proceedings of the 4th International Conference on Mushroom Biology and Mushroom Products, February 20-23, Cuernavaca, Mexico. 265-270. 73 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Sanchez JE, Royse DJ (2001) Adapting substrate formulas used for shiitake for production of brown Agaricus bisporus. Biores. Technol. 1594: 1-5. Schisler LC (1982) Biochemical and mycological aspects of mushroom composting. In:Penn State Handbook for Commercial Mushroom Growers Special publication. College of Agricultural Sciences, Pennsylvania State University, 129 pp.3-10 Schisler LC, Sinden JW (1966) Nutrient supplementation of mushroom compost at casing vegetable oils. Canadian journal of botany 4: 287-293. Straastma G, Samson RA, Olijnsma TW, Op den Camp HJM, Gerrits JPG, Van Griensven LJLD (1994a). Ecology of thermophilic fungi in mushroom compost, with emphasis on Scytalidium thermophilum and growth stimulation of Agaricus bisporus mycelium. Appl. Env. Microbiol 60(2):454-458. Straastma G, Olijnsma TW, Gerrits JPG, Amsing JGM, Op den Camp HJM, Van Griesven LJLD (1994b) Inoculation of Scytalidium thermophilum in button mushroom compost and its effect on yield. App. Env. Microbiol.60 (9): 3049-3054. Straastma G, Samson RA (1993) Taxonomy of Scytalidium thermophilum, an important thermophilic fungus in mushroom compost. Micol. Res. 97 (3): 321-328. Straatsma G, Samson RA, Olinjsma TW, Gerrits JPG, Op den Camp HJM, Vaan Griensven LJDL (1995). Bioconveersion of cereal straw into mushroom compost. Can. J. Bot. 73 (suppl) S1019-S1024 Straastma G, Gerrits JPG, Gerrits TM, Op den Camp HJM, Van Griensven LJLD, (1991) Growth kinetics of Agaricus bisporus mycelium on solid substrate (mushroom compost). J. Gen. Microbiol. 137:1471-1477 Straatsma G, Gerrits JPG, Augustijn, MPAM, Op den Camp HJM, Vogels GD, Van Griensven LJLD (1989). Population dynamics of Scytalidium thermophilum in mushroom compost and stimulatory effects on growth rate and yield Agaricus bisporus. Journal of General Microbiol 135: 751-759. Till O (1962) Cultivation of mushroom on sterile substrate and reutilization of spent compost. Mush.Sci.5, 127-133. Wiegant WM (1992) Growth characteristics of the thermophilic fungus Scytalidium thermophilum in relation to production of mushroom compost. Appl. Env. Microbiol. 58: 1301-1307. Wiegant WM, Wery J, Buitenhuis ET, De Bont JAM (1992) Growth-Promoting effect of thermophilic fungi on the mycelium of the edible mushroom Agaricus bisporus. Appl. Env. Microbiol. 58: 2654-2659. 74 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus VII. CULTIVO Y PRODUCCIÓN DEL CHAMPIÑÓN: UN ENFOQUE TECNOLÓGICO Agustín García Parada Grupo Monteblanco, Bosque de Ciruelos 304, piso 9, México D.F., C.P. 11700. <[email protected]> RESUMEN Se hace un análisis de los elementos que permiten una adecuada producción del champiñón Agaricus bisporus poniendo énfasis en la capacidad enzimática del hongo, como parte fundamental de su metabolismo y se considera de importancia primordial el tripié formado por los aspectos nutritivos, la presión de contagio y los factores del entorno en que se cultiva. Palabras clave: Agaricus bisporus, fisiología, cultivo, nutrición, sustratos, composteo INTRODUCCIÓN Para la presentación de este tema adoptaré principalmente las ideas que aprendí de mi maestro y amigo Pieter Vedder, utilizadas por él para explicar y entender a los organismos patógenos: cómo evitarlos y cómo combatirlos; proceso que también puede ser aplicado para entender mejor cómo crece cualquier otro organismo; como por ejemplo el champiñón. Al organismo lo sostienen tres patas de un tripié que sostiene su propagación y desarrollo; las tres patas del tripié a considerar son las siguientes: Nutrición. Presión de contagio e inoculación. Factores del entorno que lo favorecen o perjudican Pero antes de abordar estos conceptos comentaremos varios puntos importantes para nuestra exposición: Organismos autótrofos y heterótrofos Son llamados autótrofos aquellos organismos que producen ellos mismos sus nutrientes mediante la acción de su metabolismo (los organismos con clorofila utilizan la energía de la luz solar para este fin, la gran mayoría de las plantas tienen esta capacidad de fotosíntesis y son por ello organismos autótrofos). Una inmensa mayoría de organismos, sin embargo, se alimentan de otros organismos, de residuos de su metabolismo o bien residuos que los mismos organismos dejan al morir, a estos otros organismos se les llama heterótrofos. Todos los hongos, incluyendo a los champiñones, son organismos heterótrofos, por lo que deben procurarse los nutrientes que los alimentarán. ¿Qué nutrientes deben ser proporcionados preferentemente a los champiñones? Todos los organismos asimilan sus nutrientes con la acción que ejercen las enzimas que cada uno produce. Estas enzimas son proteínas, y cada organismo lleva encriptado en su ADN qué enzimas necesitará producir. Para poder asimilar los nutrientes el organismo requerirá de enzimas específicas que puedan romper y/o unir los componentes químicos que conforman a cada nutriente, para que lo puedan metabolizar. La investigación y la experiencia de muchos años cultivando champiñones en todo el mundo indican cuáles pueden ser los nutrientes idóneos para estos 75 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus organismos; sin embargo, para conocer mejor al champiñón conviene conocer además cuáles otras opciones de nutrición son también posibles; para ello, hay un experimento que realizó a principio de los años 1960's el Dr. Otto Till con el que se puede entender mejor los requerimientos y posibilidades de nutrición de los champiñones. ¿Qué se puede aprender del experimento del Dr. Till? El Dr. Till preparó un sustrato en el que ajustó la base nutricional a la relación carbono/nitrógeno en los niveles que en la práctica han dado mejores resultados (a la siembra: C/N = 15); utilizó el mismo tipo de componentes que se utilizan en la elaboración convencional de compost: paja de trigo, harina de semilla de algodón y de soya y carbonato de calcio (en vez de yeso), mezclándolos pero sin compostearlos (simplemente mezcló todos estos ingredientes una vez que en la paja de trigo hubo incorporado el agua para alcanzar un alto nivel de humedad (sin que existiera agua libre). Una vez preparado este sustrato se llenaron con él unos barriles a los cuales les incorporó un filtro de fibra de algodón (Huhnke y Sengbusch 1968). Estos barriles fueron esterilizados dentro de autoclaves, y posteriormente inoculados con micelio de champiñón en un cuarto estéril. Posteriormente se les dejó incubar en cuartos a temperatura ambiente, sin requerirse equipos suplementarios de enfriamiento, y al final de éste período de incubación se retiró el filtro de fibra de algodón y se colocó un material de cobertura a base de turba –no estéril- que previamente había sido ajustado a pH neutro. Estos recipientes fueron colocados en condiciones asépticas para la incubación de la cobertura y posteriormente para inducir la fructificación, el desarrollo de “primordios” y la cosecha. Los resultados de la cosecha fueron sorprendentes: productividad (rendimiento) totalmente equivalente al obtenido bajo condiciones comerciales normales (obtenido por composteo y pasteurización de los componentes para después “sembrarlos” (inocularlos) con micelio en cuartos limpios -más no estériles- e incubando el compost y la cobertura bajo las condiciones típicas comerciales, que incluyen las etapas posteriores de: inducción, desarrollo de primordios, y cosecha). La única peculiaridad era que el período de incubación había sido inusitadamente prolongado. ¿Qué explicaba estos resultados? La nutrición Era evidente que el proceso de composteo no era un requisito desde el punto de vista de asimilación de los nutrientes para los champiñones, debido seguramente a la acción enzimática de estos; entonces: ¿para qué compostear? Presión de contagio e inoculación El único organismo inoculado en los barriles fue el micelio de champiñón, el cual pudo desarrollarse sin ninguna presión de infección de ningún otro organismo que pudiera ser patógeno, competidor o auxiliar en alguna etapa. Lo anterior indica que el champiñón realmente no presenta una limitación en su capacidad enzimática para la asimilación de todos los nutrientes que están presentes antes del proceso de composteo en las materias primas utilizadas para la formulación del sustrato y que, entonces, con el proceso de composteo se busca una transformación de estos nutrientes para favorecer el desarrollo del micelio del champiñón frente al de otros organismos, ya sea competidores o patógenos. Así, mediante el composteo se eliminan los carbohidratos de fácil degradación como: azúcares, almidones y parte de la celulosa que alimentarían también a los competidores y patógenos. Dado que estos competidores y patógenos no cuentan con las enzimas para la asimilación de carbohidratos de más difícil degradación tales como la hemicelulosa ni la matriz polifenólica de la lignina, al permanecer estos compuestos después del composteo, servirán 76 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus como nutrientes selectivos para el champiñón, el cual sí dispone del equipo enzimático necesario para su asimilación. De las otras peculiaridades observadas por el Dr. Till, el período de incubación inusitadamente prolongado que se observaba en los sustratos esterilizados dio lugar a experimentos posteriores donde se comprobó que en el proceso normal de composteo y pasteurización quedan remanentes de organismos auxiliares como los hongos termófílos de los géneros Scytalidium y Humícola y del actinomiceto Streptomyces thermovulgaris, en cuya presencia el micelio de champiñón puede duplicar su velocidad de colonización. La otra peculiaridad observada fue que al incubar los sustratos estériles no se observó el incremento acostumbrado de temperatura, con lo que se elimino la necesidad de equipo suplementario de enfriamiento: Las temperaturas dentro de los barriles en la etapa de incubación subían a niveles de 26.5–27°C. y sin requerir equipo alguno para retirar calor volvían a bajar a niveles de 25–25.5°C. ¿Qué explicaba esto? Simplemente: ningún organismo comete hara-kiri -el micelio de champiñón acelera su crecimiento y genera calor hasta alcanzar temperaturas que empiezan a dañar su desarrollo. Entonces desacelera su crecimiento para generar menos calor y bajar a temperaturas más favorables para su crecimiento y desarrollo: pero nos estamos adelantando al siguiente tema: Factores del entorno que lo favorecen o perjudican Las temperaturas mencionadas en el punto anterior, observadas en el experimento del Dr. Till, indican, además de lo ya anotado, que el micelio no se suicida y que al cultivar bajo condiciones comerciales normales, donde sí se compostea y se pasteuriza, las temperaturas por encima de los 27°C son generadas por otros organismos presentes en el compost (ya sean auxiliares, competidores o patógenos), para los cuales estas temperaturas más altas les son favorables; por ello, en cultivo bajo condiciones normales, debe ponerse todo el esfuerzo y la atención para mantener el rango de temperaturas en el óptimo para el champiñón: 25–26.5°C, alejándose lo más pronto posible de temperaturas superiores a 29°C, en donde empiezan incluso a darse daños genéticos que afectarán la capacidad de fructificación del champiñón. Esta situación se presentará en cultivos donde se toleren períodos prolongados con estos rangos muy altos de temperatura. Los otros factores del entorno que deben mantenerse en condiciones óptimas para el champiñón, son: Humedad, tanto en el ambiente (humedad relativa), como del agua en el compost y en la cobertura. Acidez o alcalinidad, relacionado con el pH CO2/ventilación en las diferentes etapas del cultivo. Todos estos factores favorecen o perjudican, tanto a los champiñones como a los otros organismos (auxiliares, competidores y patógenos), por lo que habrá que analizar qué efectos se tienen en cada caso. Dejando atrás lo aprendido por el Dr. Till, volvamos a nuestro enfoque del tripié para aclarar más, desde el punto de vista tecnológico, los requerimientos más importantes para favorecer el cultivo del champiñón. NUTRICIÓN Dijimos que la necesidad de compostear el sustrato era para favorecer el desarrollo del micelio del champiñón frente a la competencia de otros organismos, tanto competidores como patógenos, en donde se consumirán mediante el proceso bioquímico de composteo, los carbohidratos de fácil 77 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus degradación, esencialmente azúcares, almidones y algunos otros polisacáridos sencillos, que alimentarían también a los competidores y patógenos, sabiendo que estos competidores y patógenos no cuentan con las enzimas para la asimilación de compuestos de más difícil degradación tales como la hemicelulosa, la lignina y el humus que permanecerán después del composteo, y que estos si podrán ser asimiladas con las enzimas producidas por el champiñón. Lo que se hace con el proceso de composteo, el cual es completado con la llamada “fase 2” (que incluye la pasteurización), es formular y preparar un sustrato selectivo solo para la nutrición del champiñón. También dijimos que “la experiencia de muchos años cultivando champiñones en todo el mundo indica cuáles pueden ser los nutrientes idóneos para los champiñones”. Esta experiencia apunta a poder obtener un sustrato que provea un complejo de compuestos con lignina y humus rico en nitrógeno, y que a la siembra presente una relación carbono/nitrógeno C/N = 14 – 16. Para poder lograr este balance entre carbono y nitrógeno -es decir: entre carbohidratos y proteínasse necesita, según cómo se lleve a cabo el proceso de composteo (“a la antigüita”: en patio abierto con trascabos y revolvedoras, o bien: con máquinas más sofisticadas -que consiguen mucho mayor uniformidad- y con “búnkers” y túneles, que permiten un control mucho más preciso del proceso), formular el sustrato por compostear con una relación carbono/nitrógeno en la mezcla inicial de componentes C/N = 30-40; y llegar al llenado para la fase 2 de pasteurización con una relación C/N = 20-25 (consiguiendo con ello a la siembra la relación ya mencionada C/N = 14–16). Además del balance antes indicado, se necesita en el proceso de composteo convertir todo el nitrógeno amoniacal presente en la formulación inicial, en las proteínas (compuestos donde se enlazan en grandes cadenas: C, H, O y N, con cantidades menores de: S, P, K, Mg y “trazas de otros elementos”) -biomasa microbiana- que sí podrá asimilar con su acción enzimática específica el champiñón (ya que el amoniaco -gas normalmente, NH3 - resulta serle sumamente tóxico; y los derivados de éste: -compuestos amoniacales NH4 - no podrán ser asimilados con la acción enzimática del champiñón, y aún peor, en un entorno alcalino (pH alto), los compuestos de NH4 reaccionarán químicamente con facilidad, liberando el ya mencionado gas tóxico: NH3. Esta noconversión o conversión-inversa se produce en entornos anaerobios (con niveles de oxígeno muy bajos) que deben ser evitados en el proceso de composteo, ... pero nos estamos adelantando a la tercer “pata” de nuestro “tripié”.... PRESIÓN DE CONTAGIO E INOCULACIÓN (MEDIANTE EL MANEJO DEL ENTORNO) / (LOS “BUENOS” Y LOS “MALOS”) Durante la etapa final del proceso de composteo (fase 2), además de terminar de convertir el nitrógeno amoniacal en proteinas, mediante dos períodos de esta fase: uno al inicio y otro al final: de “pre-acondicionamiento” y de “acondicionamiento final” en los que se incuba en condiciones óptimas del entorno los organismos termofílicos que harán esta conversión amoniacal a biomasa, se intercala entre estos dos períodos, otro período de “Pasteurización” con el que se busca eliminar prácticamente a todos los organismos “patógenos”, así como a otros que competirían con el micelio de champiñón en la asimilación de los nutrientes preparados. Para nuestra fortuna esto puede lograrse con gran efectividad mediante un proceso térmico, ya que los organismos competidores y patógenos son “mesofílicos”, mientras que los que harán la conversión -entre los que se encuentran los hongos termofílicos de los género Scytalidium y Humícola, y también el actinomiceto Streptomyces thermovulgaris, los auxiliares anteriormente mencionados- son “termofílicos”. Así vemos que con la pasteurización en la fase 2, con tiempos a temperaturas altas, pero no demasiado altas, “matamos a los malos” eliminando su presión de contagio, y “conservamos a los buenos” para que al incubarlos en la etapa final de la fase 2 termine el “acondicionamiento” con el que se completa la conversión de nitrógeno amoniacal a proteína. No daremos el detalle en el que se 78 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus receten las variantes usadas en la práctica de tiempos y temperaturas con los que típicamente se consiguen los objetivos de la fase 2, más importante es entender los objetivos y conceptos manejados. También es importante subrayar que al haber solamente pasteurizado (no esterilizado), y con el manejo posterior a la fase 2, en donde se inocula la composta con “semilla” que lleva el micelio de champiñón, bajo condiciones asépticas comerciales (no en un cuarto estéril), y sus siguientes etapas de incubación, cobertura, inducción, desarrollo de primordios y cosecha, también bajo condiciones comerciales no-estériles, la limpieza y asepsia con la que se manejen jugarán un papel fundamental para evitar contagios de organismos patógenos (y competidores) que mermarían los resultados que se puedan obtener. FACTORES DEL ENTORNO QUE LO FAVORECEN O PERJUDICAN Mencionábamos que en el proceso de composteo es necesario evitar condiciones anaerobias; en la conversión del nitrógeno amoniacal a proteínas, en condiciones muy bajas de oxígeno, daremos oportunidad a organismos anaerobios a desarrollarse y empezar a prevalecer en el sustrato (o partes de él), y estos organismos anaerobios produciran enzimas con la capacidad de romper las cadenas de compuestos protéicos ya convertidos, utilizando los átomos de oxígeno de estas cadenas, y romperan las cadenas dejando libres átomos de nitrógeno e hidrógeno para reaccionar entre si revirtiéndose a compuestos amoniacales. Por ello, en la práctica es importante conservar concentraciones de oxígeno superiores a 8% en las primeras fases de composteo, y superiores a 12% durante la fase 2. Hay múltiples valores del entorno que hay que buscar y otros que hay que evitar, para las etapas posteriores del cultivo del champiñón, algunas de las cuales se han esbozado al hablar del experimento del Dr. Till y que quedan para análisis y reflexiones posteriores a este estudio; y, como se mencionó en el párrafo introductorio, que además se pueden considerar como estrategias para combatir infecciones en las cuales hubiera aumentado su riesgo de contagio en casos específicos (por ejemplo, se detalla en otro estudio paralelo cómo combatir efectivamente una infección del hongo patógeno del champiñón, Mycogone perniciosa, “Bola húmeda”). REFERENCIAS Huhnke W, Sengbusch RV (1968) Champignonanbau auf nicht kompostiertem Nahrsubstrat. Mush. Sci. 7:405-419 Till O (1962) Champignonkultur auf sterilisiertem naehrsubstrat und die wiederverwendung von abgetragenem compost. Mush. Sci. 5:127-133. 79 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus VIII. MANEJO INTEGRADO DE PLAGAS DEL CHAMPIÑÓN Danny Lee Rinker, Mushrooms, University of Guelph, Department of Plant Agriculture, 4890 Victoria Avenue, P.O. Box 7000, Vineland, ON L0R 2E0 Canada, <[email protected]> RESUMEN Los hongos comestibles son cultivados en una ambiente protegido, lo cual representa un sistema ideal para el manejo integrado de insectos y enfermedades. Los principios básicos del manejo integrado de plagas incluyen el desarrollo de información de apoyo a través del monitoreo y la integración de múltiples enfoques de control físico, prácticas culturales, cambios tecnológicos y manejo de químicos. El control físico incluye tapar cualquier grieta o minimizar las aberturas, filtrar el aire o usar barreras pegajosas. La limpieza de herramientas, equipos e instalaciones y la remoción de sitios de apareamiento de insectos (sanidad e higiene) son esenciales. Los movimientos del personal deben ser planeados, así como la provisión de áreas separadas para baños y para comer para ciertos grupos de trabajadores. Una vez que una enfermedad es identificada, puede ser físicamente retenida si se le cubre con una capa gruesa de cal o sal. Las prácticas hortícolas incluyen la reducción del ciclo a través del manejo del ambiente, los cambios tecnológicos y de sistema, la elección de materiales y la terminación anticipadamente deliberada de la cosechas. El manejo químico está muy ligado al monitoreo. Los productos químicos, biológicos y bioracionales deben ser usados con el consecuente conocimiento de la plaga, y del modo de acción del producto, junto con métodos físicos y hortícolas. Por ejemplo, sin monitorear las poblaciones de insectos invasores y sin programar las aplicaciones de acuerdo al estado larval, el control con metopreno o con Bt es mínimo. Un enfoque integrado permite a los cultivadores de hongos minimizar o eliminar pesticidas. El control integrado es un buen negocio, más sano para el cultivador, y más saludable para el consumidor. Palabras clave: plagas y enfermedades, control de plagas, Agaricus bisporus, insectos, hongos contaminantes. INTRODUCCIÓN Los hongos son generalmente cultivados en un ambiente protegido; es decir, en un sistema ideal para el manejo integrado de insectos, plagas y otros organismos no deseados. El enfoque integrado utiliza varias estrategias para minimizar el impacto de las plagas en el cultivo, mientras se maximiza el beneficio. Es un enfoque multifacético para controlar los problemas de plagas, igualmente aplicable en el cultivo de cualquier especie de hongo; así mismo, no está restringido a un cultivo, a un país, o a un sistema de cultivo en particular. Este capítulo hará 1) una revisión de la producción canadiense de champiñones (Agaricus bisporus) y sus sistemas, 2) una discusión de los insectos y enfermedades asociadas con la producción comercial y 3) una aproximación integral del manejo de plagas y enfermedades. PRODUCCIÓN CANADIENSE DE HONGOS El champiñón A. bisporus es producido en Canadá desde inicios de 1900. Actualmente es cultivado en la mayoría de sus provincias. En 2005, una estadística preliminar indicó que Canadá produjo ese año 81,136.3 toneladas de hongos con un valor en planta de 271.7 millones de dólares 81 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus norteamericanos1. Cerca de 92% de esos hongos fueron vendidos en fresco a un precio promedio de US$ 3.80 /kg), alrededor del 15% fueron variedades oscuras (Portobello y Crimini) y solamente 1% fueron hongos exóticos como setas, shiitake o enoki. Ontario produjo 54% de los hongos de Canadá, seguido de Columbia Británica con 32% y las provincias de la Pradera con 10%. Hay menos de 100 plantas de cultivo de hongos comestibles en Canadá. En Ontario hay alrededor de 30 lugares de producción, cuyos dueños son una docena de corporaciones. La tendencia es hacia la existencia de plantas más grandes e instalaciones centralizadas de composteo. Los sistemas de producción varían en el país y serán ilustrados con los ejemplos de Ontario y Columbia Británica. En Ontario, la mayor parte de la composta es preparada en contenedores (búnkers) y toda la composta es pasteurizada y acondicionada a granel, en cámaras (túneles o búnkers). La mayoría de la composta es incubada a granel (túneles o búnkers). Existen en esta provincia los sistemas de charolas y de anaqueles; sin embargo, la mayoría de la producción es en anaqueles. Toda la composta es transferida mecánicamente hacia la red de producción ya sea en anaqueles o en charolas. Los anaqueles son generalmente de metal, no de madera; mientras que las charolas son de madera. Los hongos son producidos en instalaciones que trabajan todo el año con clima controlado. Las compañías más grandes tienen sus propias instalaciones para composteo, mientras que otras “pequeñas” compran composta colonizada a otras empresas cuyo único propósito es producir composta completamente colonizada para sus clientes. La tierra de cobertura es mecánicamente distribuida sobre la composta. El ciclo de producción en los cuartos de crecimiento en Ontario varía entre 4 y 8 semanas. La tendencia es cosechar dos cortes y luego reemplazar la composta. Columbia Británica, en contraste, pasteuriza y acondiciona la mayoría de su composta en anaqueles tradicionales, aunque la tendencia está moviéndose rápidamente hacia los sistemas de Ontario. La mayoría de esta composta es preparada de manera centralizada en sistemas de contenedores y transportada a las plantas de cultivo para ser pasteurizada y acondicionada en los anaqueles para crecimiento, en donde permanece el resto del proceso, hasta que es removida, al final del cultivo. La cobertura puede ser aplicada mecánica o manualmente. En esta provincia el sustrato permanece en los cuartos de crecimiento por 10-12 semanas. Desde una perspectiva de insectos y enfermedades, Ontario está relativamente libre de insectos y enfermedades, con solo apariciones aisladas. Varias de las plantas más grandes de Ontario son orgánicas. Sin embargo, en Columbia Británica, el hongo verde Trichoderma, la telaraña y la mole seca son problemas serios, y las moscas son parte del problema presentado por las enfermedades. La siguiente discusión sobre insectos y enfermedades, y su manejo integrado, documenta cómo un enfoque integrado puede significar la reducción de la incidencia de insectos y enfermedades y su severidad en las plantas comerciales de champiñón. INSECTOS Y ENFERMEDADES EN LA PRODUCCIÓN DE CHAMPIÑÓN Insectos Tres familias de insectos causan problemas en el champiñón: esciáridos, fóridos y cecidómidos. Las especies que se discuten a continuación están presentes en los cultivos de Canadá y de Estados Unidos. 1 1 dólar estadounidense = 11.15 pesos mexicanos 82 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Mosquito esciárido (mosquito del hongo de alas oscuras Lycoriella mali) Las larvas maduras de este esciárido tienen alrededor de 7 mm de largo y son de cuerpo translúcido blanco y cabeza blanca capsulada. Los adultos miden 5 mm de largo y tienen unas venas cruzadas y en zigzag en las alas que le hacen distintivas. Este mosquito generalmente invade el cultivo de hongos alrededor del momento de la siembra y empieza a poner huevos en el primer sitio posible. Las larvas eclosionan cuatro días más tarde. Los cuatro estadios larvales duran alrededor de 14 días y durante ese tiempo ellos pueden alimentarse de los granos de semilla, de la composta, del micelio y de los hongos. Después, las larvas dejan de comer y entran en el estado de pupa. Los mosquitos adultos emergen en siete días. Según el ciclo completo de cultivo, pueden darse dos o más generaciones completas antes de que la composta sea removida. Las larvas de esciáridos pueden consumir el contenido total de primordios en desarrollo, los cuales aparecen brillantes y ligeramente cafés, el sombrerito puede estar completamente perforado y cuando se cosechan, el tejido se desmorona. Los hongos que tienen mayor tamaño cuando son atacados muestran áreas negras necróticas en el tallo, donde la larva ha hecho galerías. Algunas larvas no perforan el estípite, pero consumen el micelio en la base de éste, en cuyo caso el hongo no se desarrolla normalmente. Si existen enfermedades, ácaros o nemátodos en el cultivo, los mosquitos adultos los transportan de un lado a otro. Mosquitos fóridos (Megaselia halterata) Seis especies de fóridos han sido reportados en la industria americana de los hongos comestibles, pero solo tres (M. nigra, M. agarici y M. halterata) en cantidades suficientes para causar “daño económico”. La especie dominante en la industria americana es M. halterata la que es discutida aquí. De manera interesante, los fóridos no han sido una plaga en la producción de hongos en Canadá y solo han sido observados en dos ocasiones por mi, en Ontario. Las larvas de fóridos son blancas sin una cabeza capsular aparente y de alrededor de 4 mm de largo. Los adultos de ambos sexos son pequeños, miden 2 ó 3 mm, no tienen venas en zigzag y cruzadas en las alas y son reconocidos fácilmente por su apariencia jorobada y sus movimientos rápidos y espasmódicos. Las hembras adultas son atraídas por el micelio en crecimiento activo, después de la siembra y de la aplicación de la tierra de cobertura y ponen sus huevos cerca de las puntas de las hifas. La composta sin sembrar no mantiene la reproducción. El tiempo promedio desde las etapas de huevo a adulto a 16°C y 24°C es de 51 y 37 días respectivamente, y los adultos sobreviven de 4 a 8 días. Los mosquitos fóridos son fácilmente atraídos por la luz y su actividad en intemperie está generalmente restringida a las horas diurnas. Las larvas de fóridos se alimentan de las puntas de micelio en crecimiento. Esta especie no perfora los hongos. Aunque puede haber pérdidas directas de rendimiento, la mayor amenaza resulta por la transmisión de enfermedades (observe que tanto las larvas de M. nigra como M. agarici han sido reportadas por dañar no solo el micelio sino también los hongos). Si hay presencia de enfermedades, ácaros o nemátodos en los cultivos, los mosquitos fóridos pueden acarrearlos de un área a otra. Las estrategias de manejo integrado de plagas para controlar esciáridos son efectivas para controlar fóridos. 83 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Cécidos (Cecidómidos ó mosquitas agalladoras Mycophila spp) Los cécidos son mosquitos pequeños raramente vistos en estado adulto, de alrededor de 1.5 mm de largo. Sin embargo, cuando las poblaciones son altas, sus larvas son fácilmente observables porque ellas salen de los anaqueles y se acumulan en montones en el piso. Las larvas son blancas o anaranjadas, según la especie. Las larvas maduras tienen alrededor de 2 mm de largo. Estas larvas se reproducen sin pasar por el estado adulto. Una larva madura puede dar nacimiento a 12-20 larvas hijas en cerca de siete días sin convertirse en adulto y aparearse. Las larvas se alimentan sobre el exterior del estípite o en la juntura del estípite con las láminas de los champiñones, así como de las setas. Su presencia puede resultar en una pérdida de volumen de producto fresco o procesado. Ellas acarrean consigo bacterias que inducen oscurecimiento. Los cécidos están asociados con material de cobertura infestado, especialmente turba, y se dispersan sobre superficies en crecimiento que no están adecuadamente limpias, especialmente sobre herramientas, equipos, zapatos y ropa de trabajadores. Cualquier práctica que minimice la dispersión de moscas y mosquitos contribuye al control de cécidos. Enfermedades Las enfermedades se dividen en cuatro grupos, según su agente causal: bacterias, hongos, virus y nemátodos. Enfermedades bacterianas Enfermedad de las momias. El patógeno es un pseudomonadal fluorescente, próximo a Pseudomonas tolaasii. Además del reporte original de la causa (Schisler et al. 1968), nadie ha satisfecho los postulados de Koch con ningún aislamiento obtenido de champiñones sintomáticos. Los síntomas de la enfermedad son distintivos y confiables para el diagnóstico. No hay un efecto conocido durante los períodos de incubación -después de la siembra, o de la aplicación de la cobertura- pero una vez que la fructificación ha iniciado los síntomas aparecen. El primer síntoma puede ser una cosecha retrasada. Los hongos infectados se caracterizan por tener tallos curvos, frecuentemente con sombreros distorsionados e inclinados. En la base del estípite el micelio es hilachoso. La base del estípite se ve frecuentemente hinchada, con un crecimiento inflado del micelio que le rodea. Cuando se cosecha, una gran cantidad de tierra de cobertura se adhiere a la base del estípite. Los hongos infectados mueren y se secan. Los hongos son duros y cuerudos. Los cosechadores pueden generalmente detectar la enfermedad al sentir el estípite al momento del corte. El tejido interno muestra frecuentemente rayas cafés o puede ser descolorido. Cuando se corta a través del estípite puede haber manchas cafés visibles momentáneamente o la cara del corte puede ser café rojiza. La enfermedad se distribuye de manera intracelular por el micelio infectado, no por esporas como en el caso de los virus. En un sistema con anaqueles, la tasa de distribución es muy rápida, 10-30 cm del largo de anaquel por día. De igual manera en cualquier sistema, cuando el cultivo se ve afectado no producirá hongos cosechables. La enfermedad ha sido implicada en cultivos en los que la composta había quedado excepcionalmente húmeda después de la pasteurización, cuando se aplicó cobertura sobre la superficie de una composta que había acumulado agua durante la incubación, o cuando la cobertura no había secado gradualmente. Mancha bacteriana. La mancha café (Pseudomonas tolaasii) es la enfermedad bacteriana más común en los cultivos comerciales de champiñón. Causa considerables pérdidas económicas a través de la reducción de la calidad del producto cada año. 84 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus El síntoma más común es la ocurrencia de áreas amarillo pálidas o manchas que después viran a amarillo oro, amarillo oscuro o café chocolate sobre el sombrero del hongo o el tallo. Ocasionalmente, el sombrero del champiñón tiene un aspecto general sucio con un rápido deterioro y descoloramiento después de la cosecha. Se debe tener cuidado de no confundir este patógeno con las enfermedades de Verticillium, o el manchado producido por especies de Trichoderma o de la telaraña. Este patógeno es un habitante natural de la turba y de la cal agrícola utilizadas para preparar la cobertura. La bacteria puede ser muy fácilmente transportada de un cultivo a otro por medio de las manos de los cosechadores o el material y el equipo utilizado para cosechar, por insectos y ácaros, por gotas de agua y aún por esporas de hongos. Una vez que la enfermedad se ha establecido el riego dispersará muy fácilmente el patógeno. Generalmente la incidencia de la enfermedad es más alta en el primer corte. A medida que el cultivo madura se dan pocos hongos, lo cual facilita que el aire circule mejor entre ellos, y que haya un mejor secado después del riego y consecuentemente menos síntomas. Enfermedades fúngicas y mohos concurrentes Eicker y van Greuning (1991) enumeraron al menos 45 especies de hongos asociados con la producción comercial de hongos comestibles. Estos hongos están divididos en dos grupos: Los que atacan al hongo directamente y los que compiten por nutrientes o son antagonistas para él. Los primeros son considerados como enfermedades y los últimos como plagas o mohos indicadores. Las principales enfermedades fúngicas infecciosas que afectan la producción canadiense de hongos incluyen la telaraña, la mole seca, los mohos verdes Trichoderma, la Trichoderma de la cobertura y la mole húmeda. La telaraña, mildiú suave. La enfermedad de la telaraña (Cladobotryum dendroides, C. mycophilum y C. varium) ocurre solamente en el material de cobertura y puede aparecer en cualquier etapa, desde primordios en adelante. Unas manchas circulares de micelio blanco atacan al champiñón y los cubren con un burdo crecimiento blanco. Los hongos afectados se vuelven cafés y se pudren. El micelio de la telaraña se vuelve rosado o rojo a medida que envejece y los hongos pueden ser encontrados desde color piel hasta café-amarillentos (como manchados). En general la telaraña ocurre de manera poco frecuente; sin embargo puede ocasionalmente dispersarse y ser muy destructiva en cultivos individuales. El patógeno es un habitante del suelo y puede ser introducido en la cobertura por medio del suelo, en esporas o micelio. Si la cobertura está contaminada con esporas, los síntomas no se desarrollarán sino hasta el cuarto o quinto corte. Sin embargo, cuando la cobertura está contaminada con micelio, los síntomas pueden ocurrir en el primer corte. La humedad mayor a 90%, temperaturas de aire mayores a 18°C y la condensación de agua estimula el crecimiento de la telaraña. El patógeno es dispersado vía aérea por sus esporas, así como por los trabajadores o material de cobertura infectado. Los hongos silvestres pueden servir como hospederos y recipientes del patógeno. Una pasteurización inadecuada del material al término del cultivo puede servir como medio para el crecimiento y la reproducción del patógeno. La mole seca, estípite partido, Verticillium, mancha de Verticillium. La enfermedad Verticillium (Verticillum fungicola, sin. Verticillium malthousei) continúa siendo la enfermedad comercial más importante de los champiñones en Canadá. Permanece invencible, persistente, ha amenazado la industria por décadas. 85 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus La infección temprana de los primordios perturba su crecimiento causándoles que formen una masa voluminosa (mole seca) de 0.5-1.0 mm de diámetro. La infección del tallo en hongos más desarrollados (estado de botón) causa que el estípite se dañe (también conocido como estípite partido) y el sombrero puede llegar a inclinarse ligeramente. Si el patógeno infecta el tejido del sombrero, el área se vuelve café y el tejido enfermo puede tener un matiz grisáceo (conocido como mancha Verticillium). Las lesiones son menos brillantes que las causadas por la mancha bacteriana. Estas zonas de color café eventualmente producen una abundante dispersión blanco grisácea de esporas de Verticillium. La temperatura óptima para el desarrollo de la enfermedad es de cerca de 20°C. A esta temperatura, los síntomas de mole seca y estípite partido se desarrollan en 10-14 días a partir de la infección. Por lo tanto, si hay presentes moles en el primer corte, el patógeno probablemente fue introducido con el material de cobertura o en algún momento durante el inicio de la formación de primordios. Las manchas de Verticillium se desarrollan dentro de las primeras 24 horas de la inoculación. El material de cobertura contaminado, los insectos y el polvo son probablemente las fuentes más comunes de infección. La contaminación puede ocurrir por el aire, a través de esporas, o por esporas acarreadas por insectos, ácaros o trabajadores. Las esporas de Verticillium son producidas en paquetes pegajosos que les permiten adherirse al polvo, moscas, ácaros, desechos, ropa, herramientas y trabajadores de la planta. Las esporas pegajosas no pueden ser removidas fácilmente al lavarse las manos con agua caliente jabonosa. La distribución por medio de las manos y la ropa de los trabajadores de la planta puede ser la forma más significativa de transporte del patógeno dentro de un cultivo o entre cultivos. El riego puede distribuir las esporas a través del salpique y el escurrimiento hacia estantes inferiores y el piso. Los insectos, especialmente los mosquitos fóridos, así como los ácaros (Tyrophagus spp.) que se alimentan de esporas de Verticillium pueden fácilmente transportar el patógeno dentro o entre las naves de cultivo. El disturbio de polvo contaminado sobre el piso incrementa la concentración de esporas en el aire y puede ser la causa primaria de epidemias. Moho verde Trichoderma, enfermedad del moho verde, moho verde agresivo, Th4. Los mohos verdes son agrupados frecuentemente con los mohos no infecciosos como indicadores de la calidad de la composta. Sin embargo, algunas especies, especialmente T. aggressivum f. aggressivum [anteriormente T. harzianum, biotipo Th4 en Norte América (Castle et al. 1998; Samuels et al., 2002)] pueden reducir significativamente la producción y la calidad de los cultivos. En Europa, un patógeno similar T. aggressivum f. europeum [anteriormente T. harzianum (biotipo Th2)] causa una destrucción similar. El moho verde Trichoderma ha sido el responsable de más pérdidas económicas que cualquier otra enfermedad de hongos comestibles en Canadá. Este contaminante es una amenaza latente en Ontario, y continúa siendo muy destructivo en Columbia Británica. La enfermedad afecta la producción del champiñón al colonizar el sustrato dejándolo totalmente improductivo. Las esporas del hongo manchan el tejido del hongo haciéndolo invendible. El crecimiento micelial blanco y lanoso se convierte en verde oscuro a medida que las esporas son producidas. La esporulación puede ser observada a siete días de la infección tanto adentro como sobre la composta, antes de aplicar la cobertura, y en el material de cobertura. La identificación positiva al inicio del crecimiento micelial o la esporulación requiere de técnicas moleculares, o un taxónomo altamente entrenado. Un área oscura no productiva con un margen externo de esporulación verde oscura con, tal vez, un crecimiento lanoso blanco en avance del verde probablemente sea la especie agresiva de Trichoderma. Algunas veces algunos carpóforos, que se infectarán más tarde, salen del centro de la infección. Los síntomas en los hongos pueden parecerse a los de la telaraña. Unos ácaros de color rojo son buenos indicadores del crecimiento de cualquier moho verde creciendo en la composta. Ellos se alimentan de las esporas y del micelio de 86 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Trichoderma y pueden alcanzar grandes poblaciones en un cultivo infectado. Cuando los champiñones están fructificando, estos ácaros rojos se agregan en la superficie del sombrero. Los cultivos de champiñones pueden ser infectados en cualquier etapa del proceso, pero la siembra es la más vulnerable de todas. El uso de suplementos protéicos en la siembra o al aplicar la cobertura pueden estimular y mantener el crecimiento de Trichoderma. Las especies de Trichoderma son fácilmente encontradas en el suelo y sobre materia orgánica. Las esporas son pegajosas y pueden ser fácilmente dispersadas por el polvo en corrientes de aire, agua, insectos, ácaros, humanos y medios mecánicos. Moho verde de la cobertura T. viride, T. koningii, T. atroviride y Trichoderma spp. Estos mohos conforman un grupo diverso y son similares en apariencia al moho verde agresivo pero carecen de su carácter destructivo. El crecimiento miceliar blanco se vuelve verde a medida que las esporas son producidas. La esporulación puede ser observada en la composta antes de aplicar la cobertura así como en la cobertura misma. T. koningii tiende a esporular tarde en el cultivo, hacia el tercer corte; mientras que T. viridae esporula en cualquier momento durante el cultivo. Cualquiera de las especies de Trichoderma manchará el sombrero de los hongos con los síntomas que semejan Verticillium, la telaraña o la mancha bacteriana y reducirá su calidad. Los síntomas pueden no ser visibles durante la cosecha y pueden desarrollarse durante el almacenamiento. Las especies de Trichoderma son fácilmente encontradas en el suelo, en la composta y la cobertura. Algunos materiales usados para la cobertura pueden tener mayor abundancia que otros. Las esporas, producidas en cadenas de conidias son fácilmente dispersadas en el agua, polvo, moscas, personal y especialmente ácaros. Los ácaros rojos (Pygmephorus spp.), también, se alimentan de estas especies. La temperatura óptima de crecimiento varía entre 22o-26oC. La esporulación puede ser observada a los 10 días de la contaminación. Trichoderma crece particularmente bien a un pH por debajo de 6, cuando el valor de nitrógeno es bajo. Las compostas con una relación C/N mayor que 16:1 al momento de la siembra típicamente favorecen al patógeno. Las compostas normales al momento de la siembra tienen una relación de 15:1 o menos. Mole húmeda. Aunque esta enfermedad ha sido históricamente un serio problema en la producción comercial de champiñones, no es un problema común en Estados Unidos o Canadá. La enfermedad de la mole húmeda (Mycogone perniciosa) es mejor reconocida por la gran distorsión en forma de coliflor que ocasiona en el champiñón. Esta masa en forma de coral puede medir hasta más de 10 cm de ancho. En condiciones de alta humedad, se forman gotas ámbar o café oscuro sobre la superficie blanca y lanosa. La otra enfermedad referida de la mole seca causada por Verticillium fungicola, no alcanza las dimensiones que obtiene la mole húmeda y no se vuelve oscura. Bajo condiciones de resequedad la mole húmeda también se seca y puede parecerse mucho a la mole seca. El material de cobertura contaminado es la primera fuente del patógeno, el cual parece estar comúnmente en el suelo. Si un champiñón joven es infectado, le tomará de 10 a 14 días adquirir su masa distintiva. La aparición de la enfermedad en la primera cosecha puede ser indicio de contaminación al aplicar la tierra de cobertura. Las esporas pueden sobrevivir en las superficies estructurales de la unidad productiva y en los residuos de cosecha. Una vez establecida la enfermedad, los principales medios de dispersión se dan a través del salpique del agua y del 87 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus escurrimiento hacia las camas inferiores. Los insectos y los ácaros son presuntos transportadores de este patógeno y los cosechadores, las herramientas y los equipos pueden también dispersarlo. Las esporas son ligeras y pueden ser transportadas por el aire. Las esporas en el polvo sobre el suelo o en el suelo puede ser otra fuente de contaminación. Mohos concurrentes Los mohos concurrentes en la producción de champiñones son aquellos hongos que indican (mohos indicadores) un desbalance químico o de nutrición en el sustrato o de las condiciones físicas de la composta o del suelo de cobertura. Esto es en contraste con las enfermedades fúngicas infecciosas que atacan al champiñón. Se incluyen las siguientes descripciones porque estos hongos pueden ser observados frecuentemente y ser confundidos con los verdaderos patógenos. Pueden además, afectar significativamente la producción. Los hongos encontrados en la composta incluyen principalmente el coprino, los mohos verde- olivo y Penicillium. Coprino El micelio de Coprinus spp [Coprinus comatus, C. niveus] es fino, de gris a blanco y no fácilmente distinguible del crecimiento del micelio del champiñón. Los cuerpos fructíferos de las especies de Coprinus generalmente se desarrollan después de aplicar la cobertura y antes de la producción de carpóforos. Ocasionalmente son observados al final de la fase II de composteo. El cuerpo fructífero degenera rápidamente licuándose hasta quedar como una tinta negra. La presencia de unos cuantos coprinos no tiene efecto directo en la producción de champiñones; sin embargo, una mayor cantidad de ellos puede indicar que la composta no es selectiva para el crecimiento de A. bisporus y consecuentemente el rendimiento se verá afectado por causa de una composta "pobre". Mohos verde olivo. El micelio de los mohos verde olivo [Chaetomium globosum, C. olivaceum] en la composta es blanco grisáceo y fino. Si no se usa plástico o papel sobre la superficie de la composta después de sembrar, un crecimiento fino aéreo puede ser visible después de 10 días; tiene un distintivo olor a moho. A los 14 días después de la siembra aparecen, observables a simple vista sobre el sustrato, unos peritecios verde olivo. Este moho ocurre frecuentemente donde la composta es negra, lo que significa que no es colonizada por el micelio del champiñón. Las esporas del hongo verde olivo son muy comunes y pueden ser encontradas en el rastrojo, en el suelo, y en el sustrato degradado. Las ascosporas pueden ser transportadas por corrientes de aire, por la ropa y en materiales. Son tolerantes al calor y pueden sobrevivir 60°C durante 6 horas. El rendimiento en hongos puede verse afectado proporcionalmente con la cantidad de composta afectada, aunque diferentes cepas de champiñón responden de manera diferente al moho verde olivo. Moho Penicillium Penicillium nigricans es otro de los mohos verdes que pueden ocurrir en la composta y/o en el suelo de cobertura. Las colonias son usualmente verdes, pero pueden ser también azul-verde, blancas, amarillas o cafés. Las especies de este género son oportunistas. Ellas prefieren los carbohidratos simples pero pueden también crecer sobre celulosa, grasas y lignina. La composta puede ser infectada por esporas transportadas por el aire durante la siembra, y la colonización ocurre después. De vez en cuando, las esporas de Penicillium pueden contaminar el grano usado como sustrato para la semilla. Pero esto es considerado como una segunda fuente de contaminación. 88 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Existen algunos reportes de rendimientos devastadores ocurridos por la incidencia de P. chermesinum sobre composta de fases I y II a granel. Aparentemente el origen fue un rastrojo sucio. Otros mohos de la composta. Durante el composteo, muchos hongos y actinomicetos mesofílicos y termofílicos forman parte del proceso de conversión. Entre los actinomicetos se incluyen Streptomyces, Thermoactinomyces y Thermomonospora. Los hongos incluyen Humicola launginosa, H. stellata, H. griseus, H. insolens y Stibella thermophila, así como especies de Mucor, Thermoascus, Torula, Myriococcum, Malbranchea y Talaromyces. La presencia visible de estos microorganismos al momento de la siembra es una indicación positiva del proceso de composteo. Otros mohos que pueden ser observados tanto en la composta como en la cobertura incluyen los mohos “bigote negro”, “café canela”, “rojo carmín” y el de la “plasta”. Bigote negro. Este moho [Doratomyces microsporus] puede ser reconocido muy fácilmente por su cerdas portadoras de esporas negro-grisáceas (2 mm) sobre la superficie del rastrojo o la cobertura. La composta densamente infectada aparecerá negra o gris debido a la alta densidad de esporas. Cuando se les perturba, las esporas son liberadas semejando humo. Los mohos de los géneros Aspergillus, Penicillium y Chaetomium pueden también estar presentes. Se han reportado respuestas humanas de alergia a las esporas de algunos de estos hongos. Moho café-canela. El moho café [Oedocephalum glomerulosum] es gris argentoso al inicio, pero las esporas al madurar cambian su color a tinte oscuro leonado o café claro. El crecimiento sobre rastrojo puede ser disperso o denso. Crece despacio a través de la cobertura apareciendo al momento de la formación de primordios. Las esporas de este hongo se sienten arenosas, comparadas con la suavidad farinosa del moho de la plasta. Moho rojo-carmín. El moho carmín [Sporendonema purpurascens] aparece en la composta durante la incubación, después de la siembra o sobre la cobertura durante la producción. Este hongo blanco no es fácilmente distinguible del micelio del champiñón. Unas bolas blancas algodonosas que semejan primordios pueden desarrollarse sobre el rastrojo o la superficie de la cobertura. A medida que las esporas maduran, sin embargo, un color rosado-rojo cereza se desarrolla tanto en la cobertura como en la composta. El micelio vegetativo se vuelve café con la edad. En Holanda, donde varias infecciones con virus han ocurrido, este hongo también ha sido observado como un moho secundario. Su aparición durante la incubación puede resultar en rendimientos reducidos, mientras que su apariencia durante el período de cosecha no afecta. Mohos de la Plasta. Estos hongos están asociados con un número de especies que incluyen: Botryotrichum piluliferum, Papulaspora byssina, Scopulariopsis brevicaulis, S. fimicola y Trichothecium roseum. El moho blanco del yeso, S. fimicola, el moho más común de este tipo encontrado en la composta, puede aparecer en la superficie de ésta, cerca del final de la fase II del composteo como un parche irregular de crecimiento blanco filamentoso y aéreo. Después de la siembra, el crecimiento aéreo desaparece y este moho blanco toma un aspecto aplanado sobre la superficie de la composta, dando la apariencia de una plasta de yeso de París o harina. Este moho puede crecer a través de la cobertura. Otros hongos con una morfología similar que pueden ocurrir en la composta son: B. piluliferum y T. roseum. Existen diferencias de color a medida que estos hongos maduran. Scopulariopsis fimicola se mantiene blanco, mientras que B. piluliferum toma un tono bronceado y T. roseum desarrolla un tono rosa-rosado. 89 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Los mohos de la plasta café, P. byssina y S. brevicaulis, aparecen durante el período de incubación como parches de 15-40 cm de tamaño, parecidos al moho de la plasta blanca. Con la madurez, el centro de la colonia se vuelve café o café-naranja. Este hongo crece a través de la cobertura y desarrolla su característico centro café con margen blanco. Ambos hongos crecen bien en composta con pH de 8.0 o más. Moho café canela. Este moho [Chromelosporium fulvum] crece principalmente sobre la cobertura durante las primeras dos semanas. En ocasiones ha sido observado sobre la superficie de la composta durante la incubación. Es visto frecuentemente sobre la superficie estructural de anaqueles y charolas de madera. El hongo primero aparece como un micelio blanco aéreo. Las esporas son formadas en unos cuantos días, lo cual le cambia el color a un café oro o amarillo claro. El borde de micelio blanco, grueso y lanoso se mantiene. Se ha reportado que un crecimiento denso retarda la primera cosecha y puede causar una ligera reducción del rendimiento. El moho desaparece durante el primer corte y 10-14 días después el estado perfecto aparecerá como un apotecio en forma de copa o discos pequeños de color café oscuro. Enfermedades virosas LaFrance. Los síntomas de enfermedades virosas varían desde reducir el rendimiento hasta distorsionar los carpóforos. Durante el período de incubación, no hay una indicación visible de la enfermedad; sin embargo, una vez que la cobertura ha sido aplicada, diferentes síntomas se pueden expresar. El micelio puede tener dificultad para crecer en la cobertura en ciertas áreas, o crecerá y luego morirá dejando partes sin hongos. Los hongos que se forman pueden 1) ser normales 2) tener pequeños sombreros sobre tallos de tamaño normal, 3) tener tallos alargados que son ligeramente doblados, 4) morir rápidamente, seguidos de una pudrición bacteriana suave, 5) abrir prematuramente, 6) volverse blanco grisáceo, cenizo o de color bronceado, 7) formar primordios más tarde de lo normal y frecuentemente debajo de la superficie, 8) al cosecharse, volverse rápidamente de color café, y 9) estar flojamente adherido a la cobertura. En otros casos, la cosecha puede parecer completamente normal, con un único efecto de una caída inexplicable de la producción. La enfermedades virales son transmitidas a través de dos formas conocidas: 1) de micelio infectado a micelio no infectado a través de la fusión de hifas (anastomosis) y 2) A través de la germinación de esporas y el micelio resultante fusionarse con micelio sano. Las esporas del champiñón pueden ser fácilmente transportadas por el aire dentro del cuarto o en la planta. Una vez establecido en el cultivo, el virus puede dispersarse a través del micelio. Se ha reportado que tan solo unas 10-100 esporas infectadas con virus en aproximadamente 3 m2 de composta inducen síntomas reconocibles. Las esporas de hongos infectados en estado seco y almacenadas a temperatura ambiente son capaces de transferir los virus a micelio sano aún después de seis años. Virus-x, MVX o enfermedad del parche. El virus-x es una nueva enfermedad que fue primeramente observada en el Reino Unido en 1999. Hasta donde se sabe, no está presente en Estados Unidos ni Canadá. Los síntomas pueden ser similares al ocasionado por el virus de LaFrance, con zonas improductivas (parches), baja calidad de los hongos, retraso en las cosechas y ocasionalmente hongos cafés en donde debiera haber blancos. Los síntomas son independientes del nivel de inóculo y el cultivo es vulnerable en cualquier momento desde la siembra hasta la aplicación de cobertura. Nemátodos Algunos nemátodos parásitos y saprofitos han sido asociados con pérdidas comerciales de rendimiento; sin embargo, la ocurrencia de nemátodos parásitos en el cultivo de hongos es raro bajo las prácticas modernas de cultivo de champiñones. Los nemátodos saprofitos son comunes. 90 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Generalmente el impacto económico total sobre la producción nacional es mínimo; sin embargo, bajo poblaciones altas puede darse una reducción significativa. Nemátodos parásitos. Los nemátodos parásitos pertenecen a los géneros Ditylenchus y Aphelenchoides. Un muestreo extensivo de instalaciones comerciales en el Canadá no ha revelado la presencia de estos nemátodos. Hussey et al. (1969) elaboraron una buena discusión sobre este grupo. Nemátodos saprófitos. Los nemátodos saprofitos (Acrobeloides spp, Rhabditis spp, Choriorhabditis spp, Caenorhabditis spp) causan áreas necróticas negras sobre la superficie sembrada de la composta. El micelio se fragmenta y la composta se ve húmeda. Estas áreas no serán recolonizadas por el micelio del champiñón. La composta colonizada alrededor degenera y los nemátodos migran hacia la capa de cobertura. Con observaciones cuidadosas y una luz brillante aplicada sobre la superficie de la composta, los nemátodos pueden ser reconocidos al agitarse Frecuentemente la cobertura está bien colonizada por el micelio, pero después de agitar o rascar la superficie, el micelio no se reestablece bien en algunas partes o en todo el anaquel. Algunas veces la cobertura es inicialmente colonizada de manera muy lenta por el micelio. El micelio es fragmentado y la cobertura no se mantiene bien junta. Algunas veces los cultivadores confunden la enfermedad de la muerte regresiva (die back) con problemas de nemátodos. De la misma manera que en el caso de la composta, los nemátodos pueden ser observados sobre la superficie de la cobertura con una luz brillante. La tonalidad blanca de los champiñones puede ser negativamente afectada cuando se detecta la presencia de nemátodos. Algunas bacterias sobre las cuales se alimentan los nemátodos se reproducen bien en el ambiente húmedo creado por ellos. Estos y sus bacterias asociadas pueden disminuir la calidad de los hongos frescos. MANEJO DE INSECTOS Y ENFERMEDADES El enfoque de “manejo integrado de plagas” para controlar los insectos y las enfermedades del champiñón es una combinación de muchas herramientas para controlar plagas de una manera más segura, más efectiva y de largo plazo. Al hacer esto, los métodos utilizados minimizan el daño al ambiente, el riesgo para la salud humana y, así también, los costos asociados con la disminución del nivel de las plagas. Las estrategias para el control comprenden: 1) Desarrollo de información básica a través del monitoreo de las plagas, el mantenimiento de registros y el conocimiento de la biología de la plaga y 2) una integración de métodos físicos, hortícolas, tecnológicos, químicos, bioracionales y biológicos. Insectos del champiñón El principio del control de moscas es similar entre especies, aunque existen algunas diferencias en base a la biología de las mosquitas. Mosquitos esciáridos Estrategias de manejo. El movimiento de mosquitos esciáridos de un cuarto de producción a otro o de una planta a otra se cumple principalmente por la dispersión sin ayuda de los adultos y la persistencia de los insectos que se arrastrarán por cualquier ranura o fisura para pasar hacia las instalaciones productivas. Bajo condiciones de poca sanidad e higiene, los mosquitos pueden entrar a los cuartos sobre el equipo que no fue limpiado en los procedimientos previos de siembra o de aplicación de la cobertura. Consecuentemente, al dejar la semilla por la noche en un corredor 91 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus infestado, una infestación de mosquitos puede ser introducida a los cuartos de producción a través de la semilla. Los cultivadores que compran hongos de otros cultivadores corren el riesgo de introducir mosquitos, si otras plantas tienen problemas de este tipo. El mosquito de las alas oscuras es la mayor plaga insectil, por lo que algunas estrategias se han desarrollado, particularmente teniendo este insecto en mente. Monitoreo. Cuando ocurre una invasión, el tamaño de la población inicial y la predicción de su tamaño futuro son dos consideraciones muy importantes a tomar en cuenta. El monitoreo de las poblaciones de mosquitos provee esta información, pero factores como el clima, las enfermedades, poblaciones inmaduras y adultas y las prácticas de cultivo también son importantes. El estado adulto del mosquito de alas oscuras es la principal preocupación cuando se monitorea una planta comercial de champiñones. El monitoreo de adultos es realizado por medio de luz fluorescente o negra como atrayente y una superficie pegajosa o recipiente de agua para atrapar los mosquitos. En un sistema de una zona con un edificio de estilo antiguo, la terminal de llenado (en forma de muelle) tiene considerablemente más mosquitos que el otro extremo, por donde entra el personal y que da paso al corredor que comunica a cuartos contiguos de crecimiento. En clima fresco, este corredor puede servir como un puente para el movimiento de los mosquitos entre los cuartos de la planta. En el sistema convencional de anaqueles o charolas, las trampas deben ser colocadas en el cuarto anterior al lugar donde se enfría la composta. Las trampas colocadas en el exterior, donde los mosquitos normalmente pernoctan, y en el corredor mencionado, proporcionan una buena indicación de la situación o de niveles de poblaciones endémicas y una medida de la efectividad del programa de control vigente. Se deben tener registros precisos de las capturas diarias para evaluar el programa de control presente y para diseñar futuras estrategias. Los niveles del umbral en las diferentes etapas del cultivo suelen variar. Por esta razón, se recomienda a los cultivadores determinar su propio umbral económico. Un nivel de acción sugerido para el mosquito de las alas oscuras es de uno o dos mosquitos cada día antes de la siembra hasta cuatro días después de ésta cuando la temperatura del cuarto de crecimiento es más fresca que 43oC; 15 mosquitos por día para el resto del período de incubación, y 30-40 mosquitos por día después de aplicar la tierra de cobertura. Prácticas culturales. El acortamiento del ciclo de cultivo ha demostrado ser una práctica viable y económica de manejo porque los problemas de mosquitos y de enfermedades se reducen. Los cultivadores han reducido el número de cosechas en las dos últimas décadas desde cinco hasta no más de dos. El enfriamiento rápido al final de la fase II reduce el tiempo disponible para la invasión. Durante la incubación y después de la aplicación de la cobertura se dan temperaturas más altas, comparadas con las observadas durante la cosecha. El acortamiento de la incubación después de la siembra y de la cobertura retrasa la emergencia de mosquitos dentro del ciclo fenológico del cultivo. Especialmente el uso de inoculo de cobertura o composta presembrada agregada a la cobertura reduce el tiempo para la primera cosecha. Tecnológicamente, el cambiar a sistema de búnker para la fase II y la incubación después de la siembra acorta el ciclo. El control de mosquitos al final del cultivo es tan importante como controlarlos durante la incubación. Los cultivadores deben tratar las instalaciones de producción con vapor, o mantener la composta por 60-65°C por cuatro horas para matar mosquitos en todos sus estadios de desarrollo; estas condiciones matarán también la mayoría de los hongos y bacterias causantes de enfermedades. Un cultivo debe ser terminado más pronto de lo programado para asegurar que la población emergente de mosquitos puede ser controlada antes de que se disperse en otros lugares. La prevención es la forma más efectiva de controlar los mosquitos del champiñón. Si se puede prevenir la entrada de adultos a los cuartos, entonces el problema está resuelto antes de que empiece. Las fisuras en las paredes, alrededor de los aparatos de aire acondicionado y de la tubería 92 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus son las rutas usuales iniciales de una invasión de mosquitos. La instalación de malla sobre las puertas y el limitar el tráfico hacia los cuartos en tiempos críticos puede ayudar a reducir la probabilidad de infestación. Las trampas pueden ser usadas para determinar el aislamiento de un cuarto y la necesidad de manejar puertas. En general, si los mosquitos pueden ser excluidos hasta la aplicación de la tierra de cobertura, tendrán poco o ningún impacto. Esto es sobretodo cierto cuando las plantas han cambiado al sistema de incubación a granel. Una buena sanidad es también importante en el control de mosquitos. Estos pueden reproducirse en los pedazos y fragmentos de hongos desechados y la composta gastada puede servir como material para reproducirse. La composta ya utilizada y los desperdicios de champiñones cosechados deben ser retirados de las instalaciones. Los cultivadores deben también retirar y desechar prontamente cualquier basura o desecho. La comunidad en la planta de champiñones también debe ser considerada. Cada cuarto, bloque y planta tiene probablemente una población de mosquitos endémica o base. Estas poblaciones son específicas para cada planta y varían de cosecha a cosecha y de una estación a la siguiente. Las poblaciones de plagas dentro de la comunidad puede ser controlada si cada cultivador entiende los beneficios de un programa total y consistente de control de mosquitos. La cooperación entre cultivadores también promueve un mejor manejo de los mosquitos, basado en compartir el conocimiento sobre la biología y el comportamiento de la plaga y las condiciones esenciales que favorecen la colonización y distribución de los patógenos. Control biológico. –Tanto Bacillus thuringiensis var. israelensis (Bti) como algunos nemátodos entomopatógenos (especialmente Steinernema feltiae) son efectivos en el control de mosquitos. Bti es más efectivo contra larvas jóvenes; sin embargo, el producto no tiene larga persistencia y debe ser aplicado cuando se piensa que las larvas están presentes. Los nemátodos, en contraste, viven hasta más de seis semanas y son más efectivos sobre la cobertura. Frecuentemente, los nemátodos son utilizados varias veces durante el cultivo. Control químico. –Se ha demostrado la resistencia del mosquito de las alas oscuras a insecticidas como permethrina y dichlorvos, y al regulador del crecimiento de insectos, diflubenzuron. Muchos insecticidas comúnmente usados en la industria del champiñón son metabolizados por el sistema enzimático implicado en la resistencia a la permethrina y el dichlorvos. El análogo de la hormona juvenil, methopreno, es efectivo contra el mosquito esciárido; sin embargo, dura poco y debe ser aplicado cuando las larvas se encuentran en el 3er o 4º estadío. El larvicida cyromazine es efectivo para controlar las larvas en la composta y en la cobertura. Es termotolerante y puede ser incorporado en la composta antes de la fase II. Las aspersiones para el control de mosquitos deben incluir las áreas de descanso, de reproducción y de pernoctar durante los picos de la temporada de mosquitos. Los cultivadores deben también tratar las paredes, los marcos de las puertas y el plástico que es colocado sobre la composta después de la siembra. Los adulticidas en la forma de aerosoles o polvos deben ser aplicados cuando se alcanza el umbral. El uso de insecticidas químicos puede ser una parte importante del control de mosquitos en la planta, pero los cultivadores deben tratar de integrarlo con otras prácticas. Fóridos Las larvas de Megaselia halterata se alimentan de las puntas de las hifas en crecimiento del micelio del champiñón. Por lo tanto, la merma en el rendimiento se correlaciona directamente con el número de larvas que atacan el micelio. Más de 12000 hembras por metro cuadrado de superficie de producción son necesarios para que haya pérdidas significativas, lo cual es 12 veces más que el 93 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus número requerido para Lycoriella mali. Aunque algunas pérdidas directas de rendimiento pueden ser un problema, la mayor amenaza es la transmisión de enfermedades. Estrategias de manejo. La estrategia de manejo para el control de esciáridos es efectivo en el manejo de fóridos. Monitoreo. Los fóridos adultos y recientemente emergidos vuelan rápidamente hacia una fuente de luz repentinamente puesta, especialmente de cortas longitudes de onda, luz negra, luz azul negra o luz blanca fría. En el exterior, la actividad se restringe a las horas del día. El umbral para actuar puede ser al menos cinco veces más alto que para los mosquitos esciáridos. Control biológico. Las larvas, pupas y adultos de M. halterata son frecuentemente parasitados por un nemátodo endoparásito, Howardula husseyi Richardson, Hesling & Riding (Tylenchida: Allantonematidae). El parasitismo por este nemátodo no cambia de manera obvia la apariencia externa ni afecta apreciablemente la duración del ciclo de vida de los mosquitos; el efecto más significativo se da en la reducción de la fecundidad. Las poblaciones de mosquitos de laboratorio pueden ser virtualmente exterminadas con cinco generaciones de este parásito. Las poblaciones del nemátodo parásito pueden ser favorecidas si no se permite que la temperatura de la composta exceda 27°C. Ni Bacillus thuringiensis var. israelensis (Bti) ni los nemátodos entomopatógenos (i.e., Steinernema feltiae) son efectivos. Prácticas culturales. Puesto que los fóridos son más pequeños que los mosquitos esciáridos, el tamaño de la malla que se use para impedir el ingreso a las instalaciones debe ser más pequeño. Control químico. El análogo de la hormona juvenil, methopreno, y el regulador del crecimiento de insectos, diflubenzurón, no contolan muy bien las poblaciones de M. halterata. Cécidos Estrategias de manejo. Los cecidómidos están asociados con material de cobertura infestado, especialmente la turba, y ellos se dispersan sobre superficies en crecimiento inadecuadamente esterilizadas y, especialmente, sobre herramientas, equipos, zapatos y ropa de los trabajadores. Cualquier práctica que minimice la dispersión de mosquitos contribuye al control de los cécidos. Enfermedades Las enfermedades del champiñón son manejadas exclusivamente con el enfoque integrado. Hay pocos químicos permitidos en el cultivo de hongos y su efectividad es marginal. La reducción y eliminación de material sobre el cual la enfermedad puede crecer, la reducción del inóculo presente y la eliminación de vectores que las pueden acarrear son las claves para el éxito del manejo integrado de enfermedades. Estos requerimientos son ilustrados por la lista de recomendaciones que sigue. El material residual o enfermo es la mayor fuente de inóculo. Todos los tocones de champiñón, desechos y hongos enfermos deben ser removidos de las áreas de producción e instalaciones de la planta diariamente. Los pisos de los cuartos de crecimiento deben ser limpiados pero sin un lavado o tallado vigoroso. Se deben limpiar los pasillos y avenidas al final de la jornada y remover la suciedad y los deposiciones de suelo. Así mismo limpiar con agua y luego aplicar un desinfectante. Es muy importante enfrentar la enfermedad desde el primer momento en que aparece y cubrir, 94 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus antes de regar, los hongos enfermos con sal (NaCl) o una mezcla 50:50 de sal y yeso o cal. En el caso de la telaraña cubrir la parte enferma con papel húmedo y luego cubrir con sal o sal y yeso. Las enfermedades pueden moverse fácilmente en la planta a través de los equipos y las herramientas. Limpie y desinfecte cualquier equipo usado en y alrededor de las instalaciones de la planta, tales como cuchillos, cajas para cosechar, botes de basura, palas, escaleras, bancos, sembradoras, antes de cada uso. Limpie el equipo con agua y luego desinfecte. Remoje o asperje el equipo abundantemente. Enjuague con agua limpia si el equipo debe estar en contacto con materiales en crecimiento o con los hongos después del tratamiento. El transporte de los organismos causantes de la enfermedad entre los cultivos debe ser evitado. Al final del ciclo, y antes del vaciado, se debe subir la temperatura de la composta a 65°C por al menos 8 horas. En caso de presencia del moho verde Trichoderma, al menos 24 horas a 65°C son deseables. Si están presentes enfermedades virales, entonces la temperatura de la composta debe ser elevada a 70°C por 12 horas. Se debe remover la composta gastada y el desecho de los hongos tan lejos de la planta de hongos como sea posible. Remueva la suciedad con pala y escoba. Limpie el cuarto con agua. Debe aplicarse un desinfectante o bien el cuarto vacío debe ser calentado por 8 horas a 65°C o ambos. Limpie los entrepaños y las mallas, y si se usa madera trátela con un conservador. Minimice las condiciones con polvo en los caminos y en las instalaciones. Instale filtros de aire de alta eficiencia (95% para polvo) en los sistemas de ventilación. Cubra la composta sembrada con plástico. Revise el almacenamiento y el manejo de la semilla y de los materiales de cobertura. Almacene la semilla en un área limpia y fresca, lejos de otros hongos. Almacene el material de cobertura sobre concreto, preferiblemente cubierto. Proteja el material para la cobertura de las contaminaciones por composta, suelo o agua del suelo. Prepare la cobertura en un área limpia y protegida, preferiblemente en un contenedor tal como un convertidor-mezclador de cemento, que haya sido limpiado con agua o desinfectante, o ambos. El área debe estar libre de polvo e insectos. Los empleados pueden ser vectores de enfermedades. Supervise el flujo de personal. Evite el cruce de trabajadores entre áreas sucias y limpias. El personal de siembra no debe tener contacto con la composta, composta gastada u hongos enfermos antes de sembrar o aplicar la cobertura. Se prefieren áreas separadas de aseo y de comida para el personal de siembra. Se deben portar ropas de trabajo limpias. Los zapatos y las botas deben ser limpiados y las suelas sumergidas en desinfectante. No permita que los trabajadores se paren sobre los bordes de los estantes. Coseche primeramente los cuartos que están libres de enfermedades. Los cosechadores deben usar ropa fresca y limpia del día. Los ciclos de cultivo cortos o recortados reducen el inóculo de enfermedades. Los cultivos con altas cargas de enfermedad deben ser terminados pronto. Recortando el número de cosechas a dos se reduce significativamente la presión de las enfermedades en la planta. El uso de los avances de la tecnología reduce la incidencia de enfermedades y su severidad. El uso de sistemas de pasteurización y acondicionamiento y de incubación a granel pueden inherentemente disminuir la exposición a los organismos causantes de las enfermedades. Los sistemas construidos de manera moderna pueden ser mantenidos muy limpios. El recortar el intervalo para la primera cosecha usando inóculo de cobertura reduce la población de insectos vectores. 95 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Los insectos y los ácaros son excelentes vectores de enfermedades. Las enfermedades no pueden ser controladas si los insectos no están bajo control. Un programa efectivo de control de insectos es crucial para el manejo de las enfermedades. Enfermedades bacterianas Mancha bacteriana. Esta enfermedad se controla mejor manejando el ambiente. La humedad relativa alta y la humedad en la superficie alimentan la expresión de la enfermedad. Cuando los hongos permanecen húmedos más de dos o tres horas después del riego, la mancha se puede desarrollar fácilmente. La circulación del aire se debe dar a través de los anaqueles, en lugar de ser a lo largo de ellos. Una humedad de la composta entre 62-64% al momento de la siembra coloca al hongo bajo estrés fisiológico. El hongo toma agua adicional de la composta, lo cual ocasiona que permanezca mojado, estimulando los síntomas de la enfermedad de la mancha. El agua clorada y el agua oxigenada pueden ayudar a reducir la población bacteriana sobre la superficie de los hongos y la expresión de la enfermedad. El uso de cloruro de calcio en el agua de riego facilita el secado y puede reducir el daño. Enfermedad de las momias. Una vez que la enfermedad de las momias es identificada y puesto que la enfermedad se mueve a través del micelio, puede ser localizada separando la sección enferma de las áreas no afectadas removiendo completamente 20 cm de sustrato al menos 1.5 m de cada lado de la sección enferma. El área expuesta y los estantes deben ser tratados con solución de formalina y la superficie del área cubierta con un plástico. Al final del cultivo, toda la composta en el cuarto deberá ser pasteurizada con vapor. Las mallas y los estantes deben ser limpiados y tratados con desinfectante antes de volver a ser utilizados. La composta debe ser examinada en cuanto a humedad después de la fase II. Las áreas con humedad sobre la composta al momento de aplicar la cobertura, o aquellas donde la cobertura seca rápidamente, deben ser examinadas en cuanto a la incidencia de esta enfermedad. Enfermedades fúngicas Mole seca, mole húmeda y telaraña. La sanidad, la higiene y el manejo de los insectos son los principales métodos de manejo, como se dijo anteriormente. Si la cobertura es una fuente sospechosa de inóculo, debe ser pasteurizada o tratada químicamente con formalina. Sólo hay unos cuantos productos químicos en Norteamérica y Europa registrados para el tratamiento de la cobertura después de haber sido aplicado sobre la composta. Estos incluyen el benomil, el clorotalonil, el percloraz, el thiabendazol y el metil tiophanato. La disponibilidad de cada uno depende del registro particular en cada país. El grupo del percloraz es el más efectivo. El clorotalonil reduce la producción de carpóforos varios días y los benzimidazoles son o inefectivos o marginalmente efectivos. Trichoderma o moho verde agresivo. La sanidad, la higiene y el manejo de insectos son los principales métodos de control, como se dijo anteriormente. El momento de la siembra es el más crítico para adquirir una infección. Se deben extremar los esfuerzos para evitar la contaminación en este punto. La detección temprana y el cubrir el área verde al menos 15 cm más allá de lo visible con sal reduce el inóculo potencial. Pasteurizar el material que queda después del ciclo de cultivo a 65°C al menos 24 horas ayuda a bajar el número de clamidosporas resistentes. Los granos de semilla pueden ser cubiertos con una mezcla de fungicida (benomil, metil thiophanato o carbendizim) y yeso; sin embargo, se ha confirmado que existe resistencia. La aplicación de 96 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus suplementos agrava la expresión de la enfermedad y puede establecer una infección donde hay ausencia de semilla. Las variedades oscuras son más tolerantes que las blancas o grises. En plantas infectadas, la técnica de rascar la cobertura para romper el micelio y recolocarlo y redistribuirlo en la capa de cobertura, debe ser evitada. También, la técnica de agregar composta sembrada al material de cobertura (CACing) incrementa el riesgo de la enfermedad y resalta la necesidad de un programa preventivo y comprensivo de higiene en la planta. El usar inóculo de cobertura (IC) elimina el riesgo de usar composta infectada a la cobertura. Mohos verdes Trichoderma en la cobertura. Las especies de Trichoderma son comúnmente encontradas en el material de cobertura, algunos más que otros. Un pH alto en la cobertura ha sido sugerido como el método que reduce su incidencia. Algunos fungicidas pueden reducirla también. Los benzimidazoles son generalmente efectivos, pero el clorotalonil no. Enfermedades virales Virus de LaFrance y el virus X. El control exitoso de las enfermedades virales del champiñón puede ser lograda con un programa completo y estricto de higiene. Puesto que las esporas son el mejor vector de los virus, no se debe permitir que los carpóforos abran y suelten sus esporas. Los filtros usados deben ser suficientemente finos para capturar esporas de 5 por 7 µm. Los sistemas de ventilación deben ser suficientemente fuertes y no deben crear presión negativa que induzca a la succión de esporas más allá del filtro. El manejo a granel de la composta colonizada hace a las plantas vulnerables a la infección. Se debe tener un cuidado meticuloso para limpiar el equipo y para prevenir que fragmentos de micelio sean transportados de un área a otra. La técnica de rascado de la cobertura o de agregar composta colonizada a la cobertura debe ser evitada (Ver moho verde Trichoderma) El almacenamiento y el envío de semilla y hongos en el mismo compartimento debe ser evitado. Si el equipo de almacenamiento y envío de semilla y hongos es compartido entre plantas de cultivo, deben ser desinfectados antes de uso. Mohos concurrentes Los mohos concurrentes son síntomas que indican problemas en las fases I y/o II del composteo. Estos hongos son saprofitos y utilizan sustratos que no son selectivos para el crecimiento del champiñón comercial A. bisporus. Muchos problemas pueden ser prevenidos al poner atención a los detalles sobre: la calidad de estos materiales y su uniformidad, el manejo hortícola de la formula del sustrato, la humedad, la temperatura, la calidad del aire, el programa de volteos, la colocación del material en bunkers, anaqueles o túneles y el diseño del equipo de manejo de materiales. Coprinos. La presencia de los hongos coprinos indica una insuficiencia en la conversión de compuestos que contienen nitrógeno en la composta. Esto puede resultar en un desbalance de la relación carbono:nitrógeno (C:N), en material sobre composteado, en una composta muy húmeda o muy compacta al llenado, en una composta muy seca, o variaciones de la temperatura de la composta por tan poco como 1 ó 2o C durante la fase II del composteo. Las especies de Coprinus pueden utilizar fácilmente amonio libre y tienen un pH óptimo cercano a 8 para su crecimiento. Más de 700 ppm de amonio a la siembra pueden estimular su producción. Una vez que el amonio es liberado y que el pH declina, el micelio del champiñón coloniza el área. Las masas de esporas liberadas por el coprino pueden infectar composta recientemente preparada. 97 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Mohos verde olivo. El desarrollo de mohos verde olivo es favorecido por la falta de oxígeno (estado de anaerobiosis, menos de 16% de oxígeno) durante la fase II del proceso de composteo. Esta condición ocurre cuando la composta está muy húmeda o muy compacta en el llenado, sobrecomposteada o sobrecalentada durante los picos de temperatura de la fase II a más de 62°C con insuficiente aireación. Los mohos verde olivo son capaces de tolerar niveles de amonio más altos que el champiñón, por lo que pueden sobrevivir y prosperar en condiciones adversas para éste. Moho Penicillium. Las especies de Penicillium son oportunistas que prefieren carbohidratos simples, pero que pueden crecer en celulosa, grasas y lignina. Los suplementos no bien mezclados o sus acumulaciones y los primordios muertos o tocones son sitios comunes para el crecimiento de estos hongos. Hay una gran variedad de especies de Penicillium asociadas con el champiñón, con las cajas de madera, con los anaqueles usados para contener la composta y con los suplementos agregados a ésta. El control de P. chermesinum debe ser similar al de las enfermedades virales Moho bigotón. Este moho es un hongo celulolítico. Puede desarrollarse cuando la composta ha sido subcomposteada, cuando la relación C:N es superior a 18:1, o cuando la composta ha sido sobrecalentada durante la incubación. Una infección secundaria del moho bigotón en un cultivo es improbable. Mohos café. Las esporas son comunes en algunas compostas, y si el amonio y las aminas no son eliminadas durante la fase II de composteo, el desarrollo de este hongo es estimulado. Moho carmín. Este moho está frecuentemente asociado con estiércol de pollo descompuesto y viejo en la formula de la composta y en compostas húmedas. El hongo tiende a moverse lentamente, pero puede colonizar composta bien acondicionada. Su diseminación es a través de esporas. Cualquier mecanismo que pueda transmitir esporas puede dispersar este organismo. Moho de la plasta. Estos moho están asociados con la composta, cuando hay insuficiente conversión de nitrógeno durante la fase I o II. Frecuentemente parecen asociados con los ingredientes de la composta. Moho café canela. Este hongo es oportunista, no tolera fácilmente otros organismos. Tiende a crecer sobre cobertura que ha sido sobre pasteurizada, donde se ha usado una solución fuerte de formalina, o donde algún virus ha matado el micelio en la cobertura. El moho desaparece en el primer corte y 10-14 días más tarde, su estado perfecto reaparece como un apotecio pequeño, café oscuro en forma de disco o copa Este moho es fácilmente transportado por el aire, lo cual facilita la contaminación de la cobertura. Puesto que no es un competidor fuerte del champiñón, las infecciones secundarias en un cultivo son altamente improbables cuando el micelio del champiñón está sano. Los brotes serios en plantas de champiñón son generalmente indicativos de higiene pobre o prácticas culturales impropias. El hongo café canela es favorecido por humedad y temperatura altas después de aplicar la cobertura. Nemátodos La buena sanidad y las prácticas de higiene reducen la diseminación de nemátodos en la planta. La pasteurización al terminar el ciclo de cosecha y la limpieza de los cuartos de producción, de las mallas y del equipo reduce el transporte de un lugar a otro. Las plantas con anaqueles de madera requieren una limpieza cuidadosa post cultivo porque los nemátodos pueden ser localizados en las hendiduras de las tablas de madera. En plantas viejas con techos de madera, los nemátodos se 98 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus pueden reproducir en el aislamiento húmedo y caer sobre la composta a través de la condensación en el techo. El mantenimiento de las temperaturas adecuadas de pasteurización de la composta y del aire es crítico para reducir la amenaza de nemátodos. Si la superficie de la composta se reseca durante la fase previa a la pasteurización, estados resistentes de los nemátodos pueden sobrevivir las temperaturas de pasteurización. En estos casos puede ser necesario realizar cambios en la duración de la pasteurización, en el flujo de aire y en el control de la humedad. Los insectos son excelentes vectores de los nemátodos. Se requiere un buen programa de manejo integrado de plagas para reducir este impacto adicional en la producción de champiñones. El material usado para la cobertura puede ser una fuente de nemátodos. El material debe ser evaluado rutinariamente en cuanto al número de nematodos. El material para la cobertura puede ser tratado con vapor antes de la aplicación o con químicos. Una vez que los nemátodos son observados en la composta o en la cobertura, el mejor control es reducir su distribución en el cuarto y en la planta y determinar la fuente o causa de la infestación. La adición de composta colonizada a la cobertura debe ser evitada así como el rascado de la superficie cuando hay nemátodos. Durante la aplicación de la cobertura, el equipo y las herramientas deben ser desinfectados al pasar de un estante o anaquel a otro. No hay control químico disponible para agregar a la composta o a la cobertura una vez que el problema aparece. Las variedades grises son menos tolerantes a los nemátodos que las variedades blancas. CONCLUSION Numerosos insectos, bacterias, hongos, virus y nemátodos pueden ser observados en el cultivo comercial del champiñón. Todos son manejables a través de la integración de actividades de higiene, sanidad, manejo del cultivo, tecnología y pesticidas. Los hongos oportunistas, competidores o indicadores son manejables a través de la selección de materiales, de los ingredientes de las formulaciones utilizadas y de la tecnología en la producción de la composta. REFERENCIAS Betterley DA, Olson JA (1989) Isolation, characterization and studies of bacterial mummy disease of Agaricus brunnescens. Mushroom Science 12: 679-688. Botha WJ, Eicker A (1986) Notes on the physiology and morphology of Sepedonium niveum, a newly recorded competitor mould of mushroom compost. Dev. Crop Sci. 10: 331-339. Carmichael JW (1962) Chrysosporium and some other aleuriosporic hyphomycetes. Can. J. Bot. 40:11321173. Castle A, Speranzini D, Rghei N, Alm G, Rinker DL, Bissett J (1998) Morphological and molecular identification of Trichoderma isolates on North American mushroom farms. Appl. Environ. Microbiol. 64:133-137. Eicker A, van Greuning M (1991) Fungi in the cultivation of Agaricus bisporus – an updated list of species, 89 -96. In: van Griensven, L.J.L.D. (ed.) Genetics and breeding of Agaricus. Proceedings of the first international seminar on Mushroom Science, Mushroom Experimental Station, Horst, the Netherlands, 14-17 May 1991. Pudoc Wageningen. Fletcher JT, White PF, Gaze RH (1989) Mushrooms: Pest and Disease Control. 2nd edn. Intercept Ltd., Andover, Hants., England. 174 pp. Gandy D (1972) Observations on the development of Verticillium malthousei in mushroom crops and the role of cultural practices in its control. Mushroom Sci. 8:171-181. Goor M, Van Tomme R, Swings R, Gillis J, Kersters M, Deley J (1986) Phenotypic and genotypic diversity of Pseudomonas tolaasii and white line reacting organisms isolated from cultivated mushrooms. J. Gen. Microbiol.132: 2249-2264. 99 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Hussey NW, Read WH, Hesling JJ (1969) The Pests of Protected Cultivation. American Elsevier Publishing Company, Inc., New York. 404 pp. Pennsylvania State University (2002) Mushroom Integrated Pest Management. The Pennsylvania State University, University Park, PA, 90 pp. Rinker DL, Castle A (2005) Green moulds and bacterial blotch of the cultivated mushroom, Agaricus bisporus. Proceedings of the Fifth International Conference on Mushroom Biology and Mushroom Products, 8-12 April 2005, Shanghai, China. Acta Edulis Fungi 12:368-372. Rinker DL, Alm G (2000) Management of green mould disease in Canada. Mushroom Sci. Rinker DL, Wuest PJ (1994) Mushrooms. J. Garland and R. Howard (ed). Diseases and Pests of Vegetable Crops in Canada. Entomological Society of Canada, Ottawa, ON. Rinker DL, Bussmann S, Alm G (1993) A selective medium for Verticilllium fungicola. Can J. Plant Pathol.15:123-124. Romaine CP, Schlagnhaufer B (1989) Evidence of double standard RNAs in healthy and LaFrance diseaseaffected basidiocarps of Agaricus bisporus. Mycologia 81: 822-825. Ross RC, Brown GA, Romaine CP (1987) Recent experience in detecting viral double-stranded RNA in commercial mushroom crops and its effect on yield. Deve.Crop Sci.10: 321-329. Samuels G, Dodd SL, Gams W, Castlebury LA, Petrini O (2002) Trichoderma species associated with the green mold epidemic of commercially grown Agaricus bisporus Mycologia 94(1):146-170. Schisler LC, Sinden JW, Sigel EM (1968) Etiology of mummy disease of cultivated mushrooms. Phytopathology 58: 944-948. Sinden JW (1971) Ecological control of pathogens and weed-moulds in mushroom culture. Ann. Rev. Phytopathol. 9: 411-432. Van Greuning M, Eicker A (1991) The identity of the lipstick mould of cultivated mushrooms, Agaricus bisporus. Bot. Bull. Academia Sinica 32: 57-62. Van Griensven, LJLD (ed.) (1988) The Cultivation of Mushrooms. Darlington Mushroom Laboratories Ltd., Rustington, Sussex, England. Wong, WC, Preece TF (1987) Sources of Verticillium fungicola on a commercial mushroom farm in England. Plant Pathol. 36:577-582. Wuest, PJ, Bengston GD (eds.) Penn. State Handbook for Commercial Mushroom Farmers. The Pennsylvania State Univ., University Park, Pennsylvania. 129. Zarkower PA, Wuest PJ, Royse DJ, Myers B (1984) Phenotypic traits of fluorescent pseudomonads causing bacterial blotch of Agaricus bisporus mushrooms and other mushroom-derived fluorescent pseudomonads. Can. J. Microbiol. 30: 360-367. 100 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus IX. INOCUIDAD ALIMENTICIA DEL CHAMPIÑÓN Luke F. LaBorde The Pennsylvania State University. Department of Food Science University Park, Pennsylvania USA 16802-2504 RESUMEN Así como el consumo de frutas y vegetales ha aumentado de manera constante en las últimas tres décadas, también las enfermedades asociadas con productos frescos ha aumentado. Varios brotes de enfermedades y revocación de productos altamente publicitados han incrementado las preocupaciones públicas sobre la inocuidad de los productos frescos. Aunque hasta la fecha ningún brote de enfermedades alimenticias ha sido atribuido al consumo de hongos frescos, la industria del champiñón tiene un nuevo reto por recientes exigencias de los compradores por programas de inocuidad alimenticia dentro de las plantas de cultivo que pro-activamente identifiquen problemas potenciales y especifiquen medidas de control para minimizar riesgos de contaminación. Además de casos accidentales de contaminación alimenticia, ahora reconocemos que nuestro abasto alimenticio puede ser vulnerable a actos criminales o terroristas. Este capítulo discute los patógenos humanos asociados con brotes en productos frescos, el potencial de que los hongos se contaminen con patógenos y el potencial de problemas a la inocuidad alimenticia en el proceso de cultivo de champiñones. Palabras clave: seguridad alimenticia, brotes de riesgo, limpieza, mantenimiento de granjas. INTRODUCCIÓN El Centro para el control y prevención de enfermedades (CDC, por sus siglas en inglés) estima que en los Estados Unidos las enfermedades causadas por alimentos ocasionan un estimado de 325 000 enfermedades serias que requieren hospitalización, 76 millones de casos de enfermedades gastrointestinales y 5000 muertes cada año (Mead et al. 1999). Tal vez una tercera parte de la población mundial es afectada cada año. Más allá del dolor y el sufrimiento que aflige a las personas, el costo para las empresas alimenticias puede también ser grande. El retiro de un producto o un brote puede ser devastador para una compañía, en términos de productos desechados, seguimientos legales, costo por primas de seguros y disminución de ventas debidas a pérdida en la confianza de los consumidores. Los incrementos observados en productos relacionados con brotes de riesgo alimenticio, en gran parte, pueden ser atribuidos a una mayor demanda de productos frescos o mínimamente procesados que no reciben tratamientos térmicos para matar patógenos humanos (Sivapalasingam 2004). Durante las últimas tres décadas la industria del champiñón ha testificado un dramático cambio en las preferencias del consumidor, alejándose de los productos procesados hacia los productos frescos o mínimamente procesados. En 1971 solamente el 18% del champiñón Agaricus bisporus cultivado en los Estados Unidos era vendido a los consumidores como producto fresco y el remanente vendido principalmente enlatado. En contraste, en el ciclo 2005-2006, 84% fue vendido como producto fresco entero o rebanado (NASS 2006). Afortunadamente, no ha habido reportes de casos de enfermedades ligadas al consumo de champiñones; sin embargo, los cultivadores enfrentan nuevas exigencias de los consumidores para asegurar que su producto es cultivado, cosechado y manejado bajo condiciones sanas e higiénicas. 101 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus INOCUIDAD ALIMENTICIA Y LA INDUSTRIA DE PRODUCTOS FRESCOS Patógenos humanos en productos frescos Los patógenos humanos no son constituyentes normales de los vegetales y frutas frescas. Si un patógeno es detectado, significa que una contaminación innecesaria y evitable ha ocurrido en algún punto del proceso de cultivo y manejo. El incremento reciente de productos relacionados con brotes de riesgo ha creado una necesidad de entender las características de los patógenos microbianos, cómo ocurre la contaminación de productos frescos y qué medidas de control pueden ser implementadas para minimizar la ocurrencia de riesgos a la seguridad alimenticia (Sivapalasingam et al. 2004). A continuación se describen algunos de los patógenos humanos conocidos por haber causado problemas en los productos frescos: Escherichia coli O157:H7 E. coli está clasificada como una especie bacteriana entérica porque es un habitante común del tracto intestinal de animales y humanos. Esta especie incluye muchas cepas, de las cuales la mayoría no causa enfermedades. Sin embargo, algunas cepas, tales como la E. coli O157:H7, puede causar una enfermedad severa y aún la muerte cuando se ingieren apenas 10 células. Las cepas patógenas pueden ser encontradas en el excremento de ganado, venado, puercos salvajes y aves silvestres y domésticas y los brotes han sido ligados a germen de alfalfa contaminada, lechuga, espinaca, melones, zanahoria y cidra no pasteurizada. Los síntomas de la infección incluyen diarrea con sangre, fiebre, calambres y en casos severos síndrome urémico hemolítico (SUH) que resulta en un paro de los riñones y la muerte. Los muy jóvenes, los ancianos y aquellos que están con deficiencias en el sistema inmune son particularmente susceptibles al SUH. Puesto que los casos están frecuentemente ligados a la contaminación fecal, las enfermedades se previenen mejor prohibiendo el uso de estiércol fresco o inadecuadamente composteado y reforzando el lavado de manos regularmente y el uso guantes por quienes manejan los alimentos. Salmonella spp. Aproximadamente 2500 serotipos de la bacteria entérica del género Salmonella pueden ser encontrados en el tracto intestinal de muchos animales incluyendo puercos domésticos y salvajes, pájaros, ganado, caballos y humanos. Los brotes de esta bacteria han sido atribuidos a jugos no pasteurizados, germen, melón, sandía y tomates. Los individuos infectados con esta bacteria típicamente muestran síntomas de diarrea, fiebre, vómito y deshidratación. Los casos severos pueden causar que ocurra artritis 3-4 semanas después de la infección. La refrigeración disminuirá el crecimiento de este patógeno, pero no lo matará. El composteo adecuado del estiércol, la buena sanidad de las instalaciones de empacado y un reforzamiento de las prácticas de higiene de los trabajadores son maneras de prevenir la contaminación de productos frescos con Salmonella. Listeria monocytogenes Esta especie bacteriana es conocida como un serio riesgo para la seguridad alimenticia por su distribución amplia en el ambiente agrícola, así como por su habilidad para sobrevivir por largos períodos de tiempo en el suelo. Es también una preocupación porque a diferencia de la mayoría de los patógenos, puede crecer en condiciones de refrigeración y tiene una tasa letal alta: cerca del 20% de los casos son fatales. Los niños, los ancianos y las personas con deficiencias del sistema inmune son especialmente susceptibles a la infección y pueden desarrollar fiebre, dolores y gastroenteritis severa. Las mujeres encinta infectadas (y su bebé no nacido) tienen riesgo de aborto espontáneo. L. monocytogenes se encuentra en el tracto intestinal de varios animales y es de particular preocupación en las empacadoras de frutas y vegetales porque prospera en lugares húmedos y fríos como agua estancada, condensados de tubería de agua, las graseras en unidades de refrigeración. Los brotes y reclamos de listeriosis están más frecuentemente asociados con leche 102 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus cruda, carnes “listas para comer” y comida preparada refrigerada. El repollo picado y las zanahorias también han sido implicadas. La cantidad de células bacterianas que debe ser ingerida para causar listeriosis no ha sido claramente establecida aunque se piensa que es relativamente baja entre individuos susceptibles. El Departamento de Agricultura de los Estados Unidos ha establecido por eso una política de cero tolerancia para L. monocytogenes en alimentos preparados listos para comer. La contaminación se previene prohibiendo el uso de estiércol crudo en cultivos y por un estricto control sanitario de los procedimientos de empacado y de las instalaciones de procesado para prevenir oportunidades de contaminación cruzada Campylobacter jejuni La mayoría de la gente que se enferma de campilobacteriosis muestra síntomas de fiebre, calambres, dolor abdominal y diarrea. Los casos severos causan artritis o síndrome de GuillainBarré, una enfermedad que afecta los nervios del cuerpo. Se estima que la bacteria C. jejuni puede ser encontrada en cerca de más de la mitad de todos los productos de aves domésticas. La aparición de brotes ha sido ligada al consumo de melones contaminados y fresas, la causa más probable de contaminación fueron heces o agua de lavado contaminada. Las medidas de control para C. jejuni son las mismas que para otros patógenos entéricos: composteo adecuado del estiércol de ganado, buenas prácticas de sanidad de las instalaciones de empacado y reforzamiento de las prácticas de higiene de los trabajadores. Parásitos microbianos Los parásitos, como las bacterias entéricas patógenas, son organismos microscópicos encontrados en el tracto intestinal de animales y humanos. Los géneros de parásitos que se sabe que han contaminado productos frescos y causado enfermedades incluyen Giardia, Cyclospora, y Cryptosporidium. Los brotes han sido ligados a frambuesas, zarzamora, fresas y cidra no pasteurizada. Estos organismos pueden existir como oocistos ambientalmente duros que sobreviven por largos períodos de tiempo en heces, agua y sobre la superficie de los productos. Una vez ingeridos, crecen en el cuerpo causando síntomas de diarrea, nausea, dolor abdominal, dolores musculares y fatiga. Los riesgos de contaminación son minimizados siguiendo prácticas apropiadas de campo y sanidad en el empacado. El refuerzo de la higiene es crítico para controlar los brotes de parásitos microbianos puesto que los cosechadores infectados y manipuladores son la ruta común de contaminación. Virus Los patógenos virales más comúnmente reportados son los virus de la hepatitis A y el calcivirus. Los brotes han estado relacionado con lechugas, tomates y cebollas frescas. Los virus causan síntomas gastrointestinales que son similares a otros patógenos entéricos. Sin embargo, la hepatitis A es únicamente conocida por causar ictericia, un repentino amarillamiento de la piel y de los ojos. La prevención de la diseminación de los virus patógenos es complicada por el hecho de que los individuos infectados pueden esparcir partículas virales hacia los alimentos varios días o semanas antes de que los síntomas aparezcan. La estricta adherencia a reglas de lavado de manos y el uso de guantes es por lo tanto esencial para prevenir contaminación y enfermedades virales. INOCUIDAD MICROBIOLÓGICA Y EL PROCESO DE CULTIVO DE CHAMPIÑONES Microorganismos sobre los champiñones frescos Como en todos los productos cultivados en suelos naturales, una gran variedad de microorganismos puebla la superficie de los champiñones. En una revisión conducida por Doores et al. (1987), el número total de bacterias sobre champiñones frescos excedieron 6.0 X 106 células por gramo. Cerca de la mitad de estor fueron determinados como bacterias no dañinas y el resto dividido entre 103 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus igualmente levaduras inocuas y mohos. Estos son considerados microorganismos de deterioro y solo son preocupantes para los cultivadores si por mal manejo o abuso de temperaturas de postcosecha, alcanzan niveles que causen decoloración o formación de lama. Un champiñón normal y sano debe estar libre de patógenos humanos. A pesar de la ausencia de reportes de enfermedades ligadas a los champiñones, los reportes publicados han demostrado que la contaminación con patógenos puede ocurrir dentro de la cadena de cultivo y distribución. Los patógenos humanos encontrados en hongos frescos incluyen Salmonella spp. (Doyle y Schoeni 1986, FSAI 2001, Samapour et al. 2006), C. jejuni (Doyle y Schoeni 1986), Listeria spp. (Heisick et al. 1989, Junttila y Brander 1989, van Netten et al. 1989, Strapp et al. 2003, Samapour et al. 2006) y la enterohemorrágica E. coli (Samapour et al. 2006). Aunque la frecuencia de contaminación de champiñones no parece ser más alta que la reportada para otros tipos de productos, la industria no ha sido salvada de llamadas de atención: en 2001, las autoridades de seguridad alimenticia en Irlanda recomendaron a los consumidores cocinar los champiñones cultivados localmente después de que un muestreo dio positivo para Salmonella kedougou (FSAI 2001). La bacteria fue encontrada en la tierra de cobertura, en el sustrato composteado y sobre los champiñones. En Estados Unidos se hicieron devoluciones voluntarias de hongos en rebanadas después que oficiales sanitarios detectaron Listeria en muestras tomadas al menudeo (FDA 2003, 2006). En estos incidentes no se reportaron enfermedades y la determinación concluyente del punto, desde la granja hasta la cadena de venta al menudeo donde la contaminación ocurrió no fue hecha. Estos incidentes deberían de servir para alertar la industria de que las prácticas de cultivo requeridas para una producción exitosa de champiñones pueden introducir riesgos potenciales de seguridad alimenticia en el proceso de cultivo. Inocuidad alimenticia en la industria del champiñón Preparación del sustrato El estiércol de caballo y el de pollo son ingredientes estándares en la mayoría de las formulaciones de sustrato (Beyer 2003). Se ha establecido que estos ingredientes son fuente potencial de Salmonella spp., E. coli O157:H7, L. monocytogenes, y C. jejuni (Atwill 2007, Heuvelink et al. 1996, Himathongkham et al. 2000, Traub-Dargatz et al. 2004). Puede esperarse que esta práctica se mantenga bajo un creciente escrutinio debido a los recientes brotes, no relacionados con el champiñón, atribuidos a contaminación por heces animales. La industria es afortunada, sin embargo en que hay tratamientos térmicos para el sustrato del champiñón bien controlados y continuamente monitoreados en la fase I y II. En la Planta de Prueba y Demostración del Champiñón y en el Centro de Investigación en Hongos (MTDF y MRC, respectivamente, por sus siglas en inglés) de la Universidad Estatal de Pennsylvania, fueron conducidos estudios recientes para determinar el destino de los patógenos humanos durante el proceso de composteo. Estos estudios demostraron reducciones de población mayores que 7-log en L. monocytogenes, Salmonella y E. coli O157:H7 durante la fase II de pasteurización y acondicionamiento cuando las temperaturas del sustrato alcanzaron al menos 60oC (140oF) por 2 horas (Weil et al. 2004). La fase II de preparación del sustrato puede por lo tanto ser considerada como una medida efectiva de control de inocuidad alimenticia. Sin embargo, debe ser mencionado que cuando la preparación del sustrato y las operaciones de cultivo del champiñón son llevadas a cabo a proximidad entre ellas, se necesita considerable cuidado para prevenir contaminación cruzada por escurrimiento y filtraciones del agua de desecho, por la dispersión del viento y por el tráfico de empleados y equipo. 104 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Materiales de cobertura Los materiales para la cobertura no presentan los mismos riesgos que el estiércol; sin embargo, los riesgos potenciales en la inocuidad alimenticia deben ser considerados puesto que la turba y algunos tipos de cal usados como suelo de cobertura son productos naturales que son obtenidos de ambientes que pueden contener microorganismos patógenos, como L. monocytogenes o Salmonella spp. De primera instancia, uno debe considerar una alta temperatura de pasteurización de las mezclas de cobertura para eliminar riesgos patogénicos. Sin embargo, un estudio reciente de la Universidad Estatal de Pennsylvania (Chikthimmah et al. 2007) demostró que el tratamiento térmico podría introducir une nuevo riesgo potencial para la inocuidad. Cuando L. monocytogenes o Salmonella spp. fueron inoculados en suelos de cobertura no tratados, la población de patógenos disminuyó a niveles indetectables en 14 días; sin embargo, cuando estos patógenos fueron inoculados en coberturas pasteurizadas y enfriadas previamente, las poblaciones permanecieron sin cambio hasta por 35 días. Esto demuestra que los patógenos probablemente vivan menos en suelo de cobertura no tratada. Un tratamiento térmico que elimina los patógenos aparentemente también mata la microflora nativa que actúa para inhibir competitivamente el crecimiento y la sobreviviencia de los patógenos. Por lo tanto, si el suelo de cobertura pasteurizado se contamina más tarde con patógenos, su sobreviviencia puede mejorar comparada con suelo no tratado. Por esta razón la pasteurización del suelo de cobertura no es recomendado actualmente. En lugar de eso, los cultivadores necesitan obtener cartas de garantía o certificados de análisis de sus proveedores de cobertura que garanticen que todos los material son recibidos libres de patógenos humanos. Una vez que los ingredientes de la cobertura o formulaciones de suelos son recibidos, sin embargo, deben ser manejados y almacenados para prevenir contaminación ambiental cruzada desde áreas adyacentes de preparación de compostas y de almacenamiento de materias primas. BUENAS PRÁCTICAS AGRÍCOLAS PARA PREVENIR LA CONTAMINACIÓN MICROBIANA DE CHAMPIÑONES Las buenas prácticas agrícolas BPA (GAP, por sus siglas en inglés) son las condiciones básicas ambientales y operativas que se necesitan para el cultivo y cosechado sanos de frutas y vegetales. En un programa BPA se consideran los riesgos microbianos, químicos y físicos potenciales que pueden conducir a enfermar o dañar al consumidor. Los lineamientos generales para las prácticas sanas de cultivo son proporcionadas por la “Guía para minimizar riesgos microbianos a la seguridad alimenticia, para frutas frescas y vegetales” (FDA 1998). Varios grupos de productos están desarrollando sus propios planes BPA que toman en cuenta prácticas de cultivo y manejo únicas. El Departamento de Ciencias Alimenticias de la Universidad Estatal de Pennsylvania ha proporcionado lineamientos sobre inocuidad alimenticia a cultivadores de champiñón (LaBorde 2001, 2002, 2003, 2006) y trabaja actualmente con el Instituto Americano del Champiñón para desarrollar estándares sobre seguridad alimenticia para las granjas de hongos. Elementos esenciales de un programa BPA de champiñones Cada planta de champiñón y operación de empaque debe tener un programa BPA escrito, en curso, que pro-activamente identifique riesgos a la inocuidad alimenticia y documente los esfuerzos para prevenir que ocurran problemas. El primer paso hacia el desarrollo de un programa BPA es seleccionar un líder quien tendrá la responsabilidad de desarrollar e implementar el plan de seguridad alimenticia. Pero un individuo no puede hacer esto sólo; el plan necesita entradas de una variedad de gente en la organización que tienen experiencia en la producción. El apoyo del dueño de la planta y/o de la alta dirección es esencial puesto que puede ser necesario asignar individuos con nuevas responsabilidades laborales y puede haber costos asociados con hacer cambios necesarios en las instalaciones. 105 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus El plan BPA debe estar sistemáticamente organizado y claramente escrito de tal manera que cuando alguien lo lea entienda cada estándar de inocuidad alimenticia. Debe enfatizar las responsabilidades del personal y la rendición de cuentas de parte de todos los empleados, desde cosechadores hasta la alta administración. Las actividades de monitoreo y verificación son necesarias para asegurar que el plan está vigente. Los registros y las listas de revisión deben ser mantenidas para que documenten la fuente y la condición de las materias primas entrantes, los procedimientos de preparación de sustrato, los procedimientos de control de plagas, las actividades de entrenamiento y cuándo y cómo son conducidas las labores de limpieza e higiene. El plan de inocuidad alimenticia y los registros que lo documentan deben ser conservados en un área segura fácilmente accesible para las personas autorizadas. Abajo se discuten algunas áreas clave que los cultivadores de champiñones necesitan incluir en su programa BPA: Seguridad en el suministro de agua El agua es utilizada extensivamente para la preparación del sustrato y los materiales de cobertura, para el riego, el uso de pesticidas, la limpieza y la higiene de equipos y utensilios, para el lavado de manos y para beber. El agua puede ser también vehículo para la dispersión de microorganismos patógenos y químicos contaminantes. Cualquier tipo de agua que entre en contacto con los hongos o con las superficies que están en contacto con los alimentos debe estar libre de microorganismos dañinos y químicos contaminantes. El agua obtenida de la fuente central municipal es considerada la más segura para usar porque ha sido tratada para eliminar microorganismos peligrosos y es regularmente muestreada para verificar criterios microbiológicos y químicos establecidos. El agua de pozos privados es segura, si ha sido obtenida de pozos construidos y mantenidos de manera apropiada. Sin embargo, los riesgos asociados con el agua de pozos son altos si ellos están pobremente construidos y mantenidos de tal manera que puedan contaminarse después de una lluvia fuerte o inundación o por filtración de fosas sépticas adyacentes o sitios agrícolas. El agua de pozo debe, por lo tanto, ser monitoreada regularmente por la presencia de microorganismos y químicos contaminantes. Si las pruebas de laboratorio revelan la presencia de niveles altos inaceptables de microorganismos, el agua debe ser inmediatamente tratada con desinfectante y la fuente de contaminación determinada. El uso de agua superficial no tratada de ríos, lagunas, reservorios y lagos no es recomendada porque su calidad puede variar inesperadamente en el transcurso del tiempo. Otra forma como el agua puede contaminarse es a través de conexiones de plomería deficientes. Cuando hay presente conexiones cruzadas en el sistema de plomería de un edificio, un repentino cambio en la presión de agua puede causar contaminación del agua desde una tanque de aguas de desecho, línea de drenaje u otra fuente de contaminación al fluir a la inversa hacia el suministro de agua limpia. Un plomero calificado debe revisar la presencia de conexiones cruzadas y asegurarse que los espacios de aire y las rupturas de vacío estén en su lugar para prevenir retroflujos de agua. Es una buena práctica arreglar todas las llaves y mangueras con dispositivos que prevengan retroflujos e instruir a los trabajadores en no dejar la punta de las mangueras en charcos en el suelo ni en cubetas que contengan químicos riesgosos. Salud de los trabajadores e higiene Las operaciones de cultivo, cosecha y empaque de champiñones requieren de un extensivo manejo de producto. La higiene básica del trabajador es importante porque los patógenos pueden ser transmitidos por el personal a los hongos. La contaminación puede ocurrir a través del contacto manual, desde facial y bello corporal hasta ropa sucia o con toser o estornudar. Cualquier persona que maneje hongos que trabaja en áreas donde los hongos están expuestos debe mantener una limpieza personal que incluya bañarse regularmente y usar ropa limpia. Las camisas abiertas y los 106 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus zapatos abiertos no son apropiados porque incrementan los riesgos de contaminación. La gerencia deberá proporcionar a los trabajadores blusas, delantales y otro tipo de ropa protectora que debe ser utilizada sobre la ropa de calle y quitada al final de la jornada para lavarla. Los que cosechan y manejan los hongos deben conservar las uñas cortadas y el cabello y el pelo facial cubierto todo el tiempo. La comida, la goma de mascar, las bebidas, los productos de tabaco, las joyas, las plumas y lápices y otros artículos personales representan riesgos potenciales que pueden causar perjuicio y deben ser mantenidos fuera de las áreas de producción. El lavado regular y frecuente de las manos es tal vez la manera más efectiva de prevenir contaminación humana de los alimentos. Quienes manejan champiñones deben lavar sus manos al inicio de un cambio, después de una pausa, después de usar el baño y después de manipular superficies que no estén limpias. Las manos y las partes expuestas de los brazos deben ser abundantemente enjabonadas y vigorosamente talladas por al menos 10-15 segundos, para después ser abundantemente enjuagadas con agua limpia. Debe ponerse particular atención en las áreas debajo de las uñas y entre los dedos. Las manos deben ser después secadas completamente con toallas desechables o con aire caliente. Los químicos antisépticos para las manos pueden proveer protección adicional contra la contaminación cruzada pero no son un sustituto de las prácticas básicas de higiene. Muchas compañías exigen ahora que los cosechadores y empacadores usen guantes desechables cuando manipulan champiñones. Los guantes proveen una excelente barrera entre los microbios de la piel y el producto. Sin embargo, es importante recordar que no son efectivos si se contaminan, rasgan o pinchan. Los trabajadores deben lavar sus manos cada vez que se ponen guantes y usarlos solo para la actividad designada. Ellos deben quitárselos cuando dejan el puesto de trabajo y reemplazarlos después de manejar superficies con tierra o si se dañan. Es importante que los supervisores se aseguren que los trabajadores entienden el correcto uso de los guantes y que hay siempre un adecuado suministro. Los supervisores deben estar alerta de trabajadores que muestren signos y síntomas de enfermedades que pueden ser transmitidas a través de la comida. Cualquier trabajador que tiene diarrea, fiebre, vómito o un amarillamiento repentino de la piel o los ojos (ictericia) no debe manejar los champiñones. Los trabajadores con heridas mayores que sangran o muestran signos de infección deben también ser alejados de los champiñones. Si las cortadas o raspaduras son menores y no hay riesgo de sangre o contacto hacia los hongos, las heridas pueden ser cubiertas con una venda y tener más protección con un guante de latex. Pero cuando una enfermedad o lastimada es suficientemente seria para convertirse en un riesgo para la inocuidad alimenticia, el trabajador afectado debe ser enviado a casa o reasignado a un área donde no se manejan champiñones. Las auto-notificaciones voluntarias de enfermedades o lastimadas son más probables de suceder si se asegura a los trabajadores que no serán penalizados o que no perderán su trabajo. El baño y las instalaciones para el lavado de manos Es responsabilidad de la gerencia de proveer instalaciones adecuadas para cumplir todos los objetivos de higiene mencionados previamente. Debe haber al menos un baño por cada 20 empleados, cada uno dentro de 400 m del sitio de trabajo. Las instalaciones deben estar bien ventiladas, deben tener puertas que se cierran solas, que no abren hacia las áreas de producción; deben ser limpiadas y saneadas cada día que se usan y monitoreadas para asegurarse que funcionan adecuadamente. También deben ser continuamente habilitadas con sus insumos. Los trabajadores deben ser entrenados para entender que el papel sanitario utilizado debe ser tirado en la tasa y desechado con abundante agua y nunca tirado en basureros o contenedores. 107 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Cada baño debe tener una estación de lavado de manos adyacente con agua limpia corriente, un distribuidor de jabón, toallas de papel desechables y un recipiente para basura. Los lavabos usados para lavarse las manos deben estar separados de aquellos usados para otros propósitos. Los señalamientos que recuerden a los trabajadores lavar sus manos antes de regresar al trabajo deben ser colocados en cada baño y escritos en el lenguaje que cada uno entienda. Los baños portátiles son alternativas aceptables a las instalaciones permanentes si cumplen con los estándares de limpieza, mantenimiento y presencia de las estaciones de lavado de manos. Mantenimiento de edificios y pisos. El diseño y operación de la granja de champiñones o del cuarto de empaque puede tener un impacto significativo en la inocuidad de los productos. En muchas granjas habrá áreas donde los ingredientes del sustrato no tratados, sustrato terminado y materiales de cobertura son manejados y almacenados. Estas áreas deben estar claramente separadas de las áreas de cultivo, empacado y cortado. Las rutas de tráfico de empleados y de equipo deben estar establecidos y reforzados para prevenir la contaminación entre áreas de producción y áreas insalubres. Cuando sea necesario para los trabajadores o visitantes moverse en las instalaciones, las manos y zapatos deben ser adecuadamente limpiados y saneados antes de permitir la entrada a las áreas de cultivo y empaque. El equipo no utilizado, paletas, contenedores y otros artículos que se guardan afuera deben ser mantenidos tan lejos como sea posible de los edificios, para que las plagas no tengan lugar donde esconderse a salvo. La maleza o el pasto altos son lugares ideales para el apareamiento de plagas y pueden contribuir a la contaminación microbiana si se les deja crecer. El buen drenaje evita el agua estancada, en la cual los insectos pueden aparearse y dispersar microorganismos. Los escurrimientos del área de composteo deben ser dirigidos lejos de las áreas de cultivo y empaque de hongos y los caminos, jardines y áreas de estacionamiento deben ser mantenidas para minimizar el polvo y la basura. Los recipientes exteriores de basura deben estar siempre tapados, lejos de los edificios y deben ser regularmente removidos del predio. Los cimientos de los edificios, las paredes exteriores y los techos deben ser mantenidos en buen estado, sin puntos de entrada para pestes o agua. Los canales de desagüe deben mantenerse libres de restos y desechos de tal manera que ellos alejen el agua de lluvia de los edificios y no atraigan plagas. Las entradas deben mantenerse cerradas cuando no están en uso o tener malla, cortinas de tiras plásticas o cortinas de aire instaladas para mantener las plagas afuera. Los muelles de carga deben estar siempre limpios y nunca deben ser utilizados como puntos de entrada para los trabajadores puesto que los roedores y los pájaros probablemente también usen la misma ruta. Los interiores de los edificios deben estar limpios y organizados, con amplio espacio para que se muevan empleados y equipo. Los pisos, paredes y techos deben ser regularmente limpiados y mantenidos en buen estado. Los contenedores y materiales de empacado deben estar almacenados de tal manera que no entren en contacto directo con el piso y, si es necesario, protegidos del polvo, desechos y condensados. Los pisos deben ser construidos de materiales lavables, no porosos, inclinados para permitir el drenaje y tener rejas removibles o tapones en los drenes para evitar la entrada de plagas. Puesto que los roedores son capaces de encogerse en aberturas tan pequeñas como de 6.3 mm (1/4 de pulgada) las puertas deben ser construidas para que cierren herméticamente. Las paredes deben ser revisadas regularmente para asegurarse que no tienen repellos, pintura, metales oxidados, aislamientos u otras partes flojas. Las partes fijas ubicadas en alto necesitan limpieza regularmente para que el polvo, los insectos y otros restos no caigan sobre los hongos expuestos. Las tuberías de agua en alto deben estar aisladas y los corredores bien ventilados para prevenir el goteo de condensados que pudieran acarrear L. monocytogenes. 108 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus La estructura de las luces interiores, sobre o cerca de donde están expuestos los champiñones deben estar equipados con lámparas de tipo seguro o bien estar protegidas con guardas que eviten contaminación con vidrio. Las ventanas deben también estar hechas de plástico a prueba de astillamiento, en lugar de vidrios que se pueden romper. La intensidad luminosa recomendada varía según la actividades, pero las áreas de trabajo deben ser suficientemente claras para permitir la continua inspección para detectar la presencia de plagas y contaminantes. Las estructuras para las luces exteriores deben ser colocadas lejos de las entradas puesto que ellas atraen insectos voladores que encontrarán la manera de entrar al edificio. El colocarlas lejos y dirigirlas hacia el edificio es una mejor configuración para mantener las plagas alejadas. Condiciones y limpieza de las superficies en contacto con alimentos El equipo y los utensilios que tienen contacto con los champiñones incluyen cuchillos, contenedores para cosechar, mesas, áreas de preparación, tapices rodantes, equipo para lavado y cortado, y los materiales de empacado. Es particularmente importante enfocarse a las condiciones y mantenimiento de esas superficies porque ellas tienen el potencial de causar directamente la contaminación de champiñones diariamente. Los utensilios y el equipo que está en contacto con los alimentos en las áreas de empacado deben ser hechos con materiales no absorbentes y no tóxicos que puedan ser limpiados fácilmente y saneados. Metales que no sean aceros inoxidables, como fierro, bronce o superficies galvanizadas deben ser evitadas porque se corroen fácilmente y pueden contaminar químicamente a los champiñones. El acero inoxidable y el plástico durable son preferidos porque resisten la corrosión. El equipo debe tener uniones, esquinas y bordes suaves y pocas rupturas o hendiduras que puedan bloquear la acción de los limpiadores y desinfectantes por alcanzar el suelo y las bacterias. Las superficies deben drenar fácilmente para permitir un rápido secado con aire después de la limpieza y desinfección. Los contenedores de cosecha (canastas, pértigas, charolas y cajas) deben ser solamente usadas para los champiñones y no para otro propósito, como contener basura, materiales de desecho o servir como sillas o banquitos. Si los contenedores para la cosecha son dañados o muestran signos de astillamiento o ruptura deben ser reparados o desechados. La limpieza frecuente es esencial para remover los residuos de alimentos (nutrientes) que las bacterias necesitan para crecer y es necesaria la higiene de las superficies que están en contacto con alimentos para reducir las poblaciones de microorganismos dañinos. Una vez que los recipientes que están en contacto con alimentos se han limpiado, deben ser almacenados en el interior del edificio, sobre estantes o anaqueles de tal manera que estén protegidos de condensados, del chapoteo del piso, de materiales provenientes de paredes frágiles o del techo, maquinaria y partes de equipos y otros objetos extraños. Los procedimientos detallados de limpieza y los programas deben ser desarrollados para todas las superficies que tengan contacto con alimentos y para aquellos que no están en contacto como por ejemplo, estructuras que penden por encima de la cabeza, paredes, techos, partes de iluminación, unidades de refrigeración, calentamiento y sistemas de ventilación. Un proveedor de productos de limpieza reconocido en su área puede determinar los mejores productos para sus necesidades. Etiquetado adecuado, almacenamiento y uso de compuestos tóxicos Hay muchos químicos tóxicos que se usan en y alrededor de las áreas de cultivo y empacado de champiñones. Los riesgos químicos potenciales incluyen a los pesticidas, los compuestos para limpieza, los agentes higiénicos, los combustibles y los lubricantes. Los procedimientos deben estar en su lugar para documentar el tipo y la cantidad de químico usado. De tal manera que sean seguidos para el uso definido que tienen y que sean usados correctamente. Los químicos tóxicos deben ser almacenados en áreas limpias, bien organizadas y seguras, lejos de las áreas de producción y los contenedores deben ser claramente etiquetados con el nombre del compuesto, el 109 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus nombre y la dirección del fabricante y las instrucciones de uso. Nunca preparar o almacenar soluciones químicas en contenedores que son normalmente usados para empacar o contener champiñones. Deben obtenerse las Hojas de Datos para la Seguridad de Materiales (HDSM; MSDS por sus siglas en inglés) para todos los químicos que se usan y deben ser archivadas en un área fácilmente accesible. Ellas contienen información valiosa sobre la toxicidad y las opciones de tratamiento si el químico es ingerido accidentalmente. Control de plagas Los roedores, pájaros e insectos son una preocupación para la inocuidad alimenticia porque ellos transfieren microbios a los alimentos y a las superficies que están en contacto con alimentos. Un programa integrado de manejo de plagas es recomendado para controlar las plagas en las áreas de cultivo y empaque. Esto significa que las áreas donde las plagas se puedan esconder deben ser primeramente eliminadas. Después, deben hacerse modificaciones a los edificios y al suelo para evitar la entrada de las plagas a las áreas de manejo de alimentos. Las trampas para roedores pueden ser colocadas dentro de los edificios, en las entradas y a lo largo del interior de las paredes. Las cajas de cebo solo deben ser colocadas afuera de los edificios. Si la plaga logra ganar la entrada al edifico, se pueden utilizar pesticidas; sin embargo el aplicador del pesticidas debe estar certificado en el manejo seguro y la aplicación de pesticidas restringidos. Generalmente es mejor contratar una empresa comercial de control de plagas que tenga conocimiento de las últimas tecnologías, además de experiencia de trabajo en y alrededor de plantas alimenticias. Defensa alimenticia Los esfuerzos por la inocuidad alimenticia se han enfocado exclusivamente a la ocurrencia potencial de contaminación accidental. Pero nosotros ahora reconocemos que es importante considerar la posibilidad de una contaminación deliberada de alimentos. La motivación para tales actos varía ampliamente. Un empleado, mental o emocionalmente inestable, que está insatisfecho con su trabajo puede tratar de ¨castigar¨ la compañía saboteando sus productos. Por otra parte, actos criminales por personas fuera de la compañía pueden estar motivadas por la necesidad de dinero o de objetos valiosos y no particularmente por una molestia con la empresa. Los terroristas actúan generalmente sin frustración, descontento o rabia, con razones políticas o económicas y pueden actuar contra una compañía o producto en particular como un gesto simbólico. Puesto que el objetivo del terrorista es ganar publicidad, es posible que pueda lograr su objetivo solamente haciendo amenazas contra el producto en particular. No es posible eliminar completamente los riesgos a la inocuidad; sin embargo hay muchas acciones que pueden ser tomadas para prevenir actos deliberados de contaminación. Reducción del riesgo significa identificar áreas más vulnerables a ataques y hacer mejoramientos físicos en las instalaciones para hacer las áreas sensibles más seguras, como las entradas, las salidas, los sitios de almacenamiento de químicos y las áreas donde los alimentos son expuestos. También significa incrementar la visibilidad en y alrededor de los edificios y monitorear de cerca el lugar y el comportamiento de empleados y visitantes. CONCLUSIONES La industria del champiñón no tiene más alternativa que enfrentar la realidad de que los champiñones, como otro tipo de productos frescos tienen el potencial de contaminarse y causar enfermedades o daños de origen alimenticio. Un programa de Buenas Prácticas Agrícolas anticipa los riesgos a la inocuidad alimenticia y prescribe medidas para evitar que ocurran. La información y las recomendaciones indicadas en este capítulo solo son algunas maneras en las cuales los riesgos a la inocuidad alimenticia pueden ser controlados. Se invita al lector a visitar regularmente el sitio de the Penn State Mushroom Food Safety http://foodsafety.cas.psu.edu/mush/foodsafety.htm donde 110 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus encontrará información continuamente actualizada sobre tópicos relacionados con la inocuidad alimenticia de los champiñones. REFERENCIAS Atwill ER (2007) Microbial pathogens excreted by livestock and potentially transmitted to humans through water. University of California, Davis Veterinary Medicine Extension. http://www.vetmed.ucdavis.edu/vetext/INF-EC_Microb.html. Accessed October 2, 2007 Beyer DM (2003) Basic Procedures for Agaricus Mushroom Growing. Penn State Cooperative Extension. University Park, PA Chikthimmah N, Beelman RB, LaBorde LF (2007) Sphagnum peat-based casing soils do not permit the survival of Listeria monocytogenes & Salmonella spp. Mush. News 54(9):6-13 Doores S, Kramer M, Beelman RB (1987) Evaluation and bacterial populations associated with fresh mushrooms (Agaricus bisporus). Dev. Crop Sci. 10:283–294 Doyle MP, Schoeni JL (1986) Isolation of Campylobacter jejuni from retail mushrooms. Appl. Environ. Microbiol. 51(2):449-450 FDA (1998) Guidance to Industry - Guide to Minimize Microbial Food Safety Hazards for Fresh Fruits and Vegetables. U.S. Food and Drug Administration. Washington D.C. October 26, 1998 FDA (2003) Georgia Ag Department Finds Contaminated Mushrooms. Press Release. U.S. Food and Drug Administration. Washington D.C. August 14, 2003. http://www.fda.gov/oc/po/firmrecalls/southmill08_03.html . Accessed October 2, 2007 FDA (2006) Monterey Mushrooms Recalls Fresh Sliced White and Baby Bella Mushrooms in PA, MD, NC, NJ, NY, OH, and VA Because of Possible Health Risk. Press Release. U.S. Food and Drug Administration Washington D.C. September 7, 2006. http://www.fda.gov/oc/po/firmrecalls/monterey09_08.html. Accessed October 2, 2007 FSAI (2001) Food Safety Authority of Ireland advises consumers to cook mushrooms. Food Safety Authority of Ireland Press Release. Dublin, Ireland. April 12, 2001. http://www.fsai.ie/news/press/pr_01/pr20010412.asp. Accessed October 2, 2007. Heisick JE, Wagner DE, Nierman ML, Peeler JT (1989) Listeria spp. found on fresh market produce. Appl.Environ. Microbiol. 55(8):1925-1927 Heuvelink AE, Zwartkruis-Nahuis JTM, van den Biggelaar FLAM (1996) Isolation and characterization of verocytotoxin-producing Escherichia coli O157 from slaughter pigs and poultry. Int. J. Food Micro. 52:67-75 Himathongkham S, Riemann H, Bahari S (2000) Survival of Salmonella Typhimurium and Escherichia coli O157:H7 in poultry manure and manure slurry at sublethal temperatures. Avian Diseases. 44:853-860 Junttila J, Brander M (1989) Listeria monocytogenes septicemia associated with consumption of salted mushrooms. Scand. J. Infect. Dis. 21, 339-342. LaBorde LF (2001) Sanitation: The key to producing safe mushroom products. Mush. News 49(9):8-18, September 2001. LaBorde LF (2002) Biosecurity - safeguarding our food supply from intentional contamination. Mush. News. 50(3): 8-12 LaBorde LF (2003) “Mushroom Farm Food Safety and Security Self-Assessment”. Penn State Cooperative Extension. http://foodsafety.cas.psu.edu/mush/foodsafety.htm. Accessed October 2. 2007 LaBorde LF (2006) Control of Listeria monocytogenes in mushroom growing and packing environments. Mush. News. 54(11):21-26. Mead PS, Slutsker L, Dietz V, McCaig LF, Bresee JS, Shapiro C, Griffin PM, Tauxe RV (1999) Food-related illness and death in the United States. Emerg Infect Dis.5:607-25 NASS (2006) Mushrooms, 2005-2006. National Agricultural Statistics Services. U.S. Dept. of Ag, Washington D.C. Samapour M, Barbour MW, Nguyen T, Cao TM, Buck F, Depavia GA, Mazengia E, Yang P, Alfi D, Lopes M, Stopforth JD (2006) Incidence of enterohemorrhagic Escherichia coli, Escherichia coli O157, Salmonella, and Listeria monocytogenes in retail fresh ground beef, sprouts, and mushrooms. J. Food Prot. 69(2):441-3 Sivapalasingam S, Friedman CR, Cohen L, Tauxe RV (2004) Fresh Produce: A Growing Cause of Outbreaks of Foodborne Illness in the United States, 1973 through 1997. J. Food Prot. 67(10):2342-2353 111 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Strapp CM, Shearer AEH, Joerger RD (2003) Survey of retail alfalfa sprouts and mushrooms for the presence of Escherichia coli O157:H7, Salmonella, and Listeria with BAX, and evaluation of this polymerase chain reaction-based system with experimentally contaminated samples, J. Food Prot. 66: 182–187 Traub-Dargatz JL, Garber LP, Fedorka-Cray PJ, Ladely S, Ferris KE (2000) Fecal shedding of Salmonella spp. by horses in the United States during 1998 and 1999 and detection of Salmonella spp. in grain and concentrate sources on equine operations. J. Am. Vet. Med. Assoc. 217(2):226-230 van Netten P, Perales I, van de Moosdijk A (1989) Liquid and solid selective differential media for the detection and enumeration of L. monocytogenes and other Listeria spp. Int. J. Food Micro. 8:299-316. Weil JD, Beelman RB, LaBorde LF (2004) Destruction of select human pathogenic bacteria in mushroom compost during phase II pasteurization. Proceedings of the 2004 ISMS/NAMC Conference. Miami, Florida. 365-371. 112 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus X. ASPECTOS SALUDABLES AL CONSUMIR HONGOS Jan I. Lelley GAMU Ltd Institut for Mushroom Research Krefeld, Alemania <[email protected]> RESUMEN Se presenta el contenido químico de los champiñones, las setas y el shiitake y se comparan con el contenido reportado en la literatura para varios vegetales de interés. Debido a su bajo valor energético, bajo contenido en sodio, contenido en manitol y proteínas, alto contenido en vitaminas, entre otros, los hongos son alimentos saludables que pueden ser recomendados ampliamente para mantener la salud y como parte de la dieta de personas con sobrepeso, diabéticas, hipertensas o con ciertos problemas metabólicos. Las características saludables de los hongos se aprecian mejor en los hongos frescos. Palabras clave: composición química, champiñón, setas, shiitake, ortomedicina, INTRODUCCIÓN Si usted pregunta a sus amigos, colegas u otras personas por qué prefieren comer frutas, vegetales y ensaladas, la respuesta será porque son sabrosas, tienen un alto valor nutritivo y son buenas. Si usted hace la misma pregunta en relación con los hongos comestibles, entonces, frecuentemente, recibirá una simple respuesta –porque son sabrosos. Desafortunadamente solo muy pocos consumidores prefieren comer hongos por su valor nutritivo. En Alemania y en muchos otros países, los hongos tienen una pobre imagen y son observados como una guarnición simplemente. Son usados de vez en cuando, pero no muy seguido ni en gran cantidad. El público en general no tiene idea de cuán valuable pueden ser los hongos para mantener una buena salud y prevenir las enfermedades. ¿QUÉ TAN SANOS SON LOS HONGOS? Para contestar esta pregunta, nosotros analizamos el valor nutritivo de varias cepas de champiñones Agaricus bisporus, dos cepas de setas Pleurotus ostreatus y una de shiitake Lentinula edodes. Comparamos el valor nutritivo con los de vegetales y frutas que estaban disponibles en la literatura científica y los discutimos bajo aspectos médicos ortomoleculares (Vetter y lelley 2004, Lelley y Vetter 2005). La medicina ortomolecular fue establecida por el bioquímico estadounidense Linus Pauling. Actualmente, es un área médica aceptada mundialmente. El mérito de la disciplina es la aplicación específica de vitaminas, minerales, elementos traza y otros nutrientes esenciales para la prevención y tratamiento de enfermedades causadas por la dieta y el ambiente. Como puede observarse en la Tabla 1, los hongos tienen una muy baja concentración en energía. En esto ellos son comparables con las frutas y los vegetales. Puesto que nosotros usamos pocas calorías en muchas de nuestras actividades diarias (Tabla 2), los alimentos con baja concentración energética, como los hongos, ayudan a mantener el balance del peso corporal. 113 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Tabla 1: Energía El consumo diario de calorías para adultos es de aproximadamente 2200-2600 kcal. La grasa y los carbohidratos son la principal fuente de energía. Promedio de energía (kcal.) contenido en 100 g de frutas y verduras (frescas): 31 105 26 52 78 Manzana Plátano Limón Cereza agria Uva 17 39 32 23 38 Lechuga Nabo Repollo Tomate Puerro Energía (kcal.) promedio contenida en 100 g de hongos frescos Champiñón 40 Setas 39 Shiitake 35 Una porción común de 100-150 g contiene 1.5-1.7% del requerimiento diario sugerido por cada nutriente Tabla 2: Calorías quemadas durante actividades populares (por hora) Demanda energética (kcal) de diferentes actividades por hora Actividad • • • • • • • • • • • ciclismo(rápido) Ciclismo (lento) Boxeo Esgrima Correr Remar (competencia) Equitación (lento) Equitación (galopar) Ping pong Bailar Bailar (vals) Energía Requerida Actividad 530 Kcal. 175 Kcal. 800 Kcal. 510 Kcal. 490 Kcal. 1120 Kcal. 98 Kcal. 470 Kcal. 310 Kcal. 266 Kcal. 140 Kcal. • • • • • • • • • • • Energía requerida Leer (en voz alta) comer sentarse en silencio Cantar (en voz alta) Pelar papas Lavar platos Costurar (a mano o máquina) Planchar Vestirse/desvestirse Tocar el chelo Tocar el piano 42 Kcal. 28 Kcal. 28 Kcal. 56 Kcal. 42 Kcal. 70 Kcal. 28 Kcal. 70 Kcal. 63 Kcal. 97 Kcal. 98 Kcal. La concentración de sodio en los hongos es extremadamente baja (Tabla 3). Podemos describir este hecho como benéfico porque los individuos que sufren de hipertensión pueden comer hongos sin restricción. En contraste con las plantas, los hongos no tienen almidón. En lugar de glucosa, los hongos contienen manitol. El manitol tiene la mitad del endulzamiento de la caña de azúcar y por lo tanto es observado como un sustituto para diabéticos. Los diabéticos pueden comer 200 gramos de hongos diariamente sin tomarlo en consideración en su dieta. Un alimento específico que proporciona 15% o más de los requerimientos diarios de una sustancia esencial en una porción diaria (100-150 g) es considerada como especialmente valiosa. Los nutricionistas y las autoridades alrededor del mundo aceptan generalmente este concepto. Por 114 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus ejemplo, 100 g de bistec proporcionan más del 30% de los requerimientos diarios de proteína. La carne es considerada por lo tanto, especialmente valiosa por proporcionar proteína. Para entender y apreciar el valor nutritivo de los hongos, y para una comparación con vegetales y frutas, vea las tablas 4-10. La tabla 11 lista los nutrientes en los hongos que son más importantes que los nutrientes encontrados en la carne. Tabla 3: Sodio El consumo diario de sodio para adultos es de aproximadamente 2000mg. El sodio se encuentra principalmente en la carne y el pescado. Promedio de sodio contenido en 100g de frutas y verduras (frescas) Manzana 16 mg Lechuga Plátano 26 mg Nabo Limón 23 mg Repollo Cereza agria 5 mg Tomate Uva 100 mg Apio Albaricoque 70 mg Zanahoria Melón 24 mg Espinaca Promedio de sodio contenido en 100g de hongos frescos Champiñón Setas Shiitake 2 mg 22 mg 4 mg 5 mg 2 mg 6 mg 8 mg 21 mg 6 mg 9 mg Una porción común de 100-150g contiene 0.5-0.75% del requerimiento diario sugerido por este nutriente Tabla 4: Potasio El consumo diario de potasio para adultos es de aproximadamente 1600mg. El potasio se encuentra principalmente en la carne y el pescado. Promedio de potasio contenido en 100g de frutas y verduras (frescas) Manzana 261 mg Lechuga Plátano 300 mg Nabo Limón 216 mg Repollo Cereza agria 240 mg Tomate Uva 370 mg Apio Albaricoque 240 mg Zanahoria Melón 526 mg Espinaca Promedio de potasio contenido en 100g de hongos frescos Champiñón Setas Shiitake 112mg 500mg 275mg 186mg 195mg 226mg 210mg 450 mg 230 mg 260 mg Una porción común de 100-150g contiene 21-32% del requerimiento diario sugerido por este nutriente 115 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Tabla 5: Vitamina B-1 (Tiamina) El consumo diario de vitamina B-1 para adultos es de aproximadamente 0.4-1.2mg. La vitamina B-1 se encuentra principalmente en el hígado, las legumbres y la levadura. Promedio de vitamina B-1 contenido en 100g de frutas y verduras (frescas) Manzana 0.06 mg Lechuga Plátano 0.05 mg Nabo Limón 0.04 mg Repollo Cereza agria 0.10 mg Tomate Uva 0.10 mg Puerro Albaricoque 0.05 mg Zanahoria Melón 0.08 mg Espinaca Promedio de vitamina B-1 contenido en 100g de hongos frescos Champiñón Setas Shiitake 0.05 mg 0.16 mg 0.06 mg 0.05 mg 0.05mg 0.02 mg 0.05 mg 0.10 mg 0.18 mg 0.06 mg Una porción común de 100-150g contiene 16-24% del requerimiento diario sugerido por este nutriente Tabla 6: Vitamina B-2 (Riboflavina) El consumo diario de vitamina B-2 para adultos es de aproximadamente 1.0-1.5mg. La vitamina B-2 se encuentra principalmente en el hígado, el riñón, el corazón, la carne y el pescado. Promedio de vitamina B-2 contenido en 100g de frutas y verduras (frescas) Manzana 0.10 mg Lechuga Plátano 0.05 mg Nabo Limón 0.06 mg Repollo Cereza agria 0.06 mg Tomate Uva 0.06 mg Puerro Albaricoque 0.15 mg Zanahoria Melón 0.20 mg Espinaca Promedio de vitamina B-2 contenido en 100g de hongos frescos Champiñón Setas Shiitake 0.05 mg 0.08 mg 0.02 mg 0.02 mg 0.05mg 0.03 mg 0.02 mg 0.47 mg 0.65 mg 0.27 mg Una porción común de 100-150g contiene 30-45% del requerimiento diario sugerido por este nutriente 116 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Tabla 7: Vitamina B-5 (Ácido pantoténico) El consumo diario de vitamina B-5 para adultos es de aproximadamente 8.0mg. La vitamina B-5 se encuentra principalmente en el hígado, el riñón, la carne y las legumbres. Promedio de vitamina B-5 contenido en 100g de frutas y verduras (frescas) Manzana 0.11 mg Lechuga Plátano 0.20 mg Nabo Limón 0.10 mg Repollo Cereza agria 0.02 mg Tomate Uva ¿? mg Puerro Albaricoque 0.30 mg Zanahoria Melón 0.11 mg Espinaca Promedio de vitamina B-5 contenido en 100 g de hongos frescos Champiñón Setas Shiitake 0.09 mg 0.15 mg 0.20 mg 0.08 mg 0.06mg 0.12 mg 0.08 mg 2.25 mg 2.10 mg ¿? mg Una porción común de 100-150 g contiene 27-41% del requerimiento diario sugerido por este nutriente Tabla 8: Vitamina B-9 (Ácido fólico) El consumo diario de vitamina B-9 para adultos es de aproximadamente 0.2mg. La vitamina B-9 se encuentra principalmente en el hígado, las espinacas, las frutas y la levadura. Promedio de vitamina B-9 contenido en 100g de frutas y verduras (frescas) Manzana 0.025 mg Lechuga Plátano ¿? mg Nabo Limón ¿? mg Repollo Cereza agria 0.037 mg Tomate Uva ¿? mg Puerro Albaricoque 0.064 mg Zanahoria Melón 0.066 mg Espinaca Promedio de vitamina B-9 contenido en 100g de hongos frescos Champiñón Setas Shiitake 0.006 mg 0.013 mg 0.004 mg ¿? mg 0.005 mg 0.003 mg 0.024 mg 0.027 mg 0.127 mg 0.025 mg Una porción común de 100-150g contiene 38-58% del requerimiento diario sugerido por este nutriente 117 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Tabla 9: Vitamina D (Calciferol) El consumo diario de vitamina D para adultos es de aproximadamente 5.0µg. La vitamina D se encuentra principalmente en la carne y el pescado. Promedio de vitamina D contenido en 100g de frutas y verduras (frescas) Manzana 0.00 µg Lechuga Plátano 0.00 µg Nabo Limón 0.00 µg Repollo Cereza agria 0.00 µg Tomate Uva 0.00 µg Puerro Albaricoque 0.00 µg Zanahoria Melón 0.00 µg Espinaca Promedio de vitamina D contenido en 100g de hongos frescos Champiñón Setas Shiitake 0.00 µg 0.00 µg 0.00 µg 0.00 µg 0.00 µg 0.00 µg 0.00 µg 1.88 µg 2.35 µg 2.00 µg Una porción común de 100-150g contiene 36-67% del requerimiento diario sugerido por este nutriente Tabla 10: Selenio El consumo diario de selenio para adultos es de aproximadamente entre 20 y 100µg. El selenio se encuentra principalmente en la carne, el hígado, el riñón y el pescado. Promedio de selenio contenido en 100g de frutas y verduras (frescas) Manzana 1 µg Lechuga Plátano 2 µg Patatas Naranja 4 µg Paprika Cereza agria 1 µg Tomate Melocotón 6 µg Ajo Ciruela 1 µg Zanahoria Uva 1 µg Espinaca Promedio de selenio contenido en 100g de hongos frescos Champiñón Setas Shiitake 1 µg 1 µg 1 µg 1 µg 1 µg 1 µg 2 µg 28 µg 10 µg 10 µg Una porción común de 100-150g contiene 10-100+% del requerimiento diario sugerido por este nutriente 118 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Tabla 11: Nutrientes en los cuales los hongos exceden el valor nutricional de la carne Nutrientes Selenio Cobre Vitamina B-2 Vitamina B-3 Vitamina B-5 Carne 100g fresca Hongos 100g frescos 3.70-30.0 µg 0.05-0.16 mg 0.15-0.21 mg 4.50-8.10 mg 0.60-0.90 mg 4.0-28.0 µg 0.3-0.4 mg 0.4-0.5 mg 5.0-9.8 mg 2.1-2.7 mg (Spiegel 2001) CONCLUSIONES Después de estudiar todos los efectos benéficos de los hongos y considerarlos desde el punto de vista de la medicina ortomolecular, se pueden hacer las siguientes observaciones: Los hongos tienen un bajo nivel de energía y contienen muy pocas calorías. Esto es benéfico para la reducción del peso. En el mundo occidental, aproximadamente 50% de adultos y desafortunadamente, muchos niños, tienen sobrepeso. Incrementando el consumo de hongos podría contribuir significativamente a controlar la obesidad. En un estudio con personas con sobrepeso, nosotros creamos una dieta para toda una semana. La dieta contenía tres platillos muy sabrosos de hongos en cada comida, los cuales no excedían 1100 calorías. Debido al alto contenido de fibra los consumidores no sufrieron de hambre durante la dieta. Los hongos tienen un bajo nivel de purinas. Este hecho es benéfico en la dieta de personas que sufren de enfermedades metabólicas como la gota y el reumatismo (Kress 1991). Los hongos tienen un bajo nivel de glucosa y contienen más manitol. Esto es especialmente adecuado para diabéticos (Kress 1991). Debido al bajo contenido en sodio, el incremento en el consumo de hongos puede ser recomendado para personas que sufren de hipertensión. Los hongos tienen una alta concentración de varias vitaminas. Esto es un aspecto ortomolecular importante porque al consumir hongos una parte importante de los requerimientos diarios de estas sustancias son cubiertos. Finalmente, los hongos también tienen una alta concentración de algunos minerales y elementos traza (en nuestro ejemplo nosotros mostramos potasio y selenio). Desde el punto de vista mencionado arriba, esto es un aspecto ortomolecular importante también. Estoy muy optimista que la consideración sobre los hongos bajo estos aspectos de salud y los esfuerzos para dispersar este conocimiento pueden incrementar significativamente el consumo de los hongos. Incrementar el consumo de hongos, especialmente frescos (los hongos enlatados pierden hasta el 75% de su valor nutritivo), influenciará positivamente su producción. Tal desarrollo beneficiaría particularmente las granjas que están localizadas cerca de los mercados para que puedan proveer a los consumidores de productors frescos. 119 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus REFERENCIAS Kress M (1991) The role of edible mushrooms in the diet. In: Lelley JI (ed) Mushroom growing – the biotechnology of cultivated mushrooms. Ulmer, Stuttgart (En alemán) Lelley J, Vetter J (2005) the posible role of mushrooms in maintaining good health and preventing diseases. Acta edulis fungi Vol 12. Supplement 412-419. Vetter J, Lelley J (2004) Selenium level of the cultivated mushroom Agaricus bisporus. Acta Alimentaría 33(3) 297-301. Speigel C (2001) How can mushrooms replace meat in the diet. Annual Meeting of the Society of Friends and Sponsors of the Applied Mycology. Presentación oral. En alemán. Este capítulo es una traducción del trabajo publicado por el autor Dr. Jan I. Lelley (2007) bajo el título ¨Healthy aspects of eating mushrooms¨ en Mush News 55 (2)20-24, con el permiso del editor en jefe de la revista. 120 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus XI. CONTROL DEL AMBIENTE EN LOS CUARTOS DE CULTIVO DE CHAMPIÑONES Ken M. Lomax Bioresources Engineering Department. University of Delaware Newark, Delaware, USA 19716 RESUMEN Los aspectos de ingeniería para controlar el ambiente interno de una nave de cultivo incluyen los siguientes temas: propiedades de la humedad del aire, poder de evaporación, diseño de ductos e intercambio gaseoso. El poder de evaporación, que es la multiplicación aritmética del déficit de presión de vapor por la velocidad del aire, provee un indicador útil de condiciones muy secas o muy húmedas alrededor del píleo de los hongos. Los ductos de aire son importantes en la distribución y la circulación del aire en el cuarto de tal manera que todas las superficies de crecimiento tengan el microambiente deseado. Palabras clave: producción de hongos, evaporación, humedad, Agaricus bisporus, ductos INTRODUCCION Los conceptos generales de ingeniería presentados en este capítulo aplican para champiñones cultivados en camas o estantes. El objetivo para controlar el ambiente interior es: Proveer el mejor aire para la producción de hongos en cada lugar del cuarto Las palabras en este objetivo están seleccionadas para enfatizar lo que puede ser logrado con un equipo apropiado y buen manejo. “El mejor aire” incluye valores medidos de velocidad, dirección y temperatura del aire, humedad relativa, oxígeno y concentración de bióxido de carbono. “Cada lugar” enfatiza que el sistema de circulación de aire debe proveer condiciones uniformes en todo el cuarto. Como un resultado de suministrar “el mejor aire”, se puede esperar 1) alcanzar el tamaño deseado de los hongos, 2) distribuir productos de alta calidad en términos de color y forma y 3) tener una cantidad redituable de hongos (rendimiento). El equipamiento que debe ser utilizado en edificios dedicados al cultivo de hongos incluye: uno o más extractores/ventiladores, ducto(s), serpentines fríos/aire acondicionado, serpentines de calefacción, compuertas de aire fresco, compuertas de recirculación y de escape y un sistema de control. Además, este artículo estimula las mediciones rutinarias para conocer las características del sistema de aire, de tal manera que el cultivador tenga instrumentos de medición disponibles inmediatamente. Es útil reconocer que el movimiento de aire a través de la superficie de crecimiento de los hongos libera oxígeno y que el intercambio de aire aleja CO2, calor y humedad. Aunque se puede decir que el aire provee “enfriamiento”, el movimiento del aire realmente aleja calor de la superficie de los hongos, más que liberar frío. Esta distinción es teórica, pero ayuda a recordar la dirección de la transferencia de energía. Los aspectos de ingeniería para controlar el ambiente interior en las instalaciones de cultivo de champiñones se dividen en las siguientes secciones: propiedades de la humedad del aire, poder de evaporación, diseño de ductos e intercambio gaseoso. 121 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus PROPIEDADES DE LA HUMEDAD DEL AIRE El aire es considerado como una mezcla de vapor de agua y aire seco y es necesario un entendimiento de esta mezcla para proveer un buen aire a los hongos. Cuatro propiedades del aire, considerado como mezcla, son importantes para esto: punto de rocío, humedad relativa, bulbo seco y bulbo húmedo. El punto de rocío (pr) tiene unidades en grados Celsius, es una medida de la cantidad de vapor de agua en el aire. En la vida cotidiana, la propiedad de la humedad relativa (%HR) es más común como indicador de humedad en el aire; sin embargo, la humedad relativa en sí, no enfoca el problema de los hongos húmedos como lo hace el pr. Cuando la parte final alargada inferior de un termómetro de vidrio es cubierta con un pequeño trapo húmedo, se considera como un “bulbo húmedo”. Otra propiedad es la temperatura de bulbo seco (bs), que es llamada comúnmente como “temperatura del aire”. El término bulbo seco viene de la apariencia del bulbo del termómetro comparado con el “bulbo húmedo”. Estas cuatro propiedades pr, bh, bs y HR están inter-relacionadas. Medición del punto de rocío La temperatura del punto de rocío es una preocupación durante el cultivo, en particular cuando la temperatura de bulbo húmedo está cambiando. Con el fin de conocer cuál es la temperatura de punto de rocío en un cuarto, se necesita medirla directamente o determinarla indirectamente con una tabla de valores. Para medir el punto de rocío directamente, se requiere de un instrumento caro, enfriado con un espejo, que no se justificaría para el cultivo de hongos. Para determinar el pr con una carta psicrométrica o con una tabla, las mediciones más comúnmente utilizadas son las temperaturas bs y bh. El instrumento recomendado para estas dos mediciones se llama psicrómetro y es fácil de conseguir a un costo razonable. Un psicrómetro de mano o uno de baterías provocan suficiente movimiento de aire sobre el trapo húmedo para permitir a la temperatura de bh alcanzar una lectura estable. La otra medición de temperatura necesaria para afrontar el problema de píleos sudados en los hongos es la temperatura del píleo. No es necesario medir la temperatura del píleo del hongo, pero puede ayudar a entender la situación en la planta. Tome un medidor de temperatura con terminación en punta, como los usados para medir la temperatura de una composta e insértelo en un hongo para medir la temperatura del sombrero. Es razonable asumir que la superficie del píleo del hongo es la misma que la del exterior del hongo, o ligeramente más baja. Si la temperatura del hongo es más baja que la temperatura de rocío del aire, el vapor de agua se condensará sobre la superficie del píleo. Piense en un vaso frío por comparación: si la superficie del vidrio es más caliente que el pr entonces no hay condensación. Como se mencionó anteriormente, la humedad relativa, el bulbo húmedo y el bulbo seco están relacionados. Si la humedad relativa en el cuarto está por debajo de 90%, entonces el punto de rocío no será un problema. Medir la humedad relativa arriba de 90% es mejor con un psicrómetro usando temperaturas de bs y bh, en lugar de usar un medidor electrónico de humedad. Usualmente, los medidores electrónicos son confiables hasta 95% HR. Si la diferencia entre bs y bh es de cerca de 1.5°C ó más, entonces la HR será menor de 90%. En la tabla 1 se dan valores aproximados de HR para una serie de diferencias de temperatura, también llamadas depresión de bulbo húmedo. Esta tabla de valores es aplicable para temperaturas típicas de cultivo. Observe que entre más próximas estén las temperaturas, de una misma lectura, más húmedo está el aire en el cuarto. Es importante entender tanto el punto de rocío como la humedad relativa y usar ambos indicadores para diferentes situaciones. Por ejemplo, el pr del aire en un cuarto será siempre menor que el bh. Si el bh es 1°C más bajo que el bs, entonces el pr será 1.5°C más bajo que el bs. Una diferencia de 2°C entre bs y pr es buena para mantener el píleo de los hongos secos. 122 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Tabla 1. Humedad relativa aproximada del aire entre 15 – 25°C Diferencia de temp bs - bh (°C) 0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6 1.8 2.0 HR (%) 100.0 98.8 97.6 96.4 95.2 93.9 92.7 91.6 90.4 89.2 88.1 Observaciones en un cuarto de cultivo Un ejemplo de problema de punto de rocío fue observado en un cuarto de cultivo típico de Pennsylvania que tenía una tubería perimetral para calentamiento y extractores. Después de regar, el cultivador quería secar los hongos tan rápido como fuera posible para reducir el riesgo potencial de la enfermedad de la mancha bacteriana. El secado rápido es recomendado como una buena práctica. Los extractores fueron encendidos completamente hacia el mediodía por cerca de cinco horas. Después de este período de ventilación, usando aire frío y seco del exterior, los extractores fueron apagados y el sistema de calentamiento de la nave calentó el aire a cerca de 15°C. Más tarde ese día, el cultivador cambió el termostato a 20°C. Como un resultado del calentamiento del aire, y consecuentemente de las camas, las temperaturas de bh y de pr también se incrementaron. Como se muestra en la Figura 1, la temperatura de pr subió más rápido que la del sombrero del hongo, causando que el sombrero del hongo sudara. Aunque los sombreros pudieron haberse secado después del riego, ellos se rehumedecieron por condensación por el efecto del punto de rocío. Como la temperatura del aire declinó a la mañana siguiente, los píleos pudieron haberse secado de nuevo, pero las bacterias en su superficie tuvieron tiempo para crecer y causar oscurecimiento y las manchas típicas de la enfermedad. Manejo de la temperatura de punto de rocío Para prevenir un problema de condensación, los cultivadores necesitan monitorear la temperatura del aire (bs) y la humedad, ambos dentro y afuera del cuarto. Durante condiciones estables, las temperaturas del píleo del hongo son cerca de 0.5-1.0°C debajo de la temperatura bs. Si el pr está más de 1°C debajo de la temperatura bs y hay un razonable flujo de aire, entonces el píleo no sudará. Con el punto de rocío al menos 1°C abajo del bulbo seco, la humedad relativa generalmente estará cerca de 90%. Estas condiciones estables no deben causar problema de punto de rocío. Si las condiciones dentro de la nave están cambiando rápido, entonces hay un gran potencial de que la temperatura del píleo caiga debajo de la temperatura de pr. Como se describió arriba en “observaciones”, el incremento rápido en la temperatura del aire en un cuarto húmedo causa un rápido incremento en la temperatura pr. La temperatura del píleo aumenta más lentamente que el pr, causando el sudor. Si la temperatura del aire incrementa lentamente, la temperatura del píleo seguirá 123 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus y la situación aparecerá casi como en las condiciones estables de arriba. Con control manual de temperatura, se puede generalmente cambiar la posición del termostato 0.5°C cada hora. Si el bs, el bh y el pr tienen el mismo valor, entonces el aire está saturado y la humedad relativa es 100%. Cuando esto pasa, hay básicamente dos maneras de reducir el punto de rocío: 1) quitar vapor de agua del aire con un serpentín de enfriamiento, como con un aire acondicionado, el cual condensa el vapor, o 2) mezclar aire exterior más seco con el aire húmedo del cuarto con ventilación. El primer método para el control del punto de rocío pasa durante un clima de verano cálido y húmedo como resultado del aire acondicionado. El segundo método es más dependiente de un clima de invierno frío usando aire fresco que está seco – y tiene una baja temperatura pr. Temperatura en el cuarto de crecimiento 22 Temperatura (°C) 20 18 16 14 12 10 11 15 19 23 3 7 hora del día Figura 1. Temperaturas registradas en un cuarto de crecimiento con énfasis en la temperatura del punto de rocío. Nomenclatura: temperatura de bulbo seco; Ú temperatura de punto de rocío; z temperatura del píleo. Mezclar aire exterior usando un extractor o la compuerta de aire fresco no es tan confiable cuando las condiciones del clima están cercanos a las condiciones del aire deseadas en el cuarto durante primavera y otoño. Puede haber días cuando el aire exterior tiene un punto de rocío arriba del valor deseado para el cuarto de cultivo. Puede ser necesario medir las propiedades exteriores del aire para estar seguro que el pr exterior es más bajo que el interior. Para estas condiciones, el aire acondicionado o el serpentín de enfriamiento deben ser utilizados para eliminar humedad aunque no sea necesario para controlar la temperatura bs. El clima mostrado a la derecha de la figura 2 sería de preocupación potencial porque la temperatura exterior podría estar cerca de la temperatura interior deseada y entonces, el termostato no mandaría calor o enfriamiento. La temperatura de pr es cercana al bs y entonces el aire húmedo puede causar condensación. 124 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Registro climático, 15 de marzo 25 Temperatura (°C) 20 15 10 5 0 -5 -10 Horas Figura 2. Registro de temperaturas naturales que muestran la temperatura de rocío. Nomenclatura: ¡: temperatura del aire; {: temperatura de punto de rocío. Tanto el calentamiento como el enfriamiento son utilizados simultáneamente para eliminar vapor de agua y también mantener la temperatura del aire. El psicrómetro puede ser utilizado afuera para asegurar que el punto de rocío del aire exterior es al menos 2°C abajo del bs deseado del cuarto. Si la condensación sobre el píleo de los hongos es un problema, entonces, elevar la temperatura de bs calentando el aire puede no ayudar en el problema. Se debe entender cómo cambian las propiedades del aire. En un cuarto vacío, el calentar el aire (incrementando el bs) no cambia el punto de rocío aunque el calentamiento sí reduce la humedad relativa. En un cuarto con hongos en crecimiento, subir el bs puede causar mayor actividad biológica lo que en su turno crea más vapor de agua del hongo y de la composta. Particularmente en un día anterior a una cosecha larga, la producción de vapor de agua por el hongo puede ser suficiente para incrementar el punto de rocío arriba de la temperatura del píleo. El control del punto de rocío durante el cultivo es importante para mantener los hongos secos pero no muy secos. Si se tiene un problema de manchado puedo sugerir que se midan las temperaturas de bulbo húmedo y bulbo seco durante el cultivo. Sí. Tomará tiempo y puede necesitarse comprar un psicrómetro, pero el costo hacia la calidad de la cosecha puede ser significativo. Puede ser necesario revisar con una frecuencia de hasta cada cuatro horas, durante los días de primavera y otoño, como la situación mostrada en la figura 4. Si se tiene un control manual para el aire acondicionado o los serpentines de frío en el manejador de aire, entonces encienda el enfriamiento, pero deje el termostato puesto igual para calentar. Si el equipo puede hacer tanto enfriamiento como calentamiento, y mantener la temperatura de bs, entonces, trate de obtener un bh que sea 1°C inferior que el bs. Ajuste el enfriamiento para alcanzar el diferencial de 1°C. La temperatura de punto de rocío es una medida del vapor de agua en el aire. Medir y controlar la temperatura de punto de rocío durante el cultivo puede reducir la humedad en el píleo de los hongos. La temperatura de punto de rocío puede ser reducida con aire acondicionado, pero no con calentamiento. 125 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus PODER DE EVAPORACION El movimiento del aire a través de la nave de cultivo aporta el microambiente en el cual cada hongo debe vivir. Es conocido generalmente que el aire seco a alta velocidad causa que los hongos presenten un aspecto escamado (o emplumado). Contrariamente, el aire húmedo en baja velocidad crea condiciones que conducen al manchado de los carpóforos. Un producto de alta calidad requiere del mejor aire para cada hongo. El poder de evaporación del aire es un concepto que explica un poco más esta tendencia general. Figura 3. Hongos húmedos, sin suficiente poder de evaporación en el sombrero. El poder de evaporación fue un concepto descrito por Edwards (1978) como un resultado de sus experiencias con champiñones Agaricus spp. El sugirió que el poder de evaporación podía ser numéricamente calculado al multiplicar la velocidad del aire por el déficit de presión de vapor. Estos dos conceptos serán explicados separadamente antes de ponerlos juntos. El déficit de presión de vapor se define como la diferencia entre la presión de saturación del vapor de agua en el aire a una temperatura dada y la presión de vapor de agua en el aire en ese momento. La presión de vapor es medida como presión barométrica en unidades de milibar, kilo pascal, mm ó pulgadas de mercurio. Recuerde que el reporte del clima dice “La lectura del barómetro es de 755 (mm de mercurio) y estable”. La lectura de presión barométrica incluye el efecto de las moléculas de vapor de agua en el aire. Cuando hay muchas moléculas de vapor de agua (naturalmente que nosotros no podemos ver las moléculas!), la presión de vapor de agua es alta. Si hay solo unas pocas moléculas de vapor de agua, se dice que la humedad es baja, y consecuentemente la presión de vapor es baja. También, se debe recordar que la energía molecular que causa la presión de vapor depende de la temperatura y que el déficit de presión de vapor y la humedad relativa no están linealmente relacionados con el cambio de temperatura. El déficit de presión de vapor es un indicador de cuántos lugares vacíos hay disponibles para moléculas adicionales de agua. 126 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Figura 4. Hongos secos con escamas en la superficie. Demasiado poder de evaporación. A continuación están algunos valores numéricos que ayudan a explicar la presión de vapor: Usemos una lectura de barómetro de un bar (valor estándar al nivel del mar) ó 1000 milibars. A 15°C, la presión de saturación de vapor es 17 milibars (ASHRAE 1989). En otras palabras, el aire a esta temperatura puede solamente mantener suficientes moléculas de agua para causar 17 unidades de presión de un total de 1000. La presión restante viene del nitrógeno, del oxígeno y de otras moléculas en el aire. A 82% de humedad relativa para esta misma temperatura de 15°C, la presión de vapor de agua (solo las moléculas de agua) es 14 mbars. Este valor de presión de vapor puede ser obtenido usando la temperatura de punto de rocío de este aire. El déficit de vapor de presión es 17 menos 14 igual a 3 mbars. Entre más grande es el déficit, más fácilmente las moléculas de agua son tomadas por el aire porque hay más “espacios” para vapor de agua. La velocidad del aire es la segunda componente del poder de evaporación. Se necesitan los dos, presión de vapor y velocidad, para describir la tasa a la cual las moléculas de vapor de agua pueden ser removidas de una superficie. Piense en un día húmedo y caliente. Si no hay viento, y usted está quieto, sentado, usted notará la incomoda acumulación de sudor en su piel. Si usted se mueve enfrente de un ventilador, o viaja en un vehículo abierto, su piel se sentirá mejor. La diferencia entre las dos situaciones no es el vapor de agua en el aire, sino solamente la velocidad del aire. El aire a alta velocidad, aún con una alta humedad, puede proveer algo de evaporación. Generalmente. La velocidad del aire a través de los sombreros de los hongos debiera ser en el rango de 3-15 m/min. Se pueden usar “banderas” como indicadores de flujo de aire para observar la velocidad a través de las camas, anaqueles o charolas (Lomax et al. 1994). El valor numérico del poder de evaporación (PE) se obtiene multiplicando la velocidad del aire por el déficit de presión de vapor. Por ejemplo: a 15°C y 82% HR, el aire tiene un déficit de presión de vapor de 3 mbars (ver arriba). Si la velocidad de ese aire es de 3 m/min entonces el poder de evaporación es 3 mbarsX3 m/min ó 9 mbars m/min. Edwards (1978) sugirió que un poder de evaporación de 4 a 10 mbars m/min “será probablemente satisfactorio para producir champiñones sanos de buena calidad ”. Una gráfica es una manera útil de describir visualmente el poder de evaporación del aire para los hongos. La figura 3 muestra el PE en términos de humedad relativa y velocidad del aire. El área medianamente sombreada entre las dos líneas curvas es la zona de PE que es buena para el píleo de los hongos. Las líneas de arriba y de abajo que dan forma de boomerang a esta área, están basadas en los valores sugeridos por Edwards, mencionados arriba. Algunas variedades de hongo pueden necesitar más o menos evaporación ocasionando diferentes límites de PE aceptables. Por lo tanto, no solamente se debe ver este gráfico en sus líneas precisas, sino pensar en ellas como difusas o amplias. 127 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Figura 5. El Poder de Evaporación es útil para entender el aire alrededor de un hongo. La utilidad de este gráfico (Figura 5) es ayudar a reconocer dónde hay más flexibilidad para la velocidad del aire o para la humedad relativa. Supóngase que el control del aire acondicionado provee de aire exactamente a 93% HR, entonces este gráfico enfatiza que la velocidad del aire debe estar en el rango de 2 a 6 m/min. La parte inferior de este rango de velocidad indica que todos los hongos que están creciendo necesitan este mínimo de flujo de aire o ellos ‘se sentirán incómodos’ y probablemente desarrollarán manchas. Arriba del límite máximo del rango, 7 m/min, el poder de evaporación es mayor, pero justo dentro de las indicaciones de Edwards. Alternativamente, si la humedad relativa es 85%, entonces, el rango recomendado de velocidad es más limitado. Para 85% HR, si el aire se mueve más rápido que 4 m/min puede causar el escamado de los carpóforos. Si se tiene un abanico o ventilador de una sola velocidad, entonces los cambios de humedad se verán como si el punto sobre el gráfico PE se moviera arriba y abajo de la velocidad dada en la superficie de crecimiento. Como se señala en el párrafo anterior, esta figura ayuda a entender un concepto y no pretende presentar valores numéricos rígidos o exactos. Los valores del ejemplo no necesariamente encajan con mi experiencia y pueden no acoplar en otra situación. Mis propias observaciones, pero no mis experimentos, sugieren que un aire que se mueve a 4 m/min y 85% HR puede empezar a mostrar una pequeña formación de escamas. Velocidades más altas, 9 m/min y superiores con 85% HR están asociados con excesivas escamas que pueden tener un impacto económico importante. Como las oportunidades económicas pueden empujar hacia una mayor producción en cada finca, es necesario recordar que el aire a través de los hongos influencia enormemente la calidad del producto. Si usted agrega solo un poco de más sustrato (composta) en cada cuarto o nave, puede no crear una carga de humedad mayor que la existente en el sistema aire (aire acondicionado o aire natural). Sin embargo, se debe recordar que un poco más, más un poco más, más un poco más, agregará una carga adicional significativa, como en la frase ‘la paja que quebró la espalda del camello’. En términos de poder de evaporación, la mancha bacteriana puede no haber sido un 128 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus problema en años previos, pero ahora, si se empuja la carga en el sistema, ambos, velocidad de aire y humedad relativa deben ser evaluados dentro del cuarto. DISEÑO DE DUCTOS ¿Cuántos diseños diferentes de ductos de aire ha visto usted? Sí. Hay muchas variantes de ductos. Empecemos con una lista de variables que influyen en el tipo de ducto de un cuarto de producción o de un cuarto de crecimiento en una planta de cultivo de champiñones. Algunas de las variables que se pueden considerar son: material del ducto (poly-tubo, madera, metal), forma a lo largo (cónicos, en pasos, corrugado), diámetro o sección transversal del ducto, agujeros o boquillas, tamaño, localización y número de agujeros. El objetivo del ducto es distribuir el aire en todas las superficies en crecimiento del cuarto. Es deseable tener una velocidad relativamente uniforme a través de las camas o charolas y el diseño del ducto es importante para establecer el patrón de circulación de aire. Puesto que este capitulo está escrito principalmente para cultivadores de hongos, más que para ingenieros de diseño, el enfoque es mejorar una situación existente. Trabajaremos desde la perspectiva de que ya hay un ducto en la nave de cultivo o cuarto de crecimiento y el reemplazo o su modificación es una posibilidad. Algunos términos técnicos necesitan ser revisados primero. Recuerde que presión se define como fuerza por unidad de área, medida en Pascales o milímetros de agua. Velocidad es distancia por unidad de tiempo, medida en m/seg, m/min o km/h. Tasa de flujo es volumen por unidad de tiempo, medida en m3/seg. Ahora, podemos considerar cada variable con más detalle. Material del ducto Los tubos de polietileno son baratos y vienen en cualquier largo. El metal o la madera pueden ser preferidos donde hay limitación de espacio, porque ya sea que el material puede ser moldeado ancho y poco profundo para ocupar un techo bajo, o delgado y alto para otras situaciones. La fibra de vidrio o los ductos de plástico rígido pueden ser utilizados en cuartos largos. La elección debe ser económica, considerando un balance entre la vida más corta de los poly-tubos contra la vida larga y más cara de los ductos de material rígido. En mi experiencia, todos los tipos de materiales pueden trabajar para proveer un flujo uniforme de aire a través de las superficies de crecimiento de los hongos. La forma a lo largo del tubo La discusión sobre la forma del tubo debe incluir los conceptos de presión estática y presión de velocidad o “empuje”. Por simplicidad, presión estática es la presión dentro de un balón. La presión de velocidad o empuje, es el momento o movimiento del aire como se ve con una bandera ondeando en el viento. En un ducto, el empuje de velocidad es más observable al principio del ducto, donde el ventilador forza el aire hacia el ducto. Puede verse el efecto de velocidad alta al inicio de un ducto de poly-tubo especialmente si el primer metro de poly-tubo se mueve o es flexible. Cuando la superficie del polytubo no es firme como un balón, entonces no hay presión estática en ese punto a lo largo del ducto. Si no hay presión estática al principio del ducto (cualquier tipo de ducto), entonces habrá poco o ningún aire que salga de los primeros agujeros. El objetivo de cualquier ducto es tener un razonable balance de presión estática a lo largo del mismo, la cual ayudará a proveer flujo uniforme de aire dentro del cuarto. Si se tiene un medidor de presión estática, puede revisarse la presión del ducto en cuatro o cinco puntos a lo largo del él. Después de tener esas mediciones, se deberá calcular la presión promedio. Hay un problema con el ducto si los extremos de presión estática son más de 10% diferentes del promedio. El siguiente ejemplo ayuda a explicar lo que puede pasar y lo que debe hacerse para mejorar la situación. 129 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Un problema típico con ducto de poly-tubo es que hay mucho aire en la parte media de la nave o cuarto de crecimiento. Dos maneras de observar el problema, además de la presión estática mencionada arriba son: 1) el aire del primer agujero es muy lento y 2) El aire de los siguientes orificios no sale perpendicular al ducto. El momento del aire continúa cuando el aire sale del agujero y así el aire tiende a viajar en la misma dirección afuera del ducto como si fuera en el interior del mismo. Se puede pensar en este momento, como si un camión saliera de la autopista, el camión debe disminuir la velocidad para cambiar de dirección. El efecto en una planta de hongos sobre esta situación es mucho más aire circulando en el medio tercio del cuarto y muy poco aire se mueve en el final del cuarto, cerca de donde el ventilador está colocado. Las formas de balancear la presión estática incluyen la reducción cónica, en pasos o presionando el ducto. La reducción progresiva o en pasos a lo largo del tubo trata de ayudar a balancear la presión estática, de tal manera que el aire que sale de cada orificio es casi el mismo. Sin varios cambios en la sección transversal, la presión estática será muy alta en la parte final de ducto y muy baja al principio. El prensado es el más apropiado para un ducto de polytubo. Un ligero apretón, como un cincho alrededor de la cintura no reducirá la tasa de flujo total, pero puede ayudar a balancear la presión estática. Es posible que la conicidad de un ducto sea tan gradual que no haya suficiente disrupción de la velocidad de presión. El aplicar pasos a un ducto puede ser tanto con metal como con madera. Cada paso necesita ser suficientemente largo para restar algo de velocidad. El propósito de estos cambios en la sección transversal es interrumpir el flujo suave de aire dentro del ducto. La interrupción del flujo de aire causa que la presión de velocidad se convierta en presión estática y usted deberá aprender aquí que la presión estática es lo que se necesita a lo largo de todo el ducto. Diámetro del ducto o sección transversal El diámetro del ducto o la sección transversal necesita ser suficientemente grande para suministrar el volumen de aire que viene del ventilador. En general, un ducto que es “muy grande” no causará tantos problemas como un ducto que es muy pequeño. Como se menciona arriba, el flujo de aire en el interior de un ducto pequeño debe ser interrumpido para ayudar a balancear la presión estática a lo largo del ducto. Si la presión es relativamente uniforme a lo largo del ducto, la sección transversal es aceptable. Si un ducto es muy pequeño en su sección transversal, entonces la tasa de flujo total de aire del ventilador será reducida. También, un ducto que es muy pequeño para la tasa de flujo del ventilador (m3/seg, pie3/min) causará mucha variación en la presión estática. Si se desea incrementar la velocidad del ventilador o instalar un ventilador más grande, entonces, el área del ducto/diámetro también debe ser incrementada. Hay un criterio general para el diámetro de un ducto – una relación de 1.7 o mayor. He aquí el cálculo: tome el área de cada orificio o boquilla y multiplique por el número de orificios para obtener la suma del área de orificios. Luego calcule el área del ducto en las mismas unidades ya sea en cm2 o m2. Divida el área del ducto por la suma del área de orificios y el resultado debe ser mayor que 1.7 para una buena presión estática del ducto. 130 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Figura 6. Esquema de ventilación y relación de áreas recomendadas. Orificios, boquillas o chorros El aire sale del ducto a través de orificios, boquillas o chorros para ser aplicado en los champiñones. Por comparación, para residencias y oficinas hay difusores para que el aire salga por los ductos. En general, los orificios o boquillas controlan la velocidad del aire a la salida del ducto. Esta velocidad de salida es importante para la circulación efectiva del aire. La velocidad (m/s) necesita ser suficientemente rápida para que el aire de salida alcance la pared próxima suavemente. Si la velocidad es muy rápida, la corriente de aire golpea la pared y rebota. Si la velocidad de salida es muy baja, entonces la corriente de aire no alcanzará la pared y la circulación será limitada. Si hay orificios simples o ranuras, boquillas redondas o boquillas cónicas, el objetivo de este componente del sistema es simplemente dirigir el aire perpendicular al ducto. Yo he observado una variedad de mecanismos exitosos de salida, de tal manera que la elección de orificios o boquillas, o qué tipo de boquilla no es una elección que limite el éxito del sistema de aire. Número y tamaño de los orificios El número de orificios o boquillas depende de tres variables: la tasa de flujo del ventilador, el tamaño de cada orificio y la distancia hacia la pared. Uno de las estimaciones de diseño que se pueden considerar es el área total de los orificios. Se debe calcular el área de un orificio en cm2 y multiplicarlo por el número de orificios. Esta área total debe ser más grande que la sección transversal del ducto al final del ventilador. Si hay muy pocos orificios, entonces el ventilador se verá restringido, causando un uso excesivo de energía o acortando la vida del motor. Si hay muchos agujeros, la velocidad en cada agujero se verá reducida. Una baja velocidad desde un agujero será fácil de detectar porque el flujo de aire no alcanzará la pared. El objetivo de que el aire alcance la pared es para que el flujo golpee suavemente la pared y caiga sobre el pasillo a lo largo de la pared. Si el aire golpea la pared muy fuerte, el aire rebotará de ella causando una pobre circulación en el cuarto. Localización de los orificios Otra elección de diseño es dónde, sobre el ducto, se deben colocar los orificios o boquillas. Para un ducto rígido, de madera o metal, los orificios son generalmente colocados sobre los lados. Para un ducto de polytubo, los orificios se posicionan mejor justo arriba de la línea central. Una de mis más importantes preguntas es “tiene el ducto orificios en la parte de abajo y en los lados? ”. Los orificios en la parte de abajo del ducto dirigen el aire hacia abajo, y el flujo hacia abajo evita el retorno del aire ascendente que circula en el cuarto. Sí. Hay excepciones para cada regla, pero usualmente los 131 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus orificios abajo causarán una circulación pobre. Es relativamente fácil probar el efecto de los agujeros inferiores. Simplemente tape los agujeros inferiores y compare la circulación con y sin tapar. Esta comparación es mejor observada si se usan indicadores de flujo colocados sobre la superficie de crecimiento. Orificios con alerones Nosotros hicimos un experimento con un corte alternativo a los orificios en un tubo de polyducto. Esta alternativa también puede llamarse orificios en forma de “C”. Yo escuché de los orificios en forma de C de Jim Grant, en Irlanda. En lugar de cortar los agujeros como una letra “O” y entonces creando un hoyo limpio, totalmente redondo, el hoyo es cortado con la forma de una letra “C” la cual forma un alerón de polietileno que permanece pegado al ducto. El Dr. Grant había encontrado que al dejar un alerón de polyducto en cada hoyo había una mejoría en la dirección del aire que sale de esos hoyos. El alerón debe estar colocado en el sentido “río abajo” del flujo de cada orificio. La base para este simple, pero efectivo método de cortar los agujeros es como sigue: La curva redondeada del alerón será golpeada por la velocidad del aire que sale del ducto y la disrupción al flujo causará una velocidad de salida ligeramente más lenta. También, las líneas de flujo dentro del ducto serán perturbadas y consecuentemente, el flujo más lento tenderá a llenar el ducto completo con presión estática. Una presión estática más uniforme hará la dirección del chorro más perpendicular, y también las velocidades del chorro serán más uniformes. Nosotros realizamos un experimento simple para demostrar la extensión del mejoramiento de la dirección del aire que podría resultar de usar agujeros con forma de “C”. Usamos el mismo tamaño de ducto con el mismo ventilador, el mismo tamaño y el mismo número de orificios, y cambiando únicamente la forma de los orificios. Este experimento fue realizado en un cuarto abierto de laboratorio, en lugar de una nave de cultivo de hongos. El resultado mostró que SÍ, los alerones causaron un mejoramiento medible de dirección. Ideas para mejorar la situación de los ductos 1. Use indicadores de flujo (banderas) para observar las condiciones actuales y los cambios. El objetivo de la circulación del aire es mantener velocidades uniformes con dirección de flujo a través de las camas o charolas. 2. Si el problema es muy poco flujo de aire a través de los orificios cercanos al ventilador, entonces trate de interrumpir el flujo aproximadamente a 1/4 - 1/3 a lo largo del ducto. Comprima un poliducto, o inserte un tablero en un ducto rígido. O si es posible, cambie el ducto a un tamaño más grande. 3. Elimine hoyos colocados hacia abajo en un mismo ducto que tenga hoyos horizontales 4. Revise el control de velocidad del ventilador en relación al patrón de circulación en el cuarto. Hay una velocidad mínima para “llenar” el ducto y “aventar” el chorro de aire hacia la pared. Use indicadores de flujo para esta comparación 5. Para un ducto de poly-tubo, pruebe agujeros en forma de “C” El alerón debe estar colocado “rio abajo” de la dirección del flujo en cada hoyo. O use boquillas de plástico que dirijan el aire perpendicular al ducto. 132 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus INTERCAMBIO DE AIRE Dos valores más de diseño que son utilizados en las instalaciones de champiñón son el tiempo de intercambio de aire y la relación “aire/cama”. Estos valores pueden no ser fáciles de cambiar para una instalación ya existente, pero son útiles en el caso de nuevos diseños y para entender una situación dada. El intercambio de aire es la relación del volumen del cuarto con la tasa de flujo del ventilador – el resultado tiene unidades de tiempo (minutos). Por ejemplo, si las dimensiones del cuarto son 20 m de largo, 12 m de ancho y 4 m de altura, entonces, el volumen interior será de 960 m3 (20X12X4). Supóngase que el ventilador tiene una capacidad de suministro de 240 m3/min. Entonces el intercambio de aire es 960 m3 dividido por 240 m3/min, o sea 4 minutos. Ese valor de 4 min indicaría que, teóricamente, el aire en el cuarto es cambiado cada 4 minutos. Pero este valor calculado es solamente para fines de comparación y no dice que cada pequeña parte de aire que entra saldrá cuatro minutos más tarde. En términos del patrón de circulación, se desea un “tiempo de residencia” uniforme para el aire dentro del cuarto, de tal manera que haya un mínimo de “cortos circuitos” de aire, como también mínimos puntos muertos de aire. La relación “aire/cama” es un cálculo para fines de comparación. A continuación, la aritmética de base: tome el volumen del cuarto, como arriba, 20 x 12 x 4 = 960 m3. Luego sume el total de superficie en crecimiento, por ejemplo: 24 estantes X1.2 m de ancho X 18 m de largo = 518.4 m2. Por lo tanto, para este mismo ejemplo, la relación es 960 / 518.4 = 1.8 m3/m2. Este ejemplo numérico es más alto que el que algunas instalaciones antiguas puedan tener disponible. La ventaja de un valor más alto de la relación aire/cama es que el aire que atraviesa cada hongo es usualmente menos “viciado” lo que significa que hay más mezclado del aire en el cuarto. REFERENCIAS ASHRAE (1989) Fundamentals. American Society of Heating, Refrigeration, and Air Conditioning Engineers. Bowman GE (1987) Air Circulation in Mushroom Houses. Mushroom Journal 173: 151-153, & 169. Edwards RL (1978) Cultivation in Western Countries: Growing in Houses. In: The Biology and Cultivation of Edible Mushrooms. Academic Press, Inc. London. Lomax KM, Gottfried S, Lavelle H (1995) Air Flow Indicators for Mushroom Houses. Journal of Agricultural Engineering Research. 60, 43-48 133 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus XII. USOS DEL SUSTRATO DEGRADADO DE LOS HONGOS Danny Lee Rinker Department of Plant Agriculture. University of Guelph, 4890 Victoria Avenue, PO Box 7000 Vineland Station, ON L0R 2E0 CANADA. <[email protected]> RESUMEN En el mundo se cultivan varias especies de hongos comestibles. La producción global es de más de seis millones de toneladas y después de la cosecha, una cantidad similar de sustrato utilizado para su cultivo es desechada. El medio usado como sustrato está muy lejos de ser realmente degradado, ya que muchos usos benéficos están siendo actualmente implementados o evaluados internacionalmente. La mayoría de la literatura publicada en los países occidentales describe el uso del sustrato degradado de los hongos proveniente del cultivo de Agaricus bisporus (aunque menos del 40% del material degradado es de esta especie). El sustrato degradado de la producción de A. bisporus está actualmente en amplio uso en horticultura como componente en mezclas de suelo, en agricultura o comercio del paisaje para enriquecer el suelo, como cobertura para el cultivo del mismo champiñón, en vermicultura como medio de crecimiento, en humedales para remediación de agua contaminada, en la estabilización de varios tipos de suelo perturbados, en la bioremediación de suelos contaminados, como material para el piso en la crianza de animales, como alimento animal, y en el control de enfermedades de plantas. Este capítulo describe la utilidad del sustrato degradado de los hongos, así como también señala usos adicionales potenciales. Palabras clave: Hongos comestibles, champiñón, sustrato gastado, composta, abono orgánico, bioremediación. INTRODUCCION En la actualidad se cultivan muchas especies de hongos comestibles en el mundo. La producción global alcanzó alrededor de 6.2 millones de toneladas en 1997, con más de 12% de incremento anual de 1981 a 1997 (Chang 1999) y tiene un valor aproximado de al menos 14 billones de dólares americanos. Los hongos son producidos en materiales naturales tomados de la agricultura, de los bosques, de la ganadería, y de la industria manufacturera. El champiñón comercial Agaricus bisporus representó cerca de 32% de la producción mundial de hongos comestibles en 1997 (Chang 1999). El champiñón comercial es cultivado típicamente sobre un sustrato basado en rastrojo o heno, más estiércol y yeso. Estos materiales llevan inicialmente un proceso de composteo de dos fases, una a temperatura alta (arriba de 85°C) y otra de pasteurización y acondicionamiento (que empieza a 60°C y decrece a alrededor de 45°C). La etapa de colonización por el champiñón es seguida por la aplicación de cobertura sobre la superficie de la composta colonizada con una capa de turba, suelo, u otro material adecuado. En dos semanas, los hongos son visibles y listos para ser cosechados. Después de tres semanas de cosecha de champiñones, el material de considerado agotado. Después, usualmente se aplica un tratamiento térmico post cosecha, el material es removido y el cuarto queda listo para iniciar otro ciclo. Cada tonelada de hongo producido resulta en una o dos toneladas de material degradado residual seco. La pregunta importante en estos tiempos de recursos limitados, de responsabilidades ambientales y de preocupaciones sobre la salud humana, es “¿Qué uso o valor tienen estos materiales residuales de la producción de hongos comestibles? Este capítulo delínea las 135 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus características del sustrato degradado de la producción comercial del champiñón Agaricus bisporus, y su utilización en áreas de bioremediación, producción agrícola, re-uso en el cultivo de hongos y manejo de plagas. CARACTERÍSTICAS DEL SUSTRATO DEGRADADO El sustrato degradado de los hongos (SDH) puede ser descrito en términos de sus características físicas y químicas. Sus características en fresco pueden variar ligeramente de una ciclo de cultivo a otro y de una finca a otra, según los materiales utilizados (Chong et al. 1991c). Para el cultivo de champiñones, las compostas son preparadas de manera similar, físicamente, las compostas de hongos son altas en materia orgánica y fibra, son poco voluminosas y porosas y retienen humedad (Chen et al. 2007, Chong et al. 1991c, Lohr et al. 1984b). Químicamente, las compostas frescas tienen un amplio rango de nutrientes. Típicamente, el SDH fresco tiene un pH neutral o ligeramente alcalino, tiene exceso de sales debido a altas concentraciones de K, Ca, SO4, Cl y Na y en algunos casos NO3 y P y tienen un valor N-P-K de 1.8 – 0.6 – 2.2 (Beyer 2001, Chong et al. 1991c, Holcomb et al. 2005). La intemperización (exposición a la lluvia, la nieve y el sol) y el escurrimiento (irrigación forzada, a la intemperie, de SDH fresco) baja dramáticamente el contenido de sales a rangos aceptables para las plantas, incrementa el volumen aparente y decrece la porosidad. BIOREMEDIACION El SDH ha sido mezclado con otros materiales para remover compuestos malolientes del aire. Shojaosadati y Siamak (1999) mezclaron el SDH con concha molida de caracol y eliminaron exitosamente H2S. Algunos compuestos orgánicos volátiles han sido reducidos con mezclas de SDH y viruta (Mohseni et al. 1998, Mohseni y Allen 1999). Así mismo, Pecchia (pers. com. 2006) ha demostrado que al pasar el aire de salida de la fase I de composteo a través de una mezcla de SDH y viruta los olores característicos pueden ser reducidos significativamente. El sustrato degradado de los hongos ha sido usado exitosamente para tratar aguas contaminadas de minas de carbón (Anon. 1997, Dvorak et al. 1992, Stark et al. 1994), drenado ácido de minas, (Chang et al. 2000) ambientes de humedales (Karathanasis y Thompson 1990, Manyin et al. 1997, Stark y Williams 1994, Stark et al. 1995, Stark et al. 1996, Tarutis y Unz 1995, Vile y Wieder 1993 y Wieder 1993), aguas de mina contaminada con niquel (Hammack y Edenborn 1992) y aguas contaminadas con elementos radiactivos y metales pesados (Groudev et al. 1999). Las construcciones abandonadas de líneas de tubería comercial/industrial y los sitios de las minas son estabilizados exitosamente con vegetación usando SDH (Rupert 1995). El SDH tiene la capacidad de redistribuir zinc (Shuman 1999a, 1999b), cadmio y plomo (Shuman 1998) entre fracciones de suelo, disminuir la toxicidad al zinc (Shuman y Li 1997), degradar clorofenoles, hidrocarburos aromáticos policíclicos o monómeros aromáticos (Semple et al. 1995, Semple et al. 1998, Fermor et al. 2000, Staments 2001) e inhibir la nitrificación (Bazin et al. 1991). Los compuestos carbaryl, 1-naftol (Kuo y Regan 1992, 1999) y el carbamato (Kuo y Regan 1998, Regan 1994) son degradados por el SDH. PRODUCCION AGRICOLA La agricultura es el principal sitio para el reciclamiento del SDH a través de la producción de cultivos protegidos en invernaderos, vegetales en el campo, producción de frutas y cultivos agronómicos. 136 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus En los cultivos protegidos, el SDH ha sido utilizado en la producción de flores como el crisantemo (Rathier 1982), las lilas de pascua (Dallon 1987, White 1976a, d), las Helleborus (Richter et al. 1980), petunias (White 1976c) y las poinsettia (White 1976b). La industria de las verduras de invernadero evaluó su uso en la producción de transplantes vegetales (Lohr 1983, Lohr et al. 1984a, Lohr y Coffey 1987, Wang et al. 1984a), pepino (Celikel y Buyukalaca 1999c), tomates (Celikel y Tuncay 1999a, Rathier 1982, Steffen et al. 1994, 1995, Vavrina et al. 1996) y berenjenas (Celikel y Tuncay 1999b). La producción de verduras en campo se beneficia usando SDH. Numerosos cultivos de verduras han sido evaluados, incluyendo espárragos, hojas de betabel, coliflor, repollo, chiles, apio, pepino, lechuga, mostaza, cebollas, papas, rábanos, ejotes, espinacas, betabel azucarero y tomate (Abak y Gul 1994, Anon. 1979, Faassen et al. 1992, Kaddous y Morgans 1986, Maher 1994, Maher et al. 2000, Male 1981, Maynard 1989, 1991, 1994b, Nguyen et al. 1987, Pill et al. 1993, Ranganathan y Selvaseelan 1997a, Rhoads y Olson 1995, Selvi y Selvaseelan 1999, Sochtig y Grabbe 1995, Stephens et al. 1989, Stewart et al. 1998b, 1998c, Schwank 1985, Wang 1983, Wang et al. 1984). En la industria de las frutas, el SDH es aplicado como “mulch” a las ciruelas italianas (Robbins et al. 1986), manzanas (AntSaoir et al. 2000, Delver 1982, Delver y Wertheim 1988), plántulas de manzana (Koch, 1980), uvas (D. Beyer, pers. com.) y durazanos (M. Derkacz, pers. com.). Los cultivos agronomicos se benefician de la incorporación de SDH al suelo, alterando sus propiedades físicas y fisicoquímicas (Ranganathan y Selvaseelan 1997b). Estos cultivos incluyen el maíz (Weber et al. 1997, Wuest y Fahy 1991, Wuest et al. 1991, Wuest et al. 1995), el pasto y trigo (Maher 1994, Maher et al. 2000). También ha sido utilizado para mejorar el suelo del té (Manivel et al. 1994) y el frijol chino (Ranganathan y Selvaseelan 1994). En estos y otros cultivos es usado como fuente “orgánica” de nutrientes para la planta (Gerrits 1987b, Levanon y Danai 1997, Maher 1990, Maher et al. 2000, Pryce 1991, Ranganathan y Selvaseelan 1997c y Robinson 1988). En los viveros y en el comercio del paisaje el SDH es ampliamente utilizado como suelo para macetas, para follajes producidos en recipientes (Chong et al. 1987, Chong y Wickware 1989, Chong et al. 1990, 1991a,b,c,d,e, Chong y Hamersma 1996a, b, Chong y Rinker 1994a,b, Chong 1991, 1999, Devonald 1987, Eames 1977, Henny 1980, Holcomb et al. 2007, Poole y Conorer 1974, Raymond et al. 1998, Smith 1982) y también en la producción de follajes en el campo (Maynard 1994c). Mejora la calidad de las áreas verdes (Landschoot y McNitt 1994). RE-USO EN EL CULTIVO DE CHAMPIÑONES El sustrato degradado de los hongos es reciclado hacia la producción de champiñones como un material de cobertura exitoso. Para su uso se requiere que el contenido de sales sea disminuido, generalmente por intemperización, y que la consistencia sea modificada a través del composteo. Los reportes sobre su uso y experimentación por parte de varios autores incluyen comparaciones con turba y/o otros materiales locales (Eicker y van Greuning 1989, Garcha y Sekhon 1981, Happ II 1974, Nair 1976a, b, Nair y Bradley 1981, Seaby 1999, Shandilya 1989a, b, Singh et al. 1992, 2000, Stoller 1979), experimentos de escurrido (Riahi et al. 1998), su tratamiento con agentes quelantes (Sharma et al. 1999), recomposteo y escurrido (Szmidt 1994, Szmidt et al. 1995), manejo adecuado y uso (Kinrus 1976, Schisler y Wuest 1982, Wuest 1976) y su separación de la composta utilizada y reutilizarla como cobertura (Hesling 1981, Jablonsky y Srb 1989, Nair y Bradley 1981, Nair 1985). 137 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Experimentalmente, pero con aplicación futura, el SDH ha sido utilizado como fuente nutritiva para cultivar Agaricus bisporus (Rinker y Alm 1990, Schisler 1988, Till 1963, Royse et al. (en prensa)), Auricularia (Sharma y Jandaik 1994), Lentinula (Kilpatrick et al. 2000), Pleurotus (Mueller et al. 1984, Sharma y Jandaik 1994) y Volvariella (Poppe 2000). MANEJO DE PLAGAS Las compostas, en general, tienen numerosos productos exógenos con potencial para suprimir las poblaciones de insectos y plagas. En el manejo de insectos, el SDH ha sido evaluado contra poblaciones del escarabajo del Colorado de la papa (Stoner et al. 1996, Gent et al. 1998). La mayoría de los esfuerzos de investigación en el manejo de plagas con SDH son para el manejo de enfermedades. Como la agricultura orgánica se desarrolla, el SDH tiene potencial para proveer una alternativa orgánica para el manejo de insectos y enfermedades. Algunos investigadores han explorado el uso de SDH como una alternativa orgánica al bromuro de metilo en fresas (Sances e Ingham 1997), los efectos de los extractos acuosos o el sustrato en sí sobre la inhibición de enfermedad que causa la defoliación temprana del manzano (Yohalem et al. 1994, 1996, Cronin et al. 1996), en el damping-off y pudrición de la raíz de ciertos tipos de césped (Craft y Nelson 1996), sobre la enfermedad del tomate causada por Pythium (Reigner et al. 2001), sobre la enfermedad del champiñón causada por Verticillium (Guardino 1998, Labuschagne et al. 2007, Wuest et al. 1996), sobre el nematodo del nudo de la raíz Meloidogyne incognita (Kaul y Chhabra 1993, Verma 1986, 1993), sobre la necrosis de la hoja y el tallo del chile (Upadhyay 2000), sobre la presencia de Fusarium oxysporum en el clavel y la pudrición negra del pepino (Ebben 1980), en la supresión de enfermedades del pasto (Viji et al. 2000), sobre la muerte prematura de la papa causada por V. dahliae y P. penetrans (Gent et al. 1998, LaMondia et al. 1999, Elmer et al. 2007), sobre Rhizoctonia en pepino (Nguyen et al. 1987), sobre Fusarium en tomate (Harender et al. 1997) y sobre nemátodos predadores (Koning et al. 1996). El SDH está siendo fuerte y ampliamente promovido contra los hongos del género Sphaerobolus (Davis et al. 2005, Davis y Kuhns 2005). USOS MISCELÁNEOS Las ovejas (Wilson et al. 1983) y las carpas Cirrhina mirigala (Sehgal y Thomas 1987, Sehgal y Simmi 1991, Sehgal et al. 1993) han sido alimentadas con SDH. Este material también ha sido usado en biorreactores airlift para determinar los nutrientes disponibles para las plantas (Velthof et al. 1998), en fórmulas termoresistentes (Donnelly y Busta 1980), como un combustible alternativo (Maher et al. 2000), como material para el piso en la cría de puercos (Beattie et al. 2001, Durrel et al. 1997), en la recuperación de enzimas celulolíticas (Ball y Jackson 1995), en el monitoreo de nemátodos entomopatógenos (Richardson et al. 2000), como vehículo para la preparación de bioinoculantes (Bahl y Jauhri 1986, Bahl et al. 1989), en la producción de biogas (Tumwasorn et al. 1980, Fleming y MacAlpine 2007) y en vermicultura (Edwards et al. 1985). IMPACTO AMBIENTAL DE LA INTEMPERIZACION DEL SDH El SDH es frecuentemente distribuido sobre el suelo y dejado a la intemperie por varios años. Esto permite que las sales y nitratos escurran del material. Chefetz et al. (2000) reportan sobre las transformaciones de la materia orgánica durante el proceso de intemperización. El almacenaje y el manejo pueden impactar la calidad del agua del suelo (Guo y Chorover 2007, Maynard 1993a, b, 1994a, Kapland et al. 1995, Pannier 1993, Wuest 1992, Wuest y Fahy 1992, Wuest et al. 1991) y liberar sulfato-sulfuro, potasio, calcio, magnesio (Stewart et al. 2000) y nitrógeno inorgánico (Stewart et al. 1998). Debe haber efectos sobre superficies líquidas adyacentes (Reed y Keil 2000), calidad del aire (compuestos odorantes) (Bazemore et al. 2000, Heinemann et al. 2003) y sobre la salud (Cobb et al. 1995). 138 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus REFERENCIAS Abak K, Celikel G, Gul A (1994) Comparison of some Turkish originated organic and inorganic substrates for tomato soilless culture. Acta Horticulturae 366:423-427. Abdallah MMF, Emara MFZ, Mohammady TF (2000) Open field interplanting of oyster mushroom with cabbage and its effect on the subsequent eggplant crop. Annals of Agricultural Science Cairo 45(1):281293. Adamovi M, Grubi G, Milenkovi I, Jovanovi R, Proti R, Sretenovi L, Stoievi LJ (1998) The biodegradation of wheat straw by Pleurotus ostreatus mushrooms and its use in cattle feeding. Animal Feed Science Technology 71:357-362. Anon (1979) Vegetables. Canada - Smithfield Experimental Farm Research Report -1979. Agriculture Canada. Smithfield, Ontario, Canada. Anon (1985) Mushroom compost may cause problems when growing flowers. Greenhouse Manager May 1985:29-30. Anon (1997) Cleaning up rivers with mushroom compost. Biocycle 138(12):6. AntSaoir SM, Mansfield J, Webster AD (2000) The potential for spent mushroom compost as a mulch for weed control in Bramley orchards. Acta Horticulturae 525:427-429. Bahl N, Jauhri KS (1986) Spent compost as a carrier for bacterial inoculant production. In: Wuest PJ, Royse DJ, Beelman RB (eds). Proceedings of International Symposium on Scientific and Technical Aspects of Cultivating Edible Fungi The Penn State University. 63-68. Bahl N, Gupta M, Jauhri KS (1989) The development of high-quality inoculants from spent compost. Mushroom Science 12(1):427-431. Bakshi MPS, Gupta VK, Langar PN (1985) Acceptability and nutritive evaluation of Pleurotus harvested spent wheat straw in buffaloes. Agricultural Wastes 13:51-58. Ball AS, Jackson AM (1995) The recovery of lignocellulose-degrading enzymes from spent mushroom substrate. Bioresource Technology 54(3):311-314. Baskaran S, Bolan NS, Rahman A, Tillman RW (1996) Effect of exogenous carbon on the sorption and movement of atrazine and 2,4-D by soils. Australian Journal of Soil Research 34(4):609-622. Batista JG, Batista ERB, Mateus FF (2000) Effectiveness of two biodegradation methods on the physical characteristics of compost for horticultural purposes. Acta Horticulturae 517:293-302. Bazin MJ, Rutili A, Gaines A, Lynch JM (1991) Humic acid relieves pH-inhibition of nitrification in continuous-flow columns. FEMS Microbiology Ecology 85(1):9-14. Beattie VE, Sneddon IA, Walker N, Weatherup RN (2001) Environmental enrichment of intensive pig housing using spent mushroom compost. Animal Science 72:35-42. Beyer D (2001) Spent mushroom substrate. http://mushroomspawn.cas.psu.edu/Spent.htm (June 29, 2001). Bisaria R, Madan M (1984) Lignin degradation by an edible mushroom Pleurotus sajor-caju. Current Science (Bangalore) 53(6):322-323. Bisaria R, Madan M, Mukhopadhyay SN (1983) Production of biogas from residues from mushroom cultivation. Biotechnology Letters 5(12):811-812. Bisaria R, Vasudevan P, Bisaria VS (1990) Utilization of spent agro-residues from mushroom cultivation of biogas production. Applied Microbiology and Biotechnology 33(5):607-610. Braun A, Wolter M, Zadrazil F, Flachowsky G, Mba CC (2000) Bioconversion of wheat straw by Lentinus tuber regium and its potential utilization as food, medicine and animal feed. Mushroom Science 15(2):549-558. Buswell JA (1994) Potential of spent substrate for bioremediation purposes. Compost Science and Utilization 2(3):31-36. Calzada JF, Franco LF, de Arriola MC, Rolz C, Ortiz MA (1987a) Acceptability, body weight changes, and digestibility of spent wheat straw after harvesting of Pleurotus sajor-caju. Biological Wastes 22:303309. Calzada JF, de Porres E, de Leon R, Rolz C, Franco LF (1987b) Production of food and feed from wheat straw by Pleurotus sajor-caju. Mushroom Journal of the Tropics 7:45-46. Celikel G, Tuncay O (1999a) Effect of different substrates on yield and quality of tomato. Acta Horticulturae 491: 353-356. Celikel G, Tuncay O (1999b) Influence of re-using substrates on the yield and earliness of eggplant in soilless culture. Acta Horticulturae 491:357-362. 139 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Celikel G, Buyukalaca S (1999c) The effects of re-using substrates on the yield and earliness of cucumber on autumn growing period. Acta Horticulturae 492:259-264. Chang ST (1999) World production of cultivated edible and medicinal mushrooms in 1997 with emphasis on Lentinus edodes (Berk.) Sing. in China. International Journal of Medicinal Mushrooms 1:291-300. Chang ST, Miles PG (1989) Edible Mushrooms and their Cultivation. CRC Press. Florida. Chang IS, Shin PK, Kim BH, Chang IS, Chang PK, Shin PK, Kim BH (2000) Biological treatment of acid mine drainage under sulfate-reducing conditions with solid waste materials as substrate. Water Research 34(4):1269-1277. Chefetz B, van Heemst JDH, Chen Y, Romaine CP, Chorover J, Rosario R, Guo M, Hatcher PG (2000) Organic matter transformations during the weathering process of spent mushroom substrate. Journal of Environmental Quality 29(2):592-602. Chen J, Zhou T, Tsao R, Yang R, Tang B, Shen H (2007) Characterization of the nutritive values and reutilization of spent mushroom substrate (SMS). Proceedings: 2nd International Spent Mushroom Substrate Symposium, September 17-20, 2006, Concordville, PA, 44-82. Chiu SW, Ching ML, Fong KL, Moore D (1998) Spent oyster mushroom substrate performs better than many mushroom mycelia in removing the biocide pentachlorophenol. Mycological Research 102(12):1553-1562. Chong C (1991) Recycling spent mushroom compost in growing media. Landscape Trades 13(3):6-8. Chong C (1999) Experiences with the utilization of wastes in nursery potting mixes and as field soil amendments. Canadian Journal of Plant Science 79:139-148. Chong C, Hamersma B (1996a) Container growing with spent mushroom compost. Landscape Trades 18(6):10-13. Chong C, Hamersma B (1996b) Using spent mushroom compost as a container substrate. American Nurseryman 184(11):63-66. Chong C, Rinker DL (1994a) Use of spent mushroom substrates for growing containerized woody ornamentals: An overview. Compost Science and Utilization 2(3):45-53. Chong C, Rinker DL (1994b) Bark- and peat-amended spent mushroom compost for container culture of shrubs. HortScience 29(7):781-784. Chong C, Wickware M (1989) Mushroom compost trial at Canavonda Nursery. Horticulture Review 7(6):1011, 13. Chong C, Cline RA, Rinker DL (1991a) Organic wastes as growing media. Proceedings of International Plant Propagators Society 41:399-403. Chong C, Cline RA, Rinker DL (1991b) Growth and mineral nutrient status of containerized woody species in media amended with spent mushroom compost. Journal of American Society of Horticultural Science 116(2):242-247. Chong C, Rinker DL, Cline RA (1991c) A comparison of five spent mushroom composts for container culture of ornamental shrubs. Mushroom Science 13(2):637-64. Chong C, Rinker DL, Cline RA (1991d) Spent mushroom compost re-utilized in ornamental crop culture. Mushroom World 2(2):51-52. Chong C, Cline RA, Rinker DL, Hamersma RA (1991e) An overview of reutilization of spent mushroom compost in nursery container culture. Landscape Trades 13(11):14-18. Chong C, Cline RA, Koole M (1990) Research Report: Container media compared in trial at Brucedale. Landscape Trades 12(5):13-14, 16. Chong C, Cline RA, Rinker DL (1987) Spent mushroom compost and papermill sludge as soil amendments for containerized nursery crops. Proceedings of International Plant Propagators Society 37:347-353. Cobb N, Sullivan PS, Etzel RA (1995) Pilot study of health complaints associated with commercial processing of mushroom compost in southeastern Pennsylvania. Journal of Agromedicine 2(2):13-25. Craft CM, Nelson EB (1996) Microbial properties of composts that suppress damping-off and root rot of creeping bentgrass caused by Pythium graminicola. Applied and Environmental Microbiology 62(5):1550-1557. Cronin MJ, Yohalem DS, Harris RF, Andrews JH (1996) Putative mechanism and dynamics of inhibition of the apple scab pathogen, Venturia inaequalis, by compost extracts. Soil Biology and Biochemistry 28(9):1241-1249. D’Annibale A, Crestini C, Vinciguerra V, Sermanni GG (1998) The biodegradation of recalcitrant effluents from an olive mill by a white rot fungus. Journal of Biotechnology 61(3):209-218. 140 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Dallon J Jr (1987) Effects of spent mushroom compost on the production of greenhouse-grown crops. International Plant Propagators Society 37:323-329. Davis DD, Kuhns LJ (2005) Spent mushroom substrate (SMS) suppresses artillery fungi in landscape mulch. Mushroom News 55(10):10-13. Davis DD, Kuhns LJ, Harpster TL (2005) Use of mushroom compost to suppress artillery fungi. Journal of Environmental Horticulture 23(4):212-215. Delver P (1982) Trickle irrigation in a humid climate. Compact Fruit Tree 15:104-118. Delver P Wertheim SJ (1988) Promotion and early growth and cropping of apple by trickle irrigation and planting-hole treatments. Gartenbauwissenschaft 53(3):128-132. Devonald VG (1987) Spent mushroom compost: a possible growing medium ingredient? In: de Bertoldi M, Ferranti MP, Hermite PL,’ Zucconi F (eds). Compost: Production, Quality and Use Elsever Applied Science, New York. Donnelly LS, Busta FF (1980) Heat resistance of Desulfotomaculum nigrificans spores in soy protein infant formula preparations. Applied and Environmental Microbiology 40(4):721-725. Dundar O, Paksoy M, Abak K, Gomez-Guillamon ML (1995) Quality changes during cold storage of tomato fruits grown in different substrates. Acta Horticulturae 412:193-199. Durrell J, Sneddon IA, Beattie VE (1997) Effects of enrichment and floor type on behaviour of cubicle loosehoused dry sows. Animal Welfare 6(4):297-308. Dvorak DH, Hedin RS, Edenborn HM, McIntire PE (1992) Treatment of metal-contaminated water using bacterial sulfate reduction. Results from pilot-scale reactors. Biotechnology and Bioengineering 40(5):609-616. Eames AG (1977) Could spent mushroom compost be used for container shrubs? Mushroom Journal 52:114. Ebben MH (1980) Management and control of soil-borne pathogens in glasshouse soils. Report: Welsh Soils Discussion Group 21:29-40. Edwards CA, Burrows I, Fletcher KE, Jones BA (1985) The use of earthworms for composting farm wastes. 229-242. In: J.K.R. Gasser (ed). Composting of agricultural and other wastes. Elsevier Applied Science Publishers, London. Eggen T (1999) Application of fungal substrate from commercial mushroom production - Pleurotus ostreatus - for bioremediation of creosote contaminated soil. International Biodeterioration and Biodegradation 44(2-3):117-126. Eicker A, van Greuning M (1989) Economical alternatives for topogenous peat as casing material in the cultivation of Agaricus bisporus in South Africa. South African Journal of Plant and Soil 6(2):129-135. Elmer WH, Gent MPN, LaMondia JA, Ferrandino FJ, Stoner KA (2007) Root nutrition, rhizobacteria, and the early dying disease of potato as affected by spent mushroom compost, straw mulch, and fumigation. Proceedings: 2nd International Spent Mushroom Substrate Symposium, September 17-20, 2006, Concordville, PA, 2-14. Faassen van HG, Leggink G, Van Faassen HG, Meulenbroek JL (1992) Nitrogen cycling in high input versus reduced-input arable farming. Agriculture and Environment in Eastern Europe and the Netherlands: proceeding 86-105. Fermor T, Watts N, Duncombe T, Brooks R, McCarthy A, Semple K. Reid B (2000) Bioremediation: use of composts and composting technologies. Mushroom Science 15:833-839. Flick M (1981) Using spent mushroom compost for growing other edible fungi. Champignon 244:22-26. Fleming R, MacAlpine M (2007) Feasibility of processing spent mushroom substrate to recover additional value. Mushroom News 54(11):6-17. Garcha HS, Sekhon A (1981) Evaluating casing materials for mushroom culture in Punjab (India). Mushroom Science 11(1):411-417. Gent MPN, Elmer WH, Stoner KA, Fernando FJ, LaMondia JA (1998) Growth, yield and mushroom nutrition of potato in fumigated or non-fumigated soil amended with spent mushroom compost and straw mulch. Compost Science and Utilization 6(4):45-56. Gent MPN, LaMondia JA, Ferrandino FJ, Elmer WH, Stoner KA (1999) The influence of compost amendment or straw mulch on the reduction of gas exchange in potato by Verticillium dahliae and Pratylenchus penetrans. Plant Disease 83(4):371-376. Gerrits JPG (1997a) Ringonderzoek Champost 1996. De Champignoncultuur 41(3):99-101. Gerrits JPG (1997b) Compost for mushroom production and its subsequent use for soil improvement. In: de Bertoldi M, Ferranti MP, L’Hermite P, Zucconi F (eds). Compost: Production, Quality and Use Elsever Applied Science, New York. 141 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Groudev SN, Bratcova SG, Komnitsas K (1999) Treatment of waters polluted with radioactive elements and heavy metals by means of a laboratory passive system. Mineral Engineering 12(3):261-270. Guardino JW (1998) The performance, microbiology and disease suppressive nature of spent mushroom substrate used as a casing for the production of the button mushroom Agaricus bisporus. MSc Thesis. The Pennsylvania State University, University Park, PA 16802. Guleria DS, Agarwala RK, Jandaik CL (1989) Effect of different compost and casing formulations on yield of different strains of Agaricus bitorquis. Mushroom Science 12(1):401-407. Guo M, Chorover J (2007) Field weathering of spent mushroom substrate: environmental impacts. Proceedings 2nd International Spent Mushroom Substrate Symposium, September 17-20, 2006, Concordville, PA. 16-40. Hammack RW, Edenborn HM (1992) The removal of nickel from mine waters using bacterial sulfate reduction. Applied Microbiology and Biotechnology 37(5):674-678. Happ AC II (1974) Yield of Agaricus bisporus (Lange) Imbach and occurrence of Verticillium disease as influenced by aerated steam treatment of peat moss, spent compost, or loam soil. MSc Thesis. The Pennsylvania State University, University Park, PA 16802. Harender Raj, Kapoor IJ, Raj H (1997) Possible management of Fusarium wilt of tomato by soil amendments with composts. Indian Phytopathology 50(3):387-395. Heinemann PH, Preti G, Wysocki CJ, Graves RE, Walker SP, Beyer DM, Holcomb EJ, Heuser CW, Miller FC (2003) In-vessel processing of spent mushroom substrate for odor control. Applied Engineering for Agriculture 19(4):461-471. Henny BK (1980) Production of six foliage crops in spent mushroom compost potting mixes. Proceedings of the Florida State Horticultural Society 92:330-332. Hesling JJ (1981) Separating spawn-run casing from compost. The Mushroom Journal 100:141-142. Hibbett DS, Thorn RG (1994) Nematode-trapping in Pleurotus tuberregium. Mycologia 86(5):696-699. Holcomb EJ, Heuser C, Heinemann P (2007) Recycled leachate from fresh spent mushroom compost for greenhouse and nursery crops. Mushroom News 55(5):4-10. Holcomb EJ, Heuser C, Heinemann P, Miller F (2005) Nutrient changes in spent mushroom substrate during composting. Mushroom News 53(11): 6-11. Huang JW (1997) Prospects for use of agricultural wastes for control of crop diseases. In: C.T. Lo and L.Y. Cho (eds.) Proceeding of a Symposium on New Techniques for Plant Protection. Taiwan Agricultural Research Institute Special Publication No. 57. 151-157. Huang JW, Huang HC (2000) A formulated container medium suppressive to Rhizoctonia damping-off of cabbage. Botanical Bulletin. Academia Sinica 41:49-56. Iiyama K, Lam TBT, Stone B, Perrin PS, Macauley B (1995) Compositional changes in composts during composting and mushroom growth: comparison of conventional and environmentally controlled composts from commercial farms. Compost Science and Utilization 3(3):14-21. International Organic Solutions Corporation (1996) Sewage and contamination remediation and materials for effecting same. US Patent 5531898, 2 Jul 1996. Jablonsky I, Srb A (1989) Recycled casing soil in the culture of Agaricus bisporus. Mushroom Science 12(1):433-443. Kaddous, Morgans (1986) Spent mushroom compost and deep litter fowl manure as a soil ameliorant for vegetables. Surface Soil Management. Proceedings New Zealand Society of Soil Science- Australian Society of Soil Science, Joint Conference, November 1986, Rotorua, New Zealand, 138-147. Kakkar VK, Dhanda S (1998) Comparative evaluation of wheat and paddy straws for mushroom production and feeding residual straws to ruminants. Bioresource Technology 66(2):175-177. Kakkar VK, Garach HS, Dhanda S, Makkar GS (1990) Mushroom harvested spent straw as feed for buffaloes. Indian Journal of Animal Nutrition 7:267-272. Kaplan LA, Standley LJ, Newbold JD (1995) Impact of water quality of high and low density applications of spent mushroom substrate to agriculture lands. Compost Science and Utilization 3(1):55-63. Karathanasis AD, Thompson YL (1990) Metal speciation and immobilization reactions affecting the true efficiency of artificial wetlands to treat acid mine drainage. Research Report No. 175. 120. Available from National Technical Information Service, Springfield, VA 22161 as PB91-107300/AS. Kaul VK, Chhabra HK. Control of Meloidogyne incognita by incorporation of organic wastes. Plant Disease Research 8:35-41. Kilpatrick M, Murray DJ, Ward F (2000) Influence of substrate formulation and autoclave treatment on Lentinula edodes production. Mushroom Science 15:803-810. 142 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Kim HK, Lee HD, Kim YG, Han GH, Moon CS, Kim HG (1998) Studies on the development of casing materials using sawdust bottle culture in cultivated mushroom, Agaricus bisporus. The Korean Journal of Mycology 26(1):51-55. Kim HK, Lee HD, Kim YG, Kim HG (1999) Studies on mushroom cultivation using spent sawdust substrate. Research Report of Chung-Nam Provincial Rural Development Administration. Kinrus A (1976) The advantages and disadvantages of re-using spent compost as a casing soil. Mushroom News 24(10):5,8. Koch BL (1980) Influence of a compost-peat mixture on the establishment of apple seedlings. Goodfruit Grower 31(18):11, 14-15. Kleyn JG, Wetzler TF (1981) The microbiology of spent mushroom compost and its dust. Canadian Journal of Microbiology 27(8):748-753. Koning G, Hamman B, Eicker A (1996) The efficacy of nematophagous fungi on predaceous nematodes in soil compared with saprophagous nematodes in mushroom compost. South African Journal of Botany 62(1):49-53. Kuo WS, Regan RW (1992) Degradation of carbaryl and 1-naphthol by spent mushroom compost microorganisms. Water Science and Technology 26(9-11):2081-2084. Kuo WS, Regan RW (1998) Aerobic carbamate bioremediation aided by compost residuals from the mushroom industry: Laboratory Studies. Compost Science and Utilization 6(1):19-29. Kuo WS, Regan RW (1999) Removal of pesticides from rinsate by adsorption using agricultural residuals as medium. Journal of Environmental Science and Health: Part B-Pesticides Food Contaminants and Agricultural Wastes 34(3):431-447. Labuschagne PM, Beyer DM, Wuest PJ (2000) Suppressive nature of spent mushroom substrate in controlling Verticillium disease of mushrooms. http://www.agro.nl/pc/isms/posters/pos57.htm (Aug 8, 2000). Labuschagne PM, Beyer DM, Wuest PJ (2007) Suppressive nature of spent mushroom substrate in controlling Verticillium disease of Agaricus bisporus mushrooms. Proceedings: 2nd International Spent Mushroom Substrate Symposium , September 17-20, 2006, Concordville, PA, 68-82. LaMondia JA, Gent MPN, Ferrandino FJ, Elmer WH (1999) Effect of compost amendment or straw mulch on potato early dying disease. Plant Disease 83(4):361-366. Landschoot P, McNitt A (1994) Improving turf with compost. Biocycle 35(10):54-57. Lemnaire F, Dartinques A, Rivière LM (1985) Properties of substrate made with spent mushroom compost. Acta Horticulture 172:13-29. Levanon D, Danai O (1995) Chemical, physical and microbiological considerations in recycling spent mushroom substrate. Compost Science and Utilization 3(1):72-73. Levanon D, Danai O (1997) Recycling agricultural residuals in Israel. Biocycle 38(6):56-57. Lin CH (1993) A study on preparation of composts from used compost. Bulletin of Taichung District Agricultural Improvement Station 39:17-27. Lin TC, Chuen SH (1993) Utilization of waste mushroom compost for tomato production. Bulletin of Taichung District Agricultural Improvement Station 40:37-44. Lin GZ, Kim CD, Ra CS, Sim TS, Oh TS, Shin JS, Hong BJ (1998a) Characteristics of waste sawdust after shiitake culture (WSSC) and potential of using WSSC for the treatment of rice straw to improve the feed value. Korean Journal of Animal Nutrition and Feedstuffs 22(4):229-236. Lin GZ, Ra CS, Kil JM, Kim BW, Kweon UG, Shin JS, Hong BJ (1998b) Effects of aerobic treatment using shiitake culture on degradation characteristics of rice straw in the rumen. Korean Journal of Animal Science 40(4):381-390. Lohr VI (1983) Spent mushroom compost: its physical and chemical characteristics and its use in soilless growth media for the production of vegetable transplants. Ph.D. Thesis. The University of Tennessee. Knoxville, Tennessee. Lohr VI, Coffey DL (1987) Growth responses of seedlings to various rates of fresh and aged spent mushroom compost. HortScience 22(5):913-915. Lohr VI, O’Brien RG, Coffey DL (1984a) Spent mushroom compost in soilless media and its effects on the yield and quality of transplants. Journal of American Society for Horticultural Science 109(5):693-697. Lohr VI, Wang SH, Wolt JD (1984b) Physical and chemical characteristics of fresh and aged spent mushroom compost. HortScience 19(5):681-683. Mann NS, Kumar N, Dahiya DVS, Khatta VK (1994) Effect of Coprinus fimetarius on urea treated crop residues and its utilization by goats. Indian Journal of Animal Sciences 64(10):1086-1091. 143 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Maher MJ (1990) The value of spent mushroom compost as an organic manure. Proceedings of the 8th National Mushroom Conference, October 11, 1990. TEAGASC, Agriculture and Food Development Authority, Kinsealy Research Centre, Malahide Road, Dublin 17. Maher MJ (1991) Spent mushroom compost (SMC) as a nutrient source in peat based potting substrates. Mushroom Science 13(2):645-60. Maher MJ (1994) Use of spent mushroom substrate (SMS) as an organic manure and plant substrate component. Compost Science and Utilization 2(3):37-44. Maher MJ, Smyth S, Dodd VA, McCabe T, Magette WL, Duggan J, Hennerty MJ (2000) Managing spent mushroom compost. Project 4444. Teagasc, Kinsealy Research Centre, Malahide Road, Dublin 17. Male RT (1981) The use of spent mushroom compost in vegetable production. Mushroom Science 11(1):111121. Manivel L, Kumar RR, Marimuthu S, Raj-Kumar R (1994) Spent mushroom compost as an amendment in tea. Planters’ Chronicle February 1994: 69-72. Manyin T, Williams FM, Stark LR (1997) Effects of iron concentration and flow rate on treatment of coal mine drainage in wetland mesocosms: An experimental approach to sizing of constructed wetlands. Ecological Engineering 9(3-4):171-185. Martirani L, Giardina P, Marzullo L, Sannia G (1996) Reduction of phenol content and toxicity in olive oil mill waste waters with the ligniolytic fungus Pleurotus ostreatus. Water Research 30(8):1914-1918. Maynard AA (1989) Agricultural composts as amendments reduce nitrate leaching from soil. Frontiers of Plant Science 42(1):2-4. Maynard AA (1991) Intensive vegetable production using compost animal manures. Bulletin Connecticut Agricultural Experiment Station No. 894. Maynard AA (1993a) Nitrate leaching from compost amended soils. Compost Science and Utilization 1(2):65-72. Maynard AA (1993b) Compost impact on ground water. Biocycle 34(4):76. Maynard AA (1994a) Protecting groundwater while recycling nutrients. Biocycle 35(5):40. Maynard AA (1994b) Sustained vegetable production for three years using composted animal manures. Compost Science and Utilization 2(1):88-96. Maynard AA (1994c) Effect of annual amendments of compost on nitrate leaching in nursery stock. Compost Science and Utilization 2(3):54-55. Mehta V, Gupta JK, Kaushal SC (1990) Cultivation of Pleurotus florida mushroom on rice straw and biogas production from the spent straw. World Journal of Microbiology and Biotechnology 6:366-370. Mohseni M, Allen DG (1999) Transient performance of biofilters treating mixtures of hydrophilic and hydrophobic volatile organic compounds. Journal of the Air and Waste Management Association 49:1434-1441. Mohseni M, Allen DG, Nichols KM (1998) Biofiltration of alpha - pinene and its application to the treatment of pulp and paper air emission. TAPPI Journal 81(8):205-211. Mueller JC, Gawley JR, Hayes WA (1984) Utilization of spent alder compost as a substrate for cultivation of Pleurotus sajor-caju. Mushroom News for the Tropics 5(2):3-7. Nakaya M, Yoneyama S, Kato Y, Harada A (2000) Recycling of cultural waste of Pleurotus cornucopiae for cultivation of P. cornucopiae and P. ostreatus. http://www.agro.nl/pc/isms/posters/pos169.htm (August 16, 2000). Nair NG (1976a) Studies on recycling spent compost for mushroom cultivation. Australian Journal of Agricultural Research 27:857-865. Nair T (1976b) Recycling spent compost for mushrooms. Agricultural Gazette of New South Wales. 87(1):10-12. Nair T (1985) The regeneration of spent peat moss. The Mushroom Journal 143:28-33. Nair NG, Bradley JK (1981) Recycling waste plant products as casing materials in mushroom culture. Mushroom Science 11(1):147-152. Nguyen HH, Teplíková J, Dobrá M, Stanék M (1987) Effect of substrates for the cultivation of mushrooms on the growth of cucumber, rhizospheric microorganisms and fall caused by Rhizoctonia solani. Environmental Microbiology 32(6):503. Pannier W (1993) Spent mushroom compost - a natural resource that provides solutions to environmental problems. Mushroom News 41(11): 10-11. Pauli G (1999) Earthworms, Mushrooms and Zero Waste in China. Biocycle 40(2):68-69. 144 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Permana IG (1990) The Evaluation of Nutritive Value of Sugarcane Bagasse as Ruminant Feed. Diploma work. Bogor Agricultural University. Bogor, Indonesia. Permana IG, Flachowsky G, ter Meulen U, Zadrazil F (2000) Use of sugarcane bagasse for mushroom and animal feed production. Mushroom Science 15(1):385-390. Pill WG, Evans TA, Garrison SA (1993) Forcing white asparagus in various substrates under cool and warm regimes. HortScience 28(10):996-998. Poole RT, Conorer CA (1974) Spent compost: a possible ingredient of potting soil. Florida Foliage Grower 11(7):7. Poppe J (1995) Cultivation of Edible Mushrooms on Tropical Agricultural Wastes. Biennial Training Course, ABOS &VLIR, University Gent. Poppe J (2000) Use of agricultural waste materials in the cultivation of mushrooms. Mushroom Science 15(1):3-22. Platt MW, Chet I, Henis Y (1981) Lignocellulose degradation during growth of the mushroom Pleurotus sp. “Florida” on cotton straw waste. European Journal of Applied Microbiology and Biotechnology 13(3):194-195. Pryce S (1991) Alternatives to peat. Plantsman 13(2):75-93. Quimio TH (1988) Continuous recycling of rice straw in mushroom cultivation for animal feed. 595-602. In: S.T. Chang, K. Chan, and N.Y.S. Woo (eds). Recent Advances in Biotechnology and Applied Microbiology Chinese University Press, Hongkong. Quimio TH, Chang ST, Royse DJ (1990) Utilization of spent mushroom compost. 131-134. In: Technical guidelines for mushroom growing in the tropics. FAO Plant Production and Protection Paper 106. FAO, Via delle Terme di Caracalla, 00100 Rome, Italy. Ranganathan DS, Selvaseelan DA (1994) Residual effect of mushroom spent rice straw compost on yield and nutrient uptake in green gram. Madras Agricultural Journal 81(9):478-480. Ranganathan DS, Selvaseelan DA (1997a) Effect of mushroom spent compost in combination with fertilizer application on nutrient uptake by potato in an Ultic Tropudalf. Journal of the Indian Society of Soil Science 45(3):515-519. Ranganathan DS, Selvaseelan DA (1997b) Effect of mushroom spent rice straw compost on soil physical and physico-chemical properties of alluvial and laterite. Madras Agricultural Journal 84(1):15-19. Ranganathan DS, Selvaseelan DA (1997c) Mushroom spent rice straw compost and composted coir pith as organic manures for rice. Journal of the Indian Society of Soil Science 45(3):510-514. Rathier TM (1982) Spent mushroom compost for greenhouse crops: Chrysanthemums, tomatoes and marigolds. Connecticut Greenhouse Newsletter 109:1-6. Raymond DA, Chong C, Varoney RP (1998) Response of four container grown woody ornamentals to immature composted media derived from waxed corrugated cardboard. Compost Science and Utilization 6(2):67-74. Raymond DA, Varoney RP, Chong C (1997) Characteristics of composts derived from waxed corrugated cardboard. Compost Science and Utilization 5(3):60-70. Reed W, KeilC (2000) The effect of spent mushroom substrate land applications on adjacent surface water using aquatic macroinvertebrates as bio-indicators. Mushroom News 48(11):4-13. Regan RW Sr (1994) Use of SMS as a compost matrix to degrade pesticide residuals. Compost Science and Utilization 2(3):56-92. Reigner M, McVoy M, Holcomb EJ, Romaine CP (2001) Evaluation of a SMS-based potting medium for plant growth and disease control. Research Progress Report. The Pennsylvania State University, University Park, PA 16802 (January 24, 2001). Rhoads FM, Olson SM (1995) Crop production with mushroom compost. Soil and Crop Science Society of Florida Proceedings. 54(0):53-57. Riahi H, Azizi N (2007) Leached SMC as a component and replacement for peat in casing soil and increasing dry matter in mushrooms. Proceedings: 2nd International Spent Mushroom Substrate Symposium, September 17-20, 2006, Concordville, PA, 41-45. Riahi H, Afagh HV, Sheidai M (1998) The first report of spent mushroom compost (SMC) leaching from Iran. 999 Acta Horticulture 469:473-480. Richardson PN, Keane GJ, Willmont DM, Long SJ, James BI (2000) Monitoring the fate of entomopathogenic nematodes by detecting their symbiotic bacteria. Proceedings of The British Crop Protection Conference- Pests and Diseases (November 13-16, 2000) 3:1019-1024. 145 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Richter P, Mugge A, Kieker W, Kubitz K (1980) Helleborus - a cut flower with a low energy demand, but with special site requirements. Gartenbau 27(12):372-373. Rinker DL, Alm G (1990) Cultivation of commercial mushrooms on spent compost. 27-28 In: Abstracts in Horticultual Research in Canada- 1990. Canadian Horticultural Council. Robbins SH, Righetti TL, Fallahi E, Dixon AR, Chaplin MH (1986) Influence of trenching, soil amendments, and mulching on the mineral content, growth, yield and quality of “Italian” prunes. Communications in Soil Science and Plant Analysis 17(5):457-471. Robinson EC (1988) Fertilizer and method. United States Patent, US 4,743,287, 9. Royse DJ (1993) Recycling of spent shiitake substrate for production of the oyster mushroom (Pleurotus sajor-caju). Mushroom News 41(2):14-20. Royse DJ (1996) Specialty Mushrooms. In: J. Janick (ed). Progress in new crops. ASHS Press, Arlington, VA 464-475. Royse DJ, Sanchez JE, Beelman RB, Davidson J (2007) Re-supplementing and re-casing mushroom (Agaricus bisporus) compost for a second crop. World Journal of Microbiology and Biotechnology (in press). Rupert DR (1995) Use of spent mushroom substrate in stabilizing disturbed and commercial sites. Compost Science and Utilization 3(1):80-83. Sances FV, Ingham ER (1997) Conventional and organic alternatives to methyl bromide on California strawberries. Compost Science and Utilization 5(2):23-27. Schisler LC (1988) Why mushroom production declines with each successive break and the production of a second crop of Agaricus mushrooms on spent compost. Mushroom News 36(9):6-11. Schisler LC, Wuest PJ (1982) Selecting, Manipulating, and Treating Mushroom Casing. In: Wuest PJ, Bengtson GD (eds). Penn State Handbook for Commercial Mushroom Growers. The Pennsylvania State University, University Park, PA. 55. Schwank J (1985) Is spent mushroom compost a good soil amendment? Perennial Plants 3(4):6-7. Seaby D (1999) The influence on yield of mushrooms (Agaricus bisporus) on the casing layer pore space volume and ease of water uptake. Compost Science and Utilization 7(4):56-65. Sehgal HS, Simmi S (1991) Efficacy of two new supplementary diets for an Indian major carp, Cirrhina mirigala: effects on flesh composition. Journal of Aguaculture in the Tropics 6:1, 25-33. Sehgal HS, ThomasJ (1987) Efficacy of two new supplementary diets for an Indian major carp, Cirrhina mirigala: effects on flesh composition. Biological Wastes 21(3):179-188. Sehgal HS, Simmi S, Sharma D (1993) A note on evaluation of some wastes and by-products from agriculture and animal husbandry as feed ingredients for Cirrhina mirigala (Ham.) Bioresource Technology 44(1):911. Selvi D, Selvaseelan DA (1999) Efficacy of mushroom spent rice straw compost as an organic manure substitute on the tuber yield of potato and nutrient availability in laterite soils of Nilgiris. South Indian Horticulture 47:1-6, 73-76. Semple KT, Fermor TR (1995) The bioremediation of xenobiotic-contamination by composts and associated microflora. Mushroom Science 14(2):917-924. Semple KT, Watts NU, Fermor TR (1998) Factors affecting the mineralization of (U 14C) benzene in spent mushroom substrate. FEMS Microbiology Letters 164(2):317-321. Sevilla CC, Mojica RE, Quimio TH (1989) Feeding value of spent mushroom (Volvariella volvacea Bull.) substrate-based diet in sheep. Recent advances in animal nutrition in Australia-1989. 1989, 22A. Shandilya TR (1989a) Studies on casing soil media during the cultivation of Agaricus bisporus. Mushroom Science 12(1):387-400. Shandilya TR (1989b) Mushroom compost and casing research in India. Mushroom Science 12(2):743-752 Sharma VP, Jandaik CL (1985) Studies on recycling of Pleurotus waste. Mushroom Journal for the Tropics 6(2):13-15. Sharma VP, Jandaik CL (1992) Recycling of mushroom industry waste for growing Pleurotus sajor-caju and Auricularia polytricha. Indian Journal of Mycology and Plant Pathology. 22(2):182-186. Sharma VP, Jandaik CL (1994) Recycling of spent compost for growing Auricularia polytricha and Pleurotus species. Mushroom Information 10/11:15-20. Sharma HSS, Furlan A, Lyons G (1999) Comparative assessment of chelated spent mushroom substrate as casing material for the production of Agaricus bisporus. Applied Microbiology and Biotechnology 53(3):366-372. 146 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Shojaosadati SA, Siamak E (1999) Removal of hydrogen sulfide by the compost biofilter with sludge of leather industry. Resources, Conservation and Recycling 27(1-2):139-144. Shuman LM (1998) Effect of organic waste amendments on cadmium and lead in soil fractions of two soils. Communications in Soil Science and Plant Analysis 29(19-20):2939-2952. Shuman LM (1999a) Organic waste amendments effects on zinc fractions of two soils. Journal of Environmental Quality 28(5):1442-1447. Shuman LM (1999b) Effect of organic waste amendments on zinc fractions of two soils. Soil Science 164(3):197-205. Shuman LM, Li Z (1997) Amelioration of zinc toxicity in cotton using lime or mushroom compost. Journal of Soil Contamination 6(4):425-438. Singh RN, Bhandari TPS, Adhikari KS, Kanaujia JP (1992) Physio-chemical parameters of casing soil in relation to yield of button mushroom (Agaricus brunnescens). Indian Journal of Mycology and Plant Pathology. 22(2):160-164. Singh M, Singh RP, Chaube HS (2000) Impact of physio-chemical properties of casing on yield of Agaricus bisporus (Lange) Imbach. Mushroom Science 15(1):441-446. Smith EM 1(982) Mushroom compost - is it safe to use as mulch or potting soil? Nursery Notes (Ohio) 15(3):2. Sochtig H, Grabbe K (1995) The production and utilization of organic-mineral fertilizer from spent mushroom compost. Mushroom Science 14(2):907-915. Sova Z, Cibulka J (1980) Mushrooms as a source of protein in animal feed. Biologizace achemizace veterinaria. 16(4):299-304. Staments P (2001) Mycova: Helping the ecosystem through mushroom cultivation. http://www.fungi.com/bioremediation/index.html (June 29, 2001) Stark LR, Williams FM (1994) The roles of spent mushroom substrate for the mitigation of coal mine drainage. Compost Science and Utilization 2 (4):84-94. Stark LR, Wenerick WR, Williams FM, Stevens SE Jr, Wuest PJ (1994) Restoring the capacity of spent mushroom compost to treat coal mine drainage by reducing the inflow rate: A microcosm experiment. Water and Air Pollution 75(3-4):405-420 Stark LR, Wenerick WR, Williams FM, Wuest PJ (1995) The effects of pH, flow rate, and carbon supplementation on manganese retention in mesocosm wetlands. Journal of Environmental Quality 24(5): 816-826. Stark LR, Williams FM, Wenerick WR, Wuest PJ, Urban C (1996) The effects of substrate type, surface water depth, and flow rate on manganese retention in mesocosm wetlands. Journal of Environmental Quality 25(1):97-106. Steffen KL, Dann MS, Fager K, Fleischer SJ, Harper JK (1994) Short-term and long-term impact of an initial large scale SMS soil amendment on vegetable crop productivity and resource use efficiency. Compost Science and Utilization 2(4):75-83. Steffen B, Cordes A, Grabbe K (1995) The large-scale production of phenoloxidases from residues of mushroom cultivation for the utilization in environmental protection services. Mushroom Science 14(2):893-899. Steffen KL, Dann MS, Harper JK, Fleischer SJ, Mkhize SS, Grenoble DW, MacNab AA, Fager K, Russo JM (1995) Evaluation of the initial season for implementation of four tomato production systems. Journal of the American Society for Horticultural Science 120(2):148-156. Stephens JM, Henry GC, Castro BF, Bennett DL (1989) Mushroom compost as a soil amendment for vegetable gardens. Proceedings of the Florida State Horticultural Society 102:108-111. Stewart DPC, Cameron KC, Cornforth LS (1998a) Inorganic-N release from spent mushroom compost under laboratory and field conditions. Soil Biology and Biochemistry 30(13):1689-1699. Stewart DPC, Cameron KC, Cornforth LS (1998b) Effects of spent mushroom substrate on soil chemical conditions and plant growth in an intensive horticultural system: a comparison with inorganic fertilizer. Australian Journal of Soil Research 36(2):185-198. Stewart DPC, Cameron KC, Cornforth LS, Main BE (2000) Release of sulfate-sulfur, potassium, calcium and magnesium from spent mushroom compost under field conditions. Biology and Fertility of Soils 31(2):128-133. Stewart DPC, Cameron KC, Cornforth LS, Sedcole JR (1998c) Effects of spent mushroom substrate on soil physical conditions and plant growth in an intensive horticultural system: a comparison with inorganic fertilizer. Australian Journal of Soil Research 36(6):899-912. 147 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Stoller BB (1979) A casing made with spent compost. Mushroom Journal 73:25,27,29. Stoner KA, Ferrandino FJ, Gent MPN, Elmer WH, LaMondia JA (1996) Effects of straw mulch, spent mushroom compost, and fumigation on the density of Colorado potato beetles (Coleoptera: Chrysomelidae) in potatoes. Journal of Economic Entomology 89(5):1267-1280. Streeter CL, Conway KE, Horn GW (1981) Effect of Pleurotus ostreatus and Erwinia carotovora on wheat straw digestibility. Mycologia 73(6):1040-1048. Sosulski K, Coxworth E (1986) Solid state fermentation to produce edible mushrooms and animal fodder. Journal of American Oil Chemists Society 63(4):435. Suess A, Curtis J (2007) Report: Value-added strategies for spent mushroom substrate in BC (August, 2006). Proceedings: 2nd International Spent Mushroom Substrate Symposium, September 17-20, 2006, Concordville, PA, 101 pages (included as additional information on CD). Szmidt RAK (1994) Recycling of spent mushroom substrates by aerobic composting to produce novel horticultural substances. Compost Science and Utilization 2(3):63-72. Szmidt RAK, Chong C (1995) Uniformity of spent mushroom substrate (SMS) and factors in applying recommendations for use. Compost Science and Utilization 3(1):64-71. Szmidt RAK, Conway PA (1995) Leaching of recomposted spent mushroom substrates (SMS). Mushroom Science 14(2):901-905. Tan YH, Wahab MN (1997) Extracellular enzyme production during anamorphic growth in the edible mushroom Pleurotus sajor-caju. World Journal of Microbiology and Biotechnology 13:613-617. Tarutis WJ Jr, Unz RF (1995) Iron and manganese release in coal mine drainage wetland microcosms. Water Science and Technology 32(3):187-192. Thorn RG, Barron GL (1984) Carnivorous Mushrooms. Science 224(4644):76-78. Till O (1963) Champignoncultuur auf sterilisiiertem Nährusbstrat und die Wiedervervendung von abgetragenen Kompost. Mushroom Science 5:127-133. Tumwasorn S, Chinoros C, Easpiakdumrong P, Pattanasettakul W (1980) Effects of different rice straws and dilution rates of manures on biogas production. Mushroom Newsletter for the Tropics 1(2):6-10. Upadhyay S (2000) Management of chilli leaf and stem necrosis caused by tomato spotted wilt virus. Journal of Mycology and Plant Pathology 30(2):159-162. Vavrina CS, Ozores-Hampton M, Armbrester K, Pena M (1996) Spent mushroom compost and biological amendments as an alternative to soilless media. Southwestern Florida Research and Extension Centre Station Report - Veg.96.3. Velthof GL, van Beusichem ML, Raijmakers WMF, Janssen BH, Beusichem ML (1998) Journal of Environmental Quality 27(5):1261-1267. Verdonck O (1984) Reviewing and evaluation of new materials used as substrates. Acta Horticulturae 150:467-473. Verma RR (1986) Efficacy of organic amendments against Meloidogyne incognita infesting tomato. Indian Journal of Nematology 16(1):105-106. Verma RR (1993) Effect of different materials on the population of root-knot nematode, Meloidogyne incognita, affecting tomato crop. Indian Journal of Nematology 23(1):135-136. Viji G, Uddin W, Romaine CP, Moorman FE (2000) Evaluation of bacterial antagonists from spent mushroom substrate for suppression of turfgrass diseases. 92nd Annual Meeting of the American Phytopathological Society (12-16 Aug 2000). Availability: American Phytopathological Society, 3340 Pilot Knob Road, St. Paul, MN 55121-2097, USA. Vile MA, Wieder RK (1993) Alkalinity generation by iron (III) reduction versus sulfate reduction in wetlands constructed for acid mine drainage treatments. Water, Air and Soil Pollution 69(3-4):425-441. Wang HS (1983) Spent mushroom compost as a soil amendment for vegetables. Ph.D. Thesis. The University of Tennessee. Knoxville, Tennessee. Wang HS, Lohr VI, Coffey DL (1984a) Spent mushroom compost as a soil amendment for vegetables. Journal of American Society for Horticultural Science 109(5):698-702. Wang HS, Lohr VI, Coffey DL (1984b) Growth response of selected vegetable crops to spent mushroom compost application in a controlled environment. Plant and Soil 82(1):31-40. Weber L, Coles P, Hautau M, Oshins C (1997) Comparison of spent mushroom substrate and fertilizer as a nutrient source for corn. Mushroom News 45(5):6-10. White JW (1976a) Mushroom casing soil and sphagnum moss peat: growing media for Easter lilies. Pennsylvania Flower Grower’s Bulletin Progress Report No. 1:3-5. 148 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus White JW (1976b) Mushroom casing soil and sphagnum moss peat: growing media for poinsettia. Pennsylvania Flower Grower’s Bulletin Progress Report No. 2:3-8. White JW (1976c) Mushroom casing soil and sphagnum moss peat: growing media for Easter lilies. Pennsylvania Flower Grower’s Bulletin Progress Report No. 3:3-6. White JW (1976d) Mushroom casing soil and sphagnum moss peat: growing media for Easter lilies. Mushroom News 24(1):17-19. Wieder RK (1993) Ion input/output budgets for five wetlands constructed for acid coal mine drainage treatment. Water, Air, and Soil Pollution 71(3-4):231-270. Wilson LL, Turner ML, Weiss MJ, Harpster HW (1983) Mushroom industry wastes studied as livestock feeds. Science in Agriculture 30(3):7. Wong PK, Au KS, Fong WK, Chan KY (1990) Bacterial flora isolated from spent composts with special reference to cellulolytic bacteria. Microbios 61:153-167. Wuest PJ (1976) Facts and fables concerning spent compost for casing. Mushroom News 24(10):8, 16, 18. Wuest PJ (1992) Mushroom compost after the crop is picked. Mushroom News 40(12):9-13. Wuest PJ, Fahy HK (1991) Mushroom compost: traits and uses. Mushroom News 39(12):9-15. Wuest PJ, Fahy HK (1992) Mushroom compost: Its origin, components & impact on water quality. Mushroom News 40(1):27-32. Wuest PJ, Anton LA, Kelly C (1996) Influence of thermal process on the suppressiveness of spent mushroom substrate for Verticillium disease of mushrooms. In: Program and abstracts. American Phytopathological Society. 1996 Joint Northeastern and Potomac Division Meeting (October 16-18, 1996). Abstract no. 44. Wuest PJ, Fahy HK, Fahy J (1995) Use of spent mushroom substrate (SMS) for corn (maize) production and its effect on surface water quality. Compost Science and Utilization 3(1):46-54. Wuest PJ, Fahy HK, Ferdinand J, Long K, Bahler CC (1991) Development of procedures for using and storing spent mushroom compost to reduce the risk of lowering water quality. Final Research Project Report. The Pennsylvania State University. University Park, PA 16802 (October 2, 1991). Yohalem DS, Harris RF, Andrews JH (1994) Aqueous extracts of spent mushroom substrate for foliar disease control. Compost Science and Utilization 2(4):67-74. Yohalem DS, Nordheim EV, Andrews JH (1996) The effect of water extracts of spent mushroom compost on apple scab in the field. Phytopathology 86(9):914-922. Yoshida J, Sugihara K, Nakamura R (1978) Effects of physical treatments on high fibrous materials. Scientific Reports of the Faculty of Agriculture Ibaraki University 0(26):85-92. Zadrazil F (1977) The conversion of straw into feed and Basidiomycetes. European Journal of Applied Microbiology 4:273-281. Zadrazil F (1980) Conversion of different plant waste into feed by Basidiomycetes. European Journal of Applied Microbiology 9:243-248. Zadrazil F (1984) Microbial conversion of lignocellulose into feed. In: S. Sundtal and E. Owen (eds). Development in Animal and Veterinary Sciences 14:276-292. Elsevier Science Publishers B.V. Amsterdam. 675. Zadrazil F, Puniya AK (1995) Studies on the effect of particle size on solid-state fermentation of sugarcane bagasse into animal feed using white-rot fungi. Bioresource Technology 54:85-87. Zhang CK, Gong F, Li DS (1995) A note on the utilization of spent mushroom composts in animal feeds. Bioresource Technology 52(1):89-91. 149 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus XIII. ORGANIZACION Y MERCADO: LA CLAVE PARA EL ÉXITO Ramón Jarquín Gálvez y Raúl Cuevas González Carretera Antiguo Aeropuerto Km. 2.5 Tapachula, Chiapas, México <[email protected]> <[email protected]> RESUMEN Se presentan algunas reflexiones en torno a la importancia de la organización de la producción de Agaricus bisporus para su mercadeo, tanto convencionales como en nichos poco explorados. Así mismo, se plantea, desde la revisión de la experiencia en el cultivo del café, la conexión estratégica en términos de mercado que representa vincular la producción con las necesidades y gustos del consumidor, como fase primordial en el éxito comercial. Palabras clave: Agaricus bisporus, champiñones, tendencias del mercado, comercialización INTRODUCCIÓN Las tendencias y los hábitos de los consumidores son la base de las decisiones que definen qué producto producir, cómo se va a cultivar, de qué manera se va a procesar, cuándo y cuánto se debe llevar al mercado. De esta manera, el mercado se enfoca al agricultor y el agricultor debe enfocarse y anticiparse al mercado. El cultivo de champiñones no escapa a esta fórmula, que parece simple. Así, en la actualidad, el productor de champiñones debe encontrar puntos de oportunidad que le permitan colocar en el mercado su producto a un precio redituable para él. El mercado exige cada vez más competitividad; es decir, puntualidad en la entrega, menor costo y la mejor calidad. Por otra parte, hoy en día el consumidor quiere saber con precisión de dónde viene lo que está comiendo y cómo se procesó. La famosa trazabilidad, o seguimiento desde la producción hasta el consumidor, y la inocuidad alimenticia, son requisitos indispensables para ser competitivos en el comercio de alimentos. Por esta razón, el productor debe conocer mucho más que lo que conoce sobre su producto, prácticamente debe basar su producción en un conocimiento pleno de éste y también en el mercado que va a enfrentar. Con la experiencia adquirida en la Dirección de Vinculación de ECOSUR, relacionada con la evolución de la crisis cafetalera observada en el primer lustro de este siglo 21, y sin tratar de hacer comparaciones, puesto que el café y los champiñones son productos totalmente diferentes, los autores hacen en este capítulo una reflexión que pudiera contribuir a plantear alternativas de mejora en cuanto a la cadena producción–consumo de los hongos comestibles. Así, en términos generales al ver cómo el gremio cafetalero mexicano enfrentó la reciente crisis económica y, sin haberla superado aún totalmente, estableció estrategias que al paso de los años han resultado benéficas. Estas reflexiones que ahora se comentan, pudieran, tal vez, ser tomadas en cuenta al plantear las estrategias que convengan al gremio de cultivadores de champiñón. GENERALIDADES SOBRE LA PRODUCCIÓN DE CHAMPIÑONES El cultivo de champiñón Agaricus bisporus es una actividad que se ha desarrollado ampliamente en diversas partes del mundo. En México, dicha actividad inició en 1933 y desde entonces ha tenido una importancia creciente, tanto social, como económica y ecológica. La producción en el año 2006 fue de 38,000 toneladas, la mayor parte de la cual se obtuvo en los estados de Coahuila, 151 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Guanajuato, Jalisco, México, Querétaro y Veracruz (ver Lahmann, capítulo 15 de este libro). Según Martínez Carrera et al. (2007), el monto anual de las operaciones relacionadas con los hongos comestibles – de los cuales, la producción del champiñón representa el 95.3% -supera los 200 millones de dólares y genera alrededor de 25 000 empleos directos e indirectos. Se estima que el consumo per cápita en México en el año 2004 fue de 0.562 kg; gracias a la adaptación exitosa de tecnologías a las condiciones del país, el inicio, consolidación e incremento del mercado de hongos frescos y envasados y la formación y capacitación de recursos humanos. TRAYECTORIA DEL MERCADO DE HONGOS Hablando de productos alimenticios, un sistema eficiente de comercialización trae como consecuencia el desarrollo de los productores y de su país, así como beneficio para los consumidores. Esto también disminuye la pobreza y la desnutrición. Al país, le permite atenuar el desempleo por medio del crecimiento del sector productivo que ocupa mano de obra. Para el productor, promueve consolidar sus mercados y la descentralización, obteniendo ganancias acordes a sus costos de producción. Contar con un sistema bien estructurado de comercialización, también mejora el déficit comercial, aumentando las exportaciones y disminuyendo las importaciones (Nava 2000). El sistema de comercialización de los productos agrícolas en el mundo, como también en México, está constituido por una diversidad de movimientos que deben ser estudiados a detalle para generar la información esencial que permita al productor vender su producto en mejores condiciones. En la India, Verma (2001) al hacer un estudio de costos relacionado con las setas, encontró que el nivel de ganancia para el cultivador era mayor cuando menos intermediarios había y que el mayor impacto en el precio final al consumidor era ocasionado por los supermercados y tiendas departamentales. Los últimos eslabones de la cadena pueden obtener márgenes de ganancia que pueden llegar a ser de hasta 50% sobre el costo de producción. En México, se estima que aproximadamente 80–90% de la producción de hongos comestibles es comercializada en el Distrito Federal, a través de la Central de Abastos, de manera que el comercio está muy centralizado y manipulado. Estas prácticas monopólicas favorecen el intermediarismo mencionado y la especulación de precios, además de observarse una fuerte carencia de infraestructura de conservación del producto (las bodegas con sistemas de refrigeración apropiada son escasas), todo esto repercute en la calidad, disponibilidad y precios al consumidor (Martínez Carrera et al. 1999, Martínez Carrera 2007). PROBLEMAS Y OPORTUNIDADES DE MEJORA Los hongos comestibles tienen una vida de anaquel breve. En el caso del champiñón, Wichers et al. (2005) señalan que durante el almacenamiento y debido al proceso natural de envejecimiento, la morfología de los hongos se ve afectada principalmente en cuanto a la apertura del sombrero, la elongación del estípite y el oscurecimiento del color por oxidación enzimática y crecimiento bacteriano. Esta situación deteriora seria y rápidamente la calidad del producto, ya que el aspecto físico es un criterio determinante, que incide por lo tanto, en el precio y obliga al productor a realizar una venta rápida. Por esta razón, para vender sus champiñones, el productor debe contar con una planeación adecuada de la producción, una buena organización para la producción y venta y también debe conocer el alcance del mercado al que dirige su producto. Los problemas que enfrentan los cultivadores de champiñones son muy variados. Según Martínez Carrera (2007), los problemas que se detectan en la cadena productiva de los hongos comestibles se refieren a una falta de organización de productores, dependencia económica del sector rural para 152 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus invertir en la infraestructura necesaria, escasa capacitación, vulnerabilidad a los agentes biológicos nocivos que contaminan el cultivo y la existencia de un sistema centralizado de comercialización en México. En este capítulo nosotros centraremos la atención fundamentalmente en dos aspectos que son la organización y el mercado. Organización de productores Los productores de champiñón no se encuentran agrupados o asociados en una unión, de tal manera que el gremio pudiera ubicarse en una posición de fortaleza económica y social que permitiera dialogar con otras instancias y obtener beneficios para el sector. Una asociación nacional de productores de champiñón, o bien de productores de hongos comestibles, sería de gran utilidad para la definición de estrategias de mercado, disminución de aranceles a la exportación y de campañas de promoción del consumo de hongos, entre otros. Vinculación La vinculación, es decir, las relaciones que por la producción y venta de su producto, puedan establecer los cultivadores con diferentes instancias como: otros productores, otros profesionales del ramo, los centros educativos y de investigación y el sector gubernamental son de particular importancia para el éxito de la cadena investigación-producción-consumo de los hongos comestibles (Sánchez et al. 2007). Un ejemplo que muestra la importancia de la vinculación entre cultivadores y el sector académico puede ser observado en el caso del café orgánico. Con este producto -cuyo consumo va creciendo a grandes pasos y ganando adeptos en el mercado mundial- la buena vinculación de los cultivadores con los centros de investigación y con las universidades, tanto nacionales como internacionales, ha sido de fundamental importancia para alcanzar los niveles actuales. Esta vinculación permitió definir estrategias y alternativas tecnológicas a las tradicionales que ahora son claves en la definición de café orgánico; por ejemplo: los métodos de manejo de plagas, la producción de abonos, los estudios de calidad de la bebida, los estudios para obtener café orgánico descafeinado, la formación de promotores campesinos, entre varios otros. Así, México es pionero en la producción de café orgánico, y desde los inicios del cultivo oficial de este producto, en los años 1960´s, ha mantenido la posición como primer productor y exportador de café orgánico del mundo. Este mérito ha sido indudablemente debido al esfuerzo de los cultivadores; sin embargo no hay que olvidar que otras instancias de la sociedad mexicana tuvieron una participación importante, entre ellas, diversas instituciones nacionales que se dedican a la investigación y la capacitación, como Ecosur, el Colegio de Postgraduados, la Universidad Autónoma de Chapingo, así como instituciones y organizaciones internacionales, como el Catie, Promecafé y organismos gubernamentales como Comcafé, a través de redes de colaboración en diversas regiones, por ejemplo en el estado de Chiapas. Sin lugar a dudas, el gremio de cultivadores de champiñón pudiera beneficiarse de este tipo de vinculación si estuviera mejor organizado y abriera sus puertas a relaciones de colaboración con el sector académico. Definitivamente que para mantener la competitividad es necesario estar actualizado. Esto obliga a mantenerse al tanto con procesos de capacitación; pero no basta, es necesario que los problemas generados por las situaciones particulares del cultivo se resuelvan con herramientas propias, para evitar la dependencia tecnológica. Esto se logra con investigación local, con estudios específicos. Así, las relaciones con diferentes sectores, no solo el académico, sino privados y gubernamental, pueden ser de gran utilidad. 153 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Por otra parte, la vinculación con el sector gubernamental puede ser útil para el planteamiento de estrategias dentro del marco legal que permitan promover las exportaciones, incrementar el consumo interno, etc. Incremento de la competitividad La era actual está marcada por una globalización nunca antes vista, en la cual las fronteras han sido eliminadas o disminuidas para la libre circulación de los productos del mercado. Así también, se observa que la producción de champiñones no ha sido la excepción: Los hongos frescos y enlatados, cultivados y silvestres, pueden ser adquiridos generalmente en el supermercado local, a precios bajos, provenientes de áreas de producción muy alejadas. El caso más relevante es el de los hongos producidos en la República Popular China, que han invadido prácticamente la mayoría de los países occidentales (Tabla 1). Esta situación de apertura comercial, que ciertamente representa un reto serio que amenaza al sector de los hongos comestibles mexicanos, es también una oportunidad de penetración de otros mercados que pudiera aprovecharse si se organizan y desarrollan las estrategias adecuadas. Tabla 1. Los 10 mayores importadores de champiñón enlatado de China (toneladas) Rusia Estados Unidos Alemania Holanda Canadá Japón Malasia Sud Corea Rumania Estonia Total 2004 20,403 37,370 28,256 12,643 19,206 13,041 12,374 9,129 8,630 10,720 2005 36,640 36,995 21,376 17,768 18,819 12,490 15,226 9,904 10,068 8,852 2006 42,367 34,970 24,476 17,116 13,545 12,120 11,044 10,212 8,720 6,330 180,900 Fuente: Huang 2007 En la Tabla 2, se comparan los niveles de importación y exportación de hongos comestibles enlatados y secos de México y de China (primer productor a nivel mundial), durante el período 1995-1997. Se observa una gran diferencia entre ambos niveles, esto se explica porque China tiene una tradición arraigada en la producción de hongos que data ya de varios siglos, mas bien, más de mil años en el caso de hongos como el “oreja de ratón” Auricularia spp y el shiitake Lentinula edodes y donde actualmente se cultivan comercialmente más de 50 especies. En comparación con los hongos mencionados, la producción de champiñón es mucho más reciente en ese país. Así, el cultivo de champiñón inició en China igual que en México, en los años 1930´s (Wang y Wang 1993) y ha ido igualmente en incremento constante; pero se observa una gran diferencia en las cantidades producidas en los dos países: en 1975 la producción China de champiñón era de 45 000 t y para 2002 fue de 1.33 millones de toneladas. Como se mencionó anteriormente, en México la producción de champiñones en 2006 fue de 38,000 toneladas. El nivel chino de producción se explica en parte, porque ese país cuenta con más de 30 millones de personas dedicadas a la industria de los hongos comestibles (Chang 2005). 154 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Tabla 2. Comparación entre China y México en exportaciones e importaciones de hongos (toneladas). AÑO EXPORTACIONES IMPORTACIONES SECOS ENLATADOS SECOS ENLATADOS China México China México China México China México 1995 26,867 0 201,808 2,018 1,050 9 2,463 2,936 1996 26,223 0 182,719 2,622 455 73 808 386 1997 29,836 2 161,686 2,298 438 9 1,140 2,091 Colegio de Postgraduados en Ciencias Agrícolas y Fundación Produce Tlaxcala, A.C. 2003 La apertura de los mercados representa, en teoría, una oportunidad para comercialización para todos los productores, sin embargo, lo cierto es que los que logran acceder y subsistir son los mejor preparados, los que tienen productos más competitivos y una buena organización. Así, el mercado es un mundo de relaciones y competencias, a veces difíciles de entender, sobre todo cuando un cultivador lo enfrenta solo. De ahí la importancia de las asociaciones de productores que conlleven a una estrategia conjunta para ubicarse de manera competitiva que permita ser participantes activos de los mercados. El reconocimiento del éxito en la producción del gremio champiñonero de un país sólo se da cuando este gremio tiene un alto grado de vinculación interna. Basta mencionar como ejemplos recientes, los casos de Holanda, la misma China y Polonia, que a base de una buena organización, vinculación con el sector gubernamental y académico y la definición de políticas económicas claras han podido sobresalir por su competitividad en la producción de champiñones a nivel mundial. Es de enfatizar que en estos casos, no ha habido competencia interna, sino colaboración. Nuestro país cuenta con condiciones adecuadas de ambiente, insumos e infraestructura para una mayor producción de hongos comestibles, no sólo cultivados sino también los silvestres; sin embargo el desarrollo de este sector económico se dará paulatinamente y deberá esperarse a que diversos factores técnicos, organizativos, de mercado, financieros, de vinculación se conjunten para impulsar esta actividad. Incremento del consumo interno Una de las estrategias que se plantearon los productores de café ante la presión de la última crisis, fue el tratar de incrementar en México el consumo interno de café y sus derivados. Esto porque los precios internacionales no permitían ni siquiera cosechar el grano y la cosecha se estaba perdiendo en el campo. Dado que el consumo per cápita era bajo, en relación con otros países, se planteó la opción de promover el incremento del consumo interno. Esto se vio, más que como una solución inmediata, como una solución de largo plazo que permitiría paliar los efectos de futuras crisis internacionales y en cierta manera, hacer menos dependiente a los productores del mercado internacional del grano. Como se mencionó líneas arriba, el consumo nacional de champiñones es de 0.56 kg por persona por año, lo cual es comparativamente inferior, en relación con otros países (Tabla 3). Debido a esto, las posibilidades de crecimiento particular para cada unidad productiva no debiera estar limitada por una falta de demanda, ya que la implementación de estrategias promocionales y la difusión de información seguramente haría posible lograr un incremento sustancial de la demanda. Se sabe que la mayor parte de los champiñones que se producen son comprados porque el consumidor disfruta su sabor y también se sabe que éste desconoce los valores nutritivos y medicinales que los champiñones pudieran tener (Lelley y Vetter 2005, Lelley 2007); por ejemplo el antioxidante 155 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus ergotionina o la vitamina B12, entre otros, son compuestos que inciden directamente en la nutrición y en la salud del consumidor y que están presentes en concentraciones importantes en A. bisporus. Así mismo, el bajo contenido en grasas o la calidad de la proteína fúngica son de gran importancia nutritiva (Ver capítulos 1 y 11 en este mismo libro). Por lo tanto, divulgar información de este tipo es de mucha importancia, como aliado para incrementar el consumo. Por esta razón, es fundamental desarrollar estudios sobre comercialización de los hongos comestibles en México, con el objeto de organizar y estructurar el mercado nacional, para dirigir la comercialización hacia la satisfacción de un consumo interno, con la reducción de importaciones, sin obviamente, desatender la exportación. Tabla 3. Promedio de consumo per cápita de champiñones de algunas ciudades y países del mundo Ciudad y/o país Peking, Shangai y Guangzhou (China)1 Francia1 Australia1 Alemania1 Italia1 Canadá2 Estados Unidos2 kg/año 10 4.5 3.5 3.1 2.4 1.77 0.97 Fuente: 1 ST Chang Com. Pers. 2007 2 MIDC 2006 Búsqueda de mercados alternativos La producción de hongos comestibles en México ha sido una actividad que ha generado una importante dinámica económica demostrada por el incremento constante de la producción, en el número de empresas dedicadas a la comercialización del producto tanto fresco como procesado, y por los crecientes volúmenes importados y exportados por las mismas. En lo que respecta a las exportaciones, el principal destino de la producción mexicana es Estados Unidos, a donde envía los mayores volúmenes (78% de los procesados exportados en 1998). Así mismo el 100% de las importaciones del producto fresco realizadas por México, provinieron de EUA, mientras que el 85% de las importaciones de hongos procesados fueron traídos de China. El mercado del champiñón es sumamente dinámico y las condiciones tecnológicas, las condiciones de mercado, los costos de mano de obra y la legislación ambiental, la investigación juegan un papel muy importante en la determinación de los cultivadores más competitivos. Esto explica por qué, países que han sido muy poderosos para producir, de pronto han caído en desventaja ante nuevos competidores. Es el caso de Holanda, que tenían una industria del champiñón muy poderosa que llegó a dominar el mercado europeo por casi 20 años, pero que después vino a menos, o de Irlanda, que en los últimos años ha tenido una crisis seria en su industria champiñonera que casi la hace desaparecer. Ante este juego de factores, la industria mexicana del champiñón tiene una oportunidad para exportar y cubrir las necesidades de la demanda en Estados Unidos y en Canadá, así como hacia los países de Centro y Sudamérica. Por otra parte, además de los mercados tradicionales para el champiñón, pudiera pensarse en incursionar mercados alternativos. Si se cumplen las reglas de producción y la calidad del producto que cada uno de estos mercados especializados exige, la estrategia puede ser particularmente atractiva, sobre todo porque estos mercados mantienen precios generalmente superiores a los 156 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus observados en los productos similares producidos de manera tradicional. La tendencia mundial de consumo de productos libres de agrotóxicos, saludables e higiénicos, esta impactando fuertemente a la juventud, por lo tanto, la tendencia a la demanda de productos no enlatados y sin conservadores va en aumento. Esta situación representa una oportunidad para el desarrollo de productos de hongos en presentaciones novedosas, en las cuales, los consumidores, informados y conscientes tienen la disposición de pagar un mejor precio por un producto de calidad especificada. Esta es una clara referencia a los mercados alternativos o especiales como: Orgánico La FAO caracteriza a la agricultura orgánica, como un sistema holistico de gestión de la producción, que fomenta y mejora la salud de los agroecosistemas, especialmente la biodiversidad, los ciclos biogeoquímicos, en particular lo vinculados a la vida del suelo, implementando actividades que evitan el uso de productos de síntesis química, como los fertilizantes, insecticidas, herbicidas, hormonas, reguladores del crecimiento, así como organismos genéticamente modificados, aguas negras, edulcolorantes y conservadores sintéticos en productos transformados. El movimiento orgánico está organizado a nivel mundial en la IFOAM (Internacional Federation of Organic Agriculture Movements). México ocupa el 13o lugar por superficie orgánica y el primero en la producción de café de este tipo en el mundo. A nivel nacional la superficie ha aumentado de 216,000 ha en 2002 a más de 300,000 ha en 2004. Según cifras oficiales hay aproximadamente unos 80,000 productores practicando agricultura orgánica en nuestro país. La producción orgánica es muy compatible con los sistemas de producción tradicionales, de ahí que la mayoría de las etnias se encuentran ligadas de alguna manera a estos sistemas de producción (Jarquín 2003). Chiapas no es la excepción, en donde además de café se han certificado recientemente otros productos como plátano, jamaica, jitomate, cacahuate, limón, mango, papaya, coco, piña y naranja entre otros. Desgraciadamente la producción de hongos no ha incursionado realmente en esta modalidad productiva: tanto en Europa como en Estados Unidos los hongos orgánicos ocupan el 1% de la producción total de hongos. En México los avances aún son incipientes. Mercado Justo Como hemos mencionado, la compra-venta organizada ofrece ventajas a los pequeños productores en las condiciones imperantes de mercado, al evitar el intermediarismo. No obstante esto no es suficiente para mejorar el nivel de vida de los productores. En ese sentido desde hace poco más de una década nació en algunos países europeos, la iniciativa de ofrecer mayores remuneraciones a estos grupos, además de mejorar sus condiciones de vida a través del fomento al trabajo y no de la caridad, de esta iniciativa nace lo que hoy conocemos como mercado justo, vinculada en primera instancia al café. Esta modalidad de mercado, alienta el intercambio comercial basado en un código de conducta que considera la justicia social y el respeto por el ambiente, mientras se fomenta la autonomía de los productores de países en desarrollo. El sistema de sobre precios del Mercado Justo (Fair Trade, en inglés), se basa en el aporte solidario del consumidor al productor por arriba del precio del café cotizado en la bolsa de valores de Nueva York. Para entrar a este mercado, es necesario estar organizado, mostrar mecanismos transparentes de ingreso, egreso y reparto de los ingresos, protegiendo la equidad de género y los derechos humanos de los trabajadores y niños. El mercado justo poco a poco ha incorporado, una gran diversidad de productos del campo, por lo cual no debe descartarse como una oportunidad de mercado para productores organizados de Agaricus bisporus. 157 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Gourmet Se refiere a un producto diferenciado por sus características de calidad, establecidas básicamente por un segmento de mercado específico. Es decir los términos de excelencia organoléptica están establecidos por quien consume este tipo de productos especiales y pueden ser reconocidos por otros consumidores. Así mismo, si este producto gourmet está referido a una región geográfica en particular, puede agregarle un valor superior. El concepto de denominación de origen, ha sido utilizado como símbolo de garantía de calidad en productos como el queso, los vinos y más recientemente para el tequila y el café. ¿Por qué no tratar de identificar características especiales de los hongos cultivados en regiones diferentes? Dadas las condiciones del mercado y las oportunidades señaladas, es evidente la necesidad de integrar los intereses de productores y consumidores. Para el mercado nacional los círculos de consumidores y de productores alrededor de tianguis orgánicos puede mejorar los hábitos de consumo a nivel local, canalizando a estos buena parte de la producción de los grupos incipientes, promoviendo la certificación participativa como inicio. Para los productores de segundo nivel, las posibilidades de los mercados alternativos, partiendo de manejo orgánico, son cada vez más amplias sobre todo en el mercado de exportación. El primer paso es integrar un organismo nacional de productores, independientemente del segmento de mercado en que participen. Esto permitiría establecer normas de producción mas claras y mecanismo de abasto menos complejos, este organismo de productores, podría representar los intereses del sector en otros ámbitos. La creación de un organismo nacional regulador de la oferta y la demanda, que atienda de manera específica el tema de los hongos comestibles en fresco es más que necesaria. La mayoría de los productos agropecuarios cuentan con sistemas producto que integra a toda la cadena productiva. En México esto no existe para los hongos. Para mayor información sobre estos mercados alternativos o emergentes, se dan a continuación las direcciones de los siguientes sitios en Internet que pueden ser de interés: Comercio Justo: Definición, historia y explicación de los fundamentos del comercio justo http://www.commercequitable.com, http://wwwfairtrade.net Fairtrade Labelling Organization (FLO) http://www.fairtrade.net/sites/aboutflo/spanish/faq.html Ecomercados: Instituto de Investigaciones para la Agricultura Organica http://www.fibl.ch IFOAM (International Federation of Organic Agriculture Movements) http://www.ifoam.org AGRADECIMIENTOS Los autores agradecen al IBT Rogelio Pérez Cruz el apoyo brindado para la realización de este capitulo. REFERENCIAS Brownlee M, Seymour GK (2004) Benefits of keeping the consumers in focus. Mush. Sci. 16:671-678 Chang ST (2005) Witnessing the development of the mushroom industry in China. In: Tan Q, Zhang J, Chen M, Cao H, Buswell JA (eds). Proceed. 5th Int. Conf. Mush. Biol. Mush. Prod. 3-34 158 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Colegio de Postgraduados en Ciencias Agrícolas y Fundación Produce Tlaxcala, A.C. 2003. Programa estratégico para el desarrollo de la producción, transformación y comercialización de hongos comestibles en el estado de Tlaxcala. Tlaxcala, México. P 31. Huang Y (2007) Chinese market trends. Mushroom business. 23:10-11 Jarquín Gálvez R (2003) Agroecosistemas cafetaleros y su problemática en Los Altos de Chiapas. Revista Sociedades Rurales, Producción y Medio Ambiente. Universidad Autónoma Metropolitana DPAA, 4(7): (83-92). ISSN-1665-1189. México, D .F. Lelley J (2007) Healthy aspects of eating mushrooms. Mush. News 55(2):20-24. Lelley J, Vetter J (2005) The possible role of mushrooms in maintaining good health and preventing diseases. Acta edulis fungi. 12 Supplement: 412-149. Martínez Carrera D, Morales P, Sobal M, Bonilla M, Martínez W (2007) México ante la globalización en el siglo XXI: El sistema producción-consumo de los hongos comestibles. In: Sánchez JE, Martínez Carrera D, Mata G, Leal Lara H (eds) El cultivo de setas Pleurotus spp en México. Ecosur. 209-224. Martinez Carrera D, Aguilar A, Martinez W, Morales P, Sobal M, Bonilla M, Larque Saavedra A (1999) A susteinable model for rural production of edible mushrooms in Mexico. Micol. Neotrop. Apl. 11: 77-96. Nava LD (2000) Estrategias para la comercialización de hongos comestibles a nivel local y regional en México. Tesis de Maestría. Colegio de Postgraduados, Campus Puebla. México. Wichers HJ, Solar-Rivas C, Danai O, Nerya O, Levanon D (2005) Post harvest quality of Agaricus bisporus mushrooms. In: Tan Q, Zhang J, Chen M, Cao H, Buswell JA (eds). Proceed. 5th Int. Conf. Mush. Biol. Mush. Prod. 475-481. Mushroom Industry development council (MIDC) (2006) BCmushrooms http://www.bcmushrooms.org/about/industry.html. 15 de octubre 2007. Sánchez JE, Martínez Carrera D, Mata G, Leal Lara H 2007 (eds) Consideraciones finales. El cultivo de setas Pleurotus spp en México. Ecosur. 225-234. Verma RN (2001) Aspectos económicos de la producción de Pleurotus spp. In: Sánchez JE, Royse D (eds) La biología y el cultivo de Pleurotus spp. Ecosur-Uthea. 273-289 Wang ZS, Wang HC (1993) Progress in cultivation techniques for Agaricus bisporus in China. In: Chang ST, Buswell JA, Chiu SW (eds). Mushroom Biology and Mushroom Products. The Chinese University Press. 133-140 159 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus XIV. EVOLUCIÓN DE LA INDUSTRIA DEL CHAMPIÑÓN AGARICUS BISPORUS EN LATINOAMÉRICA Oscar Lahmann Lahmann Enterprises, 150 Bonaventure Drive, Hamilton , Ontario Canada L9C 4P9 <[email protected]> RESUMEN La producción comercial del hongo “Botón” o Champiñón inició en América, en Estados Unidos, a finales del siglo XIX. En Latinoamérica fue iniciada en México en el año 1933, en una hacienda ganadera ubicada en Texcoco, en las cercanías de la ciudad de México. Este primer avance fue seguido con desarrollos posteriores en otros países como Argentina (1941), Colombia (1950), Brasil (1951), Chile (1959), Guatemala (1960), Perú (1960), Ecuador (1967), Venezuela (1968), Costa Rica (1970) y Honduras (2002). En Latinoamérica, México es el productor más importante. Del total producido en la región, este país es responsable de más de 50%. En Centroamérica se alcanzó la máxima producción en 1994. Sudamérica tuvo un pico productivo en el año 1994; descendió en producción en 2000-2001 pero logró superarse en el 2006 con 31,424 toneladas, su máxima producción histórica. El cambio productivo se basa principalmente en el gran aumento de la producción brasileña a partir del año 2004. Brasil se mantiene como el segundo productor latinoamericano con un 21% del total producido en la región Palabras clave: Latinoamérica, cultivo de champiñón, estadística de cultivo. INTRODUCCION La producción comercial de Agaricus bisporus en Latinoamérica para el año1970, superaba apenas las 2,000 toneladas por año (Tablas 1-2); sin embargo, el intercambio tecnológico con Norteamérica y Europa y la apertura de mercados internacionales durante el período 1970-1994, originaron un incremento muy importante en la producción latinoamericana, superando las 40,000 t/ año en 1996, un nivel 20 veces mayor que el de 1970 (Lahmann y Rinker 1995). La producción estimada para Latinoamérica para el año 2002 fue de 59,674 t, lo que correspondió al 7% de lo producido por la Unión Europea (846,900 t, Anónimo 2004)) y el 15% de la producción de Estados Unidos. (390,000 t) (AEPC 2002). La producción estimada para el año 2006 mostró un incremento de 75% con relación al de 1994, alcanzando niveles cercanos a las 70,000 toneladas, un 19% de la producción de los Estados Unidos (370,000 t) (USDA 2007). Debido a la falta de estadísticas oficiales de producción de hongos en Latinoamérica, la información aquí presentada está basada principalmente en datos estimados obtenidos por contactos personales del autor con la industria, gobierno y universidades. SUDAMÉRICA Esta región alcanzó su pico productivo en el año de 1994, debido principalmente al incremento de la producción chilena, ocasionado por la planta Nature´s Farm y orientado principalmente a la exportación de producto procesado. Durante la década pasada la producción sudamericana se redujo, afectada principalmente por la disminución de la producción en Chile (Lahmann y Rinker 1995). Para el año 2006 la producción estimada superó los niveles de 1994, debido primordialmente al incremento productivo de Brasil y en menor grado a los aumentos de la producción de Argentina, Colombia, Perú y Venezuela. 161 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Se observa una reducción de 50% en el número de plantas productoras desde 1994 a 2006 (Tabla 3); sin embargo, la producción de champiñón ha aumentado en ese período en 58%, debida a mejores técnicas de cultivo, al incremento en tamaño de algunas unidades productoras y a la sustitución de plantas por otras de mayor capacidad o eficiencia. La mayor parte de las plantas que preparan compost trabajan la fase I en pilas tradicionales, utilizando equipo de compostaje y realizando la fase II en túnel. Fundamentalmente, las operaciones son multizonales, con la mayoria de las plantas productoras trabajando con bolsas o paquetes. Sin embargo, una parte importante de la producción se realiza con sistemas plurizona de camas o cajas. La producción en plantas monozona de tipo norteamericano es poca, en volumen y numero de plantas. Argentina Aún con la reducción en el número de plantas, la producción de A. bisporus se ha incrementado en 96% desde el año 1994, alcanzando un volumen aproximado de 2,350 toneladas en 2006 (Tablas 12). En el año 2006, las plantas en producción de mayor capacidad y mayor nivel tecnológico fueron: Abrantes, Hongos del Pilar, Champiñones Argentinos, Cultivos del Sur y Horst. Esta última terminó sus operaciones a finales de 2006, debido a problemas laborales. El compost se produce con estiércol de caballo procedente, en su mayoría, de hipódromos de zonas cercanas. La mayor parte de las plantas realizan la fase I en bunker y la fase II en túneles. Por razones económicas, la mayor parte de la semilla utilizada en Argentina es producida localmente. La concentración más importante de productores se encuentra en la provincia de Buenos Aires, existen algunas pequeñas plantas localizadas en Córdoba y en Mendoza. Bolivia La producción de champiñón alcanzó 24 t/año en 2006 (Tablas 1-2). Michael Stuart, es el principal productor, establecido cerca de la ciudad de la Paz. Utiliza el sistema monozona tipo norteamericano y trabaja con paja de avena para el compost. En Santa Cruz, Bexsa, se localiza otra planta. Emplean una variedad tropical de A. bitorquis. Debido a problemas financieros se declaró en bancarrota en el año 2005, pero continúa aún en producción con un bajo perfil. Brasil La producción se ha incrementado en 225% sobre los valores del año 1994, debido a mayor demanda y mejores precios de venta. A partir de 2004 se superaron los valores de producción de 2002, alcanzando un estimado productivo de 13,000 toneladas en 2006 (Tablas 1-2). El número de productores no ha incrementado pero sí ha aumentado el tamaño de las unidades productoras y se han mejorado las técnicas de cultivo (Tabla 3). Se mantiene como el segundo productor en tamaño de América Latina. El compost tradicionalmente utilizado es una mezcla de bagazo de caña, estiércol de caballo, pastos locales y/o arroz. El material de cobertura se prepara con tierra o turba y/o fibra de coco, tratados con vapor o formaldehído. El compost se pasteuriza en túneles y se cultiva principalmente en bolsas. La semilla es producida localmente y se suministra incorporada normalmente en las bolsas de compost. La mayor parte de los productores se encuentran establecidos en el sur de Brasil: en los estados de Sao Paulo, Paraná, Santa Catarina y Rio Grande do Sul. La mayor concentración de productores se encuentra en Mogi 162 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Das Cruces, en el estado de Sao Paulo. Entre los productores importantes se encuentran Industrias Luca, Chen Mu Cheng, Aten Lin, Athon K Athen y Fazenda Sao Jose. Chile La producción de champiñón alcanzó su pico productivo en 1994, pero declinó en 1999, debido a las medidas anti-dumping aplicadas a Nature´s Farm, creando una disminución de –54% con relación al año 1994 (Lahmann y Rinker 1995). Nature’s Farm entró en bancarrota y fue vendida, actualmente opera bajo el nombre Bosques del Mauco, sin alcanzar los niveles productivos de 1994. La producción de 2006, con 5,160 t, está todavía a –51% de los niveles de 1994. La producción estimada para 2007 debe llegar a 8,760 t, lo que representa un incremento de 3,600 t con relación a 2006. La producción de Bosques del Mauco se utiliza en 70% para enlatado y 30% para el mercado fresco. El compost se ha preparado tradicionalmente con paja de trigo y estiércol de caballo. Debido a la mayor demanda y disponibilidad de materia prima, se estima que 90% del compost durante el año 2007 se deberá preparar con paja de trigo. Colombia La producción incrementó a 6,581 toneladas en 2006, lo que representa 105% sobre los niveles del año 1994 (Tablas 1-2). La mayor concentración de plantas productoras está localizada cerca de Santa Fé de Bogota, en el departamento de Cundinamarca. La planta de Setas Colombianas es la mayor y más moderna del país, establecida en Yarumal, a 110 Km. de Medellín, en el Departamento de Antioquia. Produce aproximadamente 70% de la producción total de Colombia. El compost es preparado principalmente de paja de arroz y bagazo, con algunos productores utilizando paja de sorgo o cebada. El material de cobertura consiste especialmente de turba canadiense y fibra de coco. La mayor parte de la semilla utilizada es importada de Estados Unidos; sin embargo, algunos productores utilizan la semilla producida localmente. Ecuador Alcanzó un pico productivo en 1974 basado en la producción de Amcesa (500 toneladas) (Tablas 12). Al cerrar esta planta, la producción del país en el año 1976 se redujo a menos de 300 t (Lahmann y Rinker 1995). Debido a mejoras en instalaciones y cambios tecnológicos, la producción ha ido aumentando desde el año 1994 (320 t), sin que el número de productores haya incrementado (Tabla 3). Para el año el 2006 se estiman 700 t, las que representan un incremento del 118% sobre los niveles de 1994. Las plantas productoras están ubicadas cerca de Quito y la mayor parte de la producción depende principalmente de las dos plantas más antiguas, Invidelca/Guipi y Kennet. La primera de sistema monozona norteamericano basada en las instalaciones de Amcesa y la segunda plurizona de cajas. El compost es preparado con trigo y/o arroz. Utilizan turba canadiense como material de cobertura y trabajan con semilla importada de Estados Unidos. 163 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Tabla 1. Inicio del cultivo comercial de A. bisporus en América Latina y su evolución productiva por región y país. 1970 Producción (toneladas/año) 1974 1994 2002 1,150 2,220 27,825 (b) 37,230 38,000 1941 1989 1951 1959 1950 1967 1960 1969 150 _ 150 80 100 400 60 50 990 600 _ 600 100 160 500 100 100 2,160 1,200 10 4,000 10,600 3,200 320 300 1,400 21,030 1,500 10 6,,885 4,872 6,312 625 750 1,320 22,274 2,350 24 13,000 5,160 6,581 700 1,080 2,364 31,259 1969 1960 2002 50 60 700 20 100 40 110 720 140 90 80 3 173 70 72 20 162 2,250 5,100 48,995 59,677 6,9421 Fecha de inicio America Latina Región Norte América Estados Unidos (a) Canadá (a) México Sur América Argentina Bolivia Brasil Chile Colombia Ecuador Perú Venezuela Subtotal Centroamérica Costa Rica Guatemala Honduras Subtotal Total 1880 1912 1933 2006 a.) como referencia b.) 1995 Perú La producción de A. bisporus se ha incrementado en 160% sobre los niveles de 1994 (Tablas 1-2), alcanzando 1,080 toneladas en 2006. En ese año, cuatro plantas se encontraban en operación. Las dos más importantes, Paccu y Don Hongo, están ubicadas en Pachacamac, en las afueras de Lima. Las otras dos plantas, Tulko y Chilca, solamente producen 10% del total. Para la preparación de compost utilizan paja de arroz, cascarilla de algodón y/o coronta de maíz. Don Hongo tiene un sistema plurizona con túnel y cajas y Paccu utiliza un sistema monozona norteamericano. El material de cobertura es musgo de los Andes tratado con formaldehído o vapor. Venezuela La producción comercial de A. bisporus en el año 2006 alcanzó las 2,364 toneladas, mostrando un incremento de 69% con relación al año 1994 (Tablas 1-2). La razón principal radica en la mayor disponibilidad de compost de buena calidad para pequeños productores, que operan con base en contratos de suministro de compost sembrado en bolsas y venta de los hongos al proveedor del compost. La mayor parte de los pequeños productores están localizados en Boconó, estado de Trujillo. El proveedor principal de compost y productor es Champiñones San Pedro, en el estado de 164 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Lara, que trabaja con un sistema plurizona con búnker y túneles. En las afueras de Caracas se localiza Agrícola La Reina, una planta monozona de tipo norteamericano. La paja de arroz y el pasto de corte (Brachiaria brizantha) se utilizan principalmente como materiales básicos de compostaje. En el caso de Agrícola La Reina, se usa estiércol de caballo procedente del deshecho de las Haras de cría y venta de caballos. Como material de cobertura se utiliza fibra de coco, compost usado y/o tierra negra, tratadas con formaldehído o vapor. La turba canadiense, por razones de costo, tiene uso limitado. Por razones económicas, la semilla es producida localmente en su mayor parte, solamente la planta de Agrícola La Reina mantiene importaciones de semilla de Norteamérica. Tabla 2. Producción comercial latinoamericana de A. bisporus. Período 1970-2006 (toneladas). Variación Variación 1970-994 1994-2006 País Año ton % ton 1970 1994 2002 2006 Argentina 150 1,200 1,500 2,350 1,050 700 1,150 Bolivia 10 10 24 10 14 Brasil 150 4,000 6,885 13,000 3,850 2566 9,000 Chile 80 10,600 4,872 5,160 10,520 13150 -5,440 Colombia 100 3,200 6,312 6,581 3,100 3100 3,381 Ecuador 400 320 625 700 -80 -20 380 Perú 60 300 750 1,080 240 400 780 Venezuela 50 1,400 1,320 2,364 1,350 2700 964 Costa Rica 50 100 90 70 50 100 -30 Guatemala 10 40 80 72 30 300 32 Honduras 3 20 20 México 1,150 27,825* 37,230 38,000 26,675 2320 10,175 Total * año 1995 2,200 48,995 59,677 69,421 46,795 2,127% 20,426 % 96 140 225 -51 106 118 260 68 -30 80 37 42% CENTROAMÉRICA La producción centroamericana alcanzó su pico productivo en el año 1974 con 720 toneladas por año. Descendió a menos de 300 t en 1992 y a 140 t en el año 1994 (Lahmann y Rinker 1995). Se incrementó a 173 t/año en 2002 pero descendió a 162 t en el año 2006, al reducirse el aporte productivo de Costa Rica y Guatemala, no compensado por la producción de Honduras (20 t), (Tablas 1-2). Costa Rica La producción alcanzó su pico en el año 1974 con 700 toneladas por año, con base en la operación de la compañía American Mushroom Corporation. Al cerrar la planta, nuevos propietarios han estado utilizando solamente una parte pequeña de las instalaciones originales (Lahmann y Rinker 1995). La producción del país ha ido declinando al no tener instalaciones apropiadas. Los cuartos actuales de producción en Conservas del Valle, tienen más de 30 años y no están en buenas condiciones. En este momento las instalaciones están rentadas a Marear Food and Export Ltd., una 165 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus compañía dedicada a la venta y distribución de vegetales que produce hongos y provee de compost a pequeños productores, comprando su producción en retorno. Guatemala La producción de hongos en 2006 fue de 72 toneladas, un incremento de 80% sobre los niveles de 1994. El productor principal es Agricultura Avanzada, quien suministra 80% del total del país. En 2007 reinició operaciones Grotos, una planta monozona de sistema norteamericano. Se espera que la producción total pueda llegar a 100 toneladas en este año. El compost utilizado tiene como base bagazo de caña y pasto jaragua. Utilizan como cobertura tierra negra y/o fibra de coco tratada con vapor o formol. La turba canadiense se utiliza algunas veces en mezclas, para compensar su costo. Honduras Planta establecida en las afueras de Tegucigalpa por Jaime Rojas. Utiliza un sistema monozona, con estantería metálica modelo holandés. Inicio operaciones en 2002 y produjo un estimado de 20 toneladas en 2006. Prepara compost con paja de arroz (Tablas 1- 2). NORTEAMÉRICA México México es el productor mas grande de A. bisporus en América Latina. Su producción estimada en 1970 fue de 1,150 toneladas. Alcanzó en el año 1995 las 27,825 toneladas, lo cual representa un incremento productivo de 24 veces o 2320% con relación al año 1970 (Tablas 1-2) (MartínezCarrera 2000). La producción estimada del año 2006 fue 38,000 toneladas, un incremento de 36% con relación al año 1995. Actualmente se estima que 75% del total producido se vende como producto fresco. La corporación más grande del país y el mayor productor es Monte Blanco/Hongos de México, con seis plantas de producción: tres en el estado de México y una en cada uno de los estados de Jalisco, Saltillo y Querétaro. La planta individual más grande del país es Hongos San Miguel, en San Miguel de Allende. Otras plantas operando en 2006 fueron San Francisco, Del Bosque, El Riojal, Peña Rica y Alimentos Selectos de Tlaxcala; aunque esta última cerró su planta productora en el año 2007. La mayor parte de las plantas tienen sistemas multizonales con producción en bolsas o paquetes. San Francisco y Del Bosque tienen plantas productoras con sistema de estantes tipo holandés La fase I es, en su mayor parte, manejada con bunker y la fase II en túneles. La mayor parte de las plantas produce compost preparado principalmente con paja de trigo o cebada. El sorgo, bagazo de caña y el estiércol de caballo han sido utilizados por algunos productores. Los materiales de cobertura usualmente utilizados son turba canadiense y fibra de coco. La semilla utilizada es importada de Estados Unidos. 166 Cultivo, Mercadotecnia e Inocuidad Alimenticia de Agaricus bisporus Tabla 3. Número de plantas productoras de hongos Agaricus bisporus en América Latina País Argentina Bolivia Brasil Chile Colombia Ecuador Perú Venezuela Costa Rica Guatemala Honduras México 1994 50 2 580** 13 40 5 3 30* 6 3 0 Nd 1998 12 2 200** 10 24 5 3 30* 5 5 0 Nd Año 2002 8 2 200** 8 24 5 3 27* 3 5 1 14 (a) 2006 8 2 250** 4 24 5 4 57(b) 3 3 1 14(a) Variación Número -42 0 -330 -9 -16 0 1 27 3 0 1 Nd Nd % -84% 0 -57% -69% -40% 0 33% 90% -50% 0 a.) 6 plantas pertenecen al grupo Monte blanco. b.) 50 son operaciones familiares sin producción de compost. * 24 son operaciones familiares sin producción de compost. ** Más del 90% son operaciones rústicas y estacionales sin producción de compost. RECONOCIMIENTO El autor agradece a las siguientes personas, la información suministrada para la conformación de este capítulo: Luiz Roberto Vasone, Carlos Valencia, Fernando Acosta, Carlos Alcántara, George Bennett, Juan Paulo Sánchez, Alejandro Diez, Magali Álvarez, Bernardo García, Raúl Sánchez, Lino Perrota, José Antonio Gutiérrez, José Luis Arce, Edison de Sousa, Michael Stuart, Jaime Rojas. REFERENCIAS AEPC (2002) Asoc. Española de Productores de Champiñón. Informe del grupo europeo de productores de champiñón. Boletín 37, 18-31. Anónimo (2004) Mushroom production falling in European Union. Mushroom Business. 4: 1, The Netherlands. Lahmann O, Rinker D (1995) Historical development of commercial mushroom production in Central and South America. Mush. Sci. 15:459-466 Lahmann O, Rinker DL (2004) Mushroom practices and production in Latin America 1994-2002. Mush. Sci. 16: 681-686 Martínez-Carrera D (2000) Mushroom Biotechnology in Tropical America. The International Journal of Mushroom Science, 3(1):9-20 Ramos Bononi VL (2003) O Cultivo de Agaricus bisporus no Brasil. In: Primero Simposio Internacional sobre Cogumelos na Alimentacao, Saude, Technologia e Meio Ambiente no Brasil, Brasilia, DF. 24-31 USDA (2007) Mushroom Crop Report. National Agriculture Statistics Service. 167 El champiñón Agaricus bisporus es el hongo más ampliamente cultivado y conocido en el mundo. A pesar de la creciente diversificación de la oferta de hongos comestibles cultivados (observada en los últimos treinta años), el interés general por su producción y consumo no decrece, mas bien va en aumento. El desarrollo de la tecnología para la producción de A. bisporus ha sido un proceso largo que comenzó hace más de 350 años y que, por medio de prueba y error, al principio, y con investigaciones cada vez más elaboradas durante los últimos 100 años, se ha ido afinando hasta convertirse en un proceso eficiente y productivo; que sin embargo, como todo, también tiene limitaciones. El presente libro presenta la información más actualizada que existe sobre el cultivo de A. bisporus y sobre los avances en investigaciones que buscan métodos alternativos de producción. Se incluye un tema de interés básico en cuanto a la ubicación taxonómica del género y una sección dedicada al análisis de aspectos importantes que inciden directamente en el éxito de toda empresa champiñonera, como son la inocuidad alimenticia, la organización para la producción y la comercialización. El libro está formado por una serie de capítulos escritos por especialistas reconocidos internacionalmente. Es una aportación que contribuye a la diseminación del conocimiento sobre el champiñón en personas interesadas en países hispanoparlantes. View publication stats