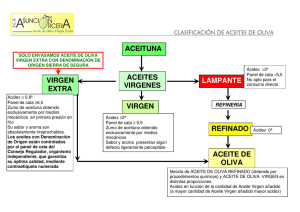
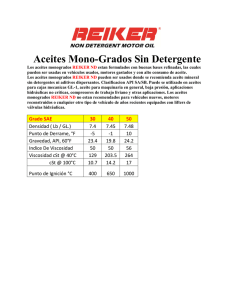
DERECHOS RESERVADOS
Anuncio

REPUBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD RAFAEL URDANETA FACULTAD DE INGENIERIA ESCUELA DE INGENIERIA QUIMICA S O D VA ER S E SR HO C E ER D COMPARACION A TRAVES DE LOS METODOS POTENCIOMETRICOS (pHMETRO, CONDUCTIMETRO) Y VOLUMETRICOS DEL INDICE DE ACIDEZ EN ACEITES VEGETALES QUE SE CONSUMEN EN VENEZUELA Trabajo Especial de Grado presentado a la Universidad Rafael Urdaneta para optar al título de: INGENIERO QUIMICO Autores: Br. MEJIAS N, LUIS G. Br. RICON R, DANIEL O. Tutor: Lic. Eudo Osorio, MSc Maracaibo; Diciembre de 2013 COMPARACION A TRAVES DE LOS METODOS POTENCIOMETRICOS (pHMETRO, CONDUCTIMETRO) Y VOLUMETRICOS DEL INDICE DE ACIDEZ EN ACEITES VEGETALES QUE SE CONSUMEN EN VENEZUELA S O D __________________________ _________________________ VA R E S Rincon Daniel Oswaldo E Mejias Novielle, Luis Gerardo Rincon R OS H C.I. 20.058.509 C.I. 20.058.470 C E R E Dde Octubre Urb. 18 Urb. Los Olivos Telf. 04146933765 Telf. 04246800952 __________________ Tutor Académico Lic. Eudo Osorio, Msc DEDICATORIA Este trabajo especial de grado y todo el esfuerzo realizado para su culminación, lo dedico principalmente a Dios y a los seres que no están presentes físicamente pero no están ausentes. A mi madre Ana Mejía y padre Roberto Mejía y a toda mi familia, siempre presentes representando un pilar indispensable en el logro de mis metas. S O D VA Mejías Novielle, Luis Gerardo. D HO C E ER ER S E SR DEDICATORIA Todo el esfuerzo y tiempo invertido en la realización de este trabajo especial de grado se lo dedico principalmente a mi padre Osvaldo Rincón, mi mamá Faridys Rincón, ya que fueron y siempre han sido mis pilares de apoyo incondicional. A Dios todopoderoso, que me abrió las puertas en muchas circunstancias cuando otras se me cerraban y me lleno de perseverancia y fé en todo momento para el logro de esta grandiosa meta en mi vida. OS H C E DER S O D Rincón VARincón, Daniel Oswaldo R E RES AGRADECIMIENTOS Principalmente a Dios, por darnos la fortaleza para superar todos los obstáculos y alcanzar nuestra meta. A nuestros padres, familiares y amigos, por brindarnos su apoyo incondicional y sus confortables consejos durante el desarrollo del presente trabajo de grado. Infinitas gracias. S O D Xiomara Méndez quienes fueron de mucha ayuda V en A el alcance de nuestros R E S E objetivos. R OS H C E R E D A la Universidad Rafael Urdaneta (URU) por permitirnos utilizar sus instalaciones, A nuestro tutor académico el Licenciado Eudo Osorio, la PhD. Olga Ortiz y la Prof. y aún más importante los conocimientos de sus profesores. INDICE GENERAL RESUMEN ............................................................................................................ 11 ABSTRACT ........................................................................................................... 12 INTRODUCCIÓN .................................................................................................. 13 CAPITULO I .......................................................................................................... 15 1.1. Planteamiento del problema ..................................................................... 15 1.2. Objetivos de la investigación .................................................................... 17 S O D VA 1.2.2. Objetivos Específicos ............................................................................ 17 R E S E R S 1.3. Justificación.............................................................................................. 17 O H C E 1.4. Delimitación DERde la investigación ............................................................... 18 1.2.1. Objetivo General ................................................................................... 17 1.4.1. Delimitación espacial ......................................................................... 18 1.4.2. Delimitación temporal ........................................................................ 18 CAPITULO II ......................................................................................................... 20 2.1. Antecedentes de la investigación. ............................................................ 20 2.2. Fundamentos teóricos .............................................................................. 21 2.2.1. Aceites vegetales comestibles ........................................................... 21 2.2.2. Acidez ................................................................................................ 21 2.2.3. Índice de acidez. ................................................................................ 22 2.2.4. Titulación potenciometrica ................................................................. 22 2.2.5. Usos Generales ................................................................................. 27 2.2.6. Aplicaciones Comunes ...................................................................... 28 2.2.7. Muestras ............................................................................................ 28 2.2.8. Titulación o valoración ....................................................................... 29 2.2.9. pH ...................................................................................................... 34 2.2.10. Curvas de valoración ...................................................................... 35 2.2.11. Método de Gran. ............................................................................ 37 2.2.12. ¿Qué es y porqué se mide la conductividad? ................................. 40 2.2.13. ¿Cómo se mide la conductividad? ................................................. 41 2.2.14. Exactitud......................................................................................... 41 2.2.15. Precisión......................................................................................... 42 2.2.16. S O D Errores experimentales .................................................................. 42 VA R E ES ............................................. 43 R Errores determinadosS o sistemáticos O H C E Errores ERaccidentales o aleatorios ................................................... 44 D 2.2.17. 2.2.18. 2.2.19. 2.2.20. Incertidumbre ................................................................................. 42 Error absoluto ................................................................................. 45 2.2.21. Error relativo ................................................................................... 46 2.2.22. Regresión lineal .............................................................................. 46 2.2.23. Tabla de valores permitidos ........................................................... 48 2.2.24. Expresión de resultados ................................................................. 48 2.3. Sistema de Variables .................................................................................. 50 CAPITULO III ........................................................................................................ 51 3.1. Tipo de investigación .................................................................................. 51 3.2. Diseño de la investigación .......................................................................... 52 3.3. Técnicas de recolección de datos ............................................................... 52 3.4. Instrumentos de recolección de datos. ....................................................... 53 3.5. Fases de la investigación............................................................................ 55 CAPITULO IV ........................................................................................................ 63 4.1. Seleccionar tres (3) tipos de aceites vegetales comestibles .................... 63 4.2. Establecer los datos experimentales para el cálculo de la acidez por medio de análisis establecidos en la norma COVENIN 325:2001. ............................... 64 4.2.1. Estandarización del NaOH ................................................................ 64 4.2.2. Recolección de datos experimentales ............................................... 67 4.3. Determinar el valor del índice de acidez resultante de los diferentes métodos potenciometricos según los criterios establecidos en la Norma S O D seleccionadas. ................................................................................................... 74 VA R E S E 4.3.1. pH-metro ............................................................................................ 75 R S O H C................................................................................... E 4.3.2. Conductimetro 75 R DE COVENIN 325:2001 para las marcas de aceites vegetales comestibles 4.3.3. Método Volumétrico ........................................................................... 76 4.4. Comparar la efectividad de los métodos potenciometricos (pH-metro y conductimetro) en las marcas de aceite vegetales comestibles seleccionados. 77 CONCLUSIONES.................................................................................................. 79 RECOMENDACIONES ......................................................................................... 80 REFERENCIAS BIBLIOGRAFICAS ...................................................................... 81 INDICE DE ILUSTRACIONES Figura 2.1. Tipos de curvas de valoracion ............................................................ 37 Figura 2.2. Grafico de Gran para la determinacion del punto de equivalencia ...... 40 Figura 3.1. Esquemas para equipos de medicion potenciometrica ....................... 60 Figura4.1. Que tipo de aceite vegetal utiliza mayormente en su hogar? ............... 63 Figura 4.2. Que tipo de aceite consigue con mas frecuencia en los supermercados?.................................................................................................... 64 S O D VA Figura 4.3. Estandarizacion de la primera solución de NaOH ............................... 65 ER S E SR Figura 4.4. Estandarizacion de la segunda solución de NaOH ............................. 66 HO C E ER Figura 4.5. pH-metro para el aceite de soya #1 ................................................... 68 D Figura 4.6. conductividad para el aceite de soya #1 ............................................. 68 Figura 4.7. pH-metro para el aceite de soya #2 ................................................... 69 Figura 4.8. conductividadpara el aceite de soya #2 .............................................. 69 Figura 4.9. pH-metro para el aceite de soya #3 ................................................... 69 Figura 4.10. conductividad para el aceite de soya #3 ........................................... 69 Figura 4.11. pH-metro para el aceite de oliva #1 .................................................. 70 Figura 4.12. conductividad para el aceite de oliva #1............................................ 70 Figura 4.13. pH-metro para el aceite de oliva #2 .................................................. 71 Figura 4.14. conductividad para el aceite de oliva #2 ............................................ 71 Figura 4.15. pH-metro para el aceite de oliva #3 .................................................. 71 Figura 4.16. Conductividad para el aceite de oliva #3 ........................................... 71 Figura 4.17. pH-metro para el aceite de canola #1 .............................................. 72 Figura 4.18. conductividad para el aceite de canola #1 ........................................ 72 Figura 4.19. pH-metro para el aceite de canola #2 .............................................. 73 Figura 4.20. conductividad para el aceite de canola #2 ........................................ 73 Figura 4.21. pH-metro para el aceite de canola #3 .............................................. 73 Figura 4.22. Conductividad para el aceite de canola #3 ........................................ 73 S O D VA D HO C E ER ER S E SR INDICE DE TABLAS Tabla 2.1. Algunos indicadores comunes .............................................................. 33 Tabla 2.2. Valores de pH para varias soluciones acuosas .................................... 34 Tabla 3.1.Encuesta para la selección de aceites .................................................. 53 Tabla 3.2. Datos experimentales para las soluciones de NaOH ........................... 54 Tabla 3.3. Datos experimentales para el metodo volumetrico ............................... 54 S O D Tabla 4.1. Encuesta para la selección de aceites vegetales VA................................. 63 R E S E R Tabla 4.2. Datos experimentales para la estandarizacion de la primera solucion de S O CH NaOH .................................................................................................................... 65 E R E D Tabla 4.3. Datos experimentales para la eztandarizacion de la segunda solucion Tabla 3.4. Tabla de datos experimentales para los aceites .................................. 55 de NaOH ............................................................................................................... 66 Tabla 4.4.Concentraciones de NaOH .................................................................... 67 Tabla 4.5. Datos experimentales para el metodo volumetrico ............................... 67 Tabla 4.6. Datos experimentales para los aceites de soya ................................... 68 Tabla 4.7. Datos experimentales para los aceites de canola ................................ 70 Tabla 4.8. Datos experimentales para los aceites de Oliva ................................... 72 Tabla 4.9. Calculo del indice de acidez usando pH-metro .................................... 75 Tabla 4.10. Calculo del indice de acidez usando conductimetro ........................... 75 Tabla 4.11. Calculo del indice de acidez usando el metodo volumetrico .............. 76 Tabla 4.12. Resumen estadistico de los resultados obtenidos de todos los metodos estudiados ............................................................................................................ 77 Mejías N., Luis G; Rincon R. Daniel., “COMPARACION A TRAVES DE LOS METODOS POTENCIOMETRICOS (pH-METRO, CONDUCTIMETRO) Y VOLUMETRICOS DEL INDICE DE ACIDEZ EN ACEITES VEGETALES QUE SE CONSUMEN EN VENEZUELA”. Universidad Rafael Urdaneta. Facultad de Ingeniería Escuela de Ingeniería Química. Maracaibo, Venezuela (2013) 86pag. RESUMEN El objetivo general de la presente investigación es comparar a través de los métodos potenciométricos (pH-metro, conductímetro) y volumétricos el índice de acidez en los aceites vegetales comestibles que actualmente se consumen en Venezuela. Según la Norma COVENIN 325:2001 los aceites vegetales comestibles son la mezcla de aceites destinado al consumo humano, extraído de semillas y frutos oleaginosos tales como, oliva, ajonjolí, algodón, maíz, maní, soya, girasol, oleína de palma, canola y aquellos que se califiquen como tales por la autoridad sanitaria competente. El análisis de algunas de las características físicas y químicas de los aceites vegetales es necesario ya que de ellas derivan sus propiedades. Como primer paso se seleccionaron tres (3) tipos de aceites vegetales comestibles de tres (3) marcas diferentes que actualmente consume la población venezolana, a través de una encuesta realizada a una población en específico, posteriormente se estandarizo el proceso para calcular el porcentaje de ácido oleico y sus debidos valores permitidos con respecto al peso de las muestras. Por otra parte, se establecieron los datos experimentales para el cálculo de la acidez de las diferentes marcas de aceites por medio de experimentos en el laboratorio, estos experimentos fueron realizados por duplicado para cada una de las marcas de aceite, por último se calculó el índice de acidez para cada una de las muestras y se compararon con los valores máximo permitidos por la COVENIN 325:2001 3ra Edición. Se concluye que el cálculo del índice de acidez con los métodos potenciometricos puede generar datos mucho más confiables que para las titulaciones volumétricas, sin embargo en el caso de que se necesiten valores rápidos y aproximados sigue siendo la mejor opción utilizar los métodos volumétricos para el cálculo de dicha característica de los aceites vegetales. S O D VA ER S E SR HO C E ER D Palabras Claves: Norma COVENIN, aceites vegetales, índice de acidez. N. Mejias, Luis G, Rincon R. Daniel., “COMPARISON BY POTENTIOMETRIC METHODS (pH-METER, CONDUCTIMETER) AND VOLUMETRIC OF THE ACID IN VEGETABLE OILS CONSUMED IN VENEZUELA”. Universidad Rafael Urdaneta. Faculty of Engineering School of Chemical Engineering. Maracaibo, Venezuela (2013) 86p. ABSTRACT S O D VA The overall objective of this research is to compare through potentiometric methods (pH-meter, conductivity) and volumetric the rating acid in vegetable oils consumed in Venezuela. According to the COVENIN 325:2001 vegetable oils are a mixture of oils for human consumption, extracted from seeds and oleaginous fruits such as olive, sesame, cotton, corn, peanuts, soybeans, sunflowers, palm Olean, canola and those who qualify by the health authority competent. The analysis of some of the physical and chemical characteristics of plant oils is necessary because of them derive their properties. As a first step were selected three (3) types of vegetable oils of three (3) different brands that currently consumes the Venezuela population, through a survey to a specific population. Then, was standardizing the process for calculating the percentage of oleic acid and allowed values due. Moreover, experimental data were established for calculating the acidity of the different brands of oils by laboratory experiments, these experiments were performed in duplicate for each of the oil marks lastly was calculated acidity for each of the samples and were compared with the maximum values allowed by the 3re edition COVENIN 325:2001. It is concluded that the calculation of the acid with potentiometric methods can generate mucho more reliable data for volumetric titrations, however in the case of fast approximate values are needed; the volumetric method remains the best option for calculating said characteristic of vegetable oils. ER S E SR HO C E ER D Keywords: COVENIN, vegetable oils, rating acid. INTRODUCCIÓN Actualmente existe un incremento en las marcas de productos alimenticios como los aceites vegetales comestibles, tanto importados como nacionales dentro del mercado venezolano. Valores altos de acidez en los aceites puede llegar a generar serios problemas de salud para las poblaciones que lo consumen, es debido a esto que se genera la necesidad de hacer un estudio de la calidad de los aceites vegetales comestibles que actualmente se consumen dentro de la población venezolana. S O D VA El índice de acidez es el número de miligramos de hidróxido de potasio R E S E libres contenidos en 1gr de aceite o requeridos para neutralizar los ácidos grasos R S HO C grasa. La acidez en losE aceites vegetales es muy variable. El análisis de algunos R E de los rasgosD físicos y químicos de los aceites vegetales es preciso ya que de ellas derivan sus propiedades fisicoquímicas. Los aceites pueden sufrir diferentes transformaciones y reducir el valor nutritivo del alimento, producen compuestos volátiles que imparten olores y sabores desagradables (Badui, 2006). Por esta razón, el contenido de ácidos grasos libres ha sido propuesto como un índice sensible del incipiente deterioro de los aceites. Existen varios métodos para el análisis del índice de acidez en aceites vegetales estipulados por diferentes leyes y normas aplicadas para cada país, con valores permitidos, concentraciones de las soluciones y diferentes reactivos. Es de gran importancia realizar la comparación de los métodos potenciométricos y volumétricos para la valoración del índice de acidez, dado que se busca siempre obtener el método que provea este valor de forma más rentable. Es importante resaltar que todos estos métodos están sometidos a errores humanos. El objetivo principal del presente trabajo especial de grado es comparar a través de los métodos potenciométricos (pH-metro, conductímetro) y volumétricos el índice de acidez en los aceites vegetales comestibles que actualmente se consumen en Venezuela. Para lograr esta meta se llevaron a cabo los siguientes pasos: Selección de 3 tipos de aceites vegetales comestibles de 3 marcas diferentes que actualmente consume la población Venezolana a través de una encuesta compuesta de 3 simples preguntas para determinar qué tipo de aceites y que marcas se escogerían para la realización de la parte experimental del trabajo de investigación. Obtención de los datos experimentales para el cálculo de la acidez de las S O D establecidos en la noma COVENIN 325:2001. Todos VAestos experimentos se R E Slos errores humanos que se puedan E realizaran por duplicado para minimizar R S O H presentar. De esta forma se presentaran las conclusiones. C E R E D del valor de índice de acidez resultante de los datos Determinación diferentes marcas de aceites vegetales comestibles por medio de análisis experimentales obtenidos en el laboratorio a través de cálculos aritméticos. Comparación de la efectividad de cada uno de los métodos potenciometricos seleccionados (pH-metro, conductimetro) y del método volumétrico, a través de diferencias porcentuales con respecto al valor máximo permitido para cada tipo de aceite, lo cual fue el objetivo final de la investigación. Con esto se consiguió demostrar el método más exacto y con mejor eficiencia para la determinación del índice de acidez en aceites vegetales, cuyo valor es de suma importancia al momento de calificar la calidad de un aceite vegetal para su consumo. Así como también, la viabilidad del método volumétrico con respecto a los métodos potenciometricos CAPITULO I EL PROBLEMA En el presente capítulo se presenta una descripción del tema de investigación abarcando principalmente el problema que se desea solucionar, se indica como debe realizarse, a quienes les favorece, cuáles serán los posibles logros obtenidos al finalizar el trabajo y por supuesto se definen los pasos que se seguirán para llevar a cabo el desarrollo satisfactorio de la investigación. 1.1. Planteamiento del problema S O D VA ER S E Rde diferentes parámetros fisicoquímicos, La calidad de los aceites depende S O CHa través de leyes y normas. En el caso del índice de los cuales están establecidos E R DElas Normas COVENIN para la caracterización de la misma. acidez se emplea Según la Norma COVENIN 325:2001 los aceites vegetales comestibles son la mezcla de aceites destinado al consumo humano, extraído de semillas y frutos oleaginosos tales como, oliva, ajonjolí, algodón, maíz, maní, soya, girasol, oleína de palma, canola y aquellos que se califiquen como tales por la autoridad sanitaria competente. Todos estos tipos aceites tienen un índice de acidez que debe ser medido para establecer la calidad del mismo. La acidez en los aceites vegetales es muy variable. Generalmente las grasas frescas o recién preparadas o mejor conocido como aceites, no contienen ácidos grasos libres o si los contienen se presentan en muy pequeñas cantidades, al envejecer, especialmente sino han estado protegidos de la acción del aire y la luz su acidez crece lentamente al principio y con cierta rapidez después. La acidez tiene importancia tanto para aceites comestibles como para los lubricantes, porque ni unos ni otros pueden contener ácidos grasos libres más allá de un límite dado. Los ácidos grasos se consideran como impurezas en las grasas. 16 El método de titulación potenciométrica según (Brunatti & De Napoli, 2002), consiste en calcular el potencial (voltaje) en una solución por medio de un electrodo en función del volumen de agente valorante agregado. En este sentido, el potencial que se mide se puede transformar a unidades de concentración de una especie en solución. La ventaja de medir el potencial es que éste se determina utilizando un electrodo que es selectivo a la especie o analito que se quiere analizar. Por lo tanto, el voltaje que se evalúa en la solución es representativo de la concentración de la especie en solución. Este alto grado de S O D una solución que contiene múltiples especies químicas) VAse debe a la propiedad R E S E física del electrodo con que se mide el voltaje. R OS H C E R E D En este experimento el voltaje es selectivo a la concentración del ion hidronio selectividad (señal analítica que puede mostrar un pequeño grupo de analitos en en solución. Existen electrodos selectivos a otros iones tales como cloruro, el ion ferroso, etc. La ventaja del uso de los métodos potenciométricos es que la determinación del punto final es mucho más precisa que el determinado con indicadores visuales. El análisis de algunas de las características físicas y químicas de los aceites vegetales es necesario ya que de ellas derivan sus propiedades. En los productos alimenticios permite establecer adulteraciones e identificar productos nuevos. Debido a la creciente demanda de productos alimenticios que ocurre actualmente en el país; específicamente aceites vegetales comestibles, es necesario determinar el índice de acidez por un método de alta precisión y exactitud para indicar si se está cumpliendo con lo establecido en las normas COVENIN 325:2001. El presente trabajo de investigación pretende realizar la comparación del índice de acidez de varios aceites vegetales comestibles a través de dos métodos 17 potenciométricos muy conocidos como lo son: el pH-métrico y el conductimétrico, con el objetivo de determinar una de las características que presiden la calidad de los aceites vegetales comestibles que se encuentran dentro del mercado y compararlo con los expresados en la normas COVENIN 325:2001. 1.2. Objetivos de la investigación 1.2.1. Objetivo General Comparar a través de los métodos potenciometricos (pH-metro, S O D comestibles que actualmente se consumen en Venezuela. VA R E S E R OS H 1.2.2. Objetivos Específicos C E DER conductimetro) y volumétricos el índice de acidez en los aceites vegetales 1. Seleccionar tres (3) tipos de aceites vegetales comestibles de tres (3) marcas diferentes que actualmente consume la población venezolana. 2. Establecer los datos experimentales para el cálculo de la acidez de las diferentes marcas de aceites vegetales comestibles por medio de análisis establecidos en la norma COVENIN 325:2001. 3. Determinar el valor del índice de acidez resultante de los diferentes métodos potenciométricos y volumétricos según los criterios establecidos en la Norma COVENIN 325:2001 3ra Edición para las marcas de aceites comestibles seleccionadas. 4. Comparar la efectividad de los métodos potenciometricos (pH-metro, conductimetro) y volumétricos en las marcas de aceite vegetales comestibles seleccionados. 1.3. Justificación A partir del presente trabajo de investigación, se pretende comparar la información de uno de los parámetros que rigen la calidad de los aceites 18 vegetales que actualmente se consume la población con los que estipula la norma COVENIN 325:2001 a través de los resultados obtenidos por los métodos potenciométricos y volumétricos como lo son: pH-metro, el conductimetro y la titulación, así mismo realizar la comparación de los métodos con respecto a la valoración del índice de acidez, dado que la calidad de los aceites es de gran importancia para justificar el cultivo de la especie que lo provee en forma rentable así como el impacto en la salud que pueda generar su consumo. De lo anterior se desprende que la calidad de los aceites vegetales juega un S O D tiamina, caroteno, lactosa, así como las vitaminas A, D VyAK el sistema estructural R E S E del ser humano. R OS H C RE E D 1.4. Delimitación de la investigación papel importante en la alimentación por cuanto ello permite la fijación del calcio, 1.4.1. Delimitación espacial La investigación se realizó en el Laboratorio de Química de la Universidad Rafael Urdaneta (URU), Ubicada en la Vereda del Lago en Maracaibo, Avenida 2, El Milagro, con calle 86, Municipio Maracaibo. Estado Zulia, Venezuela. 1.4.2. Delimitación temporal El trabajo de investigación fue realizado en un periodo de tiempo comprendido desde el mes Abril de 2013 hasta el mes de Diciembre de 2013. 1.4.3. Delimitación científica El presente trabajo se enmarco en el área analítica de la Ingeniería Química, especialmente en la parte de técnicas potenciométricas y volumétricas para la 19 determinación del índice de acidez en aceites. Los aceites comestibles fueron seleccionados y proporcionados por los bachilleres. Como base para llevar a cabo la investigación se necesita conocimientos de las siguientes cátedras; Química II, Química Analítica, Métodos instrumentales de análisis. S O D VA D HO C E ER ER S E SR CAPITULO II MARCO TEORICO La realización del presente estudio requirió de la sustentación de diversas investigaciones previas que permiten considerarlos como antecedentes documentales, así como todo un conjunto de teorías que permiten ahondar sobre el objeto de estudio, y de los cuales se consideraron de importancia y estrechamente relacionado con la investigación realizada. 2.1. S O D VA ER S E SR Antecedentes de la investigación. HO C E ER (Hernandez , Rodriguez, Zulai, & Perez, 2009) Realizaron un trabajo de D investigación denominado EFECTO DEL ALMACENAMIENTO DEL GRANO DE MAIZ (ZEA MAYS) SOBRE LA CALIDAD DEL ACEITE EXTRAIDO realizado en la Universidad de Carabobo, facultad de ingeniería, Escuela de Ingeniería Química. En dicho trabajo, se evaluó el efecto del almacenamiento de maíz (zea mays) sobre la calidad del aceite extraído del mismo, por lo que se tuvo la necesidad de evaluar la calidad del aceite a través del índice de acidez del mismo. (Albarracin, et al., 2010) Publicaron el siguiente trabajo de investigación titulado ESTUDIOS DE CARACTERIZACION DE ACEITES USADOS EN FRITURAS PARA SER UTILIZADOS EN LA OBTENCION DE JABON, realizado en el departamento de ingeniería de procesos de la Universidad Nacional de Tucumán. En esta investigación se produce debido a que desde hacía años la industria de los alimentos usaba el aceite vegetal solo para la cocción de frituras, y este aceite quemado era desechado, y para dar respuesta a esta problemática se 21 determinó el índice de acidez y saponificación de los aceites usados, para ser usado como materia prima para la fabricación de jabón. (Novoa & Salazar, 2013) Presentan el trabajo especial de grado ante la Universidad Rafael Urdaneta “Comparación de los métodos de titulación fotométrica y volumétrica para la determinación de alcalinidad y dureza en aguas”. El trabajo especial de grado se fundamentó en la comparación de dos métodos de titulación, con el fin de detectar diferencias significativas entre los 31 S O D luego comparar estos resultados a través de medidas estadísticas. VA R E S E R HOS 2.2. Fundamentos E teóricos C DER resultados obtenidos en ambos para la valoración de aguas de calderas, para 2.2.1. Aceites vegetales comestibles Según la Norma COVENIN 325:2001 los aceites vegetales comestibles son la mezcla de aceites destinado al consumo humano, extraído de semillas y frutos oleaginosos tales como, oliva, ajonjolí, algodón, maíz, maní, soya, girasol, oleína de palma, canola y aquellos que se califiquen como tales por la autoridad sanitaria competente. 2.2.2. Acidez Según la norma COVENIN 325:2001 la acidez es el contenido de ácidos grasos libres de un aceite o grasa vegetal, expresado en gramos de ácido oleico, palmítico o laurico, por 100 gr de muestra. 22 2.2.3. Índice de acidez. Según la norma COVENIN 325:2001 el índice de acidez es el número de miligramos de hidróxido de potasio requeridos para neutralizar los ácidos grasos libres contenidos en 1gr de aceite o grasa. 2.2.4. Titulación potenciometrica Consiste en medir el potencial de un electrodo indicador apropiado en función del volumen de valorante. Este tipo de titulación proporciona datos más S O D especialmente cuando se trabaja con soluciones fuertemente VA coloreadas o turbias. R E Por otra parte, presenta el inconveniente de S requerir mucho más tiempo que las E R S HOWest, Holler, & Crouch, 2005). valoraciones volumétricasC (Skoog, E DER exactos que los obtenidos por métodos que usan indicadores químicos, En este tipo de titulación el punto final se obtiene determinando el punto en el cual ocurre un cambio de potencial relativamente alto cuando se agrega un titulante. Además puede realizarse en forma manual o con un proceso automatizado. Las titulaciones manuales miden el potencial después de cada adición de titulante y luego esas lecturas se grafican contra el volumen de titulante. En este punto el analista determina el punto de inflexión de la curva, por lo que existe cierta inexactitud en el procedimiento. Otro método es utilizando un potenciómetro registrador, el cual va tomando automáticamente datos de potencial del electrodo a medida que el analista realiza la titulación, para luego proceder a graficarlos. En este punto se tienen las mismas dificultades que con las titulaciones potenciométricas manuales, en cuanto a la exactitud del punto final obtenido con la curva. Una variable de este sistema lo constituyen las titulaciones completamente automatizadas, en las cuales la bureta se detiene mecánicamente al alcanzar el punto final (Day & Underwood, 1986). 23 2.2.4.1. Electrodos de referencia Como lo explicado en (Skoog & Leary, 1994) los electrodos de referencia se les conoce como aquel electrodo cuyo potencial de semicelda es conocido, constante y completamente insensible a la composición de la disolución en estudio. Un electrodo de referencia ideal tiene las siguientes características: Es reversible y obedece a la ecuación de Nerst. Presenta un potencial constante todo el tiempo. Retorna a su potencial original después de haber estado sometido a S O D VA ER S E Presenta poca histéresis con ciclos Rde temperatura. S O CH E R DE Pese a que no hay ningún electrodo de referencia que se ajuste por completo pequeñas corrientes. a estas características, son varios los que se acercan mucho como lo son: a. Electrodos de calomelanos Son electrodos que están compuestos de mercurio en contacto con una solución saturada de cloruro de mercurio (I) que contiene también una concentración conocida de cloruro de potasio (Skoog & Leary, 1994). De los electrodos de este tipo, el más utilizado es el electrodo de calomelano saturado (ECS) debido a la gran facilidad con la que se puede preparar. b. Electrodos de plata / cloruro de plata Para los electrodos de plata o de cloruro de plata el sistema es semejante al anterior y consiste en un electrodo de plata sumergido en una disolución saturada de cloruro de potasio y cloruro de plata: 24 Los modelos comerciales de este electrodo son semejantes en apariencia externa a los electrodos de calomelanos, si bien en estos de plata / cloruro de plata, el tubo interno se reemplaza por un alambre de plata recubierto con una capa de cloruro de plata que se encuentra sumergido en una disolución de cloruro de potasio saturada con cloruro de plata. Los electrodos de plata/cloruro de plata tienen la ventaja de que pueden utilizarse a temperaturas superiores a 60ºC, mientras que los electrodos de calomelanos no. Por otra parte los iones Hg (I) reaccionan con menos S O D a la obturación de la unión entre el electrodo y la disolución VA del analito (Skoog & R E S E Leary, 1994). R OS H C E DER componentes de la muestra que los iones plata. Tales reacciones pueden conducir 2.2.4.2. Electrodos indicadores metálicos Junto con el electrodo de referencia se utiliza un electrodo indicador cuya respuesta depende de la concentración del analito. Según (Day & Underwood, 1986) Los electrodos indicadores para las medidas potenciométricas son de dos tipos fundamentales, denominados metálicos y de membrana. Estos últimos se denominan también electrodos específicos o selectivos para iones. a. Electrodos redox Son electrodos que responden al potencial redox de una disolución formada por una o más parejas redox. Los más utilizados son aquellos constituidos por oro, platino, paladio u otros metales inertes. Estos electrodos actúan como una fuente o como un sumidero de los electrones transferidos desde un sistema redox presente en la disolución (Day & Underwood, 1986). 25 Hay que resaltar que los procesos de transferencia de los electrones en los electrodos inertes no suelen ser reversibles y por lo tanto, lo electrodos inertes no responden a muchas de las semirreacciones de las tablas de electrodos de una forma predecible. b. Electrodos de primera clase Aquellos que están formados por un metal en contacto con una disolución que contiene sus iones. Por ejemplo un hilo de plata en una disolución de nitrato S O D VA de plata. El potencial del electrodo responde a la actividad de los iones plata en ER S E SR disolución, entre otros. HO C E ER Estos electrodos no son muy utilizados en el análisis potenciométrico porque D presentan una serie de inconvenientes tales como: No son muy selectivos ya que responden no sólo a sus propios cationes sino también a otros cationes más fácilmente reducibles. Algunos de estos electrodos metálicos tan sólo se pueden utilizar en disoluciones básicas o neutras ya que en disoluciones ácidas se disuelven. Algunos metales se oxidan tan fácilmente que su uso queda restringido a disoluciones previamente des aireadas, esto es, disoluciones a las que previamente se las ha eliminado el oxígeno. Ciertos metales, tales como hierro, cromo, cobalto y níquel no proporcionan potenciales reproducibles. (Day & Underwood, 1986). c. Electrodos de segunda clase Por otra parte tenemos los electrodos de segunda clase que están formados por un metal en contacto con una disolución saturada de una de sus sales poco 26 solubles. Se basan en la propiedad de que algunos metales no sólo responden hacia sus propios cationes, sino que también son sensibles a la actividad de aniones que forman precipitados poco solubles o complejos estables con dichos cationes (Day & Underwood, 1986). d. Electrodos de tercera clase Por ultimo tenemos los electrodos de tercera clase, en donde clase implica dos equilibrios que afectan a la pareja redox Mn+ / M. Por ejemplo, un electrodo de S O D ligando común para el Ca y Hg . La reacción de intercambio VA electrónico implica R E S E a la pareja redox Hg / Hg. R OS H C E DER tercera clase que responda al ion Ca 2+ se puede obtener utilizando AEDT como 2+ 2+ 2+ 2.2.4.3. Electrodos selectivos de iones Según (Day & Underwood, 1986) los electrodos selectivos de iones (ESI) implican la medida de un potencial de membrana. Es decir, permiten la determinación rápida y selectiva de numerosos cationes y aniones por medidas potenciométricas directas. Se les denomina electrodos selectivos de iones por la gran selectividad que tienen. La respuesta de la célula electroquímica, por tanto, se basa en la interacción entre la membrana y el analito que altera el potencial a través de dicha membrana. La selectividad de la respuesta de potencial hacia la especie de interés depende de la especifidad de la interacción de la membrana con esa especie. 2.2.4.4. Electrodos de membrana sensibles a los gases Los electrodos sensibles a los gases consisten en un ESI en contacto con una capa fina de un electrolito acuoso que se encuentra en el interior de otro ESI 27 rodeada de una membrana permeable a los gases. Los gases pasan a través de la membrana, se disuelven en el electrólito y modifican la situación de equilibrio del sistema. Esta modificación es detectada por el ESI y está relacionado con la presión parcial del gas en la muestra (Day & Underwood, 1986). 2.2.4.5. Electrodos de membrana biocatalitica (biosensores) En lo explicado en (Day & Underwood, 1986) los electrodos de membrana biocatalitica están formados por un ESI, o un electrodo sensible a los gases en S O D VA contacto con una capa fina de un material biocatalítico. El biocatalizador convierte ER S E SR el sustrato (analito) en un compuesto que puede ser detectado por el electrodo. HO C E ER D Los electrodos de este tipo se conocen como biosensores. La capa de biocatalizador está constituida por una enzima inmovilizada que es escogida por su selectividad catalítica hacia el analito. Por ejemplo, la ureasa inmovilizada en un gel de poliacrilamida situado en el extremo de un ESI para el ion NH4+, da lugar a un electrodo selectivo para la determinación de la urea. 2.2.5. Usos Generales Según (Brunatti & De Napoli, 2002) los métodos potenciometricos se pueden utilizar para una gran variedad de determinaciones, como es: Determinación cuantitativa selectiva de muchos iones inorgánicos y orgánicos en solución. Determinación de iones en un estado de oxidación específico dentro de una muestra. Determinación de constantes de estabilidad de complejos. Determinación de velocidades y mecanismos de reacción. Determinación cuantitativa de gases ácidos y básicos. 28 Determinación cuantitativa de productos de reacción enzimáticos. 2.2.6. Aplicaciones Comunes Las aplicaciones más comunes y más ejecutadas a niveles de campo, que se aplican en la actualidad son: Análisis de iones de procesos industriales batch o continuos. Determinación de monitoreo continuo de la calidad de aire y gases contaminantes. S O D A V Desarrollo de biosensores basados en enzimas inmovilizadas y electrodos. R E Sen muestras de agricultura, medio E R Determinación de iones constituyentes OS H C ambiente y farmacia. RE E D Determinación de pH. Determinación del punto final en titulaciones de ácidos, bases y redox. Determinación de electrolitos en fluidos fisiológicos para análisis clínicos. (Brunatti & De Napoli, 2002) 2.2.7. Muestras Las muestras de los análisis potenciometricos deben cumplir con ciertas características que son explicadas en (Brunatti & De Napoli, 2002), estas son: Estado: Se pueden analizar fácilmente la mayoría de las muestras líquidas y gaseosas. Las muestras sólidas se pueden analizar si es posible prepararlas en forma de solución. Cantidad: Los límites de detección son de aproximadamente 10-5 a 10-6 M para electrodos convencionales. Para sensores de gas, los límites de detección varían entre 0,01 y 5 ppm. 29 Preparación: Se requiere poca preparación para muestras líquidas y gaseosas. Las muestras sólidas se deben preparar en solución. Los sólidos orgánicos que no se disuelven fácilmente (tales como alimentos, vegetales y productos farmacéuticos) se deben calcinar primero, y luego extraer los iones empleando un solvente adecuado. 2.2.8. Titulación o valoración Las titulaciones incluyen un número de métodos cuantitativos que se basan S O D VA en la determinación de la cantidad en volumen de un reactivo patrón de ER S E SR concentración conocida, denominada valorante, necesario para reaccionar por HO C E ER completo con un analito. D La valoración se lleva a cabo agregando lentamente la solución patrón desde una bureta, a una solución de analito, hasta completar la reacción entre los dos. El volumen de valorante necesario para completar la reacción se determina por diferencia entre la lectura final y la inicial. Las soluciones patrón usadas en estas valoraciones son ácidos o bases fuertes, ya que estas reaccionan completamente con el analito, lo que genera un punto de equivalencia definido. Estas reacciones tienen una estequiometria conocida y reproducible y son ampliamente utilizadas en analítica para determinación de ácidos, bases, oxidantes, reductores, iones metálicos, proteínas y muchas otras especies (Skoog, West, Holler, & Crouch, 2005). 2.2.8.1. Punto de equivalencia y punto final de la valoración El punto de equivalencia de una titulación es un punto teórico que se alcanza cuando la cantidad de solución patrón añadida es químicamente equivalente a la cantidad de analito en la muestra (Skoog, West, Holler, & Crouch, 2005). 30 Es un resultado ideal, donde la cantidad de valorante añadida es la necesaria para que reaccione estequiométricamente con el analito. Sin embargo, lo que realmente se mide es el punto final, el cual se aprecia por un cambio brusco de una propiedad del sistema reaccionante. El valor exacto del pH al que se produce el cambio de color de un indicador puede calcularse a partir de la constante de disociación de dicho indicador. Para que el ojo humano aprecie el cambio de color se necesita un exceso de entre 5 y S O D produce el cambio de color del indicador: margen de pH es igual a la media VA R E Sácido, que no es más que la medida E logarítmica de la constante de disociación del R OS H cuantitativa de la fuerza del ácido en la solución, la constante de equilibrio de la C E R E reacción ácidoD base, más o menos uno. 10 veces. Haciendo esta consideración se obtiene el margen de pH en el cual se Según lo anterior, un indicador dado es adecuado para determinar el pH solamente en la zona donde tiene lugar el cambio de color; ahora bien, si el cambio de pH en el punto de equivalencia es muy grande es posible no ser tan restrictivo en la elección del indicador. La diferencia entre el punto de equivalencia y el punto final es el error de valoración, que es básicamente inevitable. Elegir una propiedad física cuyo cambio no sea difícil de observar hace posible conseguir que el punto final esté muy cerca del punto de equivalencia (Harris, 2007). Para obtener resultados óptimos en la valoración, se debe hacer lo posible por asegurar que toda diferencia entre el punto final y el punto de equivalencia, llamada error de valoración, sea mínima (Skoog, West, Holler, & Crouch, 2005). 31 Normalmente es posible establecer el error de la valoración con una valoración en blanco, que consiste en realizar el mismo procedimiento pero sin el analito (Harris, 2007). 2.2.8.2. Patrón primario Mediante el proceso de estandarización se puede conocer con exactitud la concentración del valorante. Para ello se emplea una titulación, en la que reacciona este valorante con un patrón primario, que es un compuesto de elevada pureza que sirve como material de referencia (Skoog, West, Holler, & Crouch, S O D VA 2005). ER S E Rlas siguientes características: El patrón primario debe cumplirS con O CH E R DE a. Debe encontrarse disponible en una forma pura o de pureza conocida. El porcentaje de impurezas no debe ser mayor de un 0.02%, además debe ser posible determinar las impurezas mediante ensayos cualitativos. b. Debe ser estable. Fácil de secar y no debe ser tan higroscópica como para perder agua mientras se pesa. No debe perder peso al contacto con el aire. c. Debe tener un peso equivalente razonablemente elevado para minimizar errores al pesar (Day & Underwood, 1986). d. Debe tener un coste moderado. e. Debe poseer una solubilidad razonable con el medio de valoración. Existen pocos compuestos que se aproximen a este criterio. Comercialmente existen limitados patrones primarios, por lo que pueden usarse compuestos menos puros o patrones secundarios, cuya pureza se establece mediante análisis minuciosos (Skoog, West, Holler, & Crouch, 2005). 32 2.2.8.3. Titulación volumétrica Como en toda valoración, este método se basa en reacciones químicas entre la solución patrón y el analito. El punto de equivalencia química se detecta por medio de un indicador acido-base, que es un ácido orgánico o una base orgánica débil cuya forma disociada tiene un color distinto que su base o acido conjugado; este indicador produce un cambio físico observable, el punto final, cuando se alcanza el punto de equivalencia o valores cercanos a él. Los grandes cambios en la concentración de analito o valorante ocurren en la del punto de equivalencia, con lo que se modifica el aspecto del indicador; los cambios típicos incluyen S O D VA aparición o desaparición de color o turbidez, o cambio de color. ER S E SR HO C E coloidales DERinfluyen en el Variables como la temperatura y la presencia de solventes orgánicos y partículas intervalo de pH en el que un indicador específico cambia de color. Algunos de estos efectos pueden hacer que el intervalo de transición del indicador se desplace en varias unidades de pH. Este tipo de titulación es muy susceptible a dos tipos de errores. El primero ocurre cuando el pH que modifica el color del indicador es distinto al PH del punto de equivalencia, por lo que es importante seleccionar un indicador adecuado para el procedimiento a realizar (Skoog, West, Holler, & Crouch, 2005). Cualquier indicador cuyo cambio de color se encuentre cerca del punto final de la titulación proporcionará una localización más exacta del punto de equivalencia (Harris, 2007). El segundo error se origina por la limitada capacidad del ojo humano para distinguir el color intermedio del indicador. La extensión de este error depende del cambio de pH de reactivo en el punto de equivalencia, la concentración del indicador y la sensibilidad del ojo a los dos colores extremos del indicador (Skoog, West, Holler, & Crouch, 2005). 33 La diferencia entre el punto final observado, es decir, el cambio de color del indicador, y el verdadero punto de equivalencia se llama error del indicador. Si se añade una gran cantidad de indicador a la mezcla a valorar, se introduce un error variable según el indicador debido a que los indicadores son ácidos o bases y reaccionarían con el analito o el valorante, por lo que nunca se debe añadir más de unas pocas de disolución diluida del indicador. Para utilidad práctica se supone que los moles del indicador son despreciables frente a los moles del analito. En la siguiente tabla se muestra una lista de indicadores comunes, S O D busca un indicador cuyo intervalo de transición se acerque VA lo más posible a la R E S El error en la valoración por la E zona de mayor pendiente de la curva de titulación. R S O H no coincidencia del punto final con el punto de equivalencia será más pequeño C E R E D esté la curva de titulación en las cercanías del punto de cuanto más inclinada incluyendo el intervalo de transición y el viraje de color. En términos generales se equivalencia (Harris, 2007). Tabla 2.1. Algunos indicadores comunes. Indicador Intervalo de transición (pH) Color de la forma acida Violeta de metilo 0.0 – 1.6 Amarillo Color de la forma básica Azul Rojo de cresol 0.2 – 1.8 Rojo Amarillo Azul de timol 1.2 – 2.8 Rojo Amarillo Púrpura de cresol 1.2 – 2.8 Rojo Amarillo Eritrosina disódica 2.2 – 3.6 Anaranjado Rojo Anaranjado de metilo 3.1 – 4.4 Rojo Anaranjado Rojo congo 3.0 – 5.0 Violeta Rojo Anaranjado de etilo 3.4 – 4.8 Rojo Amarillo Verde de bromocresol 3.8 – 5.4 Amarillo Azul Rojo de metillo 4.8 – 6.0 Rojo Amarillo Rojo de clorofenol 4.8 – 6.4 Amarillo Rojo Púrpura de bromocresol 5.2 – 6.8 Amarillo Púrpura p-Nitrofenol 5.6 – 7.6 Incoloro Amarillo Tornasol 5.0 – 8.0 Rojo Azul Azul de bromotimol 6.0 – 7.6 Amarillo Azul Rojo de fenol 6.4 – 8.0 Amarillo Rojo Rojo neutro 6.8 – 8.0 Rojo Naranja Rojo de cresol 7.2 – 8.8 Amarillo Rojo α-Naftolftaleína 7.3 – 8.7 Amarillo Azul Púrpura de cresol 7.6 – 9.2 Amarillo Púrpura Azul de timol 8.0 – 9.6 Amarillo Azul Fenolftaleína 8.0 – 9.6 Incoloro Rojo (Harris, 2007) 34 2.2.9. pH Siglas de potencial de hidrógeno, es una medida de la acidez/alcalinidad de una solución acuosa a una temperatura específica, usualmente de 20 a 25 ºC. Se mide en una escala continua de 0 a 14, siendo ácidas las disoluciones con pH menores a 7 y alcalinas las que tienen pH mayores a 7. El pH 7 indica la neutralidad de la disolución. Tabla 2.2. Valores de pH para varias soluciones acuosas. pH 0 1 2 3 4 5 6 7 8 9 pHS O D VA 0 1 mol dm R HCl E Sde batería E Ácido 1 R S Acidez/Alcalinidad Ejemplos -3 HO C E ER Muy ácido D Ligeramente ácido Neutro Jugo gástrico Vinagre Jugo de tomate Champú suave Saliva Agua pura Leche de magnesia 10 11 12 13 Ligeramente alcalino Amoníaco casero 14 Alcalino 1 mol dm-3 NaOH 2 3 4 5 6 7 8 9 10 11 12 13 14 Las mediciones de pH también son realizadas en muestras más complejas como alimentos, aceites, emulsiones, proteínas, lodos, lechadas y líquidos no acuosos. El valor del pH se puede medir de forma precisa mediante un potenciómetro, midiendo la diferencia de potencial entre dos electrodos. También se puede medir de forma aproximada empleando indicadores ácidos o bases débiles que 35 presentan diferente color según el pH. Generalmente se emplea papel indicador, que se trata de un papel impregnado de una mezcla de indicadores cualitativos para la determinación del pH (Prichard, 2003). 2.2.9.1. pH-metro El pH-metro es un sensor utilizado en el método electroquímico para medir el pH de una disolución. La determinación de pH consiste en medir el potencial que se desarrolla a través de una fina membrana de vidrio que separa dos soluciones S O D VA con diferente concentración de protones. En consecuencia se conoce muy bien la ER S E SR sensibilidad y la selectividad de las membranas de vidrio delante el pH. HO C E ER D Una celda para la medida de pH consiste en un par de electrodos, uno de calomel (mercurio, cloruro de mercurio) y otro de vidrio, sumergidos en la disolución a la que se quiere medir el pH. La varita de soporte del electrodo es de vidrio común no conductor, mientras que el bulbo, que es el extremo sensible del electrodo, está formado por un vidrio polarizable o vidrio sensible al pH. El voltaje en el interior del bulbo es constante, porque se mantiene su pH en 7, de manera que la diferencia de potencial solo depende del pH del medio externo. El alambre que se sumerge en su interior permite conducir este potencial hasta un amplificador (Lopez, Gomez, Rivas, & Losada, 1974). 2.2.10. Curvas de valoración Es una gráfica que representa la forma en que varía una propiedad fisicoquímica de la solución o función p, en relación al volumen del agente valorante. Permite visualizar como varía esta propiedad en el transcurso de la 36 valoración y permite determinar con certeza el punto final de la valoración y otras características de la misma (Riaño, 2007). En toda curva de titulación, Los dos puntos finales más usuales implican cambio de color debido a un indicador y cambio de potencial de un electrodo que responde a la concentración del reactivo o analito. En estas curvas el volumen del reactivo se representa en el eje horizontal y la concentración del analito o reactivo en el eje vertical. S O D titulaciones, en el primero, llamado curva sigmoidea, VA las observaciones R E S E importantes se hallan en una pequeña región en torno al punto de equivalencia, de R S HelOeje vertical en una curva de valoración sigmoidea generalmente ±0.1 a ±0.5 mL, C E DpEdelRanalito o reactivo, o el potencial de un electrodo sensible al es una función Existen dos tipos generales de curvas de valoración que se usan en analito o reactivo. En el segundo tipo, llamado curva de segmento lineal, se realizan medidas de ambos lados y alejadas del punto de equivalencia; en esta curva el eje vertical representa la lectura de un instrumento que es directamente proporcional a la concentración de reactivo o analito. De entre las dos, las curvas sigmoideas presentan ventajas de rapidez y utilidad mientras que el tipo de segmento lineal es ventajoso para reacciones en las que se necesita un exceso considerable de analito (Skoog, West, Holler, & Crouch, 2005). En la figura a continuación se puede observar en detalle los dos tipos generales de curvas de valoración, a la izquierda e identificada con la letra A se encuentra la curva sigmoidea; mientras que a la derecha y con la letra B, se puede observar la curva de segmento lineal. 37 S O D VA Figura 2.1 Tipos de curvas de valoración (Skoog, West, Holler, & Crouch, 2005) ER S E R 2.2.11. Método de Gran. S O CH E R DE Hernandez, 2009) el método de Gran se basa en el ajuste Según (Matilla mediante mínimos cuadrados de la recta resultante de representar la función de Gran para la valoración de un ácido fuerte con una base fuerte viene dada por la siguiente expresión: ( Siendo ) (Ec. 2.1) el volumen inicial de la valoración, esta ecuación conduce a una recta de ecuación , En donde m es la pendiente y b es la ordenada en el origen. Cuando G es igual a cero, X es igual al volumen en el punto de equivalencia, pudiéndose calcular este mediante el coeficiente ⁄ . 2.2.11.1. Uso de un gráfico de Gran para hallar el punto final en titulaciones potenciométricas. Este tipo de gráficos utiliza datos tomados antes del punto final, para localizar al mismo. Considerando la valoración de un ácido débil (HA) con una base fuerte (BOH): 38 [ ] [ [ ] (Ec. 2.2) ] Dónde: Ka: constante de disociación del ácido [H+]: Concentración molar del ion hidrógeno [HA]: Concentración molar del ácido débil [A–]: Concentración molar de la base conjugada del ácido γH+: Coeficiente de actividad del ion hidrógeno γA–: Coeficiente de actividad de la base conjugada del ácido γHA: Coeficiente de actividad del ácido débil S O D VA ER S E SR HO C E responde a la actividad DER del ion hidrógeno, no a la concentración. Será necesario incluir los coeficientes de actividad porque el electrodo de pH En cualquier punto que esté entre el punto inicial y el punto final de la titulación, puede decirse que, aproximadamente, cada mol de BOH convierte un mol de HA en un mol de A–, siempre y cuando la reacción química sea 1 a 1. Si se han valorado Va mL de HA (de concentración formal Fa) con Vb de BOH (de concentración formal Fb) se puede decir que: [ [ (Ec. 2.3) ] (Ec. 2.4) ] Sustituyendo los valores de [ ] y [ ] en la constante de equilibrio se obtiene: [ ] ( Que puede transformarse en: ) (Ec 2.5) 39 [ Sabiendo que [ ] ] ( ) (Ec. 2.6) ) (Ec. 2.7) se tiene que: ( El término entre paréntesis de la derecha es: S O D VA (Ec. 2.8) ER S E R de equivalencia. Por consiguiente la Donde Ve es el volumen en S el punto O H como: Cescribirse ecuación del métodoR puede E DE (Ec 2.9) Un gráfico que represente Gran. Si en función de Vb se llama gráfico de es constante, el gráfico es una línea recta con pendiente ,y abscisa en el origen del eje x, Ve puede expresarse en cualquier unidad, pero se deben usar las mismas unidades en los dos ejes. En la figura siguiente se puede observar un ejemplo de gráfico de Gran, donde ambos ejes han sido expresados en microlitros. 40 S O D VA Figura 2.2 Grafico de Gran para la determinación del punto de equivalencia ER S E La función de Gran nunca llega a 0R en el eje x porque – nunca es cero, por lo S O H ElaCcurva para hallar el valor de Ve (Harris, 2007). tanto, se debe extrapolar R E D (Harris, 2007) 2.2.12. ¿Qué es y porqué se mide la conductividad? La conductividad es la capacidad de una disolución de conducir la corriente eléctrica. La conductividad es una medida de la concentración iónica total que tiene una disolución. Se aplica en una gran variedad de industrias. En algunos casos se conoce la naturaleza de los iones y se utiliza para determinar la concentración de los mismos. Por ejemplo en la industria alimentaria se utiliza un conductimetro para medir la “salinidad” de las muestras y se aplica en control de calidad. En general, la medida de conductividad es una forma rápida y sencilla de determinar la fuerza iónica de una disolución. Su principal inconveniente es que es una técnica no específica. 41 2.2.13. ¿Cómo se mide la conductividad? Un sistema completo para la medida de conductividad está formado por los siguientes elementos básicos: Célula de conductividad. Sonda de temperatura. Instrumento de medida. El conductimetro mide la conductividad eléctrica de los iones en una S O D VA disolución. Para ello aplica un campo eléctrico entre dos electrodos y mide la ER S E R S efectos de capa sobre los electrodos, etc. se aplica una corriente alterna. O CH E R DE resistencia eléctrica de la disolución. Para evitar cambios en las sustancias, Las unidades de medida habituales son los S/cm. Otras formas alternativas de expresar la conductividad de una disolución. 2.2.14. Exactitud Capacidad de un instrumento de acercarse al valor de la magnitud real. Depende de los errores sistemáticos que intervienen en la medición, denotando la proximidad de una medida al verdadero valor y, en consecuencia, la validez de la medida. Suponiendo varias mediciones, no se mide el error de cada una, sino la distancia a la que se encuentra la medida real de la media de las mediciones (cuán calibrado está el aparato de medición). Esta cualidad también se encuentra en instrumentos generadores de magnitudes físicas, siendo en este caso la capacidad del instrumento de acercarse a la magnitud física real. Por todo esto, la exactitud es la cercanía del valor experimental obtenido, con el valor exacto de 42 dicha medida. El valor exacto de una magnitud física es un concepto utópico, ya que es imposible conocerlo sin incertidumbre alguna (Mongay, 2005). 2.2.15. Precisión Capacidad de un instrumento de dar el mismo resultado en mediciones diferentes realizadas en las mismas condiciones. Esta cualidad debe evaluarse a corto plazo. La precisión refleja la proximidad de distintas medidas entre sí, y es función S O D VA exclusiva de los errores accidentales. Es un parámetro relevante, especialmente ER S E R el verdadero valor de la magnitud zona dentro de la cual está comprendido S O CH E (Mongay, 2005) R DE en la investigación de fenómenos físicos, cuando los resultados se indican en una 2.2.16. Incertidumbre La incertidumbre está relacionada con el proceso de medida y con la precisión del instrumento; se trata del máximo error de la medida. Por regla general, se toma como incertidumbre la precisión del aparato, algunas veces aunque no sea demasiado correcto se toma la mitad de la precisión como incertidumbre (Mongay, 2005). 2.2.17. Errores experimentales Un error experimental es una desviación del valor medido de una magnitud física respecto al valor real de dicha magnitud. En general son ineludibles y dependen del procedimiento elegido y la tecnología disponible para realizar la medición (Mongay, 2005) 43 2.2.18. Errores determinados o sistemáticos Tienen que ver con la metodología del proceso de medida, es decir, la forma de realizar la medida. No son directamente calculables y deben eliminarse de la experimentación para que no superpongan su acción a la de los errores aleatorios. Generalmente se clasifican en: a. Personales: Debido a los juicios que hace el analista. Aparecen cuando se presentan errores importantes en métodos establecidos: S O D lectura existe la tendencia a redondear a 0 o a 5, A prioridad a los valores Vdar R E pares y preferir los valores bajos.RES OunSobservador mira oblicuamente un indicador o H Error de paralaje: Cuando C RE escala D delE aparato. Estimación de la posición de una aguja sobre una escala: al interpolar la Definición del color final de la titulación. Errores al enrasar soluciones en el material volumétrico. Tendencia subjetiva a elegir valores más favorables. Este tipo de errores se minimizan trabajando cuidadosamente y haciendo empleo de la autodisciplina. Los sistemas automatizados ayudan también a disminuir estos errores. b. Del método: Se deben al comportamiento químico y/o físico no ideal de reactivos y reacciones: Solubilidad finita de toda sustancia: un exceso de lavado disuelve parcialmente un precipitado. Contaminantes: un mal lavado puede mantener contaminantes en el precipitado. Reacciones lentas. 44 Volatilidad de los reactivos. Mala elección del indicador o viraje lento del mismo. Muchos de estos errores requieren un conocimiento profundo de la muestra y del comportamiento físico-químico del analito para su eliminación. c. Instrumentales: Debidos a discrepancias entre el valor real y el nominal. Se corrigen con calibraciones periódicas de los instrumentos: Puesta a cero. En algunos casos errores de fabricación del aparato de medida que desplazan la escala. S O D VA Contenido y vertido del material volumétrico, especialmente cuando se le ha ER S E SR sometido a variaciones térmicas. HO C E R por retención accidental de restos de muestras pasadas Efecto D de E memoria Reactivos con contenido de purezas. en los instrumentos. En general, los errores sistemáticos son los más importantes dentro del análisis. La mayor forma de detectarlos y corregirlos es validando el método, para lo que se requiere: Determinar la misma muestra por un método de referencia Utilizar dos o más métodos analíticos independientes. Proceder al análisis en laboratorios colaboradores Según la fase en la que se produzca este tipo de error puede llegar a afectar un solo resultado o a todo el análisis (Mongay, 2005). 2.2.19. Se Errores accidentales o aleatorios producen por causas difíciles de controlar; se distribuyen estadísticamente en torno a una medida que sería la correcta (Cromer, 2007). Son 45 directamente calculables y aparecen por causas de naturaleza errática e imprevisible. Este tipo de errores afectan la precisión o reproducibilidad de un experimento. Pueden tener lugar por exceso o por defecto con igual probabilidad y reducirse hasta límites admisibles, pero jamás son eliminados por completo sin importar el método que se emplee. Ejemplos típicos de este tipo de error lo constituyen la sensibilidad de una balanza, la calibración del enrase del material volumétrico graduado o aforado y la interpolación en las divisiones de una escala S O D VA (Mongay, 2005) ER S E SR Para evitar este tipo de error se deben tomar varias medidas de la HO C E ER experiencia y realizar un tratamiento estadístico de los resultados. Se toma como D valor o medida más cercana a la realidad la media aritmética de las medidas tomadas (Cromer, 2007). Los errores aleatorios se consignan por el número de cifras significativas con el que se expresa la magnitud, que reflejan el número de dígitos necesarios para describir el valor de la magnitud sin alterar la precisión. Cuando no se indica la precisión se presupone que la última cifra oscila entre más y menos una unidad; en la práctica, cuando se trata de resultados analíticos, se suele aceptar el uso de dos cifras significativas (Mongay, 2005) 2.2.20. Error absoluto Es la diferencia entre el valor de la medida y el valor tomado como exacta. Puede ser positivo o negativo, según si la medida es superior al valor real o inferior. Tiene unidades, las mismas que las de la medida (Mongay, 2005). 46 2.2.21. Error relativo Es el cociente entre el error absoluto y el valor exacto. Si se multiplica por 100 se obtiene el tanto por ciento de error. Al igual que el error absoluto puede ser positivo o negativo porque puede ser por exceso o por defecto (Mongay, 2005). 2.2.22. Regresión lineal Es un método matemático que modela la relación entre dos o más variables. Utiliza la relación entre una variable con valores conocidos y otra variable con S O D VA valores desconocidos para estimar dichos valores desconocidos. Entre esas dos ER S E SR variables existe relación de dependencia cuando los valores de una dependen de otra, es decir, cuando al variar una de ellas la otra experimenta cambios determinados. HO C E ER D Si la variable Y depende de la variable X, esta relación se expresa por ( ) donde se acostumbra a denominar a la variable dependiente Y a X como la variable independiente. El designar una variable como independiente y dependiente se hace referencia al significado matemático de la dependencia, pero en ningún punto implica dependencia estadística ni relación causa y efecto, por lo que el análisis no permite obtener conclusiones en ese respecto (Quintana, 1996). 2.2.23. Media Aritmética La media aritmética, que también se conoce simplemente como media o promedio, es una medida de la tendencia central o localización de un conjunto de valores. También puede expresarse en términos del valor esperado o valor promedio a la larga de la variable aleatoria (Montgomery, 2003). Se calcula por medio de la siguiente formula: 47 (EC. 2.10) ∑ ̅ Dónde: ̅ Media aritmética n: número de datos xi: Valor numérico de la variable i. Cuando la medida es del conjunto de las poblaciones se suele denotar por el símbolo μ y cuando es la medida de una muestra de la población se utiliza ̅ (Guisande, y otros, 2006). S O D VA 2.2.24. Desviación estándar ER S E Es la medida de dispersión deSla R población alrededor del valor esperado de O H EUnaCdistribución de probabilidad para datos con una alta la variable a estudiar. R E D tendencia central está agrupada más estrechamente alrededor del centro de los datos (Blank & Taquin, 2006). Es una medida del grado de proximidad de los datos en torno al valor de la media. Cuando menor es la desviación estándar, más estrechamente se agrupan los datos alrededor de la media. Se calcula mediante la siguiente ecuación √ ∑ ( ̅) Con frecuencia se hace referencia a la varianza, (Ec. 2.11) , como la medida de la dispersión. La desviación estándar es simplemente la raíz cuadrada de la varianza, de manera que pueda utilizarse cualquier medida. Sin embargo, debe observarse que la desviación estándar tiene las mismas unidades que los datos, mientras que la varianza tiene las mismas unidades de los datos al cuadrado; por lo tanto, suele preferirse la desviación estándar por encima de la varianza (Blank & Taquin, 2006). 2.2.25. Desviación estándar relativa 48 La desviación estándar relativa o coeficiente de variación es un parámetro estadístico independiente de las unidades de medida empleada que puede ser expresada en términos de porcentaje (Varcarcel y Rios, 2002). Se calcula al dividir la desviación estándar entre la media de la serie de datos. Se expresa en partes por mil (ppmil) o en porcentaje, multiplicando por 1000 ppmil o 100% respectivamente. (Ec. 2.12) ̅ A la desviación estándar relativa, multiplicada por 100% también se le conoce como coeficiente de variación. ER S E SR S O D VA ̅ (Ec. 2.13) HO C E calidad de los datos que la desviación estándar absoluta (Blank & Taquin, 2006). DER La desviación estándar relativa proporciona una visión más clara de la 2.2.23. Tabla de valores permitidos La Norma venezolana COVENIN 325:2001 establece un valor máximo permitido de 0.2% de ácidos grasos libres para los aceites vegetales. Este valor está relacionado al peso de la muestra. El valor de 0.2% de ácidos grasos libres para los aceites vegetales está establecido a partir de métodos volumétricos. 2.2.24. Expresión de resultados El porcentaje de ácidos grasos libres en la mayoría de los tipos de grasas y aceites, se calcula como ácido oleico, aunque en aceites de diferentes tipos como lo son el de almendra, de palmiste y coco, se calcula como ácido laurico y en el aceite de palma en términos de ácido palmítico. La acidez de la muestra se calcula por medio de las formulas siguientes: 49 (Expresada como ácido oleico) (Ec. 2.14) (Expresada como ácido laurico) (Ec. 2.15) (Expresada como ácido palmítico) (Ec. 2.16) Siendo: A: acidez expresada como ácido oleico, ácido laurico o como ácido palmítico, en porcentaje. V: Volumen de la solución de hidróxido de sodio gastados en la valoración de la muestra en mililitros. S O D VA N: normalidad de la solución de hidróxido de sodio. G: masa de la muestra en gramos. ER S E R 282: peso molecular del ácido oleico. S O CdelHácido laurico. 200: peso molecular E R DE 256: peso molecular del ácido palmítico. Los ácidos grasos libres se expresan frecuentemente en términos del índice de acidez. El índice de acidez se calcula por medio de las formulas siguientes: (Como ácido oleico) (Ec. 2.17) (Como ácido laurico) (Ec. 2.18) (Como ácido palmítico) (Ec. 2.19) Siendo: Ia: índice de acidez A: acidez expresada como ácido oleico, ácido laurico o como ácido palmítico, en porcentaje. Factores de 1.99, 2.80, 2,19. 50 2.3. Sistema de Variables Objetivo General: Comparar a través de los métodos potenciometricos (pH-metro, conductimetro) y volumétricos el índice de acidez en los aceites vegetales comestibles que actualmente se consumen en Venezuela. Objetivos específicos Variable Sub-variable Seleccionar tres (3) tipos de aceites vegetales R S HO comestibles de tres (3) marcas diferentes que actualmente consume la población venezolana. C E R DE Establecer los datos experimentales para el cálculo de la acidez de las diferentes marcas de aceites vegetales comestibles por medio de análisis establecidos en la norma COVENIN 325:2001. Determinar el valor del índice de acidez resultante de los diferentes métodos potenciométricos y volumétricos según los criterios establecidos en la S O D A V R E ES Marcas de aceites vegetales Indicador Tipos de aceites pH-Metro Conductimetro Titulación Índice de acidez Cálculos. Efectividad de los métodos Medidas estadísticas comestibles Métodos potenciometricos Método Volumétrico Índice de acidez en aceites vegetales Norma COVENIN 325:2001 3ra Edición para las marcas de aceites comestibles seleccionadas. Comparar la efectividad de los métodos potenciometricos (pH-metro, conductimetro) y volumétricos, en las marcas de aceite vegetales comestibles seleccionados. potenciometricos CAPITULO III MARCO METODOLOGICO El marco metodológico es el procedimiento a seguir para alcanzar el objetivo de la investigación, está compuesto por el diseño, tipo, y la modalidad de la investigación, fases de la investigación, población y muestra, técnica e instrumento de recolección de datos, validación del instrumento y análisis de los resultados. (Arias, 2004) Expone que “la metodología del proyecto incluye el tipo de investigación, las técnicas y los procedimientos que serán utilizados para llevar S O D VA acabo la indagación. Es el “como” se realizará el estudio para responder al problema” (p.45) ER S E SR HO C E 3.1. Tipo de investigación DER Toda investigación refiere un proceso que busca la obtención de una información que dé lugar a aplicar un conocimiento determinado. En consecuencia el tipo de investigación a emplear directamente es de tipo descriptivo, por cuanto se busca determinar la calidad de los aceites vegetales comestibles venezolanos que se encuentran actualmente en el mercado, midiendo el índice de acidez a través de métodos potenciometricos (pH-metro, conductimetro) y volumétricos para cada uno de ello, con la finalidad de comparar el resultado obtenido según los valores de índices de acidez con los establecidos en la norma COVENIN 325:2001 3era revisión. En tal sentido, al referir al tipo de investigador (Hurtado, 2010) expone que el objetivo de las investigaciones descriptivas es el de la describir de manera precisa el fenómeno de estudio, por lo que el propósito fundamental de ella es presentar un evento estudiado para el cual se exponen sus características, por lo que este tipo de investigación no amerita la formulación de una hipótesis, y las variables establecidas no necesariamente presentan relaciones de causalidad entre ellas. 52 3.2. Diseño de la investigación El diseño de la investigación refiere la realización de un conjunto de actividades y técnicas debidamente organizadas que permitan recolectar y efectuar un análisis de los datos obtenidos pues al considerar toda la información obtenida con ello se permite lograr el objetivo propuesto. Por lo que el diseño de la investigación a aplicar es del tipo experimental, al particular, (Hernandez, Fernandez, & Baptista, 2006) los diseños experimentales S O D A dependientes. Asimismo, pueden utilizar pre-pruebas yV post-pruebas para analizar R E S E del tratamiento experimental. Desde la evolución de los grupos antes y después R S O Hexperimentales C luego, no todos los diseños utilizan pre-pruebas pero la postE R E prueba es D necesaria para determinar los efectos de las condiciones pueden abarcar una o más variables independiente y una o más variables experimentales. Al mismo particular, (Hurtado, 2010) refiere que en el diseño experimental, el investigador interviene sobre las denominadas variables independiente y las modifica de una manera planificada e intencional para observar el efecto que se produce por la manipulación realizada, por lo que es necesario un control de las variables de orden extraño y descartar aquellas que puedan interferir o producir cambios originados por elementos o factores diferentes a la variable independiente. 3.3. Técnicas de recolección de datos Está conformada por el conjunto de medios que permiten al investigador recolectar la información precisa para el logro de los objetivos establecidos, pues se precisa de todas las indicaciones, observaciones y registros de los acontecimientos inmediatos ,y del cual el investigador toma en consideración para todos el proceso con la finalidad de producir un análisis posterior . En la presente investigación se utilizaron la siguiente técnica: 53 Técnica de Observación Directa, en este sentido, (Hurtado, 2010) refiere que todo tipo de técnica se presenta como un proceso de recopilación, selección y registro de información donde el investigador directamente está relacionado con el objeto de estudio y utiliza sus sentidos en la recopilación de los datos necesarios para resolver un problema de investigación. 3.4. Instrumentos de recolección de datos. Refiere todo instrumento conformado con los datos aportados de los cuales S O D VA el investigador utilice para registra y almacenar la información. En este sentido, ER S E SR (Arias, 2004) refiere al instrumento de recolección de datos como el dispositivo, o formato en cualesquiera de sus formas se digitalizado o en papel que permitirá HO C E ER registrar y almacenar los datos obtenidos. D En la presente investigación se utilizaran tablas de registro de información a partir de la recolección de datos en las cuales se organizaran según las variables a utilizar, con el fin de cumplir con los objetivos debidamente establecidos. Tabla 3.1. Encuesta para la selección de aceites vegetales. Tipo de aceite Preguntas Soya Maíz Canola Oliva Coco ¿Qué tipo de aceite vegetal utiliza mayormente en su hogar? ¿Qué tipo de aceite consigue con más frecuencia en los supermercados? En la tabla 3.1 se presentan las preguntas a realizar para cuantificar la selección del tipo de aceite a utilizar como muestra de estudio. 54 Tabla 3.2. Datos experimentales para la estandarización de las soluciones de NaOH. ml NaOH pH 0 5 10 15 20 25 29 30 35 40 Vb*10^(-pH) S O D VA ER S E SR En la tabla 3.2 se refieren los valores de pH para la estandarización de la HO C E ER solución de NaOH. D Tabla 3.3. Datos experimentales para el método volumétrico Muestra 1 2 1 2 1 2 Tipo Peso (g) ml NaOH N NaOH Aceite #1 Aceite #2 Aceite #3 En la tabla 3.3 se reseñan los datos obtenidos a través de la titulación para conseguir el punto de equivalencia de la solución. 55 Tabla 3.4. Tabla de datos experimentales para los aceites IT E #2 A C E IT E #1 metodo pH Conductimetro ml NaOH pH (1) vb1*10^(-pH1) pH (2) vb2*10^(-pH2) conductividad (1) conductividad (2) A C E IT E #3 A C E S O D VA ER S E SR HO C E ER D En la tabla 3.4. Se establecen los datos de pH y conductividad para diferentes volúmenes de NaOH en la solución en sus respectivas muestras. 3.5. Fases de la investigación 3.5.1. Fase I: Seleccionar tres (3) tipos de aceites vegetales comestibles de tres (3) marcas diferentes que actualmente consume la población venezolana 3.5.1.1. Preguntas En esta primera fase de la investigación se seleccionaron tres (3) tipos de aceites a través de una encuesta que se realizó a un grupo de 25 personas. Dicha encuesta está compuesta por tres (3) simples preguntas donde se contempla el tipo de aceite vegetal más usado, el tipo de aceite que actualmente; a consideración, se consigue en el mercado y la marca de aceite de su preferencia. 56 Con esta información se realizaron estadísticas para concluir que los tipos de aceites que actualmente consume la población venezolana son los de soya, oliva y canola. 3.5.1.2. Selección Se procedió a seleccionar tres (3) marcas distintas para cada uno de los diferentes tipos de aceites y a la obtención de los mismos. Los nombres de las marcas no serán mencionados para proteger la integridad de las empresas que los fabrican, debido a que el incide de acidez es una característica que está incluida S O D recolección de datos se enumeraron como N° 1, N°V2A y N° 3 para cada uno R E S E respectivamente. R OS H C E R E D 3.5.2. Fase II: Establecer los datos experimentales para el cálculo de la acidez de en los estándares de calidad para aceites vegetales comestibles. En las tablas de las diferentes marcas de aceites vegetales comestibles por medio de análisis establecidos en la norma COVENIN.325:2001 3.5.2.1. Verificación y calibración del pH-metro a. Se lavó y, posteriormente, se sumergió el electrodo en agua destilada, donde se obtuvieron valores de pH cercanos a 6. b. El pH-metro fue ajustado a modo de calibración y se registraron las lecturas de las soluciones buffer o tampones de pH 4 y 7 respectivamente, según las condiciones del fabricante y cuidando de lavar apropiadamente en electrodo entre cada medición. Debió además verificarse la temperatura de funcionamiento, esto es, la temperatura ambiental, que debe mantenerse en valores entre los 15 y 25 ºC para realizar las determinaciones. 57 c. Se midió el pH de una solución patrón o de control con un pH conocido para verifica la correcta lectura del equipo. Este valor fue registrado para determinar si el equipo está en condiciones de lectura. d. Se lavó nuevamente el electrodo y se sumergió en su correspondiente solución de mantención, cuidando de conservar una temperatura ambiental de 15 a 25 ºC. 3.5.2.2. Preparación del fenolftaleína al 1 % p/v S O D VA calibrada según las fenolftaleína en polvo en una balanza analítica previamente R E S E instrucciones del fabricante. Este se pasó a un vaso de precipitado anteriormente R OS uso de una pipeta volumétrica, se adicionó H C lavado con agua destilada y, haciendo RE E D 25 mL de agua destilada y 25 mL de etanol, agitando con una varilla de vidrio Para preparar 50 mL del indicador fenolftaleína al 1% p/v se pesaron 0,5 g de hasta la disolución total del sólido. 3.5.2.3. Preparación y estandarización de la solución de NaOH 0.002 N El NaOH sólido es una substancia higroscópica, es decir, tiene la propiedad de absorber humedad del medio ambiente; además forma carbonatos de sodio con facilidad, por lo tanto, no puede ser considerada como un patrón primario y prepararse por pesada directa. Normalmente se prepara la solución a aproximadamente 0.002 molar y se valora después con un patrón primario ácido. Teniendo en cuenta que el peso molecular del hidróxido de sodio es de 39,99707 g.mol-,1 para preparar una solución de 2 litros de NaOH 0.002N exento de carbonatos fue necesario: 1. Pesar 0.16 gramos aproximadamente de NaOH sólido, en una balanza analítica previamente calibrada según las instrucciones del fabricante. Este se 58 pasó inmediatamente a un vaso de precipitado anteriormente lavado y se adicionó la cantidad necesaria de agua destilada para disolver con la ayuda de una varilla de vidrio. 2. Una vez disuelta la solución, se vertió en un matraz o balón aforado de 2000 mL, previamente lavado con agua destilada y se enrasó con la misma. Este preparado debió almacenarse en envases de vidrio para evitar la carbonación de la misma, recordando lavar varias veces el interior del envase con pequeñas porciones de la disolución de NaOH que se desea estandarizar antes de su almacenamiento. S O D VA ER S E SR Para valorar la solución de NaOH 0.002 N se usó el patrón primario HO C E ER hidrogenoftalato de potasio D Para la estandarización de la solución previamente preparada, se agregó la solución de NaOH en una bureta de 50 mL anteriormente lavada con agua destilada. Se tomó, con una pipeta volumétrica, una muestra de 25 mL de hidrogenoftalato de potasio 0.002 N y se trasvasó a un vaso de precipitado de 150 mL, anticipadamente lavado con agua destilada. A continuación se agregaron 3 gotas del indicador fenolftaleína y se introdujo el electrodo en la porción de muestra, ajustando por medio del sistema de corrección del pH-metro la temperatura a la cual se llevó a cabo la determinación; fue necesario además tener especial cuidado de que el electrodo se encontrara por encima del nivel del agitador magnético. Se tomó el pH de la solución y luego se tituló con NaOH agregando incrementos cada dos minutos hasta observar el cambio de coloración del indicador a rosa pálido. Con los datos de la estandarización se registró una ecuación de la recta, donde el volumen del punto de equivalencia vino dado por la división del intercepto 59 con el eje X entre la pendiente de la recta. Para calcular la concentración del hidróxido de sodio fue necesaria la siguiente ecuación: (Ec. 3.1) (Ec. 3.2) Dónde: V1: Volumen gastado de hidróxido de sodio. C1: Normalidad del hidróxido de sodio. S O D VA ER S E R S C1: Normalidad del hidrogenoftalato de potasio. O CH E R DE V2: Volumen de hidrógenoftalato de potasio. 3.5.2.4. Preparación de la solución de hidrogenoftalato de potasio 0.002 N Teniendo en cuenta que el peso molecular del hidrogenoftalato de potasio es de 204,23 g.mol-,1, para preparar una solución de 500 mL fue necesario pesar, aproximadamente, 0.2 gramos del reactivo sólido en una balanza analítica previamente calibrada. Este se trasvasó a un matraz o balón aforado de 500 mL, anteriormente lavado con agua destilada y se procedió a enrasar con la misma. 3.5.2.5. Toma de datos experimentales a partir de la práctica de laboratorio A. Método volumétrico: Para la preparación de las muestras de aceite se realizó lo siguiente: 60 En un matraz Erlenmeyer se pesaron aproximadamente 10gr de aceite de cada tipo y de las diferentes marcas. Se preparó una solución alcohol etílico – éter con una proporción molar de 50:1. En cada una de las muestras se colocó 10ml de la solución preparada de alcohol etílico – éter y 3 gotas de fenolftaleína. Se tituló con el NaOH, En el momento que el aceite cambia de color se anotó el volumen de NaOH gastado. S O D VA Todas las muestras fueron realizadas por duplicado para cada uno de los aceites. ER S E SR HO C E ER B. Métodos Potenciometricos D Para la titulación con el pH-metro se realizó la misma preparación se las muestras sin embargo al momento de titular con NaOH se agregó de a 5ml y se anotó el valor de pH obtenido para cada punto. Se tituló hasta un volumen gastado de NaOH entre los 30 a 35ml. Figura. 3.1. Esquema de equipos para medición potenciometrica 61 De igual manera se realizó esta práctica para el conductimetro, anotando la medida de conductividad para cada punto obtenido al agregar 5ml. 3.5.3. Fase III: Determinar el valor del índice de acidez resultante de los diferentes métodos potenciométricos y volumétricos según los criterios establecidos en la Norma COVENIN 325:2001 3ra Edición para las marcas de aceites comestibles seleccionadas. 3.5.3.1. Acidez de los aceites vegetales comestibles S O D El cálculo del índice de acidez se basó en la norma VACOVENIN 325:2001, el R E Sel índice de acidez se expresa en % E cual indica que para la mayoría de los aceites R OlosSaceites fabricados con almendra, palmiste y H de ácido oleico; a excepción de C E R E D coco, primero se procedió a calcular la acidez con la siguiente expresión: (Ec. 2.10) En donde A es la acidez expresada como porcentaje de ácido oleico, V es el volumen de la solución de hidróxido de sodio gastados en la titulación para cada una de las muestras de aceite, N es la normalidad de la solución de hidróxido de sodio, G es la masa de la muestra expresada en gramos y el peso molecular del ácido oleico es 282. 3.5.3.2. Índice de acidez de los aceites vegetales comestibles Después de haber obtenido la acidez se procede a calcular el índice de acidez usando la siguiente expresión: (Ec. 2.12) 62 Siendo Ia el índice de acidez y A la acidez expresada como ácido oleico. Este procedimiento se realiza para cada una de las muestras de aceites vegetales preparadas en la laboratorio. 3.5.4. Fase IV: Comparar la efectividad de los métodos potenciometricos (pHmetro, conductimetro) y volumétricos en las marcas de aceite vegetales comestibles seleccionados. En la última fase de la investigación se realiza una comparación estadística S O D VA de los datos obtenidos de índice de acidez para las diferentes muestras de aceites ER S E SR (Soya, Oliva, Canola). HO C E ER Se presentaran los datos en dos tablas, una donde muestre los resultados de D todos los índices de acidez obtenidos a través de los diferentes métodos potenciometricos y por el método volumétrico, exponiendo de igual manera el valor máximo permitido de porcentaje de ácido oleico. Se calcula la media aritmética (Ec. 2.10), la desviación estándar (Ec. 2.11), la desviación estándar relativa (Ec. 2.12) y el coeficiente de variación (Ec. 2.13) a través de las ecuaciones que se enuncian en el trabajo de investigación, para así determinar cuál es el coeficiente óptimo. De esa forma se determina el método más eficiente. Todos estos valores se muestran en una segunda tabla. CAPITULO IV ANALISIS DE RESULTADOS 4.1. Seleccionar tres (3) tipos de aceites vegetales comestibles Tabla 4.1. Encuesta para la selección de aceites vegetales Tipo de aceite Soya Maíz Canola Preguntas ¿Qué tipo de aceite vegetal utiliza 10 ¿Qué tipo de aceite consigue con más Soya Maiz Canola S6 O 7 D VA 2 SER E R S 15 HO C frecuencia en los supermercados? E DER mayormente en su hogar? Oliva Oliva 0 4 6 Coco 0 0 Coco Figura 4.1. ¿Qué tipo de aceite vegetal utiliza mayormente en su hogar? En la gráfica que se presenta a continuación se expresan los resultados para la primera pregunta (¿Qué tipo de aceite vegetal utiliza mayormente en su hogar?) de la encuesta que se realizó para escoger los tipos de aceites. Como se muestra en la gráfica los aceites de soya, canola y oliva son los más utilizados para consumo hoy en día en los hogares. 64 Soya Maiz Canola Oliva Coco Figura 4.2. ¿Qué tipo de aceite consigue con más frecuencia en los supermercados? S O D VA ER S E R (¿Qué tipo de aceite consigue con más frecuencia en los supermercados?) donde S O H ECde soya, canola y oliva son los productos que se se encontró que elR aceite E D En la gráfica 4.2. Se expresan los resultados para la segunda pregunta frecuentan en los anaqueles de los supermercados. Para la última parte de la encuesta se preguntó la marca de aceite más usada dentro de los tipos de aceites previamente escogidos (Soya, canola y oliva). Debido a que el índice de acidez es una característica de calidad que debe presentar todos los aceites vegetales comestibles, no se pueden nombrar las marcas de aceites utilizadas, con el fin de proteger la integridad de los mismos. Sin embargo, en el trabajo especial de grado se plasmaron de la siguiente manera: Aceite #1, Aceite #2 y Aceite #3. 4.2. Establecer los datos experimentales para el cálculo de la acidez por medio de análisis establecidos en la norma COVENIN 325:2001. 4.2.1. Estandarización del NaOH Las concentraciones en las soluciones de NaOH no fueron las expresadas por la norma COVENIN, esto es debido a que las normas establecen una solución 65 muy concentradas para la cantidad de muestra que indican, por lo que no se podría apreciar con gran exactitud el punto de equivalencia de la solución (punto en el cual la solución cambiaria de color a rosado pálido en el método visual). Para reducir el error porcentual y para facilitar los cálculos matemáticos se estandarizo el NaOH. Los resultados se presentan a continuación en las siguientes tablas: Tabla 4.2. Datos experimentales para la estandarización de la 1ra solución de S O D ml NaOH pH Vb*10^(-pH)VA ER S 0 3,61 E0,00E+00 R 3,79E-04 5OS4,12 CH10 4,45 3,55E-04 E R 15 4,77 2,55E-04 DE NaOH 20 25 29 30 35 40 5,13 5,72 7,58 8,08 9,13 9,73 1,48E-04 4,76E-05 7,63E-07 2,50E-07 2,59E-08 7,45E-09 Primera solucion pH-metro 0,0004 Vb*10^(-pH) 0,00035 0,0003 0,00025 0,0002 0,00015 0,0001 0,00005 0 0 10 20 30 40 50 ml NaOH Figura 4.3. Estandarización de la primera solución de NaOH con pH-metro 66 En la tabla 4.3 se presenta la gráfica obtenida a través del método grafico de Gran para la estandarización de la primera solución de NaOH. Se tuvieron que preparar dos volúmenes de la solución para la realización total de los experimentos. Se trató de buscar una concentración de NaOH parecida en ambas soluciones. Ambas soluciones se estandarización y prepararon por métodos potenciometricos. Tabla 4.3. Datos experimentales de la estandarización de 2da solución de NaOH ml NaOH 0 5 10 15 20 25 30 35 pH vb*10^(-pH) 3,5 0 3,99 5,12E-04 4,38 4,17E-04 4,76 2,61E-04 5,3 1,00E-04 7,72 4,76E-07 9,18 1,98E-08 9,83 5,18E-09 S O D VA ER S E SR HO C E ER D segunda solucin pH-metro 0,0006 Vb*10^(-pH) 0,0005 0,0004 0,0003 0,0002 0,0001 0 0 10 20 30 40 ml NaOH Figura 4.4. Estandarización de la segunda solución de NaOH con pH-metro A partir de estas graficas se sacaron los datos de la recta para los cálculos de la concentración de la solución. Para ambas graficas se tomaron las secciones 67 de la curva donde la tendencia de una recta se mantenía. Pudiéndose obtener las siguientes concentraciones a partir de los cálculos realizados. Tabla 4.4. Concentraciones de NaOH Nro. de solución concentración NaOH 1 0,00183 2 2,05E-03 4.2.2. Recolección de datos experimentales S O D VA En las tablas que se presentan a continuación se muestran los datos ER S E SR obtenidos en la práctica de laboratorio para las diferentes muestras de aceites HO C E Se muestran DER también las vegetales seleccionados a partir de las encuestas realizas a un grupo de personas. gráficas obtenidas a partir de los datos conseguidos y las ecuaciones expresadas en los capítulos anteriores por los métodos potenciometricos (pH-metro y conductimetro). Tabla 4.5. Datos experimentales para el método volumétrico Muestra 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 Tipo Soya Soya Soya Oliva Oliva Oliva Canola Canola Canola Peso (g) 10,842 10,4537 10,2174 10,0759 10,0162 10,2813 10,5802 10,0634 10,4439 10,6903 10,5001 10,4596 10,8407 10,6903 10,2065 10,0582 10,287 10,536 ml NaOH 20,9 20,8 17,3 17 18,4 20,1 30,6 30 20 20,7 30,4 30,4 20,7 20,4 19,9 19,7 20 20,2 N NaOH 1,83E-03 1,83E-03 1,83E-03 1,83E-03 2,05E-03 2,05E-03 2,05E-03 2,05E-03 2,05E-03 2,05E-03 2,05E-03 2,05E-03 1,83E-03 1,83E-03 2,05E-03 2,05E-03 2,05E-03 2,05E-03 68 SO YA #2 SO YA #1 Tabla 4.6. Datos experimentales para los aceites de soya metodo pH Conductimetro ml NaOH pH (1) vb1*10^(-pH1) pH (2) vb2*10^(-pH2) conductividad (1) conductividad (2) 0 4,8 0 4,78 0 0,91 1 5 5,56 1,38E-05 5,57 1,35E-05 2,19 2,26 10 6,2 6,31E-06 6,18 6,61E-06 6,58 5,76 15 7,58 3,95E-07 7,3 7,52E-07 15,04 14,86 20 9,11 1,55E-08 9,28 1,05E-08 28,66 27,08 25 9,77 4,25E-09 9,85 3,53E-09 47,1 45,75 30 10,13 2,22E-09 10,15 2,12E-09 69,4 71,02 0 5,4 0 5,53 0 1,09 1 5 5,69 1,02E-05 5,72 9,53E-06 2,53 1,77 10 6,2 6,31E-06 6,25 5,62E-06 4,53 5,07 15 9,12 1,14E-08 8,82 2,27E-08 12,11 13,96 20 9,96 2,19E-09 9,67 4,28E-09 23,08 25,8 25 10,43 9,29E-10 10,16 1,73E-09 46,1 46,9 30 10,6 7,54E-10 10,42 1,14E-09 73,2 70,9 5 5,58 1,32E-05 5,64 1,15E-05 1,61 1,73 10 6,15 7,08E-06 6,25 5,62E-06 3,58 3,11 15 8,73 2,79E-08 8,6 3,77E-08 11,34 9,72 20 9,52 6,04E-09 9,51 6,18E-09 22,43 19,6 25 10,08 2,08E-09 9,9 3,15E-09 38,1 35,1 30 10,45 1,06E-09 10,35 1,34E-09 60,5 51,3 S O D VA ER S E SR SO YA #3 HO C E ER D 0,000016 0,000014 0,000012 0,00001 0,000008 0,000006 0,000004 0,000002 0 ml NaOH vs conductividad 80 60 muestra 1 muestra 2 µS/cm Vb*10^(-pH) ml NaOH vs vb1*10^(-pH1) muestra 1 40 muestra 2 20 0 0 20 ml NaOH 40 Figura 4.5. Grafica de pH-metro para el aceite de soya #1 0 20 ml NaOH 40 Figura 4.6. Conductividad para el aceite de soya #1 69 ml NaOH vs vb1*10^(-pH1) ml NaOH vs vb1*10^(-pH1) 0,000012 0,000006 muestra 1 0,000004 muestra 2 0,000002 0 0 10 20 30 ml NaOH R S HO 40 C E R DE Figura 4.7. pH-metro para el aceite de soya #2 Vb*10^(-pH) 0,000008 0,000014 0,000012 0,00001 0,000008 0,000006 0,000004 0,000002 0 S O D A V R E ES 0 10 20 muestra 1 muestra 2 30 40 ml NaOH Figura 4.8. pH-metro para el aceite de soya #3 ml NaOH vs conductividad ml NaOH vs conductividad 80 70 70 60 60 50 50 40 muestra 1 30 muestra 2 20 µS/cm µS/cm Vb*10^(-pH) 0,00001 40 30 muestra 1 20 muestra 2 10 10 0 0 0 10 20 30 40 ml NaOH Figura 4.9. Conductividad para el aceite de soya #2 0 10 20 30 40 ml NaOH Figura 4.10. Conductividad para el aceite de soya #3 70 OL IV A #3 OL IV A #2 OL IV A #1 Tabla 4.7. Datos experimentales para los aceite de oliva 5 10 15 20 25 30 35 0 5 10 15 20 25 30 35 0 5 10 15 20 25 30 35 5,49 6,04 6,84 8,34 8,42 9,3 9,6 5,37 5,6 6,15 7,8 9,15 9,71 10,08 10,34 5,3 5,57 6,16 7,78 9,13 9,75 10,1 10,4 1,62E-05 9,12E-06 2,17E-06 9,14E-08 9,50E-08 1,50E-08 8,79E-09 0 1,26E-05 7,08E-06 2,38E-07 1,42E-08 4,87E-09 2,50E-09 1,60E-09 0 1,35E-05 6,92E-06 2,49E-07 1,48E-08 4,45E-09 2,38E-09 1,39E-09 1,73E-05 8,51E-06 1,43E-06 9,57E-08 2,62E-08 1,34E-08 6,98E-09 0 1,35E-05 6,61E-06 4,13E-07 1,66E-08 5,60E-09 2,67E-09 1,79501E-09 0 1,26E-05 6,76E-06 4,74E-07 1,55E-08 4,45E-09 2,93E-09 1,71E-09 2,04 4,58 12,2 22,53 36,7 50,4 61,3 0,9 1,86 3,62 10,47 21,28 33,6 53,8 72,4 0,9 1,86 3,62 10,47 21,28 33,6 53,8 72,4 1,15 4,34 12,54 22,95 35,9 49,2 60,7 0,93 1,87 3,75 15,03 24,65 34,7 47,9 63,3 0,93 1,87 3,75 15,03 24,65 34,7 47,9 63,3 S O D VA ER S E SR HO C E ER D 5,46 6,07 7,02 8,32 8,98 9,35 9,7 5,33 5,57 6,18 7,56 9,08 9,65 10,05 10,29 5,36 5,6 6,17 7,5 9,11 9,75 10,01 10,31 ml NaOH vs vb1*10^(-pH1) ml NaOH vs conductividad 0,00002 70 50 0,00001 muestra 1 muestra 2 0,000005 µS/cm Vb*10^(-pH) 60 0,000015 40 muestra 1 30 muestra 2 20 10 0 0 0 20 ml NaOh 40 Figura 4.11. pH-metro para el aceite de oliva #1 0 10 20 30 40 ml NaOH Figura 4.12. Conductividad para el aceite de oliva #1 71 ml NaOH vs vb1*10^(-pH1) ml NaOH vs vb1*10^(-pH1) 0,000016 0,000016 0,000012 0,000014 0,000012 0,00001 0,000008 muestra 1 0,000006 muestra 2 0,000004 0,000002 0 10 20 DE ml NaOH 30 40 0,000008 0,000006 0,000004 muestra 1 muestra 2 0,000002 0 0 10 20 30 ml NaOH 40 Figura 4.14. pH-metro para el aceite de oliva #3 Figura 4.13. pH-metro para el aceite de oliva #2 ml NaOH vs conductividad ml NaOH vs conductividad 80 80 70 70 60 60 50 40 muestra 1 30 muestra 2 20 µS/cm µS/cm S O D VA 0,00001 SER S RE O H C RE 0 Vb*10^(-pH) Vb*10^(-pH) 0,000014 50 40 muestra 1 30 muestra 2 20 10 10 0 0 10 20 30 40 ml NaOH Figura 4.15. Conductividad para el aceite de oliva #2 0 0 10 20 ml NaOH 30 40 Figura 4.16. Conductividad para el aceite de oliva #3 72 A N O LA #2 C A N O LA #1 Tabla 4.8. Datos experimentales para los aceites de canola metodo pH Conductimetro ml NaOH pH (1) vb1*10^(-pH1) pH (2) vb2*10^(-pH2) conductividad (1) conductividad (2) 0 5,3 0 5,45 0 0,71 0,7 5 5,64 1,15E-05 5,78 8,30E-06 1,32 1,31 10 6,35 4,47E-06 6,43 3,72E-06 3,23 3,58 15 8,12 1,14E-07 8,28 7,87E-08 9,91 11,06 20 9,29 1,03E-08 9,4 7,96E-09 21,66 23,81 25 9,86 3,45E-09 9,85 3,53E-09 40,2 41,6 30 10,14 2,17E-09 10,14 2,17E-09 63,7 66,5 0 5,3 0 5,5 0 0,75 0,7 5 5,72 9,53E-06 5,8 7,92E-06 1,35 1,33 10 6,33 4,68E-06 6,49 3,24E-06 3,21 3,5 15 8,15 1,06E-07 8,26 8,24E-08 9,92 11,02 20 9,32 9,57E-09 9,35 8,93E-09 21,68 23,9 25 9,9 3,15E-09 9,9 3,15E-09 40,3 41,8 30 10,16 2,08E-09 10,18 1,98E-09 63,9 66,8 0 5,33 0 5,48 0 0,65 0,72 5 5,7 9,98E-06 5,78 8,30E-06 1,28 1,3 10 6,35 4,47E-06 6,45 3,55E-06 3,25 3,46 15 8,11 1,16E-07 8,2 9,46E-08 9,87 10,95 20 9,28 1,05E-08 9,32 9,57E-09 21,8 22 25 9,91 3,08E-09 9,85 3,53E-09 40 41,6 30 10,12 2,28E-09 10,15 2,12E-09 64,1 65,9 S O D VA ER S E SR C HO C E ER C A N O LA #3 D ml NaOH vs conductividad 0,000014 70 0,000012 60 0,00001 50 0,000008 muestra 1 0,000006 muestra 2 0,000004 µS/cm Vb*10^(-pH) ml NaOH vs vb1*10^(-pH1) 40 muestra 1 30 muestra 2 20 0,000002 10 0 0 20 40 ml NaOH Grafica 4.17. pH-metro para el aceite de canola #1 0 0 20 ml NaOH 40 Grafico 4.18. Conductividad para el aceite de canola #1 73 ml NaOH vs vb1*10^(-pH1) ml NaOH vs vb1*10^(-pH1) 0,00001 0,000012 0,000008 0,00001 0,000006 muestra 1 0,000004 muestra 2 0,000002 0 0 10 20 30 40 H C E R ml NaOH DE R S O Grafico 4.19. pH-metro para el aceite de canola #2 Vb*10^(-pH) Vb*10^(-pH) 0,000012 0,000006 R E S E 0,000004 0,000002 0 10 20 30 40 Grafico 4.20. pH-metro para el aceite de canola #3 ml NaOH vs conductividad 70 70 60 60 50 50 muestra 1 muestra 2 20 µS/cm µS/cm muestra 2 ml NaOH 80 30 muestra 1 0 ml NaOH vs conductividad 40 S O D VA 0,000008 40 30 muestra 1 20 muestra 2 10 10 0 0 0 0 10 20 30 40 ml NaOH Grafico 4.21. Conductividad para el aceite de canola #2 10 20 30 40 ml NaOH Grafico 4.22. Conductividad para el aceite de canola #3 Como se puede apreciar desde la tabla 4.5 hasta la tabla 4.8 así como en las figuras desde el 4.5 hasta el 4.22 los datos se recolectaron con la mayor precisión posible y tratando en lo posible de minimizar errores humanos. 4.3. Determinar el valor del índice de acidez resultante de los diferentes métodos potenciometricos según los criterios establecidos en la Norma COVENIN 325:2001 para las marcas de aceites vegetales comestibles seleccionadas. S O D VA Posteriormente a la toma de datos, se tomaron los puntos de las gráficas ER S E R S obtuvieron los datos de M y B. O Para el caso del pH-metro se realizó la regresión CH (sin incluir cuando los ml de la solución NaOH son E lineal con los 3 primeros puntos R E D igual a 0), mientras que para el caso del conductimetro se utilizaron los últimos 4 donde la curva tendía a una línea recta y a través de la regresión lineal se puntos, después se procedió a despejar el valor de X haciendo Y=0 para obtener los mililitros en la cual se produjo el cambio con el fin de proceder al cálculo de la acidez y el índice de acidez en las muestras preparadas. (Ec. 4.1) A continuación se muestran a través de tablas, los porcentajes de acidez obtenidos a partir de los datos obtenidos de ml de NaOH por el método grafico de Gran y las ecuaciones 2.10 y 2.12 que expresa la norma para el cálculo del índice de acidez. De igual manera se muestra el porcentaje de acidez que se calculó a través del método volumétrico. 75 4.3.1. pH-metro Tabla 4.9. Cálculo del índice de acidez usando el pH-metro. Muestra 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 Tipo Soya Soya Soya Oliva Oliva Oliva Peso (g) 10,842 10,4537 10,2174 10,0759 10,0162 10,2813 10,5802 10,0634 10,4439 10,6903 10,5001 10,4596 10,8407 10,6903 10,2065 10,0582 10,287 10,536 m -1,3E-06 -1,3E-06 -1,0E-06 -9,5E-07 -1,3E-06 -1,1E-06 -1,4E-06 -1,6E-06 -1,2E-06 -1,3E-06 -1,3E-06 -1,2E-06 -1,1E-06 -8,2E-07 -9,4E-07 -7,8E-07 -9,9E-07 -8,2E-07 D Canola Canola acidez 0,072 0,076 0,078 0,078 0,087 0,084 0,090 0,090 0,085 0,082 0,075 0,076 0,070 0,072 0,085 0,085 0,084 0,081 indice de acidez 0,143 0,152 0,155 0,156 0,174 0,168 0,180 0,180 0,169 0,164 0,149 0,152 0,139 0,143 0,170 0,169 0,167 0,162 S O D VA ER S E SR HO C E ER Canola b 2,0E-05 2,0E-05 1,6E-05 1,5E-05 2,0E-05 1,7E-05 2,3E-05 2,5E-05 1,9E-05 2,0E-05 2,0E-05 1,9E-05 1,7E-05 1,2E-05 1,4E-05 1,2E-05 1,5E-05 1,2E-05 4.3.2. Conductimetro Tabla 4.10. Cálculo del índice de acidez usando el conductimetro Muestra 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 Tipo Soya Soya Soya Oliva Oliva Oliva Canola Canola Canola Peso (g) 10,842 10,4537 10,2174 10,0759 10,0162 10,2813 10,5802 10,0634 10,4439 10,6903 10,5001 10,4596 10,8407 10,6903 10,2065 10,0582 10,287 10,536 m 4,07 4,39 5,01 4,51 3,81 3,17 2,20 2,13 3,47 2,18 3,47 2,28 4,20 4,27 4,22 4,29 4,23 4,39 b -53,46 -61,90 -77,84 -64,33 -54,83 -43,92 -33,67 -29,42 -50,19 -31,40 -50,19 -33,40 -65,25 -62,76 -63,59 -63,08 -63,78 -66,58 acidez 0,062 0,070 0,078 0,073 0,083 0,078 0,084 0,079 0,080 0,078 0,071 0,072 0,074 0,071 0,085 0,084 0,085 0,083 indice de acidez 0,124 0,138 0,156 0,145 0,165 0,155 0,166 0,158 0,159 0,155 0,141 0,144 0,147 0,141 0,170 0,168 0,169 0,166 76 4.3.3. Método Volumétrico Tabla 4.11. Cálculo del índice de acidez a través del método volumétrico Muestra 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 Tipo Soya Soya Soya Oliva Oliva Oliva Peso (g) 10,842 10,4537 10,2174 10,0759 10,0162 10,2813 10,5802 10,0634 10,4439 10,6903 10,5001 10,4596 10,8407 10,6903 10,2065 10,0582 10,287 10,536 Canola Canola indice de acidez 0,198 0,204 0,174 0,173 0,211 0,225 0,333 0,343 0,220 0,223 0,333 0,334 0,196 0,196 0,224 0,225 0,224 0,220 S O D VA ER S E SR HO C E Canola ER D acidez 0,099 0,103 0,087 0,087 0,106 0,113 0,167 0,172 0,111 0,112 0,167 0,168 0,099 0,098 0,113 0,113 0,112 0,111 Como se muestra en las tablas 4.9, 4.10 y 4.11, existe una variación en los índices de acidez para cada uno de los métodos y esto es debido a la eficacia de cada uno. El más notable en este caso es para el método volumétrico donde los datos obtenidos se separan en gran medida con respecto a los métodos potenciometricos. Por otra parte tenemos que aunque los valores para el pH-metro y el conductimetro son muy parecidos, el conductimetro tiene una mayor precisión al momento de alcanzar el punto de equivalencia de la solución, punto clave para calcular la acidez como porcentaje de ácido oleico y posteriormente el índice de acidez. Cabe destacar que una de las características primordiales del aceite de oliva es que tiene un porcentaje de ácido oleico mayor que cualquier otro tipo de aceite, por esta razón es posible conseguir valores de índice de acidez para el aceite de 77 oliva que estén muy cercanos a los valores máximos permitidos por la Norma COVENIN 325:2001. A su vez, el aceite de canola para las dos últimas muestras tiene un índice de acidez un poco elevado, esto se podría deber al tiempo de almacenamiento de este aceite dentro del laboratorio. 4.4. Comparar la efectividad de los métodos potenciometricos (pH-metro y conductimetro) en las marcas de aceite vegetales comestibles S O D VA seleccionados. ER S E En la tabla 4.12 se muestra los R resultados estadísticos del análisis de las S O H y los métodos estudiados. La primera columna C muestras para los aceites utilizados E R E de resultados,D corresponde a la medida aritmética de las muestras, la segunda columna indica la desviación estándar para cada una de los aceites, la tercera columna indica la desviación estándar relativa para cada variedad de aceite y, finalmente, la cuarta columna corresponde al porcentaje del coeficiente de variación. Tabla 4.12. Resumen estadístico de los resultados obtenidos de todos los métodos estudiados. Titulacion Volumetrica Titulacion potenciometrica (pHMetro) Titulacion potenciometrica (Conductimetro) SOYA OLIVA CANOLA SOYA OLIVA CANOLA SOYA OLIVA CANOLA X ̅ (g/100 mL) 0,20 0,30 0,21 0,16 0,17 0,16 0,15 0,15 0,16 σ (g/100 ml ) 0,02 0,05 0,01 0,01 0,01 0,01 0,01 0,01 0,01 DER (ppmil) 95,28 181,29 60,51 64,01 73,51 78,11 90,74 56,90 71,47 CV (%) 9,53% 18,13% 6,05% 6,40% 7,35% 7,81% 9,07% 5,69% 7,15% 78 De los estudios potenciometricos señalados anteriormente se resalta la desviación estándar y el coeficiente de variación, los cuales fueron considerados como una medida de la repetitividad del método. A pesar de que la desviación estándar para la mayoría de los métodos presento valores por debajo del 10%; cuyo valor cabe dentro de la definición de aceptable para el coeficiente de variación, se observó que el coeficiente de variación optimo fue obtenido por la titulación potenciometrica a través del conductimetro, con valores que varían entre 7 a 9% para todos los aceites vegetales estudiados. S O D Avan desde 6% a 18% simulares entre cada uno de los aceites, con valoresV que R E S las titulaciones potenciometricas. para la titulación volumétrica y de 6% a R 8%E para OS H C E R E D Tomando en cuenta el valor máximo permitido por la Norma COVENIN Por otro lado, los métodos presentan coeficientes de variación notoriamente 325:2001 para el índice de acidez, se observó que para el método volumétrico se encuentran en el tope de acidez permitida y para los métodos potenciometricos se localizan en rangos menores en comparación a la titulación volumétrica, con algunas excepciones para el aceite de oliva. CONCLUSIONES Se seleccionaron como objetos de estudio, 3 diferentes tipos de aceites vegetales que consume la población venezolana de manera cotidiana, de estos 3 diferentes tipos se escogieron 3 marcas distintas. En cuanto a la preparación de las muestras para su posterior análisis, fue necesario tener especial cuidado con el tiempo de almacenamiento después de haber abierto cada una de las botellas, con el fin de prevenir la contaminación y el cambio de propiedades de las muestras. S O D VA ER S E Ren cuanto a la medición del índice de titulación volumétrica o métodoO visual, S H Ccomestibles E acidez en aceites vegetales de diferentes tipos. Igualmente, en cuanto R E D a la forma de procesar los resultados obtenidos experimentalmente, la titulación El método de titulación potenciometrica es más preciso que el método de potenciometrica para el conductimetro resulto tener una mayor efectividad con el método grafico de Gran; que al utilizar el pH-metro. Se observaron discrepancias en cuanto a los resultados analíticos obtenidos con el método Volumétrico, debido que la detección del punto de equivalencia se realiza mediante el viraje de color de un indicador químico, lo que presenta la desventaja de depender enormemente de la apreciación del analista. En líneas generales, el método de titulación potenciométrica ofrece puntos de equivalencia más confiables, obteniendo mejores resultados al disminuir la cantidad de errores de medición humana. Sin embargo, se requiere un mayor tiempo de análisis para su aplicación en comparación con las titulaciones volumétricas por lo que, en base a los resultados obtenidos, se justifica el uso de titulaciones volumétricas en aquellos casos en que se requiera una medición rápida y aproximada. RECOMENDACIONES Emplear el método de titulación potenciométrica para la determinación del índice de acidez en aceites vegetales comestibles, haciendo uso del gráfico de Gran. Al utilizar el método del gráfico de Gran en titulaciones potenciométricas, eliminar los puntos de la valoración en los que se cometen más errores, es decir, los puntos iniciales de la valoración y los que están muy próximos al punto de equivalencia. S O D VA ER S E R Aplicar el método de titulación potenciométrica para la estandarización de S O H EC en el laboratorio. diversas disoluciones utilizadas R E D Realizar análisis del índice de acidez en otros aceites vegetales de diferentes tipos y marcas, en diferentes condiciones de almacenamiento y compararlas con las obtenidas en este trabajo especial de grado. Realizar diferentes pruebas estipuladas por la Norma COVENIN para la determinación de parámetros que rigen la calidad de los aceites. 81 REFERENCIAS BIBLIOGRAFICAS Albarracin, P., Garay, F., Di Bacco, V., Gonzalez, M., Tereschuk, M., Chauvet, S., & Genta, H. (2010). Estudios de la caracterizacion de aceites usados en frituras para ser utilizados en la obtencion de jabon. tucaman: departamento de ingenieria de procesos y gestion industrial, facultad de ciencias exactas y tecnologia, universidad nacional de tucaman. Arias, F. (2004). El proyecto de la investigacion: introduccion a la investgacion cientifica. Caracas: Episteme. S O D VAPearson Educacion. Baudi Dergal, S. (2006). Quimica de los alimentos. Mexico: R E S 6ta edicion. Mexico: McGrawE Blank, L., & Taquin, A. (2006). IngenieriaR economica OS H C Hill. RE E D Brunatti, C., & De Napoli, H. (20 de agosto de 2002). Metodos Potenciometricos. Badui. (2006). Obtenido de ocw.usal.es: http://ocw.usal.es/cienciasexperimentales/analisis-aplicado-a-la-ingenieriaquimica/contenidos/course_files/Tema_8.pdf Cromer, A. (2007). Fisica para las Ciencias de la Vida. Barcelona: Reverte. Day, & Underwood. (1986). Day, R., & Underwood, A. (1986). Quimica Analitica Cuantitativa. Mexico: PrenticeHall HISPANOAMERICA. Guisande, C., Barreiro, A., Maneiro, I., Riveiro, I., Vergara, A., & Vaamonde, A. (2006). Tratamiento de datos. Madrid. Harris, D. (2007). Analisis Quimico Cuantitativo. Barcelona: Reverte. Hernandez , C., Rodriguez, Y., Zulai, N., & Perez, S. (2009). Efecto del almacenamiento de maiz (Zea mays) sobre la calidad del aceite extraido. Valencia: Universidad de Carabobo. Hernandez, R., Fernandez, C., & Baptista, P. (2006). Metodologia de la investigacion. Mexico: McGraw-Hill. 82 Hurtado, J. (2010). Metodologia de la investigacion: guia para la comprension holistica de la ciencia. Caracas: Quiron. Lopez, J., Gomez, C., Rivas, J., & Losada, M. (1974). Practicas de Bioquimica: pHMetria. Sevilla: Editorial de la Universidad de Sevilla. Martinez, R. (2012). Titulacion potenciometrica. Matilla Hernandez, A. (18 de Febrero de 2009). Valoraciones potenciometricas acido-base. Obtenido de Universidad de granada: http://www.ugr.es/~focana/dfar/aplica/valorAcidoBase/valoraciones_acidobase.pdf S O D VA Mongay, C. (2005). Quimiometria. Valencia: Publicacion de la Univercidad de ER S E SR Valencia. Montgomery. (2003). Diseño y analisis de experimentos Eda Edic. Ciudad de HO C E ER Mexico. Mexico: Limusa Wiley. D Novoa, M., & Salazar, J. (2013). Comparasion de los metodos de titulacion fotometrica y volumetrica para la determinacion de la alcalinidad y dureza en aguas. (Trabajo especial de grado para optar por el titulo de ingeniero quimico). Maracaibo, Venezuela: Universidad Rafael Urdaneta. Prichard. (2003). Practical laboratory skills training guides: measurement of pH. Cambrige: LGC (Teddington) Limited. Quintana, C. (1996). Elementos de inferencia estadistica. San Jose, Costa Rica: Editorial de la Universidad de Costa Rica. Riaño, N. (2007). Fundamentos de la quimica analitica basica. Analisis cuantitativo. Manizales: Editorial Universidad de las Caldas. Sanchez, T. D. (03 de Diciembre de 2011). Proyecto de calibracion. Obtenido de http://proyectodecalibracion.blogspot.com/: http://proyectodecalibracion.blogspot.com/2011/12/ph-metro.html Skoog, D., & Leary, J. (1994). Analisis instrumental. Barcelona: McGraw-hill. Skoog, D., West, D., Holler, J., & Crouch, S. (2005). Fundamentos de Quimica Analitica. Madrid: Thomson. DER S O H EC S O D VA R E S RE Anexos 84 1. Toma de datos del método volumétrico a aceite de oliva. S O H EC DER 2. Punto de equivalencia alcanzado a través del método potenciometrico para aceite de soya. 3. Toma de datos del método volumétrico a aceite de oliva. S O D VA R E S RE 4. Punto de equivalencia alcanzado a través del método volumétrico para aceite de canola. 85 5. pH-metro utilizado para las pruebas. Marca BOECO BT-500 S O H EC DER 6. Toma de datos de laboratorio a través del método potenciometrico (pH-metro). R E S RE S O D VA