Solucionario El enlace químico
Anuncio

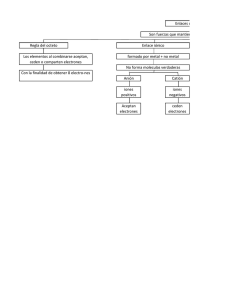
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Alternativa E B C D D D D C E C C A A B B D B C A C E A B B E Habilidad Reconocimiento Aplicación Comprensión Comprensión Aplicación Aplicación Comprensión ASE Comprensión Comprensión ASE ASE ASE Aplicación Comprensión Reconocimiento Comprensión Comprensión Comprensión Comprensión Reconocimiento Comprensión Comprensión Comprensión Reconocimiento EJERCICIOS PSU Ítem 1 Alternativa Defensa E El enlace iónico se establece entre elementos de electronegatividad diferentes (metales del grupo IA o IIA y no metales del grupo VIA o VIIA), donde la diferencia de electronegatividad es ≥ a 1,7 produciéndose una transferencia de electrones (alternativa A incorrecta). El enlace covalente se forma entre elementos no metálicos (alternativa B incorrecta), cuya diferencia de electronegatividad sea < a 1,7, existiendo compartición de electrones. Este tipo de enlace se puede clasificar a su vez en: Polar: enlace entre átomos con distinta electronegatividad (0 < ΔEN < 1,7), por lo que los electrones de enlace se encuentran desplazados hacia el de mayor electronegatividad. Apolar: enlace entre átomos sin diferencia de electronegatividad, por lo que los electrones de enlace se comparten de igual forma entre los átomos (alternativa E correcta). Típicamente se da entre átomos de un mismo elemento, formando moléculas monoelementales (alternativa C incorrecta). Coordinado: tipo particular de enlace covalente polar, donde solo uno de los elementos a unirse aporta electrones para el enlace (alternativa D incorrecta). 2 B El enlace covalente se define como la compartición de electrones entre no metales iguales o diferentes con electronegatividad igual o semejante (0 ≤ ΔEN < 1,7). Esta definición se cumple solo en el caso del BrCl (opción II). El CsF (opción I) y el CsBr (opción III) presentan enlace de tipo iónico, ya que sus diferencias de electronegatividad son, respectivamente, 3,3 y 2,1, en ambos casos mayores que 1,7. 3 C El enlace covalente polar se puede definir como la compartición de electrones entre no metales diferentes, con electronegatividad semejante pero no igual (0 < ΔEN < 1,7). Esto se cumple en el caso del oxígeno con el hidrógeno (opción III). El oxígeno (grupo VIA) y el sodio (grupo IA) (opción I) se unen mediante enlace iónico y entre dos átomos de oxígeno (opción II) se forma un enlace covalente apolar. 4 5 D Los compuestos iónicos están formados por elementos con gran diferencia de electronegatividad (grupos IA o IIA y VIA o VIIA), son solubles en disolventes polares como por ejemplo el agua, poseen elevados puntos de fusión y ebullición, son electrolitos ya que al disolverse en agua se disocian en iones y conducen la electricidad. D Teniendo claro el comportamiento de la propiedad periódica electronegatividad y observando los valores de la tabla, la molécula de NaF es la que presenta un mayor carácter iónico con un valor de ∆E.N. = 3,1, mucho mayor que: NaCl → Enlace iónico (∆E.N.= 2,1) CF4 → Enlaces covalentes polares (∆E.N. = 1,5) HI → Enlace covalente polar (∆E.N. = 0,4) F2 → Enlace covalente apolar F2 (∆E.N. = 0) 6 D El ion NH4+ corresponde al catión amonio, el cual presenta en su totalidad ocho electrones de valencia, y tiene la siguiente estructura: Uno de los enlaces N-H es de tipo coordinado o dativo, ya que es el nitrógeno el que dona los dos electrones para enlazarse con el protón. Los otros tres enlaces son covalentes polares. Cabe recordar que un enlace covalente dativo es también un tipo de enlace covalente polar. 7 D Las sustancias covalentes tienen bajos puntos de fusión y de ebullición (opción I correcta) y no conducen la corriente eléctrica en estado líquido ni en disoluciones (opción III incorrecta). Las moléculas de hidrógeno (H2) y cloro (Cl2) presentan enlace covalente apolar y el amoníaco (NH3), covalente polar (opción II correcta). 8 C En este caso, la sustancia X posee enlace iónico, ya que cumple con las características propuestas: tener elevados puntos de fusión y ebullición, ser relativamente soluble en agua, pero no en disolventes orgánicos como el benceno y no ser conductor de la electricidad en estado sólido, pero sí cuando se presenta fundido o en disolución. La sustancia Y presenta las características de un compuesto covalente y el Z, de un compuesto metálico. 9 E Las moléculas que presentan enlace covalente apolar son aquellas en las que su diferencia de electronegatividad es cercana o igual a cero, en este caso O2 y Cl2 (opciones I y III correctas). El H2O (opción II incorrecta) presenta enlace covalente polar, ya que el oxígeno es más electronegativo que el hidrógeno, con un E.N = 1,4. 10 C El enlace iónico se forma entre elementos metálicos de los grupos IA y IIA y no metales de los grupos VIA y VIIA. Por lo tanto, los compuestos W2Y y XZ2, formados por elementos de los grupos IA y VIA en el primer caso, y IIA y VIIA en el segundo, presentarán enlaces iónicos. Mientras que el compuesto YZ2, formado por elementos de los grupos VIA y VIIA (ambos no metales), presentará enlace de tipo covalente. 11 C La molécula que presenta en su estructura enlaces de tipo covalente polar y dativo es el ácido nítrico (HNO3). En donde se observa que en uno de los enlaces entre nitrógeno y oxígeno, los dos electrones de enlace son aportados por un único átomo, en este caso por el nitrógeno. El resto de los enlaces son covalentes polares, ya que ΔEN = 1,4 entre O y H y ΔEN = 0,4 entre N y O. 12 A Los compuestos iónicos presentan un alto valor en sus puntos de fusión y ebullición, se agrupan en estructuras cristalinas y presentan una alta solubilidad en disolventes polares como el agua. 13 A Habilidad de pensamiento científico: Procesamiento e interpretación de datos y formulación de explicaciones, apoyándose en los conceptos y modelos teóricos. Los compuestos 1, 2 y 3 son covalentes, ya que no conducen la corriente eléctrica y no se disuelven en agua. Observando sus puntos de fusión y ebullición podemos ver que a 25 °C se encuentran en estado gaseoso, líquido y sólido, respectivamente (opción I correcta). Los compuestos con alto punto de ebullición, son el 3, 4 y 5; 3 y 5 no se disuelven en agua, pero el compuesto 4 sí lo hace (opción II incorrecta). Para determinar qué compuestos se encuentran en estado sólido a 25°C debemos buscar aquellos con punto de fusión superior a esa temperatura. Esto se cumple para los compuestos 3, 4 y 5 (opción III incorrecta). 14 B El compuesto BF3 tiene 3 pares de electrones enlazantes (alternativa A incorrecta) y 9 pares no enlazantes, como muestra la siguiente estructura de Lewis: En el compuesto Cl2 existen 6 pares de electrones no enlazantes y un par enlazante para completar el octeto. La estructura de Lewis para la molécula es NO2-, es la siguiente: En ella se aprecia que la molécula no contiene enlaces dativos (alternativa C incorrecta). El compuesto HCl está formado por un elemento del grupo IA y uno del VIIA, sin embargo, el hidrógeno es el único elemento del grupo IA que no es metálico y su valor de electronegatividad es más alto que el resto de los elementos de este grupo. La diferencia de electronegatividad entre H y Cl es 0,9, por lo tanto, se trata de un compuesto covalente (alternativa D incorrecta). CCl4 cumple con la regla del octeto (alternativa E incorrecta), como se observa en su estructura de Lewis: 15 B Si bien es cierto que la diferencia de electronegatividades entre el H y el F es mayor a 1,7 (correspondiente a un enlace iónico), el hidrógeno solo puede formar enlaces de tipo covalente polar con otros átomos distintos a él, pues para completar el dueto debe compartir electrones. 16 D Los electrones de valencia son los que se encuentran en el nivel de energía más externo de un átomo y participan en los enlaces químicos de las moléculas. 17 B Los electrones de valencia son los que se encuentran en el nivel de energía más externo de un átomo. En este caso el nivel más externo es el 2. Sumando los electrones que se encuentran en ese nivel, se obtiene: 1s2 2s2 2p2 4 electrones de valencia 1s2 2s2 2p4 6 electrones de valencia 1s2 2s2 2p6 8 electrones de valencia 18 C El enlace covalente apolar es aquel donde los electrones se comparten de forma equidistante, por lo tanto el dibujo que mejor lo representara será aquel donde las nubes electrónicas alrededor de los dos núcleos enlazados sean simétricas entre sí. 19 A El elemento con configuración [Ar] 4s1 al unirse con otro átomo diferente, formará un enlace iónico, cediendo su electrón de valencia para convertirse en un catión de carga +1. Así, se estabiliza electrónicamente, quedando su configuración electrónica como la del gas noble argón (Ar). 20 C Para que las especies sean eléctricamente estables, ambas especies deben ganar un electrón, así se cumple la regla del octeto y del dueto, respectivamente. Para esto, las especies comparten un par de electrones, formando un enlace covalente simple y como se trata de dos elementos distintos el enlace será covalente polar. 21 E En los enlaces iónicos uno de los elementos cede electrones al otro (opción I correcta), de modo que tal como indica el nombre, se forma un enlace entre iones de carga opuesta. Este tipo de enlace se da entre elementos de los grupos IA o IIA con elementos de los grupos VIA o VIIA (opción II incorrecta). La diferencia entre los valores de electronegatividad (∆EN) debe ser mayor a 1,7 para que se trate de un enlace iónico. 22 A La unión de tipo covalente apolar se da, principalmente, en moléculas monoelementales diatómicas tales como: H2, N2, F2, etc. El MgF presenta enlace iónico, ya que Mg pertenece al grupo IIA y F al VIIA. Lo mismo ocurre con NaCl, cuyos elementos constituyentes pertenecen a los grupos IA y VIIA. H2O y el NH3, presentan enlace covalente polar, ya que el H solo puede formar enlaces covalentes y presenta menor electronegatividad que O y N. 23 B El compuesto fluoruro de potasio (KF) es el único que presenta enlaces de tipo iónico, ya que se trata de elementos del grupo IA y VIIA (gran diferencia de electronegatividad, a excepción del H). Los compuestos ácido clorhídrico (HCl) y tetracloruro de carbono (CCl4) presentan enlaces de tipo covalente. 24 B Se establece un enlace químico entre dos átomos o grupos de átomos cuando las fuerzas que actúan entre ellos conducen a la formación de un agregado con suficiente estabilidad (molécula). Dicha estabilidad de un compuesto está asociada a un estado de menor energía (alternativa E incorrecta). La alternativa A es incorrecta porque la formación de enlaces no tiene relación con la solubilidad. La alternativa C también es incorrecta porque solo algunos átomos pierden electrones al formar un enlace (aniones que forman enlaces iónicos), pero muchos ganan electrones y algunos comparten electrones. La formación del enlace no depende de los núcleos (alternativa D incorrecta). 25 E Los compuestos metálicos son dúctiles y maleables debido a que no existen enlaces con una dirección determinada. Son buenos conductores de la electricidad debido a la deslocalización de los electrones, que pertenecen a toda la red metálica. Los electrones pueden moverse a lo largo de los orbitales vacíos y conducir la corriente eléctrica al aplicar una diferencia de potencial.