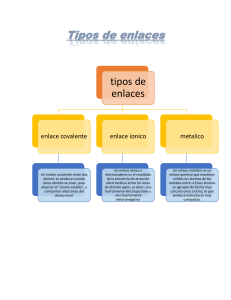
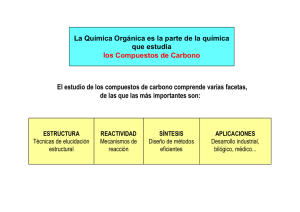
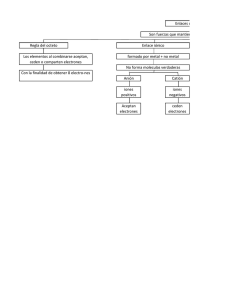
Un enlace químico es el proceso físico responsable de las
Anuncio

Un enlace químico es el proceso físico responsable de las interacciones atractivas entre átomos y moléculas, y que confiere estabilidad a los compuestos químicos compuestos químicos diatomicos y poliatomicos. La explicación de tales fuerzas atractivas es un área compleja que esta descrita por las leyes de la electrodinámica cuantica. Sin embargo, en la práctica los químicos suelen apoyarse en la mecánica cuantica o en descripciones cualitativas que son menos rigurosas, pero más sencillas en su descripción del enlace químico. En general el enlace químico fuerte esta asociado con la comparticion o transferencia de electrones entre los átomos participantes. Las moléculas, cristales y gases diatomicos están unidos por enlaces químicos que determinan la estructura de la materia. Los enlaces varían ampliamente en su fuerza. Generalmente, el enlace covalente y el enlace iónico suelen ser descritos como “fuertes” mientras que el enlace de hidrogeno y las fuerzas de Van der Waals son considerados como “débiles” Debe tenerse cuidado porque los enlaces “débiles” mas fuertes pueden ser mas fuertes que los enlaces fuertes mas “débiles”. El enlace covalente polar es intermedio en su carácter entre enlace covalente y un enlace iónico. Los átomos enlazados de esta forma tienen carga eléctrica neutra, por lo tanto que el enlace se puede llamar no polar. Los enlaces covalentes pueden ser simples cuando se comparte un solo par de electrones, dobles al compartir dos pares de electrones, triples cuando se comparten tres tipos de electrones, o cuádruples cuando comparten cuatro tipos de electrones. Los enlaces covalentes no polares se forman entre átomos iguales, no hay variación en el número de oxidación. Los enlaces covalentes polares se forman con átomos distintos con gran diferencia de electronegatividades. La molécula es eléctricamente neutra, pero no existe simetría entre las cargas eléctricas originando polaridad, un extremo se caracteriza por ser electropositivo y el otro electronegativo.