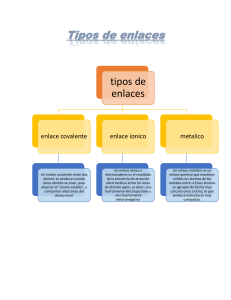
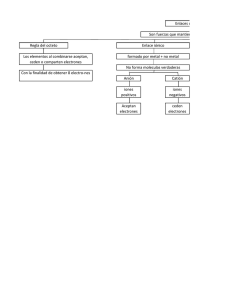
¿Qué es el enlace quimico? Son las fuerzas que mantienen unidos a los atomos ¿Para que los atomos se unen a los enlaces quimicos? Por la tendencia que poseen los atomos de lograr estructuras similares a las del gas noble mas cercano y ser electricamenete estable Enlaces intramoleculares: Enlaces dentro de la molecula Iónico Covalente Metálico Fuerzas intermolecular: Crean interrelación entre 2 o más moléculas Puente de hidrogeno: Se forma solo entre moléculas polares que tienen átomos de H unidos a un elemento muy electronegativo Los enlaces por puente de hidrogeno se forman cuando el hidrogeno esta unido a elementos muy electronegativos Fuerzas de van der Waals: (Fuerzas de atracción entre moléculas neutras), Dipolo- dipolo (covalentes polares),dispersión de London (covalentes no polares) ¿Cuál es la importancia del puente de hidrogeno? Es esencial para la integridad estructural de muchas moléculas biológicas Enlace iónico o electrovalente Son interacciones de naturaleza eléctrica muy intensa que se da entre un catión y un anión Se caracteriza por la transferencia de electrones desde un metal hacia un no metal Se da entre un elemento metálico y un no metálico No forman moléculas verdaderas, existe como un agregado de aniones y cationes Formación de Cationes: Los metales pierden electrones formando cationes, al proceso de perder electrones se le llama oxidación Formación de aniones: Los no metales ganan electrones este proeso es llamado reducción Características de los compuestos iónicos: Solidos a temperatura ambiente (25º) Fragilidad en estado solido Malos conductores eléctricos Enlace covalente: Es una unión química entre 2 o más átomos donde se comparte electrones, la diferencia de la electronegatividad es menor a 1,7 Características de los átomos que forman un enlace covalente: No metálicos Tener electronegatividad similares Cuando se unen no forman iones Características de compuestos covalentes: Puntos de fusión y ebullición bajos Ser blandos Baja resistencia mecánica Redes covalentes: Diamante: Tetraedros de átomos de carbono Grafito: Laminas de átomo de carbono Tipos de enlaces covalentes: Según el número de enlaces: Enlace simple: 1 enlace sigma Enlace doble: 1 enlace sigma y 1 enlace pi Enlace triple: 1 enlace sigma y 2 enlaces pi Según la manera de aportar electrones: Normal: Cada átomo aporta un electrón para formar el par electrónico enlace Coordinado o dativo: Cuando el par de electrones compartidos es puesto por el mismo átomo Según su polaridad: Apolar: Unión de átomos con la misma electronegatividad, ejemplo: H21 N21 Covalente no polar: Está formado por átomos iguales y la diferencia de electronegatividad es igual a 0, ejemplo: CL2 O2 Polar: Átomos unidos con una diferencia de electronegatividad menor a 1,7, ejemplo: H2S H2O Covalente Polar: Está formado por no metales de diferente electronegatividad Enlace metálico: Es el que mantiene unido a los átomos de los metales entre sí. Propiedades de los metales: Poseen un brillo metalico No se disuelven en los disolventes ordinarios Son flexibles, dúctiles y maleables