Presentación de PowerPoint
Anuncio

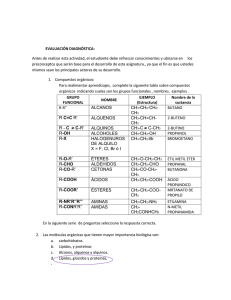
www3.uah.es Título del diagrama COMPUESTOS INORGANICOS ORGANICOS Sintetizados por los seres vivos Tienen "Fuerza vital" El carbono ¿Por qué el carbono? Los enlaces del carbono son covalentes Los átomos tienen tendencia a adquirir la configuración electrónica del gas noble mas cercano, a rodearse de un octeto de electrones. En el caso del carbono esto es difícil, acumularía mucha carga En carbono no forma enlaces iónicos El carbono forma enlaces covalentes compartiendo electrones El carbono se rodea de un octeto de electrones Pero hay tres hechos que nos hacer dedicar una atención especial a la química del carbono El número de compuestos donde interviene el C es de varios millones Las moléculas que constituyen los seres vivos Los compuestos del C presentan, en general, propiedades físicas y químicas distintas a las de los compuestos inorgánicos Enseñanza - Aprendizaje www.cida.gob.ve La corteza terrestre contiene un 0.1 % de carbono … …pero los compuestos orgánicos suponen un 95% de los conocidos El carbono es el elemento clave alrededor del cual se construye el proceso de la vida misma desarrollando el último subnivel: 1s2 2s2 2px1py1pz Pero esta configuración electrónica no explica: 1) la valencia covalente 4, que es la normal en el C 2) los enlaces iguales en casos como el metano, pues se formarían a partir de OA diferentes, unos del orbital atómico tipo s y otros de los orbitales atómicos tipo p 3) los ángulos de enlace, que en el caso de los p serían de 90º y con el s no tendrían una dirección determinada. La teoría del enlace de valencia resuelve el problema suponiendo que el carbono utiliza un tipo de orbitales, idénticos entre sí, resultado de la hibridación entre los orbitales atómicos puros 2s y 2p. Las cadenas de carbono son muy estables El carbono tiene una facilidad única para formar enlaces fuertes con otros átomos de carbono. Puede formar cadenas tridimensionales. blog.educastur.es Los átomos de carbono, tienen mucha facilidad para unirse entre sí y formar cadenas muy variadas. Todos sus átomos forman siempre cuatro enlaces covalentes C C H H C C C H H H H H Cadena cerrada: ciclo H | C H | H Cadena abierta lineal H H H H H H H H | | | | C C C C | | | | H H H H H H H | | C C | H H H | C | C H | H H | C H | H Cadena abierta ramificada Las fórmulas desarrolladas solo muestran como están unidos los átomos entre sí, pero sin reflejar la geometría real de las moléculas H H H | | | H C C C | H CH3 CH CH Las fórmulas semidesarrolladas solo especifican los enlaces entre átomos de carbono H H | | C C | | H H CH2 H CH3 H CH3 H H H | | | C C C CC H | | | H H H CH2 CH2 C CH Además puede formar enlaces fuertes con otros átomos como H, O, N. 83 kcal/mol 53 kcal/mol Átomos más grandes, mayor distancia de enlace 40 kcal/mol Repulsión de pares electrónicos no enlazados 34 kcal/mol Repulsión de 2x pares electrónicos no enlazados La tetravalencia del carbono se debe a que posee 4 electrones en su última capa, de modo que formando 4 enlaces covalentes con otros átomos consigue completar su octeto Metano Eteno CH2 CH4 H H H H H C H CH2 H C C H Etino H C C H CH CH • • • Enlace simple: Los cuatro pares de electrones se comparten con cuatro átomos distintos. Ejemplo: CH4, CH3–CH3 Enlace doble: Hay dos pares electrónicos compartidos con el mismo átomo. Ejemplo: H2C=CH2, H2C=O Enlace triple: Hay tres pares electrónicos compartidos con el mismo átomo. Ejemplo: HCCH, CH3–CN microamacro.blogspot.com La hibridación es un fenómeno que consiste en la mezcla de orbítales atómicos puros para generar un conjunto de orbítales híbridos, los cuales tienen características combinadas de los orbítales originales. El carbono puede hibridarse de tres maneras distintas: • Hibridación sp3: – 4 orbitales sp3 iguales que forman 4 enlaces simples de tipo “” (frontales). • Hibridación sp2: – 3 orbitales sp2 iguales que forman enlaces “” + 1 orbital “p” (sin hibridar) que formará un enlace “” (lateral) • Hibridación sp: – 2 orbitales sp iguales que forman enlaces “” + 2 orbitales “p” (sin hibridar) que formarán sendos enlaces “” Hibridación sp3 • • • • 4 orbitales sp3 iguales que forman 4 enlaces simples de tipo “” (frontales). Los cuatro pares de electrones se comparten con cuatro átomos distintos. Geometría tetraédrica: ángulos C–H: 109’5 º y distancias C–H iguales. Ejemplo: CH4, CH3–CH3 Hibridación sp2 • • • • 3 orbitales sp2 iguales que forman enlaces “” + 1 orbital “p” (sin hibridar) que formará un enlace “” (lateral) Forma un enlace doble, uno “” y otro “”, es decir, hay dos pares electrónicos compartidos con el mismo átomo. Geometría triangular: ángulos C–H: 120 º y distancia C=C < C–C Ejemplo: H2C=CH2, H2C=O Hibridación sp • 2 orbitales sp iguales que forman enlaces “” + 2 orbitales “p” (sin hibridar) que formarán sendos enlaces “” • Forma bien un enlace triple –un enlace “” y dos “”–, es decir, hay tres pares electrónicos compartidos con el mismo átomo, o bien dos enlaces dobles, si bien este caso es más raro. • Geometría lineal: ángulos C–H: 180 º y distancia CC < C=C < C–C • Ejemplo: HCCH, CH3–CN ¿Cómo ocurre la hibridación sp3 http://ocw.uam.es/cursos/almokhtarquimica/Tema_I.ppt http://ocw.uam.es/cursos/almokhtarquimica/Tema_I.ppt sp3 sp3 109°280 2s 2 py 2px Combinación lineal sp3 sp3 2 pz 4 OA 4 OA sp3 H H sp3 sp3 H H sp3 sp3 H C H CH4 OA orbital atómico OA orbital atómico H H La molécula de etano http://ocw.uam.es/cursos/almokhtarquimica/Tema_I.ppt ¿Cómo ocurre la hibridación sp2 http://ocw.uam.es/cursos/almokhtarquimica/Tema_I.ppt La molécula de etileno Combinación lineal sp2 2 py 2s 2px 2 pz p 4 OA Axial H sp2 sp2 sp2 Axial H p H H C sp2 Axial sp2 p H H Axial sp2 3 OA sp2 + 1 OA p Axial LATERAL sp2 sp2 π H C C2H4 H La presencia del enlace π explica la planariedad de la molécula http://ocw.uam.es/cursos/almokhtarquimica/Tema_I.ppt La molécula de etileno. El enlace π. http://ocw.uam.es/cursos/almokhtarquimica/Tema_I.ppt ¿Cómo ocurre la hibridación sp http://ocw.uam.es/cursos/almokhtarquimica/Tema_I.ppt Acetileno : C2H2 p Combinación lineal 2 py 2s sp sp p 2px 2 pz 4 OA 2 OA sp + 2 OA p LATERAL p H sp p sp p LATERAL sp sp H H C C p C2H2 http://ocw.uam.es/cursos/almokhtarquimica/Tema_I.ppt H Resumen de hibridación http://ocw.uam.es/cursos/almokhtarquimica/Tema_I.ppt imagenes-enlace-quimico.blogspot.com