UNIDAD I. INTRODUCCIÓN A LA QUÍMICA
Anuncio

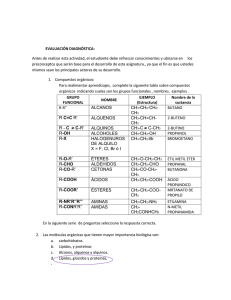
Química Orgánica UNIDAD I. INTRODUCCIÓN A LA QUÍMICA ORGÁNICA. Tema 2. Propiedades del carbono. I.1 Objetivo de aprendizaje: SABER: Explicar las propiedades del carbono: electronegatividad, energía de ionización, energía de enlace carbono-carbono, configuración electrónica, hibridación del carbono. SABER HACER: Modelar la estructura tridimensional del carbono en sus diferentes estados de hibridación. Configuración electrónica. Es la forma en la cual los electrones se acomodan o configuran en un átomo, o entre átomos (moléculas) de acuerdo con el modelo de capas electrónico. Propiedades del carbono. Todos los átomos deben tener el mismo número de protones que de electrones para permanecer neutros. En el caso del carbono con número atómico 6, tiene 6 electrones y 6 protones; es un elemento no metálico y tiene la capacidad de compartir 4 electrones dado que es la cantidad de estas partículas que tiene en su última capa. A continuación se muestra el diagrama energético del carbono en su estado basal. Electronegatividad. Esta característica mide la capacidad de un átomo de atraer electrones, el carbono posé una electronegatividad de 2.4 en la escala de Pauling que va del 0.7 al 4. Este valor intermedio significa que no tiene suficiente fuerza para atraer electrones pero tampoco para cederlos por completo; por lo cual una característica del carbono es que COMPARTE electrones con otros elementos lo cual genera una gran variedad de compuestos. Las posibles formas en cómo se puede representar en la estructura de Lewis el carbono depende si forma enlaces simples, dobles o triples; tal como se muestra a continuación: Energía de ionización. Representa la energía necesaria para “arrancar” o desprender un electrón de un átomo en estado gaseoso; existe una primera energía de ionización que representa la energía para arrancar un electrón, y se puede requerir una segunda energía de ionización para arrancar el segundo electrón de la sustancia. Como el átomo de carbono tiene 6 electrones es posible reportar 6 energías de ionización. Energía de enlace carbono carbono. Cada enlace tiene una energía determinada, por ejemplo en el proceso de combustión cuando los hidrocarburos se consumen con oxígeno se libera energía en forma de calor, esto representa los enlaces que han sido rotos (se libera energía) y se generan otros enlaces que requieren menos energía. Este tipo de reacciones se llaman EXOTÉRMICAS, ya que liberan calor. En el caso del carbono es necesario que cumpla con la famosa regla del octeto; es decir, dado que comparte 4 electrones en su última capa de valencia (indicado por cada uno de los puntos) se requiere que comparta otros 4 electrones, los cuales serán aportados por los elementos con los que puede formar enlaces. Cada enlace simple esta formado por dos electrones con diferente espin, (un spin positivo y uno negativo). Lo mismo ocurre con las reacciones ENDOTÉRMICAS, es decir las que absorben calor para poder llevarse a cabo; esto debido a que se forman enlaces que requieren energía del medio ambiente. Elaboró: Ing. Marcel Ruiz Martínez 1 Química Orgánica Ahora cuando un átomo de carbono reacciona con otros átomos se modifica su estado basal y se forma un estado que se conoce como de activación: Hibridación sp3 del carbono. La segunda capa, donde se encuentran los electrones de valencia al combinarse (un orbital s con 3 orbitales p) forman 4 orbitales sp3. Como puede notarse ahora se pueden acomodar 4 electrones en cada orbital: uno “s” y 3 orbitales ”p”. Una persona podría pensar que en el enlace del orbital 2s tendrá características diferentes que el resto de los orbitales “p” pero la sorpresa es que esto no es así, los 4 enlaces simples que pueden formarse son idénticos en energía y características. Este fenómeno hace que se introduzca el concepto del ORBITALES HIBRIDOS DEL CARBONO, dado que éstos comparten sus propiedades. Recuerda que orbital es el A continuación se muestra la estructura tridimensional. Existen 3 formas en como los orbitales se combinan para formar enlaces, se conocen como hibridaciones sp3, sp2 y sp. Los 4 enlaces simples del carbono se representan en una hoja o en un plano de esta forma para lograr escribir estructuras más complejas o moleculares. Elaboró: Ing. Marcel Ruiz Martínez 2 Química Orgánica Hibridación sp2. Existe una gran variedad de compuestos orgánicos que contienen enlaces dobles y simples; a continuación se muestra una estructura. Si se mezclan 3 orbitales atómicos (un “s” y dos “p”) dará lugar a 3 orbitales sencillos o simples llamados sp2 y un orbital “p” quedara puro. Pregunta para los alumnos: Del compuesto anterior indica cuales átomos de carbono presentan una hibridación sp3 y sp2. Hibridación sp del carbono. Si se mezclan dos orbitales atómicos, un “s” y un “p”; se forma la hibridación sp del carbono. La formula estructural del carbono en esa hibridación se representa de la siguiente forma: Por ejemplo en el caso del eteno o etileno la estructura queda de la siguiente forma: Ambos átomos de carbono tienen orbitales híbridos sp2. Elaboró: Ing. Marcel Ruiz Martínez 3 Química Orgánica Como son solo dos orbitales híbridos éstos se alejan lo m más posible formando un ángulo de 180° la geometría queda de la siguiente forma: hibridaci sp: RESPUESTA se indican los carbonos que tienen hibridación Por ejemplo la molécula de etileno tiene la siguiente representación representaci en papel (2D) y en su estructura de Lewis. Ejercicio en clase: Para la siguiente molécula écula identificar con una flecha cuales carbonos tienen hibridación sp3, sp2 y sp. hibridación sp3: RESPUESTA se indican los carbonos que tienen hibridaci RESPUESTA se indican los carbonos que tienen hibridaci hibridación sp2: Elaboró: Ing. Marcel Ruiz Martínez 4 Química Orgánica Actividad 1.2. Hibridaciones sp3, sp2, sp. A continuación revisa las siguientes moléculas: Actividad 1.3. Estructura tridimensional del carbono: carbono De manera individual realiza una na maqueta de la estructura del: metano, etano y etileno. A) METANO (CH4),, sigue las siguientes instrucciones: A) Materiales: 4 Bolas de unicel pequeñas (representan los átomos de hidrógeno). 1 Bola de unicel grande (representa el átomo de carbono). 4 Palitos de madera (representan los enlaces simples). B) Tal como fue realizado en clase identifica ca con una flecha cuales carbonos tienen hibridación sp3, sp2 y sp. Realiza una PRÁCTICA DE EJERCICIOS, las as rubricas de dicho producto se puedee consultar en la siguiente liga: http://marcelrzm.comxa.com/Rubricas/Rubricas.htm Enviar el trabajo a los siguientes correos: [email protected]; [email protected]; [email protected]; [email protected]; [email protected] También enviar copia del correo a sus compañeros de equipo y a usted mismo. Colocar en ASUNTO: “1.2 Propiedades del carbono” En la bola grande de unicel coloca con palillos las 4 bolitas pequeñas de forma tal que representen la posición de los enlaces y los átomos de hidrógeno. Siguiendo la misma lógica realiza las estructuras para los compuestos restantes: etileno y acetileno. acetileno B) ETILENO (C2H4) C) ACETILENO (C2H2) Toma una fotografía de tus maquetas y añádelas a un resumen en WORD sobre estos 3 compuestos haciendo incapié en la estructura tridimensional de cada compuesto y los estados de hibridación del carbono en cada uno. Las rubricas de RESUMEN se puedee consultar en la siguiente liga: http://marcelrzm.comxa.com/Rubricas/Rubricas.htm Enviar el trabajo a los siguientes correos: [email protected]; [email protected]; [email protected]; marcelrz [email protected] También enviar copia del correo a sus compañeros de equipo y a usted mismo. Colocar en ASUNTO: “1.3 Estructura tridimensional del carbono” carbono Elaboró: Ing. Marcel Ruiz Martínez 5