Bases Físicas y Químicas del Medio Ambiente 2004/2005. Hoja 11 Corregida
Área de Química-Física. Universidad Pablo de Olavide- pág. 1
82*. Soluciones:
a) PCl5 → PCl3+Cl2
∆Gºr=6.37 Kcal/mol
b) K(298K)=2.14·10-5
c) PPCl5=0.21(RT/V)=0.21(0.082·523/12)
K=( PPCl3 PCl2)/(PPCl5 Pº)
K(250ºC)=1.74
83*.
a) Calcular el número de moles de amoniaco necesario en la disolución final:
n=[NH3]Vfinal=0.25·0.1=0.025 mol
Se calcula la cantidad en gramos de amoniaco puro correspondiente:
mNH3=n·Pm=0.025·17=0.425 g
El bote de amoníaco concentrado que se utiliza tiene una riqueza de 25%, es decir que hay 25% en peso
de amoniaco. De ahí se calcula la cantidad de solución que se debe echar:
msol= mNH3/(25/100)=1.7 g
(Obviamente, si la solución no es pura, la cantidad de amoníaco a echar será mayor que si fuera pura)
ρ=msol/V V=msol/ρ=1.7/0.9=1.89 ml
NH4+ +OHb) NH3 →
cx
cx
0.25-cx
Hemos asumido que la cantidad de OH- que se forma a través de esta reacción es muy superior a la de la
disociación del agua H+ + OH-→H2O, Kw=10-14, que produciría una [OH-]=10-7 mol/l. Una vez finalizado el
cálculo, habrá que comprobar la hipótesis.
Kb=[NH4+][OH-]/[NH3]=cx2/(0.25-cx)
cx2=Kb(0.25-cx)
Aunque podríamos resolver esta ecuación de segundo grado sin aproximaciones, vamos a introducir la
hipótesis simplificadora que x << 0.25.
c x = 0.25 K b =2 10-3 mol/l
pOH=-log([OH-])=-log(cx)=2.7
pH=14-pOH=14-2.7=11.3
Comprobación de las hipótesis:
Si, cx es 20000 veces más grande
10-7 << cx
cx << 0.25
Si, cx es 125 veces menor que 0.25 M.
c) Obtenemos una disolución de un ácido débil y su base conjugada. De la teoría recordamos que:
pH = pKa + log
[base]
[ácido]
pKa = 14 − pKb
pKa=9.2
[base]=0.25 0.1/(0.1+0.1)=0.125 M
[ácido]=0.2 0.1/(0.1+0.1)=0.1 M
pH=9.2+log(0.125/0.1)=9.3
84*.Soluciones:
a) [NH3]=0.067 mol/l
[NH4+]= 1.0·10-3 mol/l
b) nHCl =nNH3+nNH4+
=(0.067+1.0·10-3)500·103
=34000 mol
mHCl=1241 kg
Bases Físicas y Químicas del Medio Ambiente 2004/2005. Hoja 11 Corregida
Área de Química-Física. Universidad Pablo de Olavide- pág. 2
c) Es el pH de una disolución de cloruro de amonio
NH3+H+
NH4+ →
n-x
x
x
cx=x/V
cn=n/V
Ka= cx2/(cn- cx)≈ cx2/cn
cx = cn K a
⇔ log(cx)=log((cnKa)1/2)
⇔ -log(cx)=(1/2)(-log(cnKa))
⇔ pH=(1/2)(pCn+pKa)=(1/2)(9.2+1.2)=5.2
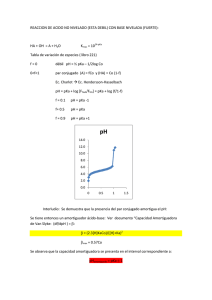
85*.Soluciones:
a) V=2.19 ml
b) pH=pKa+log([A-]/[AH])=pKa=4.75
c) nHCl=5·10-4 mol
nA-=(5-0.5) 10-3 mol
nAH=(5+0.5) 10-3 mol
[A-]= nA-/V
pH = pKa + log
= pKa + log
pH=4.66
n A− / V
n AH / V
n A−
n AH
86*.Soluciones:
a) CH3COOH →
CH3COO-+H+
Para simplificar, llamaremos el ácido AH y la base A[H+]=[A-]=1.91 10-3 M
[AH]=0.202 M
b) La base conjugada del ácido, por ejemplo la sal acetato de sodio CH3COONa
Hay que añadirle 0.02 mol del acetato, es decir p.ej. 100 ml de una solución 0.2 M
pH=pKa=4.75