Profesor: Félix Muñoz
ACTIVIDADES DE QUÍMICA. TERCERA EVALUACIÓN 1º BACHILLERATO
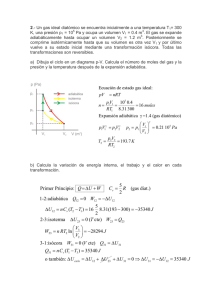
1. Cuando reacciona el óxido de calcio con el cloruro de amónico se forma cloruro de calcio, amoniaco y agua.
a) Escribe la ecuación química ajustada.
b) Calcula el número de moles de amoniaco que se obtienen al reaccionar 50 g de cloruro amónico.
c) Calcula el número de moléculas de agua que se forman.
d)
Solución: 0,93 moles de amoniaco. 2,8 · 1023 moléculas de H2O.
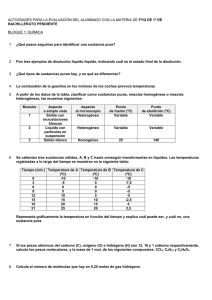
2. Reaccionan 10 g de cinc con ácido clorhídrico diluido, obteniéndose cloruro de cinc e hidrógeno.
a)
b)
c)
d)
Escribe la ecuación química ajustada.
Calcula el número de moles de sal obtenidos.
Calcula el número de moléculas de hidrógeno formadas.
Averigua el número de átomos de hidrógeno formados.
Solución: 0,15 moles de ZnCl2 y 0,15 moles H2, 9,03· 1022 moléculas de H2, 1,8 · 1023 átomos de hidrógeno
3. El azufre se combina con el oxígeno para formar dióxido de azufre. Razona si es cierta o falsa la siguiente
afirmación: “Al reaccionar 32 g de azufre con 16 g de oxígeno se forman 48 g de dióxido de azufre”
Solución: La afirmación es falsa. Tendríamos 32g de dióxido de azufre.
4. Señala si es verdadera o falsa la siguiente afirmación: “Al reaccionar 108 g de aluminio con 48 g de oxígeno se
obtienen 156 g de óxido de aluminio”.
Solución: La afirmación es falsa. Tendríamos 102g de óxido de aluminio.
5. La síntesis de Haber es el procedimiento que se lleva a cabo en la industria para la obtención de amoniaco a
partir de sus elementos. Si se parte de 250 litros de hidrógeno medidos a 400 ºC y 900 mm de Hg, calcula cuantos
litros de amoniaco se podrán recoger en esas mismas condiciones de presión y temperatura.
Solución: 166,96 litros
6. El acetileno o etino arde en el aire con llama muy luminosa.
a) ¿Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 L de
dióxido de carbono medidos en c.n.?
b) ¿Cuántos moles de dióxido de carbono se obtienen?
Solución: La reacción ajustada es: 2 H2C2 + 5 O2 → 4 CO2 + 2 H2O. 50 l de acetileno. 4,46 moles.
7. Un vaso de precipitados contiene 10 g de Al y 50 g de HCl, obteniéndose tricloruro de aluminio e hidrógeno.
¿Qué masa de sal se obtiene? Solución: 49,44 g
9. Reaccionan 10 g de sodio en agua.
a) Calcula el volumen de hidrógeno recogido a 20ºC y 0,98 at.
b) Calcula el número de moléculas contenidas en ese volumen.
Solución: 5,15 l, 1,26 · 1023
10. El dióxido de estaño se reduce a estaño metálico al reaccionar con el carbono.
a) Escribe la ecuación ajustada.
b) Calcula el volumen de dióxido de carbono que se obtiene en c.n., sabiendo que se han reducido 50 g de
dióxido de estaño.
Solución: 7,4 litros
11. El hidróxido sódico se prepara comercialmente mediante la reacción entre el carbonato de sodio y el hidróxido
de calcio. ¿Cuántos gramos de hidróxido sódico se obtendrán al tratar 1 kg de carbonato sódico con suficiente
cantidad de hidróxido de calcio? ¿Cuántos moles de carbonato de calcio se obtendrán?
Solución: 755g, 9,43 moles.
12. Se han tratado 25 g de cloruro de hidrógeno con 50 g de dióxido de manganeso, obteniéndose cloruro de
manganeso (II) cloro y agua. ¿Qué volumen de cloro se obtiene medido a 10ºC y 700 mm de Hg?
Solución: 4,3 litros
13. Se hacen reaccionar 25 g de cinc puro con una disolución de ácido clorhídrico de concentración 6 Molar.
Calcula el volumen de disolución que será preciso utilizar.
Solución: Zn + 2 HCl → ZnCl2 + H2 ; 130 cc
14. A 400 ºC se carga en un alto horno un mineral que contiene un 85 % en óxido de hierro (III). Al reaccionar con
monóxido de carbono, se reduce a óxido de hierro (II) y se desprende dióxido de carbono. Calcula la cantidad de
muestra de mineral añadida, si se han formado 2 500 g de óxido de hierro (II).
Solución: 3300 g
15. Al reaccionar una muestra de 70 g de sodio en agua se forma hidróxido de sodio y se desprenden 22 L de
hidrógeno medidos a 20 ºC y 1,5 atm.
a) Averigua la riqueza en sodio que contiene la muestra.
b) Los gramos de hidróxido sódico formados.
Solución: (64,4g / 70g = 0,92 ) 92% , 112 g de NaOH
16. El cloro se puede obtener en el laboratorio mediante la reacción entre el dióxido de manganeso con ácido
clorhídrico. Si reaccionan 30 g de MnO2, calcula el volumen de disolución que habrá que emplear si ésta tiene una
concentración del 30 % en masa y densidad 1,5 g/mL.
Solución: 111,7 mL (50,3g de HCl al 30% 167,6 g de disolución )
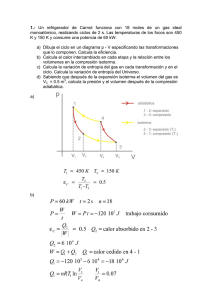
17. Para la reacción: 2 Al 2 O 3 (s) → 4 Al (s) + 3 O 2 (g)
∆H 0 = -3 351 kJ
a) Calcula el calor de formación de 1 mol de Al2O3.
b) ¿Cuántos kJ se desprenderán en las mismas condiciones de presión y temperatura al formarse 50 g de Al2O3?
Solución: - 1675,5kJ; 821,3kJ
18. El calor de formación del monóxido de cobre es -161,1 kJ/mol y el calor de formación de agua en estado líquido
es -285,8 kJ/mol. Al reaccionar el monóxido de cobre con hidrógeno gaseoso se reduce a cobre metálico además de
formarse agua. Calcula la entalpía de dicha reacción.
Cu (s) + ½ O 2 (g) → CuO (s) ∆H a = -161,1 kJ
H 2 (g) + ½ O 2 (g) → H 2 O (l)
∆H b = -285,8 kJ
Solución: CuO (s) + H 2 (g) → Cu (s) + H 2 O
∆H = -124,7 kJ